3.4: البروتينات
- Page ID
- 196020
المهارات اللازمة للتطوير
- وصف الوظائف التي تؤديها البروتينات في الخلية والأنسجة
- ناقش العلاقة بين الأحماض الأمينية والبروتينات
- شرح المستويات الأربعة لتنظيم البروتين
- وصف الطرق التي يرتبط بها شكل البروتين ووظيفته
البروتينات هي واحدة من أكثر الجزيئات العضوية وفرة في الأنظمة الحية ولديها مجموعة متنوعة من الوظائف لجميع الجزيئات الكبيرة. قد تكون البروتينات هيكلية أو تنظيمية أو قابلة للانقباض أو واقية؛ قد تعمل في النقل أو التخزين أو الأغشية؛ أو قد تكون سموم أو إنزيمات. قد تحتوي كل خلية في النظام الحي على آلاف البروتينات، ولكل منها وظيفة فريدة. تختلف هياكلها، مثل وظائفها، بشكل كبير. ومع ذلك، فهي جميعها بوليمرات من الأحماض الأمينية مرتبة في تسلسل خطي.
أنواع ووظائف البروتينات
تعتبر الإنزيمات، التي تنتجها الخلايا الحية، محفزات في التفاعلات الكيميائية الحيوية (مثل الهضم) وعادة ما تكون بروتينات معقدة أو مترافقة. كل إنزيم خاص بالركيزة (متفاعل يرتبط بالإنزيم) الذي يعمل عليه. قد يساعد الإنزيم في تفاعلات الانهيار أو إعادة الترتيب أو التوليف. تسمى الإنزيمات التي تكسر ركائزها الإنزيمات التقويضية، والإنزيمات التي تبني جزيئات أكثر تعقيدًا من ركائزها تسمى الإنزيمات الابتنائية، والأنزيمات التي تؤثر على معدل التفاعل تسمى الإنزيمات التحفيزية. تجدر الإشارة إلى أن جميع الإنزيمات تزيد من معدل التفاعل، وبالتالي تعتبر محفزات عضوية. مثال على الإنزيم هو الأميليز اللعابي، الذي يحلل ركيزة الأميلوز، وهو أحد مكونات النشا.
الهرمونات هي جزيئات إشارات كيميائية، عادة ما تكون بروتينات صغيرة أو ستيرويدات، تفرزها خلايا الغدد الصماء التي تعمل على التحكم في عمليات فسيولوجية معينة أو تنظيمها، بما في ذلك النمو والتطور والتمثيل الغذائي والتكاثر. على سبيل المثال، الأنسولين هو هرمون بروتيني يساعد على تنظيم مستوى الجلوكوز في الدم. يتم سرد الأنواع والوظائف الأساسية للبروتينات في الجدول\(\PageIndex{1}\).
| النوع | أمثلة | الوظائف |
|---|---|---|
| إنزيمات الجهاز الهضمي | الأميليز، الليباز، البيبسين، التربسين | تساعد في هضم الطعام عن طريق تحويل العناصر الغذائية إلى وحدات أحادية |
| وسائل النقل | الهيموجلوبين والألبومين | احمل المواد في الدم أو اللمف في جميع أنحاء الجسم |
| هيكلي | أكتين، توبولين، كيراتين | قم ببناء هياكل مختلفة، مثل الهيكل الخلوي |
| الهرمونات | الأنسولين، هرمون الغدة الدرقية | تنسيق نشاط أنظمة الجسم المختلفة |
| دفاع | الغلوبولين المناعي | حماية الجسم من مسببات الأمراض الأجنبية |
| منقبض | أكتين، ميوسين | تأثير تقلص العضلات |
| تخزين | بروتينات تخزين البقوليات، بياض البيض (الألبومين) | توفير التغذية في مرحلة مبكرة من نمو الجنين والشتلات |
للبروتينات أشكال وأوزان جزيئية مختلفة؛ بعض البروتينات كروية الشكل بينما البعض الآخر ليفي بطبيعته. على سبيل المثال، الهيموجلوبين هو بروتين كروي، لكن الكولاجين، الموجود في بشرتنا، هو بروتين ليفي. شكل البروتين مهم لوظيفته، ويتم الحفاظ على هذا الشكل من خلال العديد من أنواع الروابط الكيميائية المختلفة. قد تؤدي التغيرات في درجة الحرارة ودرجة الحموضة والتعرض للمواد الكيميائية إلى تغييرات دائمة في شكل البروتين، مما يؤدي إلى فقدان الوظيفة، والمعروف باسم التمسخ. تتكون جميع البروتينات من ترتيبات مختلفة من نفس 20 نوعًا من الأحماض الأمينية.
أحماض أمينية
الأحماض الأمينية هي المونومرات التي تشكل البروتينات. كل حمض أميني له نفس البنية الأساسية، والتي تتكون من ذرة كربون مركزية، تُعرف أيضًا باسم كربون ألفا (α)، مرتبطة بمجموعة أمينية (NH 2) ومجموعة كربوكسيل (COOH) وذرة هيدروجين. يحتوي كل حمض أميني أيضًا على ذرة أخرى أو مجموعة من الذرات المرتبطة بالذرة المركزية المعروفة باسم مجموعة R (الشكل\(\PageIndex{1}\)).
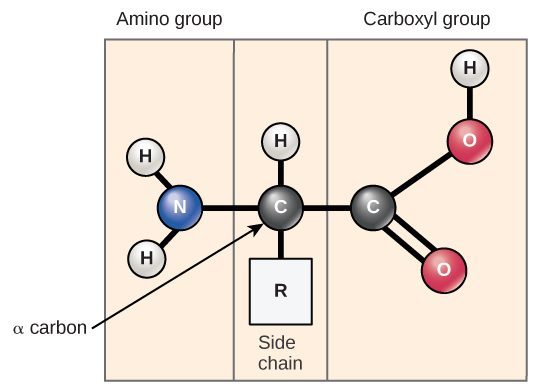
يُشتق اسم «الأحماض الأمينية» من حقيقة أنها تحتوي على كل من المجموعة الأمينية ومجموعة حمض الكربوكسيل في بنيتها الأساسية. كما ذكرنا، يوجد 20 حمضًا أمينيًا في البروتينات. تعتبر عشرة من هذه الأحماض الأمينية الأساسية للإنسان لأن جسم الإنسان لا يستطيع إنتاجها ويتم الحصول عليها من النظام الغذائي. بالنسبة لكل حمض أميني، تختلف مجموعة R (أو السلسلة الجانبية) (الشكل\(\PageIndex{2}\)).
آرت كونيكشن
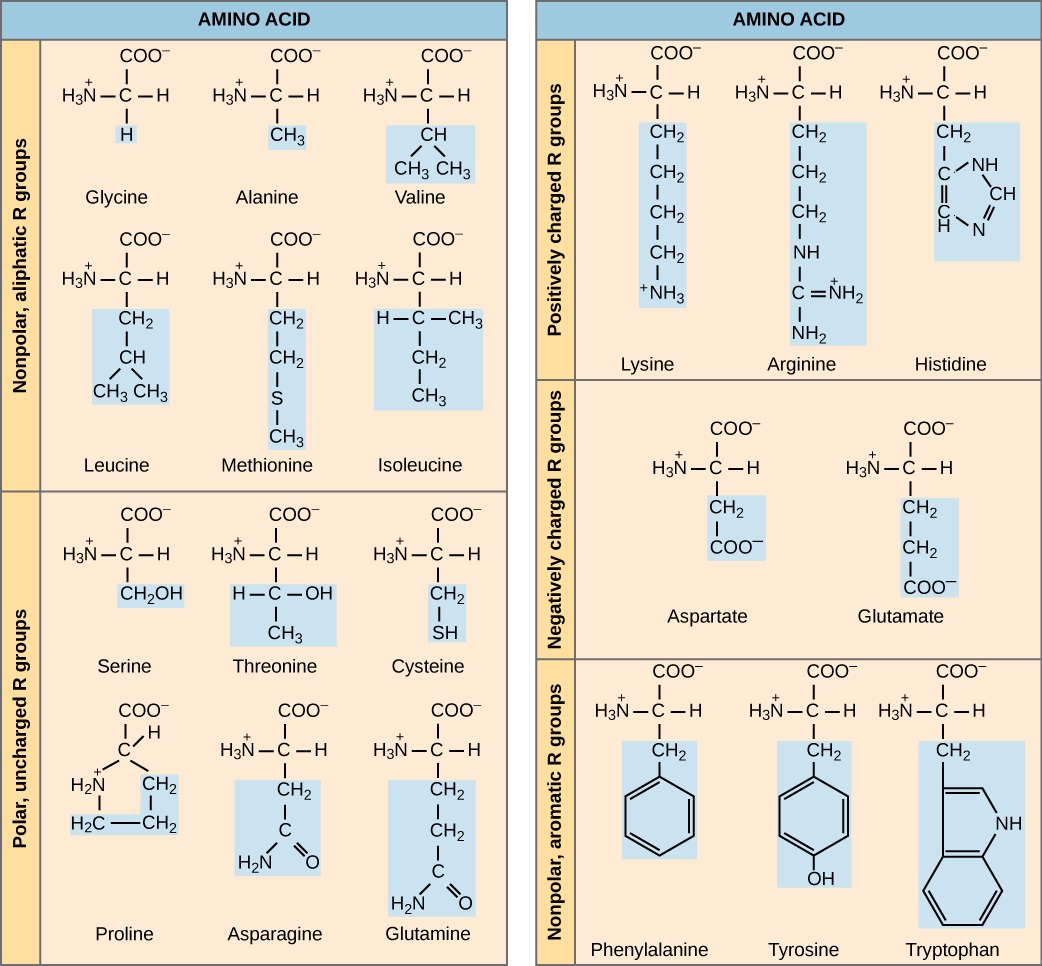
ما هي فئات الأحماض الأمينية التي تتوقع أن تجدها على سطح البروتين القابل للذوبان، وما هي الفئات التي تتوقع أن تجدها في الداخل؟ ما توزيع الأحماض الأمينية الذي تتوقع أن تجده في البروتين المضمن في طبقة ثنائية الدهون؟
تحدد الطبيعة الكيميائية للسلسلة الجانبية طبيعة الأحماض الأمينية (أي ما إذا كانت حمضية أو أساسية أو قطبية أو غير قطبية). على سبيل المثال، يحتوي جليكاين الحمض الأميني على ذرة هيدروجين كمجموعة R. الأحماض الأمينية مثل الفالين والميثيونين والألانين غير قطبية أو كارهة للماء بطبيعتها، في حين أن الأحماض الأمينية مثل السيرين والثريونين والسيستين هي أحماض قطبية ولها سلاسل جانبية محبة للماء. يتم شحن السلاسل الجانبية لليسين والأرجينين بشكل إيجابي، وبالتالي تُعرف هذه الأحماض الأمينية أيضًا باسم الأحماض الأمينية الأساسية. يحتوي البرولين على مجموعة R مرتبطة بالمجموعة الأمينية، وتشكل بنية تشبه الحلقة. يعد البرولين استثناءً للهيكل القياسي لحمض الأنيمو نظرًا لأن مجموعته الأمينية ليست منفصلة عن السلسلة الجانبية (الشكل\(\PageIndex{2}\)).
يتم تمثيل الأحماض الأمينية بحرف كبير واحد أو اختصار مكون من ثلاثة أحرف. على سبيل المثال، يُعرف الفالين بالحرف V أو الرمز المكون من ثلاثة أحرف val. مثلما أن بعض الأحماض الدهنية ضرورية للنظام الغذائي، فإن بعض الأحماض الأمينية ضرورية أيضًا. تُعرف باسم الأحماض الأمينية الأساسية، وفي البشر تشمل الإيزوليوسين والليوسين والسيستين. تشير الأحماض الأمينية الأساسية إلى تلك الضرورية لبناء البروتينات في الجسم، على الرغم من عدم إنتاجها من قبل الجسم؛ وتختلف الأحماض الأمينية الأساسية من كائن حي إلى آخر.
يحدد تسلسل وعدد الأحماض الأمينية في النهاية شكل البروتين وحجمه ووظيفته. يرتبط كل حمض أميني بحمض أميني آخر بواسطة رابطة تساهمية، تُعرف باسم رابطة الببتيد، والتي تتكون من تفاعل الجفاف. تتحد مجموعة الكربوكسيل المكونة من حمض أميني واحد والمجموعة الأمينية للحمض الأميني الوارد، مما يؤدي إلى إطلاق جزيء من الماء. الرابطة الناتجة هي رابطة الببتيد (الشكل\(\PageIndex{3}\)).
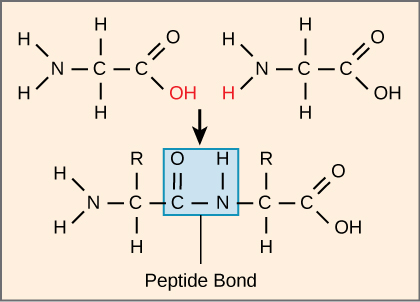
المنتجات التي تشكلها هذه الروابط تسمى الببتيدات. مع انضمام المزيد من الأحماض الأمينية إلى هذه السلسلة المتنامية، تُعرف السلسلة الناتجة باسم بولي ببتيد. يحتوي كل بولي ببتيد على مجموعة أمينية حرة في أحد طرفيه. تسمى هذه النهاية بالمحطة N، أو المحطة الأمينية، والطرف الآخر يحتوي على مجموعة كربوكسيل حرة، تُعرف أيضًا باسم C أو محطة الكربوكسيل. في حين أن مصطلحي بولي ببتيد وبروتين يستخدمان أحيانًا بالتبادل، فإن البولي ببتيد هو من الناحية الفنية بوليمر من الأحماض الأمينية، في حين يستخدم مصطلح البروتين في البولي ببتيد أو البولي ببتيدات التي اجتمعت معًا، وغالبًا ما تكون لها مجموعات اصطناعية غير ببتيد، ولها شكل مميز، ولها وظيفة فريدة. بعد تخليق البروتين (الترجمة)، يتم تعديل معظم البروتينات. تُعرف هذه التعديلات باسم تعديلات ما بعد الترجمة. قد تخضع للانشقاق أو الفسفرة أو قد تتطلب إضافة مجموعات كيميائية أخرى. فقط بعد هذه التعديلات يعمل البروتين بشكل كامل.
اتصال التطور
تعد الأهمية التطورية للسيتوكروم CCYtoChrome c مكونًا مهمًا في سلسلة نقل الإلكترون، وهي جزء من التنفس الخلوي، وتوجد عادةً في العضية الخلوية، الميتوكوندريا. يحتوي هذا البروتين على مجموعة اصطناعية من الهيم، ويتم تقليل الأيونات المركزية للهيم وتتأكسد بالتناوب أثناء نقل الإلكترون. نظرًا لأن دور هذا البروتين الأساسي في إنتاج الطاقة الخلوية أمر بالغ الأهمية، فقد تغير قليلاً جدًا على مدى ملايين السنين. أظهر تسلسل البروتين أن هناك قدرًا كبيرًا من تجانس تسلسل الأحماض الأمينية السيتوكروم ج بين الأنواع المختلفة؛ بمعنى آخر، يمكن تقييم القرابة التطورية عن طريق قياس أوجه التشابه أو الاختلاف بين تسلسل الحمض النووي أو البروتين للأنواع المختلفة.
لقد قرر العلماء أن السيتوكروم ج البشري يحتوي على 104 من الأحماض الأمينية. بالنسبة لكل جزيء من السيتوكروم ج من كائنات مختلفة تم تسلسلها حتى الآن، تظهر 37 من هذه الأحماض الأمينية في نفس الموضع في جميع عينات السيتوكروم ج، وهذا يشير إلى أنه ربما كان هناك سلف مشترك. عند مقارنة تسلسلات البروتين البشري والشمبانزي، لم يتم العثور على فرق في التسلسل. عندما تمت مقارنة تسلسلات القرد البشري وقرد الريسوس، كان الاختلاف الوحيد الموجود في حمض أميني واحد. في مقارنة أخرى، يُظهر التسلسل بين البشر والخميرة اختلافًا في المركز 44.
هيكل البروتين
كما تمت مناقشته سابقًا، فإن شكل البروتين أمر بالغ الأهمية لوظيفته. على سبيل المثال، يمكن أن يرتبط الإنزيم بركيزة معينة في موقع يعرف باسم الموقع النشط. إذا تم تغيير هذا الموقع النشط بسبب التغييرات المحلية أو التغييرات في البنية العامة للبروتين، فقد لا يتمكن الإنزيم من الارتباط بالركيزة. لفهم كيفية حصول البروتين على شكله النهائي أو شكله النهائي، نحتاج إلى فهم المستويات الأربعة لبنية البروتين: الأولية والثانوية والثالثية والرباعية.
الهيكل الأساسي
التسلسل الفريد للأحماض الأمينية في سلسلة البولي ببتيد هو هيكلها الأساسي. على سبيل المثال، يحتوي هرمون البنكرياس الأنسولين على سلسلتين من البولي ببتيد، A و B، وترتبط معًا بروابط ثنائي كبريتيد. الحمض الأميني الطرفي N من السلسلة A هو الجليسين، في حين أن الحمض الأميني الطرفي C هو الأسباراجين (الشكل 1)
ملخص
البروتينات هي فئة من الجزيئات الكبيرة التي تؤدي مجموعة متنوعة من الوظائف للخلية. فهي تساعد في عملية التمثيل الغذائي من خلال توفير الدعم الهيكلي والعمل كإنزيمات أو ناقلات أو هرمونات. اللبنات الأساسية للبروتينات (المونومرات) هي الأحماض الأمينية. يحتوي كل حمض أميني على كربون مركزي مرتبط بمجموعة أمينية ومجموعة كربوكسيل وذرة هيدروجين ومجموعة R أو سلسلة جانبية. هناك 20 حمضًا أمينيًا شائعًا، يختلف كل منها في مجموعة R. يرتبط كل حمض أميني بجيرانه بواسطة رابطة ببتيد. تُعرف السلسلة الطويلة من الأحماض الأمينية باسم بولي ببتيد.
يتم تنظيم البروتينات على أربعة مستويات: الابتدائي والثانوي والثالثي والرباعي (الاختياري). الهيكل الأساسي هو التسلسل الفريد للأحماض الأمينية. يشكل الطي المحلي للبولي ببتيد لتشكيل هياكل مثل اللولب ألفا والصفائح المطوية بالبيتا الهيكل الثانوي. الهيكل العام ثلاثي الأبعاد هو الهيكل الثالث. عندما يتحد اثنان أو أكثر من الببتيدات المتعددة لتشكيل بنية البروتين الكاملة، يُعرف التكوين باسم البنية الرباعية للبروتين. يرتبط شكل البروتين ووظيفته ارتباطًا وثيقًا؛ أي تغيير في الشكل بسبب التغيرات في درجة الحرارة أو درجة الحموضة قد يؤدي إلى تمسخ البروتين وفقدان الوظيفة.
اتصالات فنية
الشكل\(\PageIndex{2}\): ما هي فئات الأحماض الأمينية التي تتوقع أن تجدها على سطح البروتين القابل للذوبان، وما هي الفئات التي تتوقع أن تجدها في الداخل؟ ما توزيع الأحماض الأمينية الذي تتوقع أن تجده في البروتين المضمن في طبقة ثنائية الدهون؟
- إجابة
-
من المرجح أن توجد بقايا الأحماض الأمينية القطبية والمشحونة (الباقي بعد تكوين رابطة الببتيد) على سطح البروتينات القابلة للذوبان حيث يمكن أن تتفاعل مع الماء، ومن المرجح أن توجد المواد غير القطبية (مثل السلاسل الجانبية للأحماض الأمينية) في المناطق الداخلية حيث يتم عزلها عن الماء. في البروتينات الغشائية، ترتبط السلاسل الجانبية للأحماض الأمينية غير القطبية والكارهة للماء بذيول الفوسفوليبيدات الكارهة للماء، بينما تتفاعل السلاسل الجانبية للأحماض الأمينية القطبية والمشحونة مع مجموعات الرؤوس القطبية أو مع المحلول المائي. ومع ذلك، هناك استثناءات. في بعض الأحيان، تتفاعل السلاسل الجانبية للأحماض الأمينية المشحونة إيجابًا وسالبًا مع بعضها البعض في الجزء الداخلي من البروتين، ويمكن العثور على السلاسل الجانبية للأحماض الأمينية القطبية أو المشحونة التي تتفاعل مع الليجاند في جيب ربط الليجاند.
مسرد المصطلحات
- هيكل ألفا الحلزون (ألفا - اللولب)
- نوع التركيب الثانوي للبروتينات المتكونة عن طريق طي البولي ببتيد إلى شكل حلزوني مع روابط هيدروجينية تثبت الهيكل
- حمض أميني
- مونومر البروتين؛ يحتوي على كربون مركزي أو كربون ألفا ترتبط به مجموعة أمينية ومجموعة كربوكسيل وهيدروجين ومجموعة R أو سلسلة جانبية؛ تختلف مجموعة R لجميع الأحماض الأمينية العشرين
- ورقة مطوية بيتا (β - مطوية)
- البنية الثانوية الموجودة في البروتينات التي تتكون فيها «الطيات» عن طريق الترابط الهيدروجيني بين الذرات على العمود الفقري لسلسلة البولي ببتيد
- مرافق
- (أيضًا بروتين الشابيرونين) الذي يساعد البروتين الناشئ في عملية الطي
- تمسخ
- فقدان الشكل في البروتين نتيجة للتغيرات في درجة الحرارة أو درجة الحموضة أو التعرض للمواد الكيميائية
- خميرة
- محفز في تفاعل كيميائي حيوي عادة ما يكون بروتينًا معقدًا أو مترافقًا
- هرمون
- جزيء الإشارة الكيميائية، عادة ما يكون بروتينًا أو ستيرويد، تفرزه خلايا الغدد الصماء التي تعمل على التحكم في عمليات فسيولوجية معينة أو تنظيمها
- رابطة الببتيد
- رابطة تشكلت بين اثنين من الأحماض الأمينية من خلال تفاعل الجفاف
- بولي ببتيد
- سلسلة طويلة من الأحماض الأمينية المرتبطة بروابط الببتيد
- الهيكل الأساسي
- تسلسل خطي للأحماض الأمينية في البروتين
- بروتين
- جزيء بيولوجي كبير يتكون من سلسلة واحدة أو أكثر من الأحماض الأمينية
- هيكل رباعي
- رابطة وحدات البولي ببتيد الفرعية المنفصلة في البروتين
- هيكل ثانوي
- هيكل منتظم يتكون من البروتينات عن طريق الترابط الهيدروجيني داخل الجزيء بين ذرة الأكسجين لبقايا أحد الأحماض الأمينية والهيدروجين المرتبط بذرة النيتروجين لبقايا حمض أميني آخر
- هيكل التعليم العالي
- تشكيل ثلاثي الأبعاد للبروتين، بما في ذلك التفاعلات بين العناصر الهيكلية الثانوية؛ يتكون من التفاعلات بين السلاسل الجانبية للأحماض الأمينية


