12.9: תנועתיות התא
- Page ID
- 208438
ישנן מספר דרכים שבהן תא יכול לנוע מנקודה אחת בחלל לאחרת. במדיום נוזלי, שיטה זו עשויה להיות סוג של שחייה, תוך שימוש בתנועה ריסית או דגלית כדי להניע את התא. על משטחים מוצקים, מנגנונים אלה בבירור לא יעבדו ביעילות, והתא עובר תהליך זחילה. בחלק זה, אנו מתחילים בדיון על תנועה ריסית/דגלרית, ולאחר מכן נבחן את הדרישות המסובכות יותר של זחילה סלולרית.
Cilia ו-flagella, הנבדלים בעיקר באורך ולא בבנייה, הם אברונים מבוססי מיקרוטובולים הנעים בתנועה קדימה ואחורה. זה מתורגם ל"חתירה "על ידי הריסים הקצרים יחסית, אך בדגלים הארוכים יותר, הגמישות של המבנה גורמת להתפשטות התנועה הלוך ושוב כגל, כך שתנועת הדגל היא גלית יותר או דמוית שוט (שקול מה קורה כשאתה מכשכש בצינור גינה במהירות מצד לצד בהשוואה לחתיכה קצרה מאותו צינור). הליבה של כל אחד מהמבנים נקראת האקסונמה, המורכבת מ-9 כפילות מיקרוטובוליות המחוברות זו לזו על ידי חלבונים מוטוריים של דינין ריסי, ומקיפות ליבה מרכזית של שני מיקרוטובולים נפרדים.
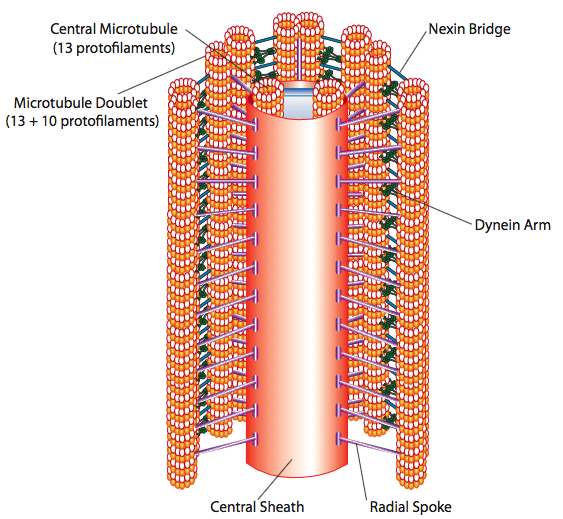
זה ידוע בשם היווצרות "9+2", אם כי תשעת הכפילות אינן זהות לשתי המיקרוטובולים המרכזיים. צינורית A היא 13 פרוטופילמנטים מלאים, אך צינורית B שהתמזגה אליה מכילה רק 10 פרוטופילמנטים. כל אחד מהמיקרוטובולים המרכזיים הוא 13 פרוטופילמנטים מלאים. האקסונמה 9+2 מאריכה את אורך הציליום או הדגל מהקצה עד שהוא מגיע לבסיס, ומתחברת לגוף התא דרך גוף בסיסי, המורכב מ -9 שלישיות מיקרו-צינוריות המסודרות בחבית קצרה, בדומה לצנטריולים מהם הם נגזרים.
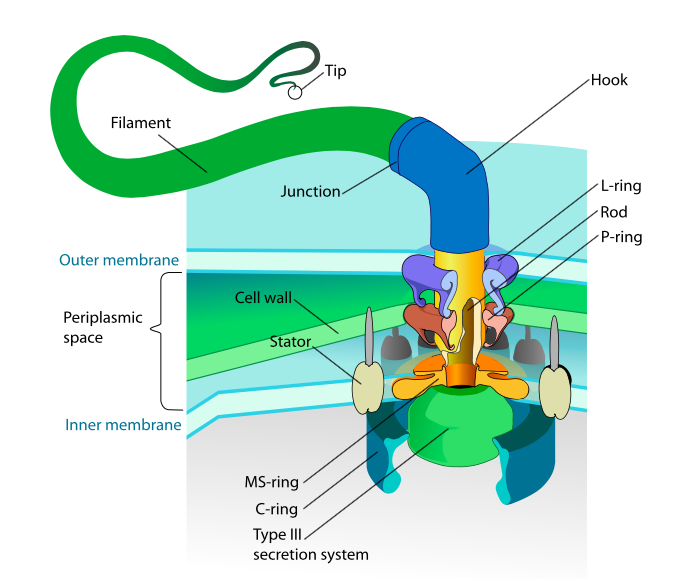
סעיף זה מתייחס רק לאיקריוטים. לחלק מהפרוקריוטים יש גם נספחים תנועתיים הנקראים flagella, אך הם שונים לחלוטין הן במבנה והן במנגנון. הדגלים עצמם הם פולימרים סליליים ארוכים של החלבון פלגלין, ובסיס סיבי הפלגלין מחובר לחלבון מוטורי סיבובי, לא למנוע תרגום. מנוע זה (איור\(\PageIndex{18}\)) מנצל יון (H+ או Na + בהתאם למינים) במורד שיפוע אלקטרוכימי כדי לספק את האנרגיה לסובב עד 100000 סיבובים לדקה. נהוג לחשוב שהסיבוב מונע על ידי שינויים קונפורמטיביים בטבעת הסטטור, השוכנת בקרום התא.
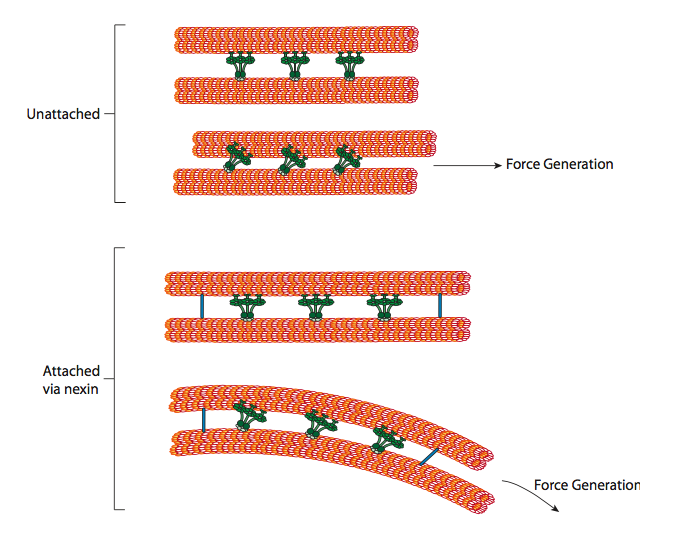
הדינינים הריסיים מספקים את היכולת המוטורית, אך ישנם שני חלבוני קישור נוספים גם באקסונמה. ישנם נקסינים המצטרפים לצינורית A של כפילה אחת לצינורית B של הכפילה הסמוכה שלה, ובכך מחברים את הטבעת החיצונית. ויש חישורים רדיאליים המשתרעים מצינורית A של כל כפילה לזוג המיקרו-צינורות המרכזי בליבת האקסונמה. לאף אחד מאלה אין פעילות מוטורית. עם זאת, הם חיוניים לתנועה של cilia ו flagella מכיוון שהם עוזרים להפוך תנועת הזזה לתנועת כיפוף. כאשר דינין ריסי (דומה מאוד לדינינים ציטופלסמיים אך יש לו שלושה ראשים במקום שניים) מעורב, הוא קושר מיקרוטובולה A בצד אחד, מיקרוטובולה B מהכפילה הסמוכה, ונעה אחד ביחס לשני. שורה של דינינים אלה הנעים בקונצרט הייתה מחליקה אפוא כפילה אחת ביחס לשנייה, אם (וזה "אם" גדול) לשתי הכפילות היה חופש תנועה מוחלט. עם זאת, מכיוון שהכפילות קשורות זו בזו על ידי חלבוני הנקסין, מה שקורה כאשר כפילה אחת מנסה להחליק הוא שהיא מכופפת את המבנה המחובר במקום זאת (איור). \(\PageIndex{17}\) עיקול זה מסביר את תנועת החתירה של הריסים, שהם קצרים יחסית, כמו גם את תנועת ההקצפה של הדגל הארוך, המפיץ את תנועת הכיפוף במורד האקסונמה.
למרות שאנו חושבים על תנועה ריסית ודגלרית כשיטות להנעה של תא, כגון שחייה דגלית של זרע לעבר ביצית, ישנם גם מספר מקומות חשובים בהם התא נייח, והסיליות משמשות להזזת נוזל מעבר לתא. למעשה, ישנם תאים עם ציציות ברוב האיברים העיקריים בגוף. דווח על מספר דיסקינזיות ריסיות, מתוכן הדיסקינזיה הריסית העיקרית הבולטת ביותר (PCD), הכוללת את תסמונת Kartagener (KS), נובעת ממוטציה של הגן DNAI1, המקודד ליחידת משנה (שרשרת ביניים 1) של דינין אקסונלי (ריסי). PCD מאופיין במצוקה נשימתית עקב זיהום חוזר, והאבחנה של KS נעשית אם יש גם situs inversus, מצב בו האסימטריה התקינה של שמאל-ימין של הגוף (למשל בטן משמאל, כבד מימין) מתהפכת. התסמין הראשון נובע מחוסר פעילות של ציציות רבות של תאי אפיתל בריאות. הפונקציה הרגילה שלהם היא לשמור על ריר במסלול הנשימה כל הזמן בתנועה. בדרך כלל הריר עוזר לשמור על לחות הריאות כדי להקל על התפקוד, אך אם הריר הופך נייח, הוא הופך להיות כר גידול לחיידקים, כמו גם הופך לגירוי ומכשול לחילופי גזים תקינים.
Situs inversus הוא מום מעניין מכיוון שהוא מתעורר בהתפתחות העוברית, ומשפיע רק על 50% מחולי PCD מכיוון שתפקוד הריסי הפגום גורם לאקראיות של אסימטריה שמאל-ימין, לא להיפוך. במילים פשוטות מאוד, במהלך התפתחות עוברית מוקדמת, אסימטריה שמאל-ימין נובעת בחלקה מתנועת האותות המולקולריים בכיוון שמאל דרך הצומת העוברי. זרימה זו נגרמת על ידי מכות מתואמות של cilia, ולכן כאשר הם לא עובדים, הזרימה מופרעת ואקראיות מתרחשת.
תסמינים אחרים של חולי PCD מצביעים גם על עבודתם של cilia ו flagella בגוף. אי פוריות הגבר שכיחה עקב זרע לא נעים. עקרות נשית, אם כי פחות שכיחה, יכולה להתרחש גם היא, עקב תפקוד לקוי של הריסים של הביצית והחצוצרה שבדרך כלל מעבירים את הביצית מהשחלה לרחם. מעניין שיש גם קשר נמוך של hydrocephalus internus (מילוי יתר של חדרי המוח בנוזל מוחי, וגורם להגדלה שלהם הדוחסת את רקמת המוח סביבם) עם PCD. סביר להניח שזה נובע מתפקוד לקוי של ריסים בתאים האפנדימליים המצפים את החדרים, ואשר עוזרים להפיץ את ה- CSF, אך ככל הנראה אינם נחוצים לחלוטין. מכיוון שחושבים כי זרימת CSF בתפזורת מונעת בעיקר על ידי שינוי הסיסטולה/דיאסטולה בלחץ הדם במוח, יש המשערים כי הריסים עשויים להיות מעורבים בעיקר בכמה מהערוצים ההדוקים יותר במוח.
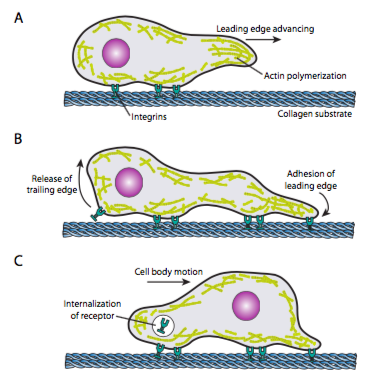
זחילת תאים (איור\(\PageIndex{19}\)) דורשת סידור מחדש מתואם של רשת המיקרופילמנט המובילה, הרחבה (הן על ידי פילמור והן על ידי חוטים הזזה) ולאחר מכן יצירת הידבקויות בנקודה החדשה ביותר קדימה. זה יכול ללבוש צורה של פילופודיה או lamellipodia, ולעתים קרובות שניהם בו זמנית. פילופודיה הן הקרנות ארוכות ודקות מאוד עם צרורות ליבה של מיקרופילמנטים מקבילים וריכוזים גבוהים של קולטני פני התא. מטרתם היא בעיקר לחוש את הסביבה. Lamellipodia משתרעת לעתים קרובות בין שתי לופודיות והיא יותר סלסול רחב מאשר אצבע. באופן פנימי האקטין יוצר יותר רשתות מאשר צרורות, והקצה הרחב יותר מאפשר לבצע יותר הידבקויות למצע. לאחר מכן רשת המיקרופילמנט מתארגנת מחדש, והפעם פותחת חלל בציטופלזמה המשמש כערוץ לתנועת המיקרוטובולים לכיוון קדמת התא. זה מציב את רשת התחבורה במקום כדי לעזור להעביר חומר בתפזורת תוך תאית קדימה. כאשר זה קורה, ההידבקויות הישנות בקצה הזנב של התא משתחררות. שחרור זה יכול לקרות באמצעות שני מנגנונים עיקריים: אנדוציטוזה של הקולטן או ביטול הקולטן על ידי איתות/שינוי קונפורמציה. כמובן, פשטנות יתר זו סותרת את המורכבות בתיאום ובקרה של כל הפעולות הללו להשגת תנועה מכוונת של תא.
מודל אחד של יצירת כוח מיקרופילמנט, דגם המחגר הבראוניאני האלסטי (Mogilner and Oster, 1996), מציע שבשל תנועה בראונית של קרום התא הנובעת מתנודות תרמיות דקות מתמשכות, חוטי האקטין הדוחפים החוצה לכיוון קצוות הממברנה מכופפים בדרגות שונות. אם הגמיש גדול מספיק, מונומר אקטין חדש יכול להשתלב בין הממברנה לקצה החוט, וכאשר החוט הארוך יותר מתגמש לאחור, הוא יכול להפעיל דחיפה גדולה יותר על הממברנה. ברור שנימה אחת אינה מייצרת כוח רב, אך הרחבה מתואמת של חוטים רבים יכולה לדחוף את הממברנה קדימה.
ברגע שתא מקבל אות לזוז, התגובה הציטו-שלדית הראשונית היא פילמור אקטין, בניית מיקרופילמנטים נוספים לשילוב בקצה המוביל. בהתאם לאות (מושך או דוחה), הפילמור עשוי להתרחש באותו צד או הפוך של התא מנקודת הפעלת קולטן האות. באופן משמעותי, פילמור של f-actin חדש לבד יכול לייצר כוח מספיק כדי להזיז את הממברנה קדימה, גם ללא מעורבות של מנועי מיוסין! מודלים של ייצור כוח מתלבטים, אך בדרך כלל מתחילים בשילוב של g-actin חדש בחוט נימה בקצהו; כלומר בממשק נים-קרום. גם אם זה יכול להיות מספיק מבחינה טכנית, בתא חי מעורבים מיוזינים ועוזרים לדחוף ולסדר חוטים בכיוון כדי להקים את הקצה המוביל החדש. בנוסף, יש לנתק במהירות כמה חוטים ורשתות וליצור קשרים חדשים, הן בין חוטים והן בין חוטים לחלבונים אחרים כמו מולקולות הדבקה או מיקרו-צינורות.
כיצד נשלטת הפילמור וסידור האקטין? הקולטנים המאותתים על תנועת תאים עשויים ליזום מסלולים שונים במקצת, אך רבים חולקים כמה מאפיינים משותפים בהפעלת אחד או יותר מבני משפחת RAS של GTPases קטנים. מולקולות איתות אלה, כגון Rac, Rho ו- cdc42 יכולות להיות מופעלות על ידי קולטן טירוסין קינאזות (ראה מסלולי הפעלה של RTK-Ras, פרק 14). לכל אחד מאלה יש תפקיד מעט שונה בתנועתיות התא: הפעלת cdc42 מובילה להיווצרות פילופודיה, Rac מפעיל מסלול הכולל Arp2/3 וקופילין להיווצרות lamellipodia, ו-Rho מפעיל מיוסין II כדי לשלוט בהידבקות מוקדית ויצירת סיבי מתח. סוג אחר של מפל קולטן, מפל האיתות של חלבון G (גם פרק 14), יכול להוביל להפעלה של PLC ולביקוע לאחר מכן של PIP 2 ולעלייה ב- Ca 2+ הציטוזולי. שינויים אלה, כפי שצוין קודם לכן, יכולים גם להפעיל מיוסין II, כמו גם את אנזימי השיפוץ ג'לסולין, קופילין ופרופילין. זה מפרק מבני אקטין קיימים כדי להפוך את התא לנוזל יותר, תוך שהוא תורם יותר g-actin ליצירת שלד הציטוס החדש.
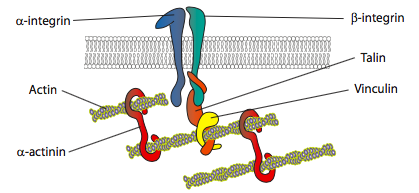
ניסויים במבחנה מראים שככל שהממברנה דוחפת קדימה, נוצרים מגעי דבק חדשים באמצעות מולקולות הידבקות או קולטנים הקושרים את המצע (לעתים קרובות שקופיות או כלים של תרבית תאים מצופים בקולגן, פילמינין או חלבוני מטריצה חוץ -תאיים אחרים). לאחר מכן המגעים מגייסים אלמנטים ציטו-שלד ליציבות רבה יותר ליצירת הידבקות מוקדית (איור\(\PageIndex{20}\)). עם זאת, נראה כי היווצרות הידבקויות מוקדיות היא חפץ של תרבית תאים, ולא ברור אם סוגי ההידבקויות הנוצרות in vivo מגייסים את אותם סוגים של רכיבים ציטו-שלד.
השלב השלישי לתנועת תאים הוא התנועה בתפזורת של התוכן הסלולרי קדימה. המנגנונים לשלב זה אינם ברורים, אך ישנן עדויות לכך ששימוש בקישורים בין שלד האקטין בקצה המוביל וחלקים קדימה של שלד המיקרוטובוליות, המיקרוטובולים מסודרים מחדש ליצירת נתיב תחבורה יעיל לתנועה בתפזורת. היבט נוסף לכך עשוי להיות אפקט "מתאם" של רשתות האקטין, הפותחות כיוון את החלל לכיוון הקצה המוביל. לאחר מכן המיקרוטובולים נכנסים לחלל הזה ביתר קלות מאשר לעבוד דרך רשת אקטין הדוקה, מה שמאלץ זרימה בכיוון הנכון.
חלק ניכר מהעבודה על אינטראקציות מיקרוטובול-אקטין בתנועתיות התא נעשתה באמצעות מחקר על חרוט הגדילה העצבי, המכונה לעתים תא ברצועה, מכיוון שהוא פועל כמעט באופן עצמאי כמו תא זוחל, ומחפש את המסלול המתאים להוביל את האקסון שלו מגוף התא לחיבור הסינפטי התקין שלו (AW Schaefer et al, Dev. תא 15:146-62, 2008).
לבסוף, התא חייב לבטל את ההידבקויות הישנות שלו בקצה הנגרר. זה יכול לקרות במספר דרכים שונות. בַּמַבחֵנָה, נצפו תאים זוחלים קורעים את עצמם מהמצע, ומשאירים אחריהם פיסות קרום זעירות וחלבוני הדבקה נלווים בתהליך. יש להניח שהכוח שנוצר מגיע מסיבי לחץ אקטין-מיוסין המובילים מההידבקויות המוקדיות יותר קדימה. עם זאת, ישנם מנגנונים פחות הרסניים הזמינים לתאים. במקרים מסוימים, ניתן לווסת את הדבקות של הקולטן הסלולרי למצע החוץ -תאי באופן פנימי, אולי על ידי זרחון או דה-פוספורילציה של קולטן. אפשרות נוספת היא אנדוציטוזה של הקולטן, מורידה אותו מעל פני התא. זה יכול פשוט למחזר עד לקצה המוביל היכן שהוא נחוץ (כלומר טרנסציטוזיס), או אם אין בו עוד צורך או פגום, הוא עלול להתפרק בליזוזום.

