12.8: דינמיקה ציטושלדית
- Page ID
- 208439
בהתפתחות המוקדמת של בעלי חיים, יש כמות עצומה של סידור מחדש ונדידה תאית כאשר כתם התאים הכדורי בערך הנקרא הבלסטולה מתחיל להתמיין וליצור תאים ורקמות עם פונקציות מיוחדות. תאים אלה צריכים לעבור מנקודת הלידה שלהם למיקומם הסופי בחיה המפותחת במלואה. לתאים מסוימים, כמו נוירונים, יש סוג נוסף של תנועתיות תאים - הם מרחיבים תהליכים ארוכים (אקסונים) מגוף התא אל יעד העצבנות שלהם. הן בהארכת הנויריט והן בתנועתיות התא כולו, התא צריך להזיז תחילה את נקודות ההתקשרות שלו ולאחר מכן את עיקר התא מנקודה אחת לאחרת. זה נעשה בהדרגה, ומשתמש בשלד הציטוס כדי לייעל את התהליך. המרכיבים העיקריים בתנועתיות התא הם שינוי נקודת ההידבקות קדימה, ניקוי החלל הפנימי על ידי סידור מחדש המופעל על ידי מיוסין של מיקרופילמנטים של אקטין והמילוי שלאחר מכן של חלל זה במיקרוטובולים.
כדי להעביר כוח, יש לחבר את הממברנה לשלד הציטוס. למעשה, איתות מקולטנים בממברנה יכול לפעמים לגרום ישירות לסידורים מחדש או תנועות של השלד באמצעות חלבוני מתאם המחברים אקטין (או אלמנטים ציטו-שלד אחרים) לחלבונים טרנסממברניים כגון קולטני אינטגרין. אחת ממערכות הניסוי המוקדמות ביותר למחקרים על אינטראקציה בין ציטושלד לממברנה הייתה האריתרוציט (כדוריות דם אדומות).
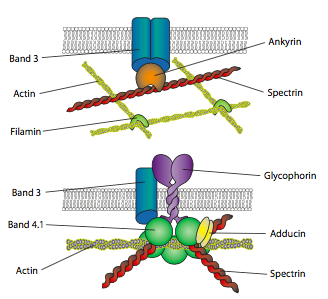
האיורים לעיל (איור\(\PageIndex{15}\)) מראים כמה מהאינטראקציות של רשת מיקרופילמנט אקטין נרחבת עם חלבונים טרנסממברניים. אנקירין וספקטרין הם חלבוני קישור חשובים בין החלבונים הטרנסממברניים למיקרופילמנטים. רעיון זה של בניית קומפלקס חלבון סביב הצד הציטופלזמי של חלבון טרנסממברני נמצא בכל מקום, וחלבוני פיגומים (מקשרים) משמשים לא רק בחיבור המצע החוץ-תאי (באמצעות חלבון טרנסממברני) לשלד הציטו, אלא גם לחיבור פיזי של מולקולות איתות ובכך להגביר את המהירות והיעילות של העברת אותות.
חלבונים נלווים לפעולותinfilaments ומיקרוטובולים הוזכרו בקצרה קודם לכן. בין שאר הפונקציות, הם יכולים לשלוט על פילמור ודה-פולימריזציה, ליצור צרורות, לסדר רשתות ולגשר בין הרשתות הציטו-שלד השונות. עבור אקטין, חלבוני בקרת הפילמור העיקריים הם פרופילין, המקדם פילמור ותימוסין β 4, אשר עוקב את g-actin. חלבוני מכסת הקצה המינוס Arp 2/3 קומפלקס וטרופומודולין, וחלבוני מכסת הקצה הפלוס CapZ, severin ו- gelsolin יכולים לייצב את הקצוות של f-actin. לבסוף, קופילין יכול להגביר את הדפולימריזציה מהקצה (-).
לפרופילין שתי פעילויות המקדמות פילמור. ראשית, זהו גורם חילופי נוקלאוטידים המסיר ATP הקשור ל- g-actin, ומחליף אותו ב- ADP. זה נשמע לא אינטואיטיבי, אך המשך לקרוא עד לפסקה הבאה. שנית, כאשר הוא קשור ל-g-actin, הוא מגביר את קצב ההוספה למיקרופילמנטים של אקטין. הוא עושה זאת על ידי קשירה לקצה שמול אתר הקישור ל-ATP, ומשאיר את האתר ואת הצד הזה פתוחים לקשירת ATP וגם את הקצה (+) של מיקרופילמנט. ניתן למצוא פרופילין הן בציטופלזמה בכלל והן קשור לפוספוליפידים (PIP 2) וחלבוני ממברנה, כדי לשלוט בתהליכים כגון שיפוץ קצה מוביל של מבנים ציטו-שלד f-actin.
Thymosin β 4 מסדיר את הרכבת המיקרופילמנט על ידי שליטה במאגר הזמין של g-actin. כבר הצהרנו שריכוזים גדולים יותר של g-actin יכולים להגביר את שיעורי הפילמור. עם זאת, בגלל האופי הדינמי ביותר של שלד האקטין, אילוצי הזמן של השפלה וייצור אקטין חדש ימנעו את בקרת התגובה המהירה הדרושה. לכן, המנגנון האופטימלי הוא לשמור על מאגר גדול של מונומרים g-actin, אך לווסת את זמינותו על ידי קשירתו לחלבון sequestering - thymosin β 4. לתימוסין β 4 יש זיקה גבוהה פי 50 ל- G-actin-ATP מאשר ל- G-actin-ADP, אז כאן חוזר הפרופילין לתמונה. פרופילין מחליף את ה- ATP של קומפלקס Tβ 4 -G-אקטין-ATP עבור ADP. התוצאה היא שה- Tβ 4 משחרר את ה- G-actin-ADP, ומאפשר לו להיכנס לבריכה הכללית לבניית חוטים.
דה-פולימריזציה מוגברת והאטה או הפסקת פילמור יכולים לפרק בהדרגה מבני f-actin, אבל מה אם יש צורך בפירוק מהיר? לשניים מחלבוני המכסה שהוזכרו קודם לכן, ג'לסולין וסוורין, יש אופן פעולה חלופי שיכול לנתק מיקרופילמנטים של אקטין בכל נקודה על ידי קישור לצד נימה אקטין ושינוי הקונפורמציה של יחידת המשנה שאליה הוא קשור. השינוי הקונפורמטיבי מאלץ את האינטראקציה של אקטין-אקטין להישבר, והגלסולין או הסוורין נשארים במקומם כחלבון מכסה קצה (+).
גלסולין מעוכב על ידי הפוספוליפיד PIP 2. פוספוליפאז C, המפרק את PIP 2 יכול גם להגדיל Ca 2+ ציטוזולי, שהוא מפעיל של גלסולין. כך ניתן להגביר במהירות את פעילות הג'לסולין על ידי איתות PLC.
בצד המיקרוטובולי של הדברים, בשל חוסר יציבות דינמית, אפשר לחשוב שאין צורך באנזים מנותק, אך למעשה, ספסטין וקטנין הם חלבונים המנתקים מיקרו-צינורות המצויים במגוון סוגי תאים, במיוחד נוירונים. יש גם חלבון דמוי Tβ 4 לטובולין: Op18, או סטתמין, הנקשר לדימרים של טובולין (לא מונומרים), הפועל כדי להפריד אותם ולהוריד את ריכוז העבודה. הוא מוסדר על ידי זרחון (שמכבה את קישור הטובולין שלו).
מוטציות בספסטין קשורות ל -40% מאותם פרפלגיות ספסטיות הנבדלות על ידי ניוון של אקסונים ארוכים מאוד. נראה כי יכולת הניתוק של ספסטין נדרשת לשיפוץ שלד הציטוס בתגובה לנזק עצבי.
חלבונים הקשורים למיקרו-צינוריות MAP1, MAP2 וטאו (t) פועלים כל אחד לקידום הרכבה של מיקרו-צינורות, כמו גם פונקציות אחרות. MAP1 הוא המופץ ביותר מבין השלושה, כאשר טאו נמצא בעיקר בנוירונים, ו- MAP2 מוגבל עוד יותר לדנדריטים עצביים. אלה וכמה MAPs אחרים פועלים גם לייצוב מיקרוטובולים נגד קטסטרופה על ידי קשירה לצד המיקרוטובולה וחיזוק האינטראקציות בין טובולין-טובולין.
לטאו יש היסטוריה ביו-רפואית מסובכת. תפקודו הרגיל ברור - הרכבה, ייצוב וקישור מיקרו-צינורות. עם זאת, הוא נמצא גם בסבכים נוירו-פיברילריים היפר-פוספוריליים הקשורים למחלת אלצהיימר. עדיין לא ידוע על גורם לאלצהיימר, ולכן עדיין לא ברור אם סבכי חלבון הטאו ממלאים תפקיד מרכזי באחד מהתסמינים.
לבסוף, ביחס לחלבוני אביזר מיקרופילמנט ומיקרוטובולה, ישנם הקישורים. חלק מה-MAPs שהוזכרו לעיל יכולים להצליב מיקרוטובולים למערכים מקבילים או רשת, וכך גם כמה קינסינים ודינינים, אם כי הם נחשבים כחלבונים מוטוריים. בצד המיקרופילמנט, ישנם חלבונים ידועים רבים המצטלבים בין f-actin, שרבים מהם נמצאים במשפחת העל של תחום ההומולוגיה של קלפונין, כולל פימברין, α-actinin, β-spectrin, דיסטרופין ופילמין. למרות שכולם יכולים להיקשר לאקטין, צורת החלבון מכתיבה סוגים שונים של אינטראקציה: לדוגמה, פימבורין מקבץ בעיקר f-actin במקביל ליצירת צרורות, בעוד פילמין מפגיש חוטי אקטין בניצב ליצירת רשתות רשת.
תסמונת FG היא מחלה הקשורה גנטית המאופיינת בפיגור שכלי, ראש מוגדל, היפוטוניה מולדת, פי הטבעת לא מחורר ואגנזה חלקית של קורפוס הקאלוסום. הוא נקשר למוטציות במספר גנים של כרומוזום X, כולל פילמין A (FLNA, FLN1, ממוקם Xq28).
מוטציות בדיסטרופין, שהוא חלבון שריר עיקרי ממשפחת העל של תחום ה- CD, עלולות לגרום לניוון שרירים של דושן או לניוון שרירים בקר קשור אך פחות חמור. המאפיין המובהק ביותר הוא ניוון שרירים פרוקסימלי פרוגרסיבי ופסאודוהיפרטרופיה של שרירי השוקיים. הופעת DMD מזוהה בדרך כלל לפני גיל 3 והיא קטלנית עד גיל 20. עם זאת, תסמינים של BMD עשויים שלא להופיע עד שנות ה -20, עם הסתברות טובה להישרדות לטווח הארוך. למרות שמדובר בעיקר במחלה מבזבזת שרירים, דיסטרופין קיים בסוגי תאים אחרים, כולל נוירונים, מה שעשוי להסביר קשר לפיגור שכלי קל אצל חלק מחולי DMD. בדומה ל- FLNA, גם הגן הדיסטרופין ממוקם על כרומוזום X (Xp21.2).

