11.6: הובלה שלפוחית
- Page ID
- 208584
בנוסף לעיבוד חלבונים, ה- ER והגולגי דואגים גם לסוגים מסוימים של הובלת חלבונים. שלפוחיות (בועות הקשורות לממברנה, בעצם) צובטות מה- ER, Golgi ואברונים קרומיים אחרים, נושאות איתן את כל המולקולות המסיסות שהיו בתוך הנוזל שהיה סגור, כמו גם כל מולקולות המוטמעות בחלק זה של הממברנה. שלפוחיות אלה תופסות טרמפ על מנוע מולקולרי כגון קינסין או מיוסין, ונוסעות לאורך השלד עד שהן עוגנות ביעד המתאים ומתמזגות עם קרום המטרה או האברון. באופן כללי, שלפוחיות עוברות מה-ER ל-cis Golgi, מה-cis ל-Golgi המדיאלי, מהמדיאלי לטרנס גולגי, ומהטרנס גולגי לממברנת הפלזמה או לתאים אחרים. למרות שרוב התנועה היא בכיוון זה, יש גם שלפוחיות שנעות חזרה מהגולגי למיון, נושאות חלבונים שהיו אמורים להישאר במיון (למשל PDI) ונאספו בטעות בתוך שלפוחית.
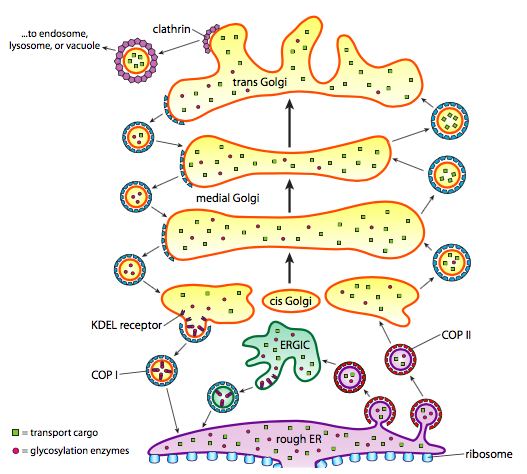
היווצרות שלפוחיות תלויה בחלבוני מעיל אשר, בתנאים מתאימים, יתאספו בעצמם לכלובים כדוריים. כאשר הם קשורים לחלבונים טרנסממברניים, הם יכולים למשוך את הממברנה המחוברת גם לצורה כדורית. הסוגים העיקריים של חלבוני המעיל המשמשים ביצירת שלפוחית הם COPII, COPI וקלתרין.
חלבוני מעיל COPII יוצרים את השלפוחיות שעוברות מ-ER ל-Golgi. חלבוני מעיל COPI משמשים בין חלקים ממנגנון הגולגי וכן ליצירת שלפוחיות העוברות מהגולגי בחזרה למיון. לבסוף, קלתרין משמש ליצירת שלפוחיות העוזבות את הגולגי לממברנת הפלזמה וכן לשלפוחיות הנוצרות מממברנת הפלזמה לאנדוציטוזיס.
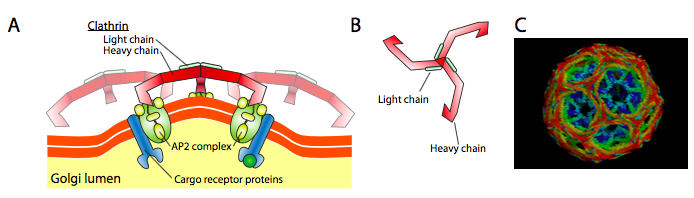
קלתרין (איור\(\PageIndex{17}\)) הוא המתואר בצורה הטובה ביותר מבין השלושה, והמעילים השלפוחית עשויים מסידורים של טריסקליונים של קלתרין (מיוונית, כלומר שלוש רגליים). כל טריסקליון מורכב משלוש שרשראות כבדות המחוברות זו לזו בקצה C, ושלוש שרשראות קלות, אחת הקשורה לכל שרשרת כבדה. השרשראות הכבדות של טריסקליונים שונים מתקיימות לאורך "רגלי" השרשרת הכבדה שלהן כדי ליצור מבנה יציב מאוד. שרשראות האור אינן נחוצות להיווצרות שלפוחית, ונחשבות כמסייעות במניעת אינטראקציות מקריות של מולקולות קלתרין בציטופלזמה.
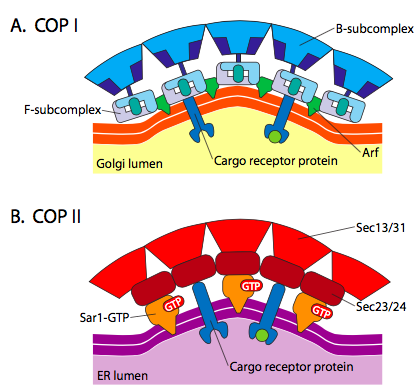
קיים דמיון משמעותי בין מנגנוני היווצרות השלפוחית באמצעות חלבוני המעיל השונים הללו, החל בגיוס ARF1 (ARF מייצג גורם ריבוזילציה ADP, שאין לו שום קשר לתפקודו כאן) לממברנה. זה דורש החלפה בהנחיית Arno של GTP עבור GDP (ARNO הוא פותחן אתר מחייב נוקלאוטיד ARF). לאחר ש- ARF1 קשר את GTP, השינוי הקונפורמטיבי חושף קבוצת מיריסטויל מסוף N אשר נכנסת לקרום. הן COPI והן שלפוחיות מצופות קלתרין משתמשות ב- ARF1 ו- ARNO, אך COPII משתמש בחלבונים דומים הנקראים Sar1p ו- Sec12p.
איור\(\PageIndex{18}\). שלפוחיות מצופות COPT
ה- ARF1 (או Sar1p) משמש לגיוס חלבוני מתאם הנקשרים לקצה ה"זנב "של חלבוני קולטן הקשורים לממברנה. הקצה העסקי של הקולטנים הללו נקשר למולקולות רכב שצריך לארוז לתוך השלפוחית. חלבוני המתאם פועלים כקישור בין הממברנה (דרך הקולטנים) לחלבוני המעיל. עבור קלתרין, חלבוני המתאם הם AP1 עבור שלפוחיות שמקורן בטרנס-גולגי ו-AP2 עבור שלפוחיות אנדוציטיות. עבור שלפוחיות COPI, ההומולוגים המשוערים הם β-, γ-, δ- ו-- COP בעוד שמערכת COPII משתמשת ב- Sec23p ו- Sec24p.
לבסוף, המתאמים מקשרים לחלבוני המעיל בפועל: קלתרין, α- או ε- COP, Sec13p ו- Sec31p. המשותף לכל החלבונים הללו הוא שבאופן ספונטני (כלומר ללא כל דרישה להוצאת אנרגיה), הם מתאספים בעצמם למבנים כדוריים דמויי כלוב. מתחת למיקרוסקופ האלקטרונים, השלפוחיות המצופות קלתרין מוגדרות בצורה חדה יותר והצורות המשושה והמחומשות הגובלות על ידי יחידות המשנה של הקלתרין מעניקות לשלפוחית מראה "כדור כדורגל". שלפוחיות מצופות מעיל COP מעורפלות הרבה יותר במראה תחת EM.
לכל שלושת סוגי חלבוני מעיל השלפוחית יש את היכולת להתחבר באופן ספונטני למבנה כדורי, אך רק השלפוחית המצופה COPI ו- COPII גם "צובטת" את הממברנה באופן ספונטני כדי לשחרר את השלפוחית מהקרום שמקורו. שלפוחיות מצופות קלתרין דורשות מנגנון חיצוני לשחרור השלפוחית (איור). \(\PageIndex{19}\)
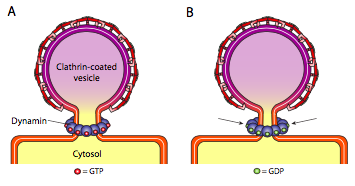
לאחר שהשלפוחית כמעט הושלמה, עדיין יש גבעול קטן או צוואר קרום המחבר את השלפוחית לקרום. סביב גבעול זה, מולקולות GTP דינמיות מצטברות במבנה טבעת/ספירלה. מולקולות דינמין הן GTPases כדוריים המתכווצים עם הידרוליזה של GTP. כאשר הם מתחברים סביב גבעול השלפוחית, כל חלבון דינמין מתכווץ, כאשר ההשפעה המשולבת של כיווץ הגבעול מספיק כדי שהממברנה תצבט יחד, אוטמת ומשחררת את השלפוחית מהממברנה המקורית.
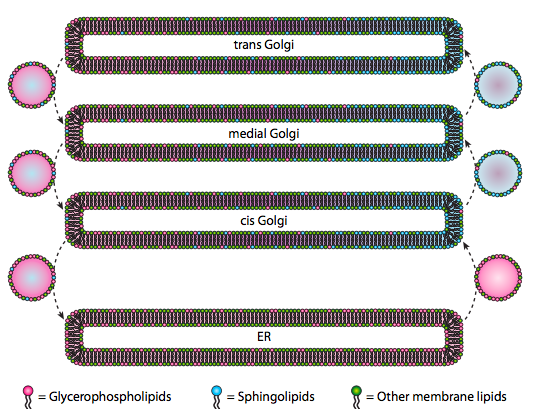
למרות ששומנים וממברנות נדונו בפרק 4, הזנחנו לדון במיקום הסינתזות שלהם באיקריוטים. כפי \(\PageIndex{20}\) שמציין איור, הסינתזה של סוגים מסוימים של שומנים היא מופרדת ובלעדית. גליצרופוספוליפידים נוצרים בעיקר ברטיקולום האנדופלזמי, אם כי הם מיוצרים גם במיטוכונדריה ובפרוקסיזומים. לעומת זאת, ספינגוליפידים אינם מיוצרים ב-ER (אם כי מבשרי הסרמיד שלהם הם) ביונקים, האנזימים הדרושים נמצאים בלומן של ה-cis וה-Golgi המדיאלי. ישנן עדויות לתנועה שלפוחית אנטרוגרדית ורטרוגרדית בין תאי הגולגי וה- ER השונים, מה שיעיד תיאורטית על חלוקה מחדש של סוגי השומנים. עם זאת, הספינגוליפידים נוטים להצטבר לרפסודות שומנים ונראה שהם מרוכזים יותר בשלפוחיות הנעות אנטרוגרד.
חלבוני המעיל יורדים זמן קצר לאחר שחרור שלפוחית. עבור קלתרין, התהליך כולל Hsc70, ATPase. עם זאת, עבור שלפוחיות מצופות COPI או COPII, נראה כי הידרוליזה של ה- GTP ב- ARF/SAR1p מחלישה את הזיקה לחלבון המעיל למתאמים ויוזמת ביטול ציפוי. מפעיל GTPase הוא ARF GAP (או SEC23p) והוא חלק בלתי נפרד מהמעיל COP I (או II).
השלפוחיות נושאות שתי קטגוריות של מטען: חלבונים מסיסים וחלבונים טרנסממברניים. מבין החלבונים המסיסים, חלקם נקלטים בשלפוחית מתוקף היותם קשורים לקולטן. חלבונים אחרים פשוט נמצאים בסביבה ונאספים ככל שנוצרת השלפוחית. מדי פעם נלקח חלבון שלא היה אמור להיות; לדוגמה, PDI עשוי להיות סגור בשלפוחית הנוצרת מה- ER. יש לו מעט תפקוד בגולגי, והוא נחוץ במיון, אז מה קורה לו? למרבה המזל, ל-PDI ולחלבוני ER רבים אחרים יש רצף אותות C-טרמינלי, KDEL (ליזין-אספרטיק-חומצה גלוטמית-לאוצין), שצועק "אני שייך למיון". רצף זה מזוהה על ידי קולטני KDEL בתוך הגולגי, וקשירה של חלבוני KDEL לקולטנים מעוררת היווצרות שלפוחית כדי לשלוח אותם בחזרה למיון.
שלפוחית הפרשה יש בעיה מיוחדת עם מטען מסיס. אם השלפוחית הייתה מסתמכת פשוט על סגירת חלבונים בתוכה במהלך תהליך ההיווצרות, יהיה קשה להשיג ריכוזים גבוהים של אותם חלבונים. חלבונים מופרשים רבים נחוצים לאורגניזם במהירות ובכמויות משמעותיות, ולכן קיים מנגנון בטרנס גולגי לצבירת חלבונים מפרישים. המנגנון משתמש בחלבונים מצטברים כגון secretogranin II וכרומוגרנין B המאגדים את חלבוני המטרה בגרגירים מרוכזים גדולים. גרנינים אלו פועלים בצורה הטובה ביותר בסביבת הטרנס גולגי של pH נמוך ו-Ca 2+ גבוה, כך שכאשר השלפוחית משחררת את תכולתה מחוץ לתא, ה-pH הגבוה יותר וה-Ca 2+ התחתון מפרקים את האגרגטים כדי לשחרר את החלבונים הבודדים.
יש שינוי pH עקבי במהלך התבגרותו של הגולגי, כך שככל שאנו עוברים מ- ER לגולגי, לכל תא יש pH לומנלי נמוך יותר (חומצי יותר).
לבסוף, יש את השאלה של מיקוד שלפוחית. השלפוחיות הרבה פחות שימושיות אם הן נזרקות על רכבת משא מולקולרית ויורדות באקראי. לכן, קיים מנגנון עגינה הדורש התאמה של חלבון V-snare על פני השטח הציטופלזמי של השלפוחית ושל ה-T-snare על המשטח הציטופלזמי של קרום המטרה. היתוך של שלפוחית לקרום ממשיך רק אם יש התאמה. אחרת, השלפוחית לא יכולה להתמזג, והיא תתחבר למנוע מולקולרי אחר כדי להגיע ליעד אחר, בתקווה נכון. תהליך זה נעזר בקשירת חלבונים אשר יוצרים בתחילה מגע עם שלפוחית נכנסת ומושכים אותה קרוב מספיק למטרה כדי לבדוק אינטראקציה בין חלבון SNARE. חלבונים אחרים על השלפוחית וממברנות המטרה מקיימים אינטראקציה ואם ה-SNAREs תואמים, יכולים לעזור "לכנף" את השלפוחית לתוך קרום המטרה, ואז הממברנות מתמזגות. כלל אצבע חשוב להבנת היתוך שלפוחית וגם הכיווניות של חלבוני הממברנה והשומנים, הוא שהצד הפונה לציטופלזמה של הממברנה תמיד עומד מול הציטופלזמה. לכן חלבון שנמצא בסופו של דבר על פני השטח החיצוניים של קרום התא יוחדר מלכתחילה למשטח הלומנלי של קרום ה- ER.
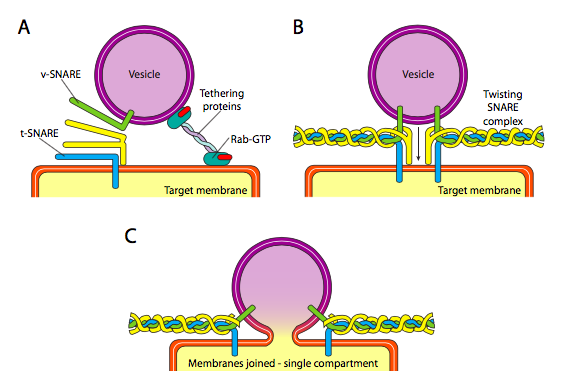
ליתר דיוק, כאשר שלפוחית מתקרבת לממברנת המטרה, חלבון הקשירה Rab-GTP, המקושר לקרום המטרה באמצעות זנב שומנים כפול של גרנילגרניל, מתחבר באופן רופף לשלפוחית ומחזיק אותו בקרבת קרום המטרה כדי לתת ל-SNARES הזדמנות לעבוד. ל- V-snares ו- T-snares יש כעת הזדמנות ליצור אינטראקציה ולבדוק התאמה. לאחרונה, SNAREs קיבלו את שמם R-SNARES ו- Q-SNARES, בהתאמה, בהתבסס על שאריות ארגינין וגלוטמין שמורות. בנוסף לשני ה- SNARE העיקריים הללו, מעורב לפחות SNARE אחד נוסף, ויוצרים יחד צרור של ארבעה סלילי α (ארבעה, לא שלושה, מכיוון שלפחות בדוגמה הנחקרת הטובה ביותר, אחד ה- SNARE כפוף כך ששניים מהתחומים האלפא-סליליים שלו משתתפים באינטראקציה. ארבעת הסלילים עוטפים זה את זה וחושבים שבזמן שהם עושים זאת, הם מושכים את השלפוחית ואת קרום המטרה יחד.
רעלן טטנוס, tetanospasmin, אשר משוחרר על ידי Clostridium tetani חיידקים, גורם עוויתות על ידי פעולה על תאי עצב, ומניעת שחרור נוירוטרנסמיטר. המנגנון לכך הוא שהוא מבקע סינפטוברווין, חלבון SNARE, כך שהשלפוחיות הסינפטיות לא יכולות להתמזג עם קרום התא. רעלן בוטולינום, מקלוסטרידיום בוטולינום, פועל גם על SNAREs למניעת היתוך שלפוחית ושחרור נוירוטרנסמיטר, אם כי הוא מכוון לנוירונים שונים ולכן יש לו השפעה הפוכה: טטנוס נגרם על ידי מניעת שחרורם של מעבירים עצביים מעכבים, ואילו בוטוליזם נגרם על ידי מניעת שחרור של נוירוטרנסמיטורים מעוררים.


