9.2: ויסות תעתיק אוקריוטי
- Page ID
- 208526
כמו כמעט בכל השוואה למערכות פרוקריוטיות, ויסות השעתוק האוקריוטי מורכב הרבה יותר מאשר בקרת גנים פרוקריוטיים, אם כי עדיין מבוסס על מנגנונים דומים של מפעילים ומדכאים. עם זאת, אין מקבילה אוקריוטית קרובה לאופרונים: גנים אוקריוטיים מתועתקים תמיד אחד לכל mRNA. הפרק הקודם תיאר את היווצרותו של קומפלקס טרום-התחלה של גורמי שעתוק עבור RNA פולימראז II. גורמי שעתוק אלה (למשל TFIID, TFIIH וכו ') ידועים כגורמי שעתוק כלליים, ונדרשים לשעתוק של כל גן בכל רמה. עם זאת, ישנם גם גורמי שעתוק ספציפיים, המכונים בדרך כלל פשוט גורמי שעתוק (TF), המווסתים את תדירות התעתיק של גנים מסוימים. חלק מהאלמנטים במעלה הזרם וה-TFs הקשורים אליהם שכיחים למדי, בעוד שאחרים הם ספציפיים לגן או למשפחת גנים. דוגמה לראשון הוא האלמנט במעלה הזרם AACCAAT וגורם השעתוק הקשור אליו, CP1. גורם שעתוק נוסף, Sp1, נפוץ באופן דומה, ונקשר לרצף קונצנזוס של ACGCCC. שניהם משמשים בשליטה על הגן בטא-גלובין, יחד עם גורמי שעתוק ספציפיים יותר, כגון GATA-1, הקושר קושר קונצנזוס AAGTATCACT ומיוצר בעיקר בתאי דם. זה ממחיש אפשרות נוספת שנמצאת בבקרה אוקריוטית שאינה נמצאת בפרוקריוטים: ביטוי גנים ספציפי לרקמות. גנים, הנמצאים ב- DNA, זמינים מבחינה טכנית לכל תא ותא, אך ברור שהצרכים של תא דם שונים מאוד מהצרכים של תא כבד, או נוירון. לכן, כל תא עשוי לייצר גורמי שעתוק הספציפיים לסוג התא או הרקמה שלו. גורמי שעתוק אלה יכולים לאחר מכן לאפשר או להדחיק ביטוי של גנים מרובים המסייעים לסוג התא המסוים הזה, בהנחה שלכולם יש את רצפי הזיהוי של ה-TFs. רצפי זיהוי אלה ידועים גם בשם רכיבי תגובה (RE).
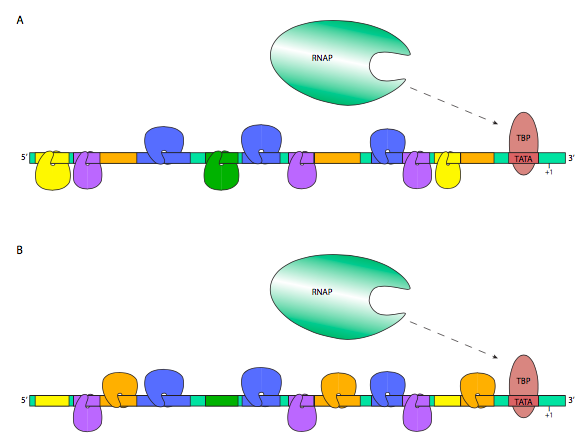
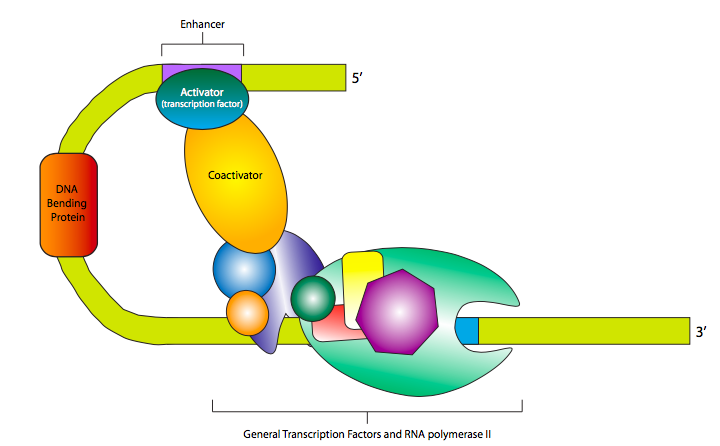
לעתים קרובות מאוד, שילוב של גורמי שעתוק רבים, הן משפרים והן משתיקי קול, אחראי לקצב הביטוי האולטימטיבי של גן אוקריוטי נתון. ניתן לעשות זאת בצורה מדורגת, שבה הביטוי מתחזק או נחלש ככל שיותר משפרים או משתיקי קול קשורים, בהתאמה, או שזה יכול להיות אופן שליטה בינארי, שבו נדרשת קבוצה מוגדרת היטב של TFs כדי להפעיל תמלול, וחסר רק אחד יכול למעשה לכבות את התמלול לחלוטין. במקרה הראשון, הפעלת TFs נקשרים בדרך כלל ל-GTFs או ל-RNA Polymerase II ישירות כדי לעזור להם לזהות את האמרגן בצורה יעילה או יציבה יותר, בעוד שהדחקת TFs עשויה להיקשר ל-TFs המפעילים, או ל-GTFs או RNAP II, במניעת הכרה של האמרגן, או לערער את יציבות קומפלקס ההתחלה המוקדמת של RNAP II. במקרה השני, ההפעלה תלויה בבניית אוזום שיפור, שבו גורמי שעתוק ואלמנטים של פיגומי חלבון וקו-אקטיבטורים מתאחדים כדי למקם ולייצב את קומפלקס ההתחלה מראש ו-RNAP II על האמרגן. הקואקטיבטור הבולט והכמעט בכל מקום נקרא מתווך, ונקשר ל- CTD של יחידת המשנה β 'של RNA פולימראז II וגם למגוון גורמי שעתוק.
גורמי שעתוק אוקריוטיים, למרות שהם מגוונים, מכילים בדרך כלל לפחות אחד מהמוטיבים הבאים של גורם השעתוק: אצבעות אבץ, רוכסני לאוצין, תחומים בסיסיים של סליל-לולאה-סליל, תחומי אזור הומולוגיה של Rel, או וריאציה שלהם.
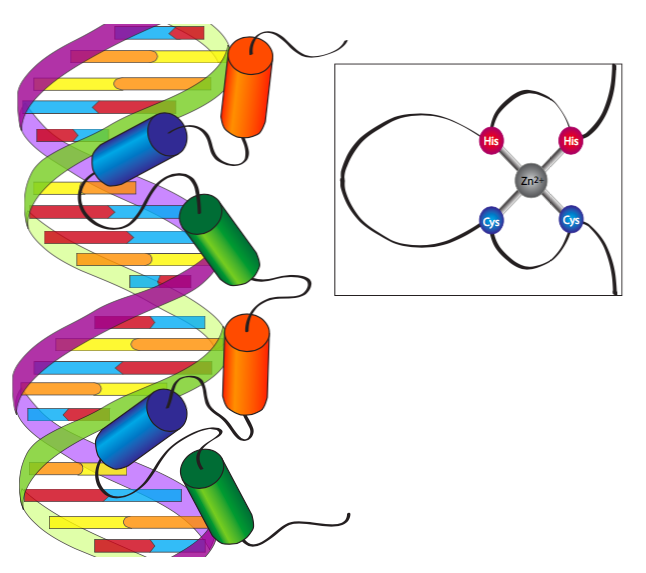
מוטיב אצבע האבץ היה התחום הראשון המחייב DNA שהתגלה, ונמצא בגורם שעתוק כללי הקשור ל- RNA פולימראז III. המבנה הראשוני שנמצא היה מוטיב חוזר של ~30 חומצות אמינו עם שני Cys בלתי משתנים ושני שיירי His בלתי משתנים הקושרים יחד יון Zn 2+ ובכך מביאים לולאה הדוקה או "אצבע" של שאריות בסיסיות שעלולות לקשור DNA יחד. האצבע הבסיסית נקשרת לחריץ הראשי של ה-DNA, כאשר המאפיינים המדויקים של התאמת הרצף נקבעים על ידי הטופולוגיה של השאריות המסוימות המרכיבות את האצבע. למרות שרוב המוטיבים המחייבים את ה-DNA מכניסים תחום α-סלילי טעון חיובי לחריץ הראשי של ה-DNA, חלבוני אצבע האבץ הם היחידים המשלבים מספר מוטיבים כאלה לאינטראקציה עם ה-DNA במספר אתרים עוקבים.
בנוסף לסוג הראשון של אתר הקישור Zn 2+ המתואר עם שני Cys ושני His (Cys 2 -His 2), ישנן שתי וריאציות עיקריות שיש לציין. הראשון הוא סוג Cys 2 -Cys 2, האופייני לגורמי שעתוק קולטן סטרואידים כמו הקולטן לגלוקוקורטיקואידים או קולטן לאסטרוגן. נשקול אותם ביתר פירוט בהמשך עם הדיון בהעברת אותות תוך תאיים, אך לעת עתה, הרעיון הכללי הוא שקולטני הורמון סטרואידים לא מופעלים נמצאים בציטופלזמה, שם הם באים במגע וקושרים את מולקולת ההורמונים המקושרת שלהם. לאחר מכן הם עוברים לגרעין, שם הם מתעמעמים ומסוגלים לפעול כגורמי שעתוק. הווריאציה העיקרית השנייה של אצבע האבץ היא Cys 6 הדו-גרעיני, הנושא שישה שאריות Cys ליצירת "סל" מעט גדול יותר בו מוחזקים שני יוני Zn 2+, ולא רק אחד. הדוגמה הנחקרת ביותר לסוג זה של חלבון אצבע אבץ היא GAL4, גורם שעתוק מטבולי שמרים.
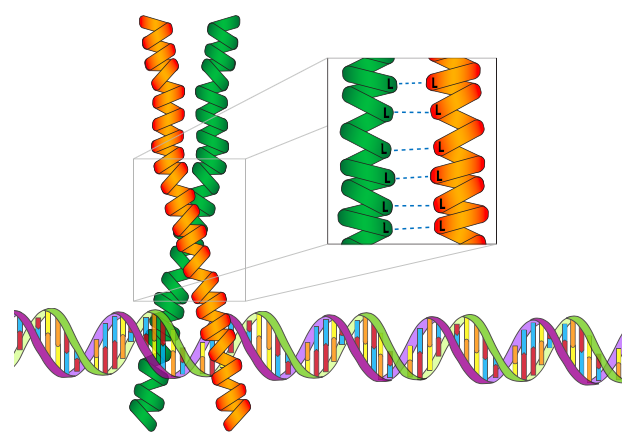
המוטיב הבא הוא רוכסן לאוצין. למרות שזהו מוטיב נפוץ לגורמי שעתוק, חשוב לציין שבניגוד לאצבע האבץ, רוכסן הלאוצין עצמו אינו מוטיב מחייב DNA. במקום זאת, זהו מוטיב דימריזציה של חלבון, וקובע את האופן שבו שתי יחידות משנה של חלבון מתקשרות. עם זאת, רוכסן לאוצין הוא מוטיב מבני נפוץ בגורמי שעתוק. זה עובד באמצעות תחומים מנוגדים של חומצות אמינו הידרופוביות במרווחים קבועים, במיוחד לאוצינים, אשר יעילים מאוד להחזיק את שתי יחידות המשנה יחד בסביבה המימית של התא. הלוצינים נמצאים בכל מיקום שאריות 7 של תחום α-סלילי, מה שמוביל למבנה על סליל מפותל כאשר שתי יחידות משנה מקיימות אינטראקציה. התחומים המחייבים את ה-DNA הטעונים (+) של חלבונים אלה הם בדרך כלל מסוף N לרוכסני לאוצין, כמו במקרה של קטגוריית bZip של חלבוני רוכסן לאוצין (השם מייצג רוכסן לאוצין אזור בסיסי).
נראה כי תחומי bHLH, או בסיסי סליל-לולאה-סליל הם פירוט על נושא רוכסן לאוצין. במקרה זה, האזור ה-N-טרמינלי הוא בסיסי ביותר, מה שהופך אותו לאידיאלי לאינטראקציה עם DNA, והתחום הבסיסי הזה, שהוא גם סלילי, מוביל לסליל הראשון (H1) של המוטיב, המחובר לאחר מכן על ידי לא לולאה סלילית של חומצות אמינו, המובילה לאזור סליל שני (H2). מעבר ל-bHLH, גורמי שעתוק אלה עשויים להתמזג למוטיב רוכסן לאוצין או לתחום אינטראקציה אחר של חלבון לצורך דימריזציה. למרות שתחום הקישור העיקרי הוא N-טרמינלי ל-H1, נראה שגם תחומי ה-H1 ממלאים תפקיד בקשירת החריץ העיקרי של ה-DNA. [דוגמה myc]
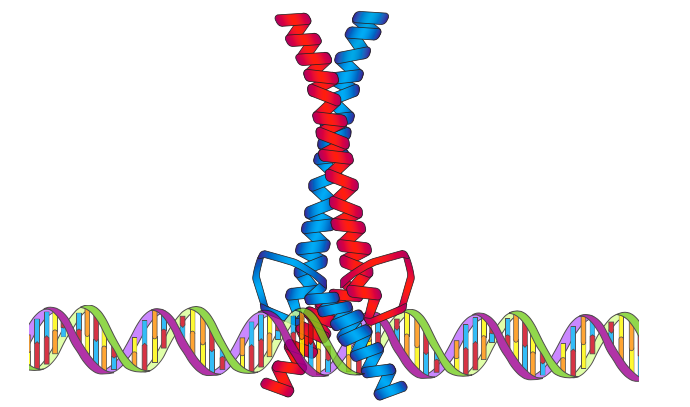
NF-kB (גורם גרעיני kB) הוא גורם שעתוק בכל מקום שהתגלה (והכי בולט) במערכת החיסון. כאשר הוא פעיל, זהו הטרודימר, כאשר שתי יחידות המשנה מכילות אזור הומולוגיה של Rel (RHR). Rel הוא אונקוגן, וה-RHR נקראים על שם הדמיון שלהם ל-rel ברצף בעבר. תחומי ה- RHR נקשרים ל- DNA עם זיקה יוצאת דופן, בין היתר בשל לולאות ve למגע DNA לכל יחידת משנה. בדיוק כמו בסוגים אחרים של גורמי שעתוק, חלק מהחלבונים המכילים RHR הם מדכאים, בעוד שאחרים הם מפעילים.
הרגולציה של NF-kB מעניינת למדי: ברגע שהיא נמצאת בגרעין, היא פעילה בדרך כלל. עם זאת, הוא, כמו כמעט כל החלבונים הסלולריים, מיוצר בציטופלזמה. מעכבי NF-kB (IkB) שוכנים גם בציטופלזמה, והם פועלים על ידי קשירת ה- NF-kB וכיסוי אות הלוקליזציה הגרעינית המאפשרת ייבוא שלו לגרעין. כך מבודד, ה-NF-kB חייב להישאר בציטופלזמה לא פעיל עד שגירוי כלשהו מפעיל את קינאז IkB, אשר מזרחן את ה-IKB ומוביל ל-ubiquitination והשפלה, ולבסוף משחרר את ה-NF-kB מהקשרים שלו.
מכיוון שניתן לגייס אותו במהירות (בהשוואה לסינתזה של חלבון חדש), NF-kB נחשב לגורם שעתוק תגובה מהירה המשמש לעתים קרובות כדי להתחיל ביטוי של גן הדרוש זמן קצר לאחר ש"הוזמן "על ידי אות, או חוץ תאי או תוך תאי. באופן לא מפתיע עבור גורם שהתגלה במערכת החיסון, הוא מופעל בתגובה לאנטיגנים חיידקיים ונגיפיים, כמו גם לסוגים אחרים של לחץ או עלבון תאי.
בנוסף לוויסות לטווח הקצר יחסית של ביטוי גנים הנשלט על ידי קשירת גורמי שעתוק לאלמנטים רגולטוריים, ישנן גם שיטות חזקות יותר לנעילת גן כדי למנוע את ביטויו. בפרק 7 נדונו אצטילציה ודה-אצטילציה של היסטונים כשיטה להפחתה והגברת הזיקה שלהם ל-DNA. זה יכול להיות נשלט (איור \(\PageIndex{11}\) B) על ידי גיוס של היסטון deacetylase (HDAC) לגנים מסוימים באמצעות קומפלקסים מדכא/מדכאי שיתוף. הדאצטילאז מאלץ סלילה הדוקה של ה-DNA הממוקד להיסטונים, ומונע גישה על ידי פולימראזות RNA או גורמי שעתוק כלליים.
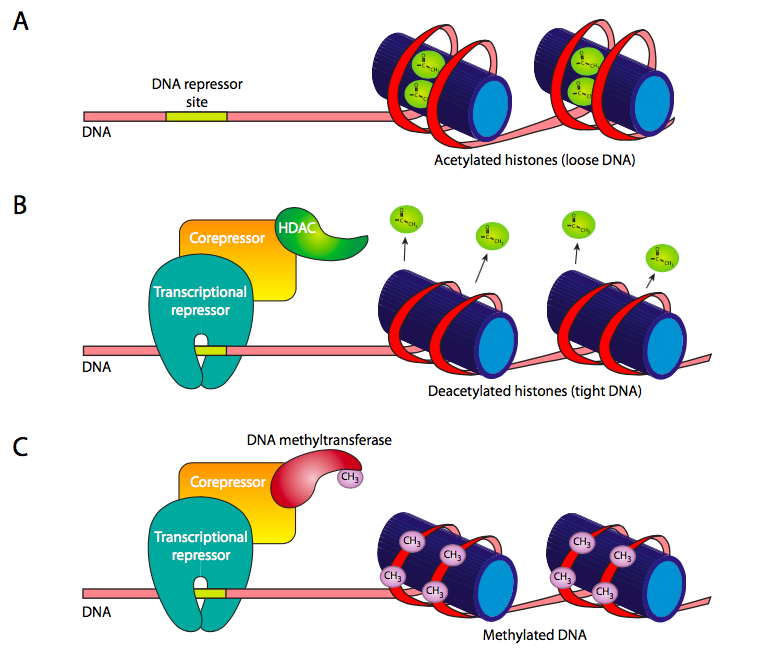
מגייס נוסף של HDAC הם חלבוני MBD, הנקשרים ל- DNA מתיל. מתילציה של DNA ביונקים מתרחשת בדרך כלל ברצפי דינוקלאוטידים CpG. נראה כי למתילציה זו יש השפעה של חסימת גישה של גורמי שעתוק ואנזימים ל- DNA. הוא יכול לעשות זאת ישירות, או על ידי גיוס חלבוני MBD (תחום מחייב מתיל-CPG). בכל מקרה, מתילציה היא שיטה ארוכת טווח לנעילת גנים, והיא המנגנון לכיבוי גנים שלעולם לא ישמשו בסוג תא מסוים (למשל המוגלובין בנוירונים).


