9.1: ויסות תעתיק פרוקריוטי
- Page ID
- 208527
בניגוד לאורגניזמים רב-תאיים, שבהם רוב התאים נמצאים בסביבה פנימית מוסדרת היטב, רוב התאים הפרוקריוטים מגיבים כל הזמן לתנאים משתנים בסביבתם הקרובה, כגון שינויים בריכוז המלח, הטמפרטורה, החומציות או זמינות החומרים התזונתיים. מכיוון שאורגניזמים אלה חייבים להגיב במהירות, אורך חייו של RNA נשמר קצר, בסדר גודל של מספר דקות - כך שמוצרי גנים שאינם שימושיים בתנאים החדשים אינם מבזבזים משאבים. מאותה סיבה, התחלת שעתוק חדש חייבת להתרחש גם היא במהירות רבה - כך שתוצרי גנים הדרושים לייצוב התא בתנאים החדשים זמינים במהירות. יש צורך במערכת בקרה מהירה ויעילה, ובפרוקריוטים זה אומר שהפקדים על שעתוק הם מפעילים ומדכאים פשוטים. עבור גנים מסוימים, שניהם עשויים לשמש לוויסות, ואילו עבור אחרים, יש צורך רק באחד כדי לשנות ממצב ברירת מחדל של ביטוי או אי ביטוי.
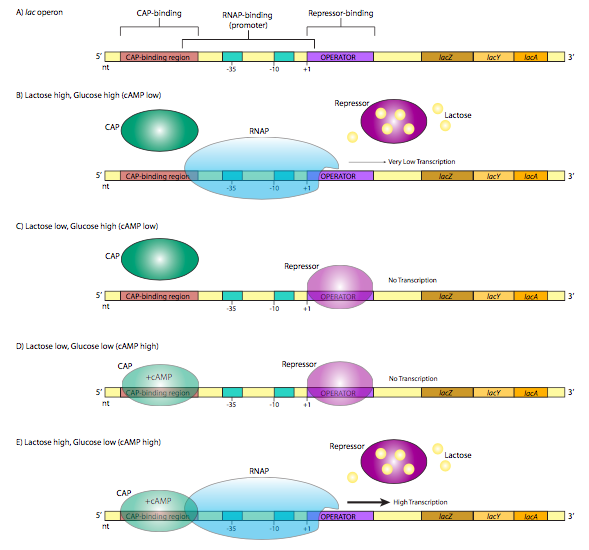
דוגמה קלאסית לשליטה מדכאת בביטוי הגנים, lac operon, ממחישה גם שיטה אחרת שבאמצעותה חיידקים עשויים לשלוט בביטוי הגנים. אופרון הוא קבוצה של גנים שמוצריהם משתתפים באותו מסלול מטבולי, ומתועתקים בשליטת מקדם יחיד. האופרון lac מורכב משלושה גנים (lacZ, LacY, lacA) המשתתפים בקטבוליזם של הדיסכריד, לקטוז. LacZ הוא β-galactosidase, אנזים המבקע לקטוז לגלקטוז וגלוקוז. LaCy הוא β-galactoside permease, המעביר לקטוז מהסביבה החוץ-תאית לתא. שניהם נדרשים לקטבוליזם לקטוז. באופן מוזר, LacA אינו נדרש לחלוטין למטבוליזם של לקטוז, אך תפקודו קשור לשניים האחרים: זהו טרנסצטילאז β-galactoside שמעביר קבוצות אצטיל מאצטיל-CoA ללקטוז. שלושתם מתורגמים (הם שומרים על קודוני ההתחלה והעצירה האישיים שלהם לתרגום, לא להתבלבל עם ההתחלה והעצירה של התמלול) מתמליל בודד. מעניין במיוחד ביחס להסדרת תעתיק זה הוא מבנה אזור המקדם. שים לב שבנוסף לאמרגן σ 70 הצפוי במעלה הזרם של אתר ההתחלה, יש רצף בקרה נוסף בכל צד של אתר ההתחלה (איור \(\PageIndex{1}\) A).
שים לב שמוטיב הסליל-סיבוב-סליל (HTH), הנפוץ בחלבונים קושרי DNA חיידקיים, אינו אותו דבר כמו החלבונים המחייבים את ה-DNA של סליל-לולאה-סליל המשמשים במערכות אוקריוטיות רבות. פירוט של מוטיב ה-HTH הבסיסי, המכונה מוטיב הסליל המכונף, נמצא גם במגוון חלבונים קושרים ל-DNA פרוקריוטיים.
האופרטור הוא רצף של DNA שנמצא בין האמרגן לאתר ההתחלה. הוא מזוהה על ידי מדכא lac, חלבון קושר DNA עם מוטיב סליל-סיבוב-סליל. בהיעדר לקטוז (איור \(\PageIndex{1}\) C), למדכא lac יש זיקה גבוהה לרצף האופרטור והוא נקשר בחוזקה, חוסם את אתר ההתחלה ויוצר "מחסום" פיזי לשעתוק על ידי מניעת ה-RNA פולימראז להתקדם מהפרומוטור. זה הגיוני מבחינה פיזיולוגית מכיוון שהתא יעיל יותר בחילוף חומרים של גלוקוז, ואם אין לקטוז בסביבה, אז זה בזבוז משאבים לייצר אנזימים המטבולים אותו. עם זאת, מה אם פתאום יש שפע של לקטוז בסביבה? כאשר הלקטוז נלקח לתא, הרמות התוך תאיות עולות, וכעת יש צורך באנזימים כדי לנצל את מקור המזון החדש הזה. הלקטוז למעשה מפעיל את הביטוי של אנזימים שיעברו חילוף חומרים! באופן ספציפי, הלקטוז נקשר לחלבון מדכא lac (4 אתרי קישור ללקטוז), מה שגורם לשינוי קונפורמטיבי שמשחרר אותו מרצף האופרטור (איור B). \(\PageIndex{1}\) כעת פולימראז RNA שמתחבר במקדם lac אופרון יכול להמשיך לתמלל את ההודעה ללא הפרעה, לייצר RNA ובהמשך חלבונים המשמשים לפירוק הלקטוז. זה נמשך כל עוד יש לקטוז בשפע בתא. ככל שרמות הלקטוז יורדות, חלבונים מדכאים אינם קשורים עוד ללקטוז, ויכולים שוב לקשור את המפעיל ולעכב שוב את ביטוי האופרון. לעת עתה, התעלם מחלבון CAP באיור\(\PageIndex{1}\), וחלקים D ו- E. נחזור לזה. ה lac אופרון הוא דוגמה לאופרון הניתן להשראה, שבו המצב המקומי "כבוי" והכנסת ומעורר (במקרה זה לקטוז) תקשור את המדכא ותפעיל את האופרון "דולק".
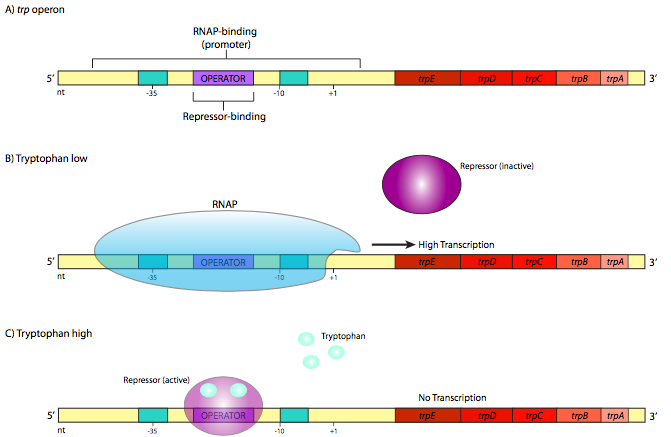
לעומת זאת, ישנם גם אופרונים עם מנגנון הפוך. דוגמה לאופרון אחד כזה שניתן להדחיק הוא האופרון trp (איור). \(\PageIndex{2}\) אופרון זה מכיל גנים המעורבים בסינתזה של חומצת האמינו טריפטופן: TrpE ו- TrpD, המקודדים יחד את יחידות המשנה של סינתטאז אנתרנילט, TrpC, המקודד N- (5'- phosphoribosyl) -אנתרנילט איזומראז, ו- TrpB ו- TrpA, אשר כל אחת מקודדת יחידות משנה של טריפטופן סינתטאז. מדכא ה-trp גדול ומורכב יותר ממדכא ה-lac, אך הוא משתמש גם במוטיב קושר DNA של סליל-סיבוב-סליל.
עם זאת, זה שונה בהיבט מכריע. בצורתו המקורית, הוא אינו נקשר לרצף האופרה. הוא נקשר למפעיל רק לאחר שקשר לראשונה טריפטופן (שתי מולקולות של trp נקשרות למדכא אחד). זה ההפך של מדכא lac, אבל כאשר בוחנים את הפונקציה הפיזיולוגית של גנים אלה, זה צריך להיות הגיוני לחלוטין. כל עוד אין טריפטופן, המפעיל אינו מאוגד, מה שמאפשר ל-RNA פולימראז לתמלל את הגנים הדרושים לייצור טריפטופן (איור \(\PageIndex{2}\) B). כאשר הצטבר מספיק טריפטופן בתא, חלק מהטריפטופן ה"אקסטרה" נקשר למדכא trp, שמפעיל אותו ומאפשר לו להיקשר למפעיל (איור \(\PageIndex{2}\) C). כשזה קורה, ה-RNAP לא יכול להגיע לאתר ההתחלה, ומשאבים לא מבוזבזים בתמלל גנים לאנזימים שיוצרים משהו שיש לתא כבר הרבה ממנו.
הבה נחזור כעת לאופרון לאק באיור\(\PageIndex{1}\). מסתבר שגם כאשר האופרון נגרם על ידי נוכחות לקטוז, קצב השעתוק נמוך. המגבלה אינה מהמדכא - שהוסר כמתואר לעיל (איור \(\PageIndex{1}\) B). במקום זאת, הביטוי הנמוך נובע ממקדם זיקה נמוכה. זה נכון לא רק לגבי lac אופרון, אלא גם גנים אחרים שאינם מסלול גלוקוז של סוכר-קטבוליזם. יש הסבר פשוט: גם אם יש שפע של סוכרים חלופיים זמינים (למשל לקטוז), אם יש גלוקוז זמין, זהו המסלול היעיל והמועדף ביותר של התא לייצור אנרגיה, וייצור אנזימים למסלולים אחרים יהיה שימוש לא יעיל במשאבים. אז מתי ואיך באמת מופעל האופרון לאק?
התשובה נעוצה בחלבון CAP, מפעיל גן קטבוליט, המכונה גם CRP, או חלבון קולטן cAMP. זהו חלבון קושר DNA הומודימרי קטן הנקשר לרצף החופף את הצד 5' של הפרומוטור. בנוכחות cAMP, הנקשר לחלבון, ל-CAP יש זיקה גבוהה לרצף זיהוי ה-DNA, והוא נקשר אליו (איור \(\PageIndex{1}\) E). לאחר מכן החלבון עוזר לגייס את ה-RNAP לאתר האמרגן, נקשר ישירות לתחום ה-C-terminal של ה-RNAP תת-יחידה כדי להגביר את הזיקה של הפולימראז לרצף האמרגן כדי להתגבר על מקדם חלש.
איך cAMP צריך לעשות עם זה? כאשר יש שפע של גלוקוז חוץ תאי, יש מעט cAMP. האנזים המסנתז cAMP, אדנילט ציקלאז, מווסת לרעה על ידי הובלת גלוקוז. עם זאת, כאשר יש מעט גלוקוז סביבתי, אדנילט ציקלאז פעיל יותר, מייצר cAMP, הקושר CAP, ומוביל לייצור חזק של אנזימי קטבוליזם של לקטוז. CAP הוא דוגמה למפעיל שיכול לשלוט בביטוי גנים בכיוון חיובי.
ב אי - קולי, רמות cAMP אינן קשורות ישירות לרמות גלוקוז תוך תאי או למטבוליזם של גלוקוז. במקום זאת, רמות cAMP משתנות על ידי הובלת גלוקוז דרך מערכת פוספוטרנספרז תלויה בפוספואנולפירובט (PTS), שחלקה מפוספס (תוצר הגן crr, הידוע גם בשם EIIA) כאשר גלוקוז מועבר פנימה. ה-EIIA~P הפוספורילי הוא מפעיל של אדנילט ציקלאז. לכן, כאשר הגלוקוז עובר לתא, רמות cAMP יורדות עקב ציקלאז אדנילט לא פעיל.
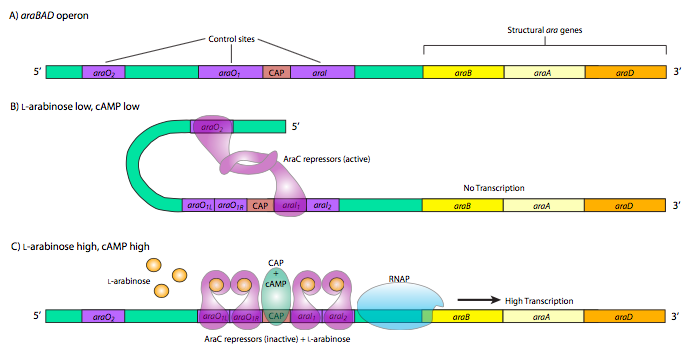
הדוגמה האחרונה והמסובכת ביותר לבקרת גנים מטבוליים פרוקריוטיים היא אופרון ArabAD. אופרון זה מייצר אנזימים המשמשים לקטבוליזם של סוכר 5 פחמן, L-arabinose. הדבר המעניין באופרון זה הוא נוכחותם של רכיבי בקרה חיוביים ושליליים המשמשים את אותו חלבון בקרה, AraC. כאשר יש מעט או ללא ערבינוז, ה- araC נקשר לרצפי האופרטור AraO2 ו- arAI1. לאחר מכן שני חלבוני ה- ARaC מקיימים אינטראקציה, מה שגורם ל- DNA להסתובב סביב מניעת RNAP להיקשר למקדם ולתמלל את AraBad. יתר על כן, אופרון זה נמצא גם בשליטת CAP, ומבנה הלולאה הכפול של AraC מונע גם את הקישור של CAP. עם זאת, כאשר יש שפע של ארבינוז, araC repres- sors קושרים את הערבינוז ואז מתקשרים בצורה שונה, עדיין יוצרים דימרים, אך כעת בקונפורמציה אחרת המובילה לקשירה של AraO1l ו- Arao1r יחד כמו גם arAI1 ו- ARAI2. ה- ARaC הקשור לערבינוזה באתרי AraI מקיים אינטראקציה עם RNAP ויחד עם CAP מקדמים הפעלה חזקה של ביטוי AraBad.
לא כל האופרונים עוסקים בתיאום פעילויות מטבוליות. אופרון לא מטבולי חשוב ב אי - קולי הוא אופרון התגובה Lexa/ RecA SOS, המכיל גנים המעורבים בתיקון DNA. מערכת התיקון SOS מופעלת כדי לאפשר לשכפול ה- DNA להמשיך דרך אזורים של DNA פגום, אך עם עונש של נאמנות נמוכה. אחד מתוצרי הגנים של אופרון זה, RecA, חשוב בזיהוי ותיקון נזקים הנגרמים מאור UV. הוא מתפקד גם כווסת של חלבון מדכא LexA. LexA הוא למעשה מדכא למספר אופרונים SOS, הנקשר לרצף אופרטור משותף במעלה הזרם של כל גן/אופרון. הוא מופעל כאשר RecA, לאחר גילוי נזק ל-DNA, עובר שינוי קונפורמטיבי ומפעיל פעילות פרוטאז, אשר לאחר מכן מבקעת את LexA, ומאפשרת שעתוק מהגנים/אופרונים של SOS.
תיקון SOS נוטה לשגיאות מכיוון שכאשר הרפליזום נתקל בנזק מגושם, הוא עובר "קריסת מזלג שכפול" שבה משתחררות יחידות ה- DNA פולימראז III. לפולימראזות החלופיות, או המעקפים, Pol IV (DinB) ו-Pol V (uMudC), אין פעילות אקסונוקלאז הגהה של 3'-5'. שילוב שגוי של G מול דימרים של תימין מתרחש בכמחצית מהשיעור של שילוב A תקין, ובאופן כללי, הפולימראזות העוקפות נוטות פי 1000 לטעויות מאשר Pol II או Pol I.


