ת: יסודות הפיזיקה והכימיה החשובים למיקרוביולוגיה
- Page ID
- 208945
כמו כל עניין אחר, העניין הכולל מיקרואורגניזמים נשלט על ידי חוקי הכימיה והפיזיקה. התכונות הכימיות והפיזיקליות של פתוגנים מיקרוביאליים - תאיים ואצלולריים כאחד - מכתיבים את בית הגידול שלהם, שולטים בתהליכים המטבוליים שלהם וקובעים כיצד הם מתקשרים עם גוף האדם. נספח זה מספק סקירה של כמה מעקרונות היסוד של כימיה ופיזיקה החיוניים להבנת המיקרוביולוגיה. רבים מהפרקים בטקסט זה - במיוחד ביוכימיה מיקרוביאלית ומטבוליזם מיקרוביאלי - מניחים שלקורא כבר יש הבנה של המושגים הנסקרים כאן.
מבנה אטומי
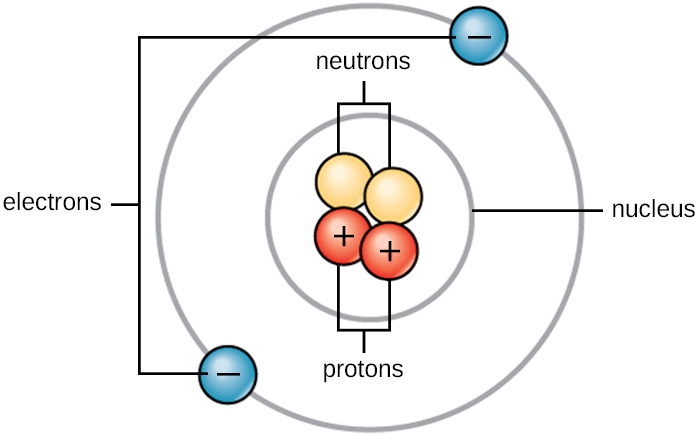
החיים מורכבים מחומר. החומר תופס מקום ויש לו מסה. כל החומר מורכב מאטומים. כל האטומים מכילים פרוטונים, אלקטרונים ונויטרונים (איור\(\PageIndex{1}\)). היוצא מן הכלל היחיד הוא מימן (H), העשוי מפרוטון אחד ואלקטרון אחד. פרוטון הוא חלקיק טעון חיובי השוכן בגרעין (ליבת האטום) של אטום ובעל מסה של יחידת מסה אטומית אחת (אמו) ומטען של +1. אלקטרון הוא חלקיק טעון שלילי הנע בחלל סביב הגרעין. אלקטרונים מופצים ברמות אנרגיה שונות הנקראות קליפות אלקטרונים. לאלקטרונים יש מסה זניחה ומטען של -1. נויטרונים, כמו פרוטונים, שוכנים בגרעין האטום. יש להם מסה של 1 אמו וללא מטען (ניטרלי). המטענים החיוביים (פרוטון) ושליליים (אלקטרונים) מאזנים זה את זה באטום ניטרלי, שיש לו מטען אפס נטו. מכיוון שלפרוטונים ונויטרונים יש מסה של 1 אמו, המסה של אטום שווה למספר הפרוטונים והנייטרונים של אותו אטום. מספר האלקטרונים אינו גורם למסה הכוללת מכיוון שמסת האלקטרונים כל כך קטנה.
אלמנטים כימיים
כל החומר מורכב מאטומים של יסודות. לאלמנטים יש תכונות פיזיקליות וכימיות ייחודיות והם חומרים שלא ניתן להפוך בקלות פיזית או כימית לחומרים אחרים. לכל אלמנט ניתן שם, שמקורו בדרך כלל מלטינית או אנגלית. לאלמנטים יש גם סמלים של אות אחת או שתיים המייצגים את השם; לדוגמה, נתרן (Na), זהב (Au) וכסף (Ag) כוללים קיצורים הנגזרים משמותיהם הלטיניים המקוריים natrium, aurum ו- argentum, בהתאמה. דוגמאות לקיצורים באנגלית הן פחמן (C), מימן (H), חמצן (O) וחנקן (N). בסך הכל זוהו 118 יסודות שונים (92 מהם מתרחשים באופן טבעי) ואורגנו בטבלת היסודות המחזורית. מבין היסודות המופיעים באופן טבעי, פחות מ -30 נמצאים באורגניזמים על פני כדור הארץ, וארבעה מהם (C, H, O ו- N) מהווים כ -96% ממסת האורגניזם. 1
כל יסוד ייחודי מזוהה על ידי מספר הפרוטונים בגרעין האטום שלו. בנוסף לפרוטונים, גרעין האטום של כל יסוד מכיל מספר שווה או גדול יותר של נויטרונים (למעט מימן, שיש בו רק פרוטון אחד). המספר הכולל של פרוטונים ליסוד מתואר כמספר האטומי, והמסה המשולבת של פרוטונים ונויטרונים נקראת המסה האטומית או מספר המסה. לכן, ניתן לקבוע את מספר הנייטרונים על ידי הפחתת המספר האטומי ממספר המסה.
איזוטופים הם צורות שונות של אותו יסוד שיש להם מספר זהה של פרוטונים, אך מספר שונה של נויטרונים. לאלמנטים רבים יש כמה איזוטופים עם איזוטופ אחד או שניים נפוצים בטבע. לדוגמה, פחמן-12 (12 צלזיוס), האיזוטופ הנפוץ ביותר של פחמן (98.6% מכל C שנמצא על פני כדור הארץ), 2 מכיל שישה פרוטונים ושישה נויטרונים. לכן יש לו מספר מסה של 12 (6 פרוטונים + 6 נויטרונים) ומספר אטומי של 6.
ישנם שני סוגים נוספים של איזוטופים בטבע: איזוטופים כבדים ורדיואיזוטופים. לאיזוטופים כבדים יש נויטרון נוסף אחד או יותר תוך שמירה על גרעין אטום יציב. דוגמה לאיזוטופ כבד הוא פחמן-13 (13 צלזיוס) (1.1% מכלל הפחמן). 3 13 C יש מספר מסה של 13 (6 פרוטונים + 7 נויטרונים). מכיוון שהמספר האטומי של 13 C הוא 6, הוא עדיין היסוד פחמן; עם זאת, יש לו יותר מסה מהצורה הנפוצה יותר של היסוד, 12 C, בגלל הנויטרון הנוסף בגרעין. פחמן-14 (14 C) (0.0001% מכלל הפחמן) 4 הוא דוגמה לרדיואיזוטופ. ל- 14 C יש מספר מסה של 14 (6 פרוטונים + 8 נויטרונים); עם זאת, הנויטרונים הנוספים ב- 14 C גורמים לגרעין לא יציב. חוסר יציבות זה מוביל לתהליך של ריקבון רדיואקטיבי. ריקבון רדיואקטיבי כרוך באובדן של נויטרון אחד או יותר ושחרור אנרגיה בצורה של קרני גמא, חלקיקי אלפא או חלקיקי בטא (תלוי באיזוטופ).
איזוטופים כבדים ורדיואיזוטופים של פחמן ואלמנטים אחרים הוכחו כשימושיים במחקר, בתעשייה וברפואה.
קשרים כימיים
ישנם שלושה סוגים של קשרים כימיים החשובים כאשר מתארים את האינטראקציה של אטומים הן בתוך והן בין מולקולות במיקרוביולוגיה: (1) קשרים קוולנטיים, שיכולים להיות קוטביים או לא קוטביים, (2) קשרים יוניים ו- (3) קשרי מימן. ישנם סוגים אחרים של אינטראקציות כגון כוחות פיזור לונדון וכוחות ואן דר ואלס שניתן לדון בהם גם כאשר מתארים את התכונות הפיזיקליות והכימיות של האינטראקציות הבין-מולקולריות של אטומים, אך לא נכלול כאן תיאורים של כוחות אלה.
קשר כימי נקבע על ידי מעטפת האלקטרונים החיצונית ביותר, הנקראת אלקטרוני הערכיות (VE), של אטום. מספר ה- VE חשוב בעת קביעת מספר וסוג הקשרים הכימיים שייווצר אטום.
אג"ח קוולנטיות
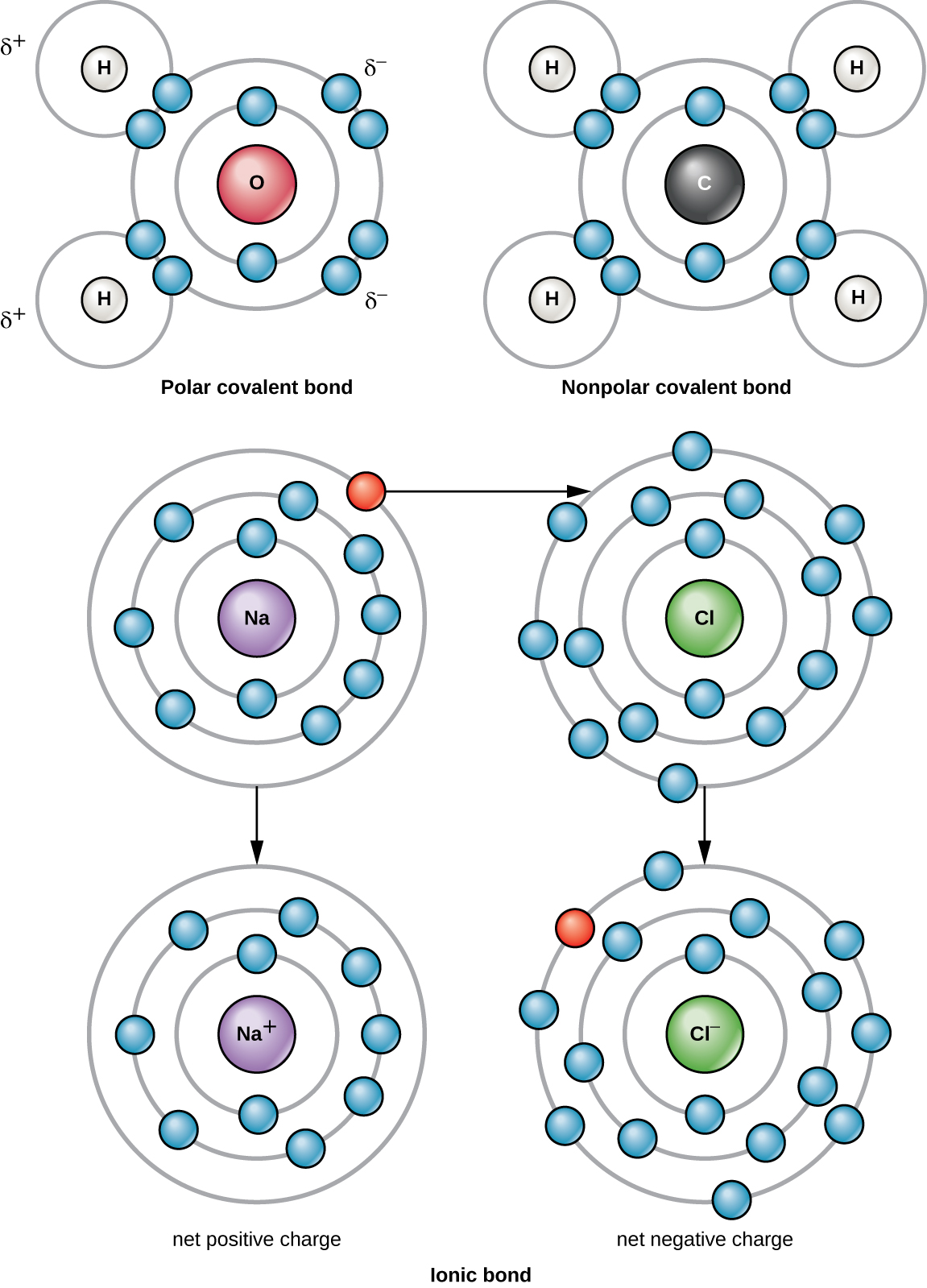
הקשר הכימי החזק ביותר בין שני אטומים או יותר הוא קשר קוולנטי. קשרים אלה נוצרים כאשר אלקטרון משותף בין שני אטומים, ואלו הם הצורה הנפוצה ביותר של קשר כימי באורגניזמים חיים. קשרים קוולנטיים נוצרים בין אטומי היסודות המרכיבים את המולקולות הביולוגיות בתאים שלנו. דוגמה למולקולה פשוטה הנוצרת עם קשרים קוולנטיים היא מים, H 2 O, עם VE אחד לכל אטום H ו- 6 VE לאטום O. בגלל תצורת VE, כל אטום H מסוגל לקבל VE נוסף אחד וכל אטום O מסוגל לקבל שני VE נוספים. כאשר חולקים אלקטרונים, אטומי המימן והחמצן המתחברים ליצירת מולקולות מים נקשרים זה לזה על ידי קשרים קוולנטיים (איור\(\PageIndex{2}\)). האלקטרון מאטום המימן מחלק את זמנו בין מעטפת האלקטרונים החיצונית של אטום המימן לבין מעטפת האלקטרונים החיצונית ביותר של אטום החמצן. כדי למלא לחלוטין את הקליפה החיצונית של אטום חמצן, יש צורך בשני אלקטרונים משני אטומי מימן, ומכאן הכתב "2" המציין שני אטומים של H במולקולה של H 2 O. שיתוף זה הוא מצב אנרגיה נמוך יותר עבור כל האטומים המעורבים מאשר אם הם היו קיימים ללא הקונכיות החיצוניות שלהם מלאות.
ישנם שני סוגים של קשרים קוולנטיים: קוטביים ולא קוטביים. קשרים קוולנטיים לא קוטביים נוצרים בין שני אטומים של יסודות זהים או שונים החולקים את האלקטרונים באופן שווה (איור\(\PageIndex{2}\)). בקשר קוולנטי קוטבי, האלקטרונים המשותפים לאטומים מבלים יותר זמן קרוב יותר לגרעין אחד מאשר לגרעין השני. בגלל ההתפלגות הלא שוויונית של האלקטרונים בין הגרעינים השונים, מתפתח מטען מעט חיובי (δ+) או מעט שלילי (δ—). מים הם דוגמה למולקולה הנוצרת עם קשרים קוולנטיים קוטביים (איור\(\PageIndex{2}\)).
יונים וקשרים יוניים
כאשר אטום אינו מכיל מספר שווה של פרוטונים ואלקטרונים, הוא נקרא יון. מכיוון שמספר האלקטרונים אינו שווה למספר הפרוטונים, לכל יון יש מטען נטו. יונים חיוביים נוצרים על ידי איבוד אלקטרונים ונקראים קטיונים. יונים שליליים נוצרים על ידי השגת אלקטרונים ונקראים אניונים.
לדוגמה, לאטום נתרן יש רק אלקטרון אחד בקליפה החיצונית ביותר שלו. אטום הנתרן דורש פחות אנרגיה כדי לתרום את האלקטרון האחד הזה מאשר לקבל שבעה אלקטרונים נוספים, אותם הוא יצטרך למלא את הקליפה החיצונית שלו. אם אטום הנתרן מאבד אלקטרון, יש לו כעת 11 פרוטונים ורק 10 אלקטרונים, מה שמשאיר אותו עם מטען כולל של +1. זה נקרא כיום יון נתרן (Na +).
לאטום כלור יש שבעה אלקטרונים במעטפת החיצונית שלו. שוב, אטום הכלור יעיל יותר באנרגיה להשיג אלקטרון אחד מאשר לאבד שבעה. לכן, סביר יותר שהוא ישיג אלקטרון ליצירת יון עם 17 פרוטונים ו -18 אלקטרונים, ויעניק לו מטען שלילי נטו (-1). כיום הוא נקרא יון כלוריד (Cl —). תנועה זו של אלקטרונים מאטום אחד למשנהו מכונה העברת אלקטרונים. מכיוון שמטענים חיוביים ושליליים מושכים, יונים אלה נשארים יחד ויוצרים קשר יוני, או קשר בין יונים. כאשר יוני Na + ו-Cl — מתחברים לייצור NaCl, אלקטרון מאטום נתרן נשאר עם שבעת האחרים מאטום הכלור, ויוני הנתרן והכלוריד מושכים זה את זה בסריג של יונים עם מטען אפס נטו (איור\(\PageIndex{2}\)).
יונים פוליאטומיים מורכבים ממספר אטומים המחוברים לקשרים קוולנטיים; אך בניגוד למולקולה, ליון פוליאטומי יש מטען חיובי או שלילי. הוא מתנהג כקטיון או אניון ולכן יכול ליצור קשרים יוניים עם יונים אחרים ליצירת תרכובות יוניות. האטומים ביון פוליאטומי עשויים להיות מאותו יסוד או יסודות שונים.
הטבלה \(\PageIndex{1}\) מפרטת כמה קטיונים ואניונים המופיעים בדרך כלל במיקרוביולוגיה. שים לב שטבלה זו כוללת יונים מונוטומיים כמו גם יונים פוליאטומיים.
| קטיונים | אניונים | ||
|---|---|---|---|
| נתרן | נה + | כלוריד | Cl — |
| מימן | H + | ביקרבונט | \(\ce{HCO3-}\) |
| אשלגן | K + | קרבונט | \(\ce{CO3^2-}\) |
| אמוניום | \(\ce{NH4+}\) | מימן גופרתי | \(\ce{H2SO4^2-}\) |
| נחושת (I) | Cu + | מימן גופרתי | HS - |
| נחושת (II) | Cu 2+ | הידרוקסיד | הו — |
| ברזל (II) | פה 2+ | היפוכלוריט | קלו — |
| ברזל (3) | פה 3+ | ניטריט | \(\ce{NO2-}\) |
| חנקה | \(\ce{NO3-}\) | ||
| פרוקסיד | \(\ce{O2^2-}\) | ||
| זרחה | \(\ce{PO4^3-}\) | ||
| פירופוספט | \(\ce{P2O7^4-}\) | ||
| סולפיט | \(\ce{SO3^2-}\) | ||
| תיוסולפט | \(\ce{S2O3^2-}\) | ||
נוסחה מולקולרית, מסה מולקולרית ושומה
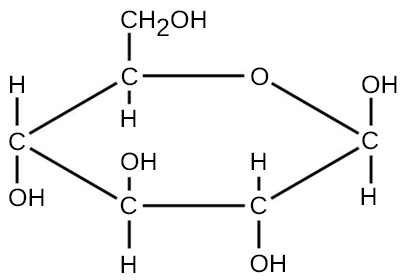
עבור מולקולות הנוצרות על ידי קשרים קוולנטיים, הנוסחה המולקולרית מייצגת את מספר וסוגי האטומים היסודיים המרכיבים את המולקולה. כדוגמה, לשקול מולקולה של גלוקוז, אשר יש את הנוסחה המולקולרית C 6 H 12 O 6. נוסחה מולקולרית זו מצביעה על כך שמולקולה אחת של גלוקוז נוצרת משישה אטומי פחמן, שנים עשר אטומי מימן ושישה אטומי חמצן.
ניתן לחשב את המסה המולקולרית של מולקולה באמצעות הנוסחה המולקולרית והמסה האטומית של כל יסוד במולקולה. המספר של כל סוג אטום מוכפל במסה האטומית; ואז המוצרים מתווספים כדי לקבל את המסה המולקולרית. לדוגמה המסה המולקולרית של גלוקוז, C 6 H 12 O 6 (איור\(\PageIndex{3}\)), מחושבת כ:
\ [\ התחל {מערך} {l}
\ טקסט {מסה של פחמן} & =12\:\ frac {\ mathrm {amu}} {\ mathrm {atom}\ פעמים 6\ טקסט {amu}\\ טקסט {מסה של מימן} & = 1
\:\ frac {\ mathrm {amu}} {\ mathrm {atom {}\ פעמים 12\ טקסט {אטומים} =12\ טקסט {אמו}\\\ טקסט {מסת חמצן} & =16\:
\ frac {\ mathrm {amu}} {\ mathrm {atom}}\ פעמים 6\ טקסט {אטומים} = 96\ טקסט {amu}\ טקסט {amu}} +96\ טקסט {אמו} =180
\ טקסט {אמו}\ סוף {מערך}\]
מספר הישויות המרכיבות שומה נקבע בניסוי להיות 6.022 × 10 23, קבוע בסיסי בשם המספר של אבוגדרו (NA) או קבוע אבוגדרו. קבוע זה מדווח כראוי עם יחידה מפורשת של "לכל שומה".
אנרגיה
תרמודינמיקה מתייחסת לחקר האנרגיה והעברת האנרגיה הכרוכה בחומר פיזי.
חומר המשתתף במקרה מסוים של העברת אנרגיה נקרא מערכת, וכל מה שמחוץ לחומר זה נקרא הסביבה. ישנם שני סוגים של מערכות: פתוח וסגור. במערכת פתוחה ניתן להחליף אנרגיה עם סביבתה. מערכת סגורה אינה יכולה להחליף אנרגיה עם סביבתה. אורגניזמים ביולוגיים הם מערכות פתוחות. אנרגיה מוחלפת בינם לבין סביבתם כאשר הם משתמשים באנרגיה מהשמש לביצוע פוטוסינתזה או צורכים מולקולות אוגרות אנרגיה ומשחררים אנרגיה לסביבה על ידי ביצוע עבודה ושחרור חום. כמו כל הדברים בעולם הפיזי, האנרגיה כפופה לחוקים פיזיקליים. באופן כללי, אנרגיה מוגדרת כיכולת לבצע עבודה, או ליצור שינוי כלשהו. אנרגיה קיימת בצורות שונות. לדוגמה, אנרגיה חשמלית, אנרגיית אור ואנרגיית חום הם כולם סוגים שונים של אנרגיה. החוק הראשון של התרמודינמיקה, המכונה לעתים קרובות חוק שימור האנרגיה, קובע כי כמות האנרגיה הכוללת ביקום קבועה ושמורה. אנרגיה קיימת בצורות רבות ושונות. על פי החוק הראשון של התרמודינמיקה, אנרגיה עשויה להיות מועברת ממקום למקום או להפוך אותה לצורות שונות, אך לא ניתן ליצור אותה או להרוס אותה.
האתגר של כל האורגניזמים החיים הוא להשיג אנרגיה מסביבתם בצורות שהם יכולים להעביר או להפוך לאנרגיה שמישה לביצוע עבודה. מיקרואורגניזמים התפתחו כדי לעמוד באתגר זה. אנרגיה כימית המאוחסנת בתוך מולקולות אורגניות כגון סוכרים ושומנים מועברת והופכת באמצעות סדרה של תגובות כימיות תאיות לאנרגיה בתוך מולקולות ATP. אנרגיה במולקולות ATP נגישה בקלות לביצוע עבודה. דוגמאות לסוגי העבודה שהתאים צריכים לבצע כוללות בניית מולקולות מורכבות, הובלת חומרים, הפעלת תנועת ריסים או דגלים והתכווצות סיבי שריר ליצירת תנועה.
המשימות העיקריות של מיקרואורגניזם להשיג, לשנות ולהשתמש באנרגיה לביצוע עבודה עשויות להיראות פשוטות. עם זאת, החוק השני של התרמודינמיקה מסביר מדוע משימות אלה קשות יותר מכפי שהן נראות. כל העברות האנרגיה והטרנספורמציות לעולם אינן יעילות לחלוטין. בכל העברת אנרגיה, כמות מסוימת של אנרגיה הולכת לאיבוד בצורה שאינה שמישה. ברוב המקרים, צורה זו היא אנרגיית חום. מבחינה תרמודינמית, אנרגיית החום מוגדרת כאנרגיה המועברת ממערכת אחת לאחרת שאינה עבודה. לדוגמה, אנרגיה מסוימת הולכת לאיבוד כאנרגיית חום במהלך תגובות מטבוליות תאיות.
ככל שהולכת לאיבוד יותר אנרגיה על ידי מערכת לסביבתה, המערכת פחות מסודרת ואקראית יותר. מדענים מתייחסים למדד האקראיות או ההפרעה בתוך מערכת כאנטרופיה. אנטרופיה גבוהה פירושה הפרעה גבוהה ואנרגיה נמוכה. למולקולות ולתגובות כימיות יש גם אנטרופיה משתנה. לדוגמה, האנטרופיה עולה ככל שמולקולות בריכוז גבוה במקום אחד מתפזרות ומתפשטות. החוק השני של התרמודינמיקה אומר שאנרגיה תמיד תאבד כחום בהעברת אנרגיה או טרנספורמציות. מיקרואורגניזמים מסודרים מאוד, הדורשים קלט אנרגיה קבוע להישמר במצב של אנטרופיה נמוכה.
תגובות כימיות
תגובות כימיות מתרחשות כאשר שני אטומים או יותר מתחברים יחד ליצירת מולקולות או כאשר אטומים קשורים מתפרקים. החומרים המשמשים בתגובה כימית נקראים המגיבים (נמצאים בדרך כלל בצד שמאל של משוואה כימית), והחומרים המיוצרים מהתגובה ידועים כתוצרים (נמצאים בדרך כלל בצד ימין של משוואה כימית). בדרך כלל נמשך חץ בין המגיבים והתוצרים כדי לציין את כיוון התגובה הכימית; כיוון זה אינו תמיד "רחוב חד כיווני".
דוגמה לתגובה כימית פשוטה היא פירוק מולקולות מי חמצן, שכל אחת מהן מורכבת משני אטומי מימן הקשורים לשני אטומי חמצן (H 2 O 2). מי חמצן המגיב מתפרק למים, מכיל אטום חמצן אחד הקשור לשני אטומי מימן (H 2 O), וחמצן, המורכב משני אטומי חמצן קשורים (O 2). במשוואה שלהלן, התגובה כוללת שתי מולקולות מי חמצן ושתי מולקולות מים. זוהי דוגמה למשוואה כימית מאוזנת, שבה מספר האטומים של כל יסוד זהה בכל צד של המשוואה. על פי חוק שימור החומר, מספר האטומים לפני ואחרי תגובה כימית צריך להיות שווה, כך שאף אטומים, בנסיבות רגילות, לא נוצרים או נהרסים.
\[\ce{2H2O2\:(hydrogen\: peroxide)⟶2H2O\:(water) + O2\:(oxygen)}\]
כמה תגובות כימיות, כמו זו המוצגת לעיל, יכולות להתקדם בכיוון אחד עד שהמגיבים ייגמרו. משוואות המתארות תגובות אלו מכילות חץ חד כיווני והן בלתי הפיכות. תגובות הפיכות הן אלו שיכולות ללכת לשני הכיוונים. בתגובות הפיכות, מגיבים הופכים למוצרים, אך כאשר ריכוז המוצר עולה מעל סף מסוים (המאפיין את התגובה המסוימת), חלק מהמוצרים הללו יומרו בחזרה למגיבים; בשלב זה, ייעודם של מוצרים ומגיבים מתהפכים. השינויים בריכוז נמשכים עד שמתרחש איזון יחסי מסוים בריכוז בין מגיבים למוצרים - מצב הנקרא שיווי משקל כימי. בשלב זה, הן התגובות קדימה והן לאחור ממשיכות להתרחש, אך הן עושות זאת באותו קצב, כך שריכוזי המגיבים והתוצרים אינם משתנים. מצבים אלה של תגובות הפיכות מסומנים לעתים קרובות על ידי משוואה כימית עם חץ דו-ראשי המצביע לכיוון המגיבים והתוצרים כאחד. לדוגמה, כאשר פחמן דו חמצני מתמוסס במים, הוא יכול לעשות זאת כגז המומס במים או על ידי תגובה עם מים לייצור חומצה פחמנית. בתאים של מיקרואורגניזמים מסוימים, קצב ייצור החומצה הפחמנית מואץ על ידי האנזים פחמן אנהידראז, כפי שמצוין במשוואה הבאה:
\[\ce{CO2 + H2O \stackrel{carbonic}{\stackrel{anhydrase}{\rightleftharpoons}} H2CO3 \rightleftharpoons H+ + HCO3-}\]
תכונות של מים ופתרונות
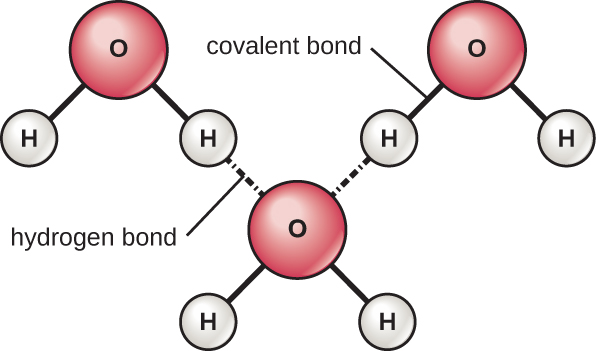
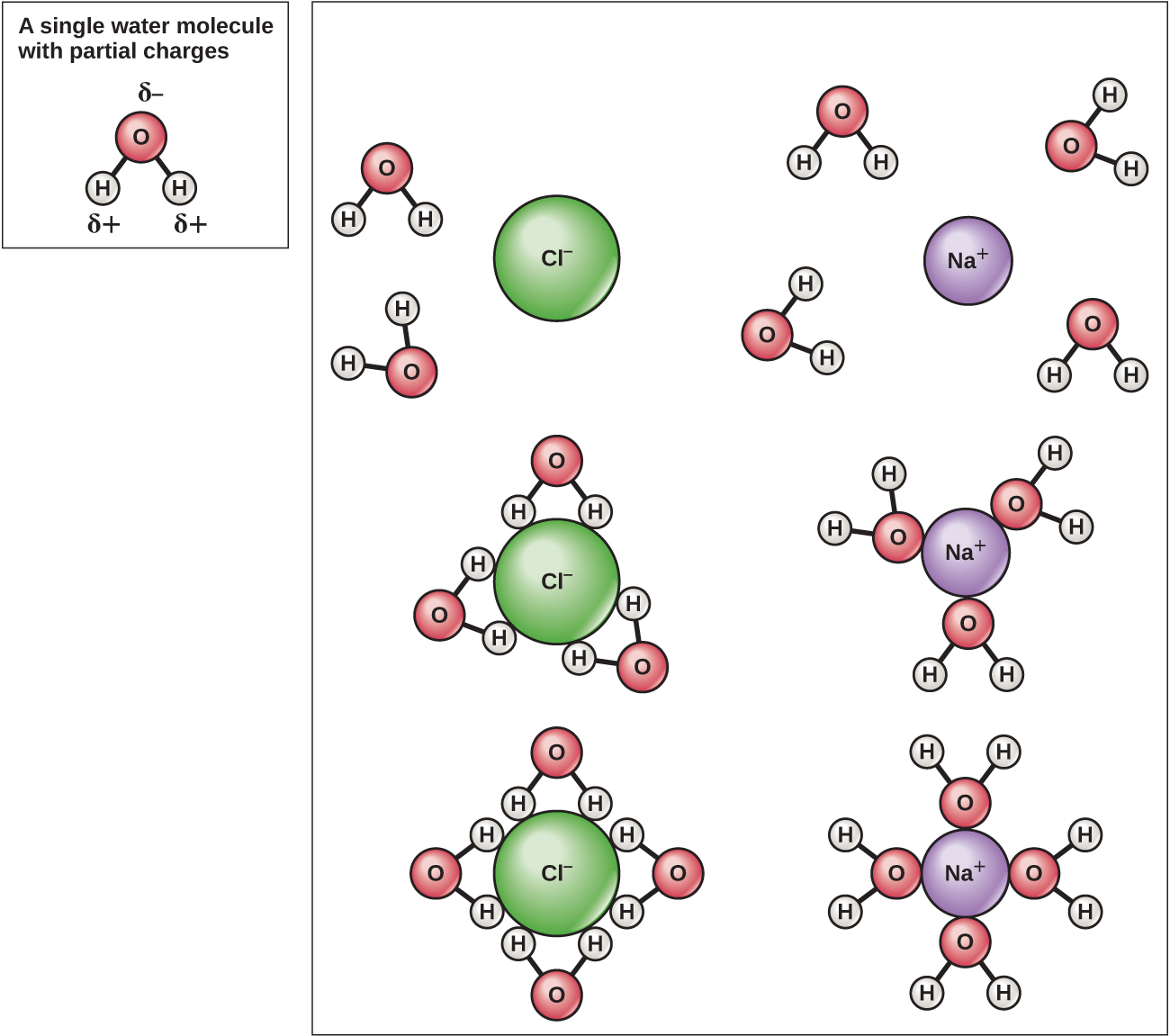
אטומי המימן והחמצן בתוך מולקולות המים יוצרים קשרים קוולנטיים קוטביים. אין מטען כולל למולקולת מים, אך יש + אחד על כל אטום מימן ושני — על אטום החמצן. כל מולקולת מים מושכת מולקולות מים אחרות בגלל המטענים החיוביים והשליליים בחלקים השונים של המולקולה (איור\(\PageIndex{4}\)). מים מושכים גם מולקולות קוטביות אחרות (כגון סוכרים) ויוצרים קשרי מימן. כאשר חומר יוצר בקלות קשרי מימן עם מים, הוא יכול להתמוסס במים ומכונה הידרופילי ("אוהב מים"). קשרי מימן אינם נוצרים בקלות עם חומרים לא קוטביים כמו שמנים ושומנים. תרכובות לא קוטביות אלו הינן הידרופוביות ("חוששות מים") והן יתכוונו הרחק ממים וימנעו מהם.
קשרי המימן במים מאפשרים לו לספוג ולשחרר אנרגיית חום לאט יותר מחומרים רבים אחרים. המשמעות היא שמים ממתנים את שינויי הטמפרטורה בתוך אורגניזמים ובסביבתם. ככל שקלט האנרגיה נמשך, האיזון בין היווצרות קשרי מימן לשבירה מתנדנד לעבר פחות קשרי מימן: יותר קשרים נשברים ממה שנוצרים. תהליך זה מביא לשחרור מולקולות מים בודדות על פני הנוזל (כגון גוף מים, עלים של צמח או עור של אורגניזם) בתהליך הנקרא אידוי.
לעומת זאת, ככל שהתנועה המולקולרית יורדת והטמפרטורות יורדות, קיימת פחות אנרגיה לשבירת קשרי המימן בין מולקולות המים. קשרים אלה נשארים שלמים ומתחילים ליצור מבנה קשיח דמוי סריג (למשל קרח). כשהוא קפוא, הקרח פחות צפוף (המולקולות רחוקות יותר זו מזו) מאשר מים נוזליים. המשמעות היא שקרח צף על פני גוף מים. באגמים, בבריכות ובאוקיינוסים, קרח ייווצר על פני המים, ויוצר מחסום מבודד כדי להגן על בעלי החיים והצומח שמתחת מפני קפיאה במים. אם זה לא היה קורה, צמחים ובעלי חיים החיים במים היו קופאים בגוש קרח ולא יכלו לנוע בחופשיות, מה שהופך את החיים בטמפרטורות קרות לקשים או בלתי אפשריים.
מכיוון שהמים הם קוטביים, עם מטענים חיוביים ושליליים קלים, תרכובות יוניות ומולקולות קוטביות יכולות להתמוסס בהם בקלות. מים הם, אם כן, מה שמכונה ממס - חומר המסוגל להמיס חומר אחר. החלקיקים הטעונים יווצרו קשרי מימן עם שכבה מסביב של מולקולות מים. זה מכונה כדור של הידרציה ומשמש לשמירה על היונים מופרדים או מפוזרים במים (איור\(\PageIndex{5}\)). תחומי הידרציה אלה מכונים גם קליפות הידרציה. הקוטביות של מולקולת המים הופכת אותה לממס יעיל וחשובה בתפקידיה הרבים במערכות חיות.
יכולתם של חרקים לצוף ולהחליק על פני מי הבריכה נובעת מתכונה של לכידות. בלכידות, מולקולות מים נמשכות זו לזו (בגלל קשר מימן), ושומרות על המולקולות יחד בממשק הנוזל-אוויר (גז). לכידות מולידה מתח פנים, יכולתו של חומר לעמוד בקרע כאשר הוא ממוקם תחת מתח או לחץ.
כוחות מלוכדים אלה קשורים גם לתכונת ההידבקות של המים, או למשיכה בין מולקולות מים למולקולות אחרות. זה נצפה כאשר מים "מטפסים" במעלה קש המונח בכוס מים. תבחין כי נראה שהמים גבוהים יותר בצידי הקש מאשר באמצע. הסיבה לכך היא שמולקולות המים נמשכות לקש ולכן נצמדות אליו.
לכידות והדבקה הם גם גורמים במושבות חיידקים ויצירת ביופילם. הלכידות שומרת על המושבה שלמה (עוזרת לה "להיצמד" למשטח), בעוד שההדבקה שומרת על התאים דבוקים זה לזה. כוחות מלוכדים ודביקים חשובים לקיום החיים. לדוגמה, בגלל כוחות אלה, מים בסביבה טבעית מספקים את התנאים הדרושים כדי לאפשר לתאים חיידקיים וארכאיים להיצמד ולהצטבר על משטחים.
חומצות ובסיסים
ה-pH של תמיסה הוא מדד לריכוזי יון מימן (H +) ויון הידרוקסיד (OH —) ומתואר כחומציות או בסיסיות, בהתאמה. חומציות ואלקליות (המכונה גם בסיסיות) ניתן למדוד ולחשב. pH יכול להיות מיוצג פשוט על ידי המשוואה המתמטית,. \(\mathrm{pH=-\log_{10}[H^+]}\) בצד שמאל של המשוואה, ה- "p" פירושו "הלוגריתם השלילי של" וה- H מייצג את [H +]. בצד ימין של המשוואה, [H +] הוא הריכוז של H+ בשומות/L. מה שלא מיוצג במשוואה הפשוטה הזו הוא התרומה של ה- OH -, שמשתתף גם בחומציות או בסיסיות. חישוב ה- pH מביא לטווח מספרים של 0 עד 14 הנקרא סולם ה- pH (איור\(\PageIndex{6}\)). ערך pH בין 0 ל -6.9 מצביע על חומצה. הוא מכונה גם pH נמוך, עקב ריכוז גבוה [H +] ונמוך [OH —]. ערך pH בין 7.1 ל -14 מציין אלקלי או בסיס. הוא מכונה גם pH גבוה, עקב ריכוז נמוך [H +] וגבוה [OH -]. pH של 7 מתואר כ- pH ניטרלי ומתרחש כאשר [H +] שווה ל- [OH —].

שינוי של יחידה אחת בסולם ה- pH מייצג שינוי ב- [H +] בפקטור 10, שינוי בשתי יחידות מייצג שינוי ב- [H +] בפקטור 100. לפיכך, שינויים קטנים ב-pH מייצגים שינויים גדולים ב- [H +].
הערות שוליים
- 1 שרייבר, קארל ואיריס שרייבר. לחיות עם הכוכבים: כיצד גוף האדם מחובר למחזורי החיים של כדור הארץ, כוכבי הלכת והכוכבים. הוצאת אוניברסיטת אוקספורד, ארה"ב, 2015.
- 2 המינהל הלאומי לאוקיינוסים ואטמוספירה, "איזוטופים יציבים ופחמימנים של פחמן דו חמצני." דף אינטרנט. גישה ל -19 בפברואר 2016 [http://www.esrl.noaa.gov/gmd/outreac...hemistry.html]
- 3 שם.
- 4 שם.


