20.3: מבחני התלכדות
- Page ID
- 209054
מטרות למידה
- השווה התלכדות ישירה ועקיפה
- זיהוי שימושים שונים בהמוגלוטינציה באבחון המחלה
- הסבר כיצד נקבעים סוגי הדם
- הסבר את השלבים המשמשים להתאמה צולבת דם לשימוש בעירוי
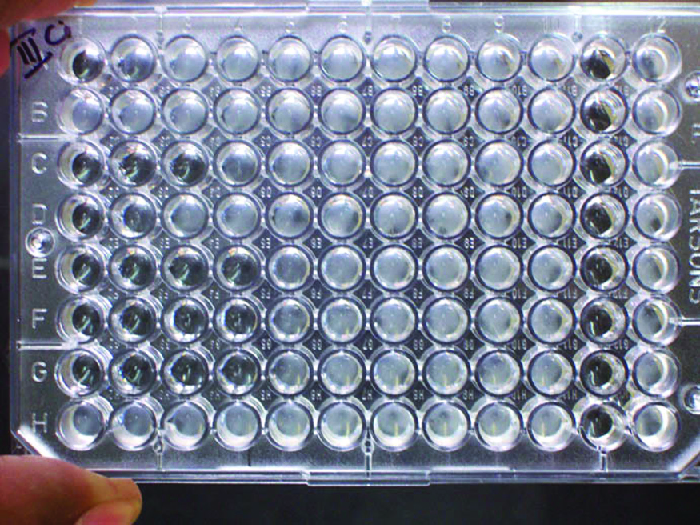
בנוסף לגרימת משקעים של מולקולות מסיסות ולפלוקולציה של מולקולות בתרחיף, נוגדנים יכולים גם לקבץ יחד תאים או חלקיקים (למשל, חרוזי לטקס מצופים אנטיגן) בתהליך הנקרא צבירה (איור 18.1.8). התלכדות יכולה לשמש אינדיקטור לנוכחות נוגדנים כנגד חיידקים או כדוריות דם אדומות. מבחני התלכדות הם בדרך כלל מהירים וקלים לביצוע על שקופית זכוכית או צלחת מיקרוטיטר (איור). \(\PageIndex{1}\) ללוחות מיקרוטיטר יש מערך של בארות כדי להחזיק כמויות קטנות של ריאגנטים ולצפות בתגובות (למשל, צבירה) באופן חזותי או באמצעות ספקטרופוטומטר שתוכנן במיוחד. הבארות מגיעות בגדלים רבים ושונים למבחנים הכוללים נפחים שונים של ריאגנטים.
התלכדות של חיידקים ווירוסים
השימוש בבדיקות התלכדות לזיהוי חיידקי סטרפטוקוקל פותח בשנות העשרים על ידי רבקה לנספילד בעבודה עם עמיתיה א 'ר דוצ'ס ואוסוולד אייברי. 1 היא השתמשה בנוגדנים לזיהוי חלבון M, גורם ארסיות על סטרפטוקוקים הנחוץ ליכולתו של החיידק לגרום לדלקת גרון. ייצור נוגדנים כנגד חלבון M הוא קריטי בהרכבת תגובת הגנה מפני החיידקים.
לאנספילד השתמש באנטיסרה כדי להראות שזנים שונים מאותו מין של סטרפטוקוקים מבטאים גרסאות שונות של חלבון M, מה שמסביר מדוע ילדים יכולים לרדת עם דלקת גרון שוב ושוב. לאנספילד סיווג סטרפטוקוקים בטא-המוליטיים לקבוצות רבות על סמך הבדלים אנטיגניים בפוליסכרידים ספציפיים לקבוצה הממוקמים בדופן התא החיידקי. הזנים נקראים סרוברים מכיוון שהם נבדלים באמצעות אנטיסרה. זיהוי הסרוברים הקיימים בהתפרצות מחלה חשוב מכיוון שחלק מהסרוברים עלולים לגרום למחלות קשות יותר מאחרים.
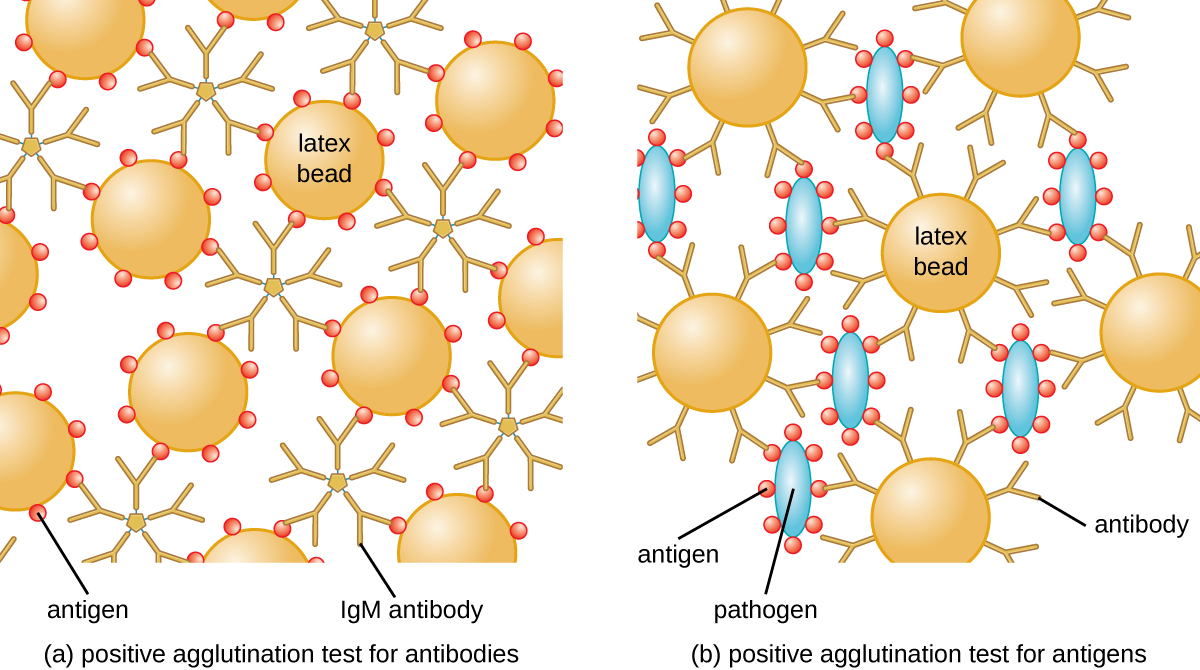
השיטה שפותחה על ידי לנספילד היא בדיקת צבירה ישירה, מכיוון שתאי החיידק עצמם מצטברים. אסטרטגיה דומה נפוצה יותר כיום בעת זיהוי סרוברים של חיידקים ווירוסים; עם זאת, כדי לשפר את ההדמיה של התלכדות, הנוגדנים עשויים להיות מחוברים לחרוזי לטקס אינרטיים. טכניקה זו נקראת בדיקת צבירה עקיפה (או בדיקת קיבוע לטקס), מכיוון שהתלכדות של החרוזים היא סמן לקשירת נוגדנים לאנטיגן אחר (איור). \(\PageIndex{2}\) ניתן להשתמש במבחנים עקיפים כדי לזהות נוכחות של נוגדנים או אנטיגנים ספציפיים.
כדי לזהות נוגדנים בסרום של המטופל, האנטיגן המעניין מחובר לחרוזי לטקס. כאשר הם מעורבבים עם סרום המטופל, הנוגדנים יקשרו את האנטיגן, יצלבו את חרוזי הלטקס ויגרמו לחרוזים להצטבר בעקיפין; זה מצביע על נוכחות הנוגדן (איור). \(\PageIndex{3}\) טכניקה זו משמשת לרוב כאשר מחפשים נוגדנים מסוג IgM, מכיוון שהמבנה שלהם מספק קישור צולב מרבי. דוגמה אחת בשימוש נרחב למבחן זה היא בדיקה לגורם ראומטי (RF) לאישור אבחנה של דלקת מפרקים שגרונית. RF הוא, למעשה, נוכחות של נוגדני IgM הנקשרים ל- IgG של המטופל עצמו. RF יצבור חרוזי לטקס מצופים IgG.
בבדיקה ההפוכה, ניתן לזהות אנטיגנים מסיסים בסרום של המטופל על ידי הצמדת נוגדנים ספציפיים (בדרך כלל mAbs) לחרוזי הלטקס וערבוב קומפלקס זה עם הסרום (איור\(\PageIndex{3}\)).
בדיקות התלכדות נמצאות בשימוש נרחב במדינות לא מפותחות שעשויות להיות חסרות מתקנים מתאימים לגידול חיידקים. לדוגמה, בדיקת Widal, המשמשת לאבחון קדחת הטיפוס, מחפשת צבירה של תת-מין סלמונלה אנטריקה typhi בסרה של המטופל. בדיקת Widal מהירה, זולה ושימושית לניטור היקף ההתפרצות; עם זאת, זה לא מדויק כמו בדיקות הכרוכות בתרבית החיידקים. בדיקת Widal מייצרת לעתים קרובות תוצאות חיוביות שגויות בחולים עם זיהומים קודמים עם תת-מינים אחרים של סלמונלה, כמו גם שליליות כוזבות בחולים עם היפר-פרוטאינמיה או חסרים חיסוניים.
בנוסף, בדיקות התלכדות מוגבלות על ידי העובדה כי חולים בדרך כלל אינם מייצרים רמות ניתנות לזיהוי של נוגדנים במהלך השבוע הראשון (או יותר) של זיהום. אומרים כי מטופל עבר המרה סרוקית כאשר רמות הנוגדנים מגיעות לסף הגילוי. בדרך כלל, seroconversion עולה בקנה אחד עם הופעת הסימנים והתסמינים של המחלה. עם זאת, בזיהום HIV, למשל, זה בדרך כלל לוקח 3 שבועות עבור seroconversion להתרחש, ובמקרים מסוימים, זה עלול לקחת הרבה יותר זמן.
בדומה לטכניקות לבדיקת טבעת precipitin ומבחני פלאק, זה שגרתי להכין דילולים סדרתיים כפולים של הסרום של המטופל ולקבוע את טיטר הנוגדן המצטבר הקיים. מכיוון שרמות הנוגדנים משתנות עם הזמן בתגובות חיסוניות ראשוניות ומשניות כאחד, על ידי בדיקת דגימות לאורך זמן, ניתן לזהות שינויים בטיטר הנוגדנים. לדוגמה, השוואה של הטיטר בשלב החריף של זיהום לעומת הטיטר משלב ההבראה תבדיל אם זיהום הוא נוכחי או שהתרחש בעבר. ניתן גם לעקוב אחר מידת התגובה של מערכת החיסון של המטופל לפתוגן.
צפה בסרטון זה המדגים תגובות התלכדות עם חרוזי לטקס.
תרגיל \(\PageIndex{1}\)
- כיצד משתמשים בהתלכדות כדי להבחין בין סרוברים זה מזה?
- במבחן חרוזי לטקס לבדיקת נוגדנים בסרום של מטופל, עם מה החרוזים מצופים?
- מה קרה כאשר מטופל עבר המרה סרוקוונסורית?
המגלוטינציה
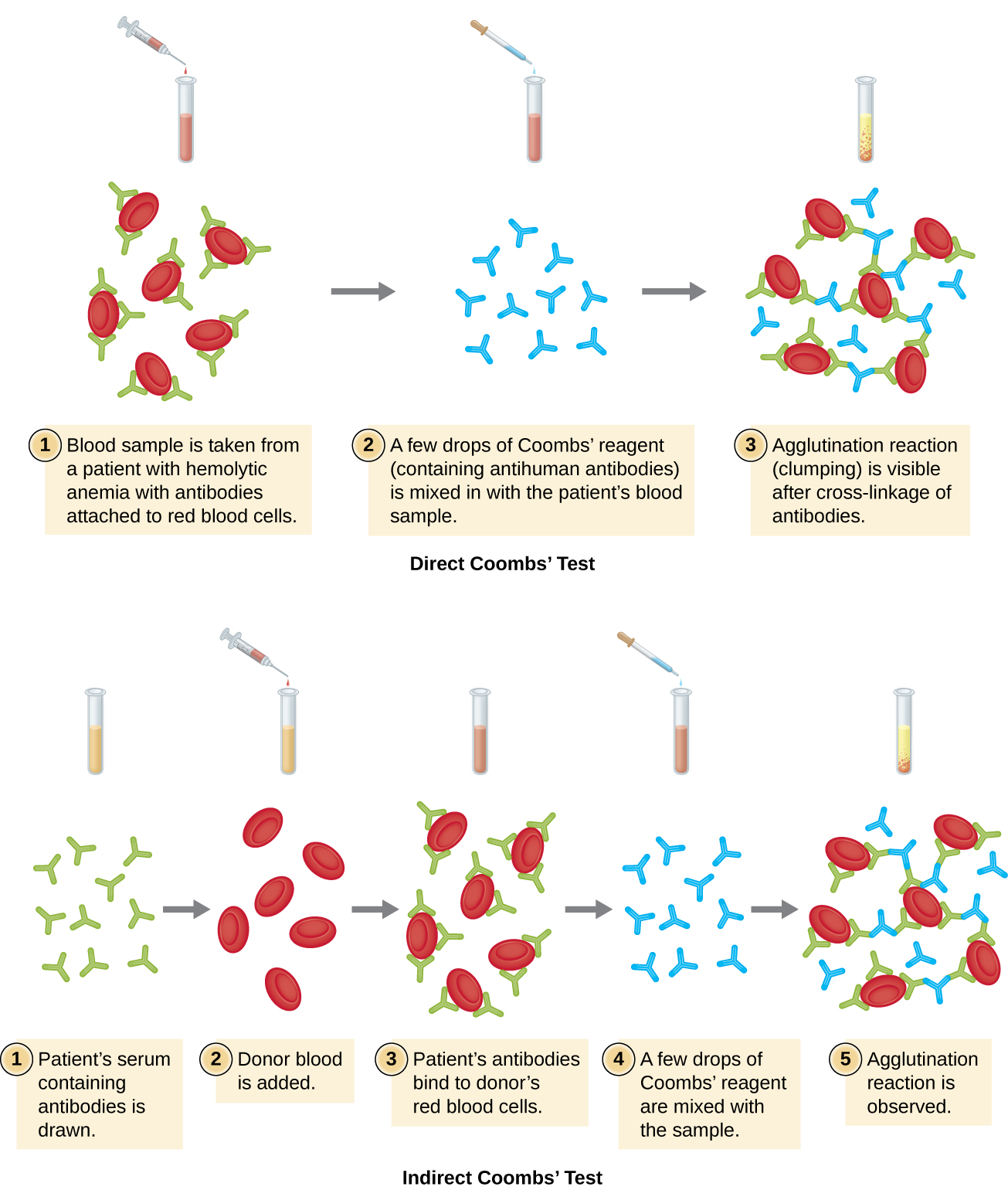
התלכדות של כדוריות דם אדומות נקראת המוגלוטינציה. בדיקה נפוצה אחת המשתמשת בהמוגלוטינציה היא בדיקת Coombs הישירה, הנקראת גם בדיקת הגלובולין האנטי-אנושית הישירה (DAT), שבדרך כלל מחפשת נוגדנים שאינם מגלינים. הבדיקה יכולה גם לאתר השלמה המחוברת לכדוריות הדם האדומות.
בדיקת ה- Coombs משמשת לעיתים קרובות כאשר ליילוד יש צהבת, הצהבה של העור הנגרמת כתוצאה מריכוזי דם גבוהים של בילירובין, תוצר של פירוק המוגלובין בדם. בדיקת ה- Coombs 'משמשת כדי לקבוע אם תאי הדם האדומים של הילד נקשרו לנוגדנים של האם. נוגדנים אלה יפעילו משלים, מה שיוביל לתמוגה של תאי דם אדומים ולצהבת שלאחר מכן. מצבים אחרים שיכולים לגרום לבדיקות ישירות חיוביות של קומבס כוללים תגובות עירוי המוליטיות, אנמיה המוליטית אוטואימונית, מונונוקליוזה זיהומית (הנגרמת על ידי נגיף אפשטיין-בר), עגבת ודלקת ריאות Mycoplasma. בדיקת קומבס ישירה חיובית עשויה להיראות גם בכמה סוגי סרטן וכתגובה אלרגית לתרופות מסוימות (למשל פניצילין).
הנוגדנים הקשורים לתאי דם אדומים בתנאים אלה הם לרוב IgG, ובגלל הכיוון של אתרי קשירת האנטיגן ב- IgG והגודל הגדול יחסית של כדוריות דם אדומות, אין זה סביר שתתרחש צבירה גלויה כלשהי. עם זאת, ניתן לזהות נוכחות של IgG הקשור לתאי דם אדומים על ידי הוספת ריאגנט של Coombs, אנטי-סרום המכיל נוגדני IgG אנטי-אנושיים (שניתן לשלב עם אנטי-משלים) (איור). \(\PageIndex{4}\) המגיב של ה- Coombs מקשר את ה- IgG המחובר לתאי דם אדומים שכנים ובכך מקדם צבירה.
קיימת גם בדיקה עקיפה של קומבס המכונה בדיקת האנטיגלובולין העקיפה (IAT). זה מסנן אדם אחר נוגדנים נגד אנטיגנים של תאי דם אדומים (מלבד האנטיגנים A ו-B) שאינם קשורים בסרום של המטופל (איור\(\PageIndex{4}\)). ניתן להשתמש ב- IAT כדי לסנן נשים בהריון אחר נוגדנים העלולים לגרום למחלה המוליטית של הרך הנולד. זה יכול לשמש גם לפני מתן עירויי דם. פירוט נוסף על אופן ביצוע ה- IAT נדון להלן.
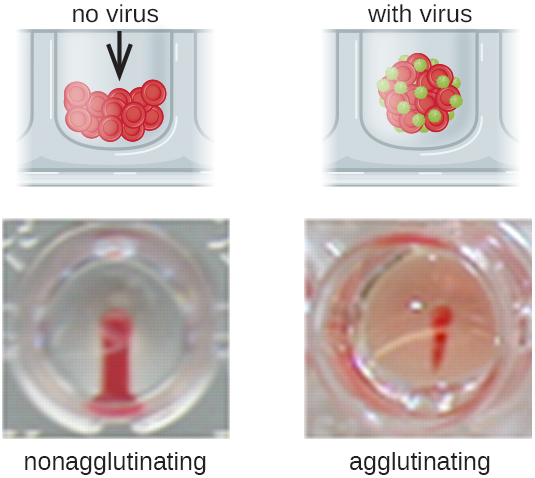
נוגדנים הנקשרים לתאי דם אדומים אינם הגורם היחיד להמוגלוטינציה. נגיפים מסוימים נקשרים גם לתאי דם אדומים, וקשירה זו עלולה לגרום להתלכדות כאשר הנגיפים מצטלבים בין כדוריות הדם האדומות. לדוגמה, לנגיפי שפעת יש שני סוגים שונים של קוצים ויראליים הנקראים neuraminidase (N) והמגלוטינין (H), האחרון נקרא על שם יכולתו לצבור תאי דם אדומים (ראה וירוסים). לכן, אנו יכולים להשתמש בתאי דם אדומים כדי לזהות את נוכחותו של וירוס שפעת על ידי מבחני hemagglutination ישיר (HA), שבו הנגיף גורם צבירה גלוי של כדוריות דם אדומות. ניתן לאתר את נגיפי החזרת והאדמת באמצעות HA.
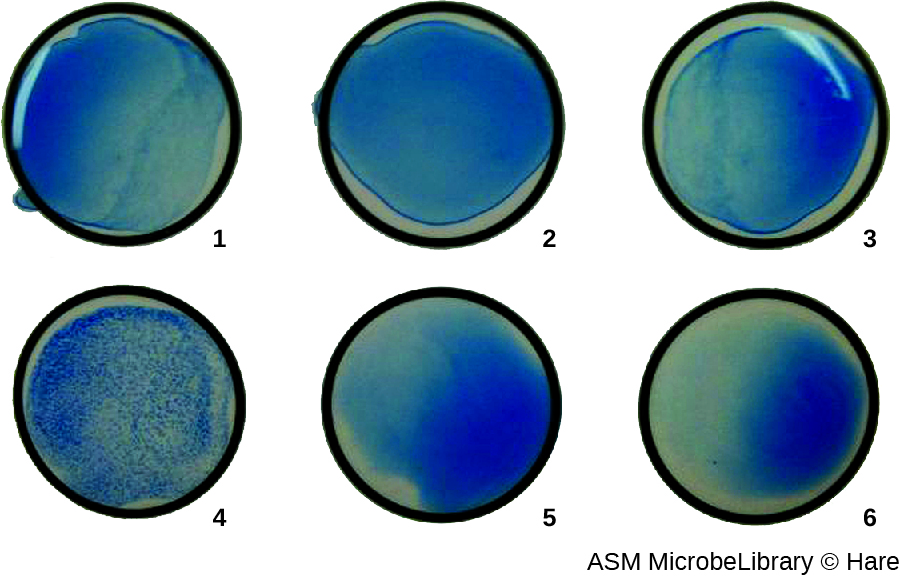
לרוב, נעשה שימוש בבדיקת צבירה ויראלית של דילול סדרתי למדידת הטיטר או הערכת כמות הנגיף המיוצר בתרבית תאים או לייצור חיסונים. טיטר ויראלי ניתן לקבוע באמצעות HA ישיר על ידי ביצוע דילול סדרתי של המדגם המכיל את הנגיף, החל בריכוז גבוה של מדגם כי הוא מדולל לאחר מכן בסדרה של בארות. הדילול הגבוה ביותר המייצר צבירה גלויה הוא הטיטר. הבדיקה מתבצעת בצלחת מיקרוטיטר עם בארות V- או עגולות. בנוכחות וירוסים מצטברים, תאי הדם האדומים והנגיף מתקבצים יחד ומייצרים מחצלת מפוזרת על קרקעית הבאר. בהיעדר וירוס, תאי הדם האדומים מתגלגלים או משקעים לתחתית הבאר ויוצרים גלולה צפופה, ולכן לא ניתן להשתמש בבארות עם תחתית שטוחה (איור). \(\PageIndex{5}\)
ניתן להשתמש בשינוי של מבחן HA כדי לקבוע את הטיטר של נוגדנים אנטי-ויראליים. נוכחותם של נוגדנים אלה בסרום של מטופל או באנטי-סרום המיוצר במעבדה תנטרל את הנגיף ותחסום אותו מלהצטבר בתאים האדומים, מה שהופך את זה למבחן עיכוב המוגלוטינציה ויראלי (HIA). במבחן זה, סרום המטופל מעורבב עם כמות סטנדרטית של וירוס. לאחר דגירה קצרה מתווספת כמות סטנדרטית של כדוריות דם אדומות ונצפית המוגלוטינציה. טיטר הסרום של המטופל הוא הדילול הגבוה ביותר שחוסם התלכדות (איור). \(\PageIndex{6}\)

תרגיל \(\PageIndex{2}\)
- מהו המנגנון שבאמצעותו מתגלים וירוסים במבחן המוגלוטינציה?
- איזו תוצאת המגלוטינציה מספרת לנו את טיטר הנגיף בדגימה?
בעלי חיים במעבדה
הרבה ממה שאנו יודעים כיום על מערכת החיסון האנושית נלמד באמצעות מחקר שנערך באמצעות בעלי חיים - בעיקר יונקים - כמודלים. מלבד מחקר, יונקים משמשים גם לייצור רוב הנוגדנים ורכיבי מערכת החיסון האחרים הדרושים לאבחון חיסוני. חיסונים, אבחון, טיפולים ורפואה תרגומית בכלל פותחו באמצעות מחקר עם מודלים של בעלי חיים.
שקול כמה מהשימושים הנפוצים של חיות מעבדה לייצור רכיבי מערכת החיסון. שרקנים משמשים כמקור להשלמה, ועכברים הם המקור העיקרי לתאים לייצור mAbs. ניתן להשתמש ב-mAbs אלה במחקר ולמטרות טיפוליות. אנטיסרה גדלים במגוון מינים, כולל סוסים, כבשים, עזים וארנבות. בעת ייצור אנטי-סרום, החיה בדרך כלל תוזרק לפחות פעמיים, וניתן להשתמש באדג'ובנטים כדי להגביר את תגובת הנוגדנים. בעלי החיים הגדולים יותר המשמשים לייצור אנטיסרה יקצרו דם שוב ושוב לאורך פרקי זמן ארוכים, עם מעט נזק לבעלי החיים, אך בדרך כלל זה לא המקרה של ארנבות. למרות שאנו יכולים להשיג כמה מיליליטר דם מעורקי האוזניים של ארנבים, לרוב אנו זקוקים לנפחים גדולים יותר, מה שמביא למותם של בעלי החיים.
אנו משתמשים גם בבעלי חיים לחקר מחלות. הדרך היחידה לגדל Treponema pallidum לחקר עגבת היא בבעלי חיים חיים. ניתן לגדל וירוסים רבים בתרבית תאים, אך גידול בתרבית התאים מספר לנו מעט מאוד על האופן שבו המערכת החיסונית תגיב לנגיף. כאשר אנו עובדים על מחלה שהתגלתה לאחרונה, אנו עדיין משתמשים בהנחות של קוך, הדורשות גרימת מחלות בחיות מעבדה המשתמשות בפתוגנים מתרבות טהורה כצעד מכריע בהוכחת מיקרואורגניזם מסוים הוא הגורם למחלה. חקר התפשטות החיידקים והנגיפים במארחים של בעלי חיים, וכיצד מגיבה מערכת החיסון המארחת, היה מרכזי במחקר המיקרוביולוגי כבר למעלה מ -100 שנה.
בעוד שהפרקטיקה של שימוש בחיות מעבדה חיונית למחקר מדעי ולאבחון רפואי, אנשים רבים מתנגדים בתוקף לניצול בעלי חיים לטובת האדם. טיעון אתי זה אינו חדש - אכן, אחת מבנותיו של צ'ארלס דרווין הייתה אנטי-ויוויסקציוניסטית פעילה (ויוויסקציה היא הנוהג לחתוך או לנתח חיה חיה כדי לחקור אותה). רוב המדענים מכירים בכך שצריכות להיות מגבלות על המידה שבה ניתן לנצל בעלי חיים למטרות מחקר. שיקולים אתיים הובילו את המכונים הלאומיים לבריאות (NIH) לפתח תקנות מחמירות על סוגי המחקר שניתן לבצע. תקנות אלה כוללות גם הנחיות לטיפול אנושי בחיות מעבדה, קביעת סטנדרטים לדיור, טיפול והמתת חסד. מסמך NIH "מדריך לטיפול ושימוש בחיות מעבדה" מבהיר כי השימוש בבעלי חיים במחקר הוא פריבילגיה שמעניקה החברה לחוקרים.
הנחיות ה- NIH מבוססות על העיקרון של שלושת ה- R: להחליף, לחדד ולהקטין. על החוקרים לשאוף להחליף מודלים של בעלי חיים במודלים שאינם חיים, להחליף חוליות בחסרי חוליות במידת האפשר, או להשתמש במודלים ממוחשבים במידת האפשר. הם צריכים לחדד את הגידול ואת ההליכים הניסויים כדי להפחית כאב וסבל, ולהשתמש עיצובים ניסיוניים ונהלים להפחית את מספר בעלי החיים הדרושים כדי לקבל את המידע הרצוי. כדי להשיג מימון, על החוקרים לספק את מבקרי NIH כי המחקר מצדיק את השימוש בבעלי חיים וכי השימוש בהם הוא בהתאם להנחיות.
ברמה המקומית, כל מתקן שמשתמש בבעלי חיים ומקבל מימון פדרלי חייב להיות בעל ועדה מוסדית לטיפול ושימוש בבעלי חיים (IACUC) המבטיחה כי הנחיות ה- NIH מתקיימות. על ה- IACUC לכלול חוקרים, מנהלים, וטרינר ולפחות אדם אחד ללא קשר למוסד, כלומר אזרח מודאג. ועדה זו מבצעת גם בדיקות של מעבדות ופרוטוקולים. למחקר הכולל נבדקים אנושיים, מועצת סקירה מוסדית (IRB) מבטיחה לעקוב אחר ההנחיות הנכונות.
בקר באתר זה כדי לצפות במדריך NIH לטיפול ושימוש בחיות מעבדה.
הקלדת דם והתאמה צולבת
בנוסף לנוגדנים כנגד חיידקים ווירוסים אליהם נחשפו בעבר, רוב האנשים נושאים גם נוגדנים כנגד סוגי דם שאינם שלהם. כיום קיימות 33 מערכות מסוג דם חשובות מבחינה אימונולוגית, שרבות מהן מוגבלות בתוך קבוצות אתניות שונות או גורמות לעיתים רחוקות לייצור נוגדנים. החשובות ביותר ואולי הידועות ביותר הן קבוצות הדם ABO ו- Rh (ראה איור 19.1.3).
כאשר נשקלים יחידות דם לעירוי, יש לבצע בדיקת דם לפני עירוי. עבור יחידת הדם, נוגדנים מוכנים מסחרית כנגד אנטיגנים A, B ו- Rh מעורבבים עם כדוריות דם אדומות מהיחידות כדי לאשר בתחילה שסוג הדם ביחידה מדויק. לאחר שהתבקשה יחידת דם לעירוי, חשוב מאוד לוודא שהתורם (יחידת הדם) והמקבל (המטופל) תואמים לאנטיגנים מכריעים אלה. בנוסף לאישור סוג הדם של היחידה, סוג הדם של המטופל מאושר גם באמצעות אותם נוגדנים מוכנים מסחרית ל- A, B ו- Rh. לדוגמה, כפי שמוצג באיור\(\PageIndex{7}\), אם הדם התורם הוא חיובי A, הוא יצטבר עם האנטי-סרום נגד A ועם האנטי-סרום נגד Rh. אם לא נצפתה התלכדות באף אחת מהסרה, אז סוג הדם יהיה שלילי O.
לאחר קביעת סוג הדם, מיד לפני שחרור הדם לעירוי, מבוצעת התאמה צולבת בה מעורבב חלק קטן של תאי הדם האדומים התורמים בסרום מהמטופל הממתין לעירוי. אם למטופל אכן יש נוגדנים כנגד כדוריות הדם האדומות של התורם, תתרחש המוגלוטינציה. כדי לאשר כל תוצאות בדיקה שליליות ולבדוק אם יש תאי דם אדומים רגישים, ריאגנט של Coombs עשוי להתווסף לתערובת כדי להקל על הדמיה של האינטראקציה של נוגדן-תאי דם אדומים.
בנסיבות מסוימות, ניתן לבצע גם התאמה צולבת קלה. במבחן זה, חלק קטן של סרום התורם מעורבב עם תאי דם אדומים של המטופל. זה מאפשר זיהוי של נוגדנים מצרפים בסרום התורם. לעתים רחוקות יש צורך בבדיקה זו מכיוון שעירויים משתמשים בדרך כלל בתאי דם אדומים ארוזים כאשר רוב הפלזמה מוסרת על ידי צנטריפוגה.
לתאי דם אדומים יש אנטיגנים רבים אחרים בנוסף ל- ABO ו- Rh. בעוד שלרוב האנשים לא סביר שיהיו נוגדנים נגד אנטיגנים אלה, נשים שעברו הריונות מרובים או חולים שעברו עירויים מרובים עשויים לקבל אותם בגלל חשיפה חוזרת. מסיבה זו, נעשה שימוש בבדיקת מסך נוגדנים כדי לקבוע אם קיימים נוגדנים כאלה. סרום החולה נבדק כנגד תאי דם אדומים מסוג O שהוכנו מסחרית, משולבים, המבטאים אנטיגנים אלה. אם מתרחשת התלכדות, יש לזהות את האנטיגן אליו מגיב המטופל ולקבוע שלא יהיה נוכח ביחידת התורם.

תרגיל \(\PageIndex{3}\)
- אם הדם של המטופל מצטבר בסרום אנטי-B, מהו סוג הדם של המטופל?
- מהו מבחן התאמה צולבת, ומדוע הוא מבוצע?
הטבלה \(\PageIndex{1}\) מסכמת את הסוגים השונים של מבחני התלכדות הנדונים בסעיף זה.
| סוג הבדיקה | מנגנון | דוגמא |
|---|---|---|
| התלכדות | ישיר: נוגדן משמש לגוש תאי חיידקים או מבנים גדולים אחרים | חיידקי סרוטיפינג |
| עקיף: חרוזי לטקס משולבים עם אנטיגן או נוגדן כדי לחפש נוגדן או אנטיגן, בהתאמה, בסרום המטופל | אישור נוכחות של גורם ראומטי (Ig מחייב IgM) בסרום המטופל | |
| המגלוטינציה | ישיר: כמה חיידקים ווירוסים מצטלבים תאי דם אדומים ומגבשים אותם יחד | אבחון שפעת, חזרת וחצבת |
| בדיקת Direct Coombs '(DAT): מזהה נוגדנים שאינם מצטברים או חלבונים משלימים על תאי דם אדומים in vivo | בדיקת נוגדנים אימהיים הנקשרים לתאי דם אדומים בילודים | |
| בדיקת Coombs 'עקיפה (IAT): מסננת אדם לאיתור נוגדנים נגד אנטיגנים של תאי דם אדומים (מלבד האנטיגנים A ו- B) שאינם קשורים בסרום של המטופל בַּמַבחֵנָה | ביצוע בדיקות דם לפני עירוי | |
| עיכוב המוגלוטינציה ויראלי: משתמש בנוגדנים ממטופל כדי לעכב צבירה ויראלית | אבחון מחלות ויראליות שונות על ידי נוכחות של נוגדנים החולה נגד הנגיף | |
| הקלדת דם והתאמה צולבת: מזהה ABO, Rh ואנטיגנים מינוריים בדם | מתאים את דם התורם לדרישות החיסון של הנמען |
מושגי מפתח וסיכום
- נוגדנים יכולים לצבור תאים או חלקיקים גדולים למטריצה גלויה. בדיקות צבירה נעשות לרוב בכרטיסים או בצלחות מיקרוטיטר המאפשרות להתרחש תגובות מרובות זו לצד זו באמצעות נפחים קטנים של ריאגנטים.
- שימוש באנטיסרה כנגד חלבונים מסוימים מאפשר זיהוי של סרוברים בתוך מיני חיידקים.
- איתור נוגדנים כנגד פתוגן יכול להיות כלי רב עוצמה לאבחון מחלות, אך יש פרק זמן עד שהחולים עוברים המרה ורמת הנוגדנים הופכת לגילוי.
- ניתן להשתמש באגלוטינציה של חרוזי לטקס במבחני צבירה עקיפים כדי לזהות נוכחות של אנטיגנים ספציפיים או נוגדנים ספציפיים בסרום המטופל.
- ניתן לאשר את נוכחותם של כמה נוגדנים אנטיבקטריאליים ואנטי-ויראליים על ידי שימוש בבדיקת Coombs הישירה, המשתמשת בריאגנט של קומבס כדי לקשר בין נוגדנים הקשורים לתאי דם אדומים ולהקל על המוגלוטינציה.
- נגיפים וחיידקים מסוימים יקשרו ויגבירו תאי דם אדומים; אינטראקציה זו היא הבסיס למבחן ההמוגלוטינציה הישיר, המשמש לרוב לקביעת כייל הנגיף בתמיסה.
- מבחני ניטרול מכמתים את רמת הנוגדן הספציפי לנגיף על ידי מדידת הירידה בהמוגלוטינציה שנצפתה לאחר ערבוב סרום המטופל עם כמות סטנדרטית של וירוס.
- מבחני המגלוטינציה משמשים גם לסינון והתאמה צולבת של דם תורם ונמען כדי להבטיח שלמקבל העירוי אין נוגדנים לאנטיגנים בדם שנתרם.
הערות שוליים
- 1 לאנספילד, רבקה סי, "המתחם האנטיגני של סטרפטוקוקוס המוליטיקוס. הדגמה של חומר ספציפי לסוג בתמציות של סטרפטוקוקוס המוליטיקוס," כתב העת לרפואה ניסיונית 47, מס '1 (1928): 91-103.


