20.2: זיהוי מתחמי אנטיגן-נוגדנים במבחנה
- Page ID
- 209045
מטרות למידה
- תאר סוגים שונים של מבחנים המשמשים למציאת קומפלקסים של אנטיגן-נוגדנים
- תאר את הנסיבות שבהן מתחמי אנטיגן-נוגדנים יוצאים מהתמיסה
- הסבר כיצד ניתן להשתמש בנוגדנים בסרום המטופל לאבחון מחלות
בדיקות מעבדה לאיתור נוגדנים ואנטיגנים מחוץ לגוף (למשל במבחנה) נקראות מבחני חוץ גופית. כאשר שני הנוגדנים והאנטיגנים המתאימים להם נמצאים בתמיסה, לעתים קרובות אנו יכולים לצפות בתגובת משקעים שבה נוצרים קומפלקסים גדולים (סריגים) ומתיישבים מחוץ לתמיסה. במספר הסעיפים הבאים, נדון במספר מבחני חוץ גופית נפוצים.
תגובות פרסיפיטין
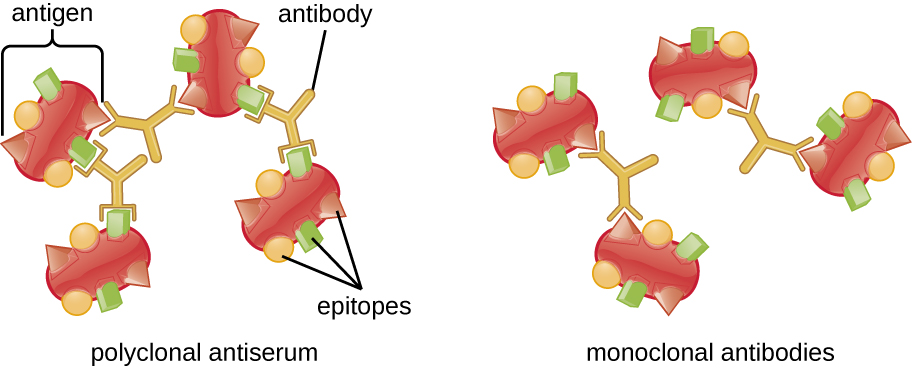
קומפלקס אנטיגן-נוגדן גלוי נקרא פרסיפיטין, ומבחנים במבחנה המייצרים פרסיפיטין נקראים תגובות פרסיפיטין. תגובת precipitin כוללת בדרך כלל הוספת אנטיגנים מסיסים למבחנה המכילה תמיסה של נוגדנים. לכל נוגדן שתי זרועות, שכל אחת מהן יכולה להיקשר לאפיטופ. כאשר נוגדן נקשר לשני אנטיגנים, שני האנטיגנים נקשרים זה לזה על ידי הנוגדן. סריג יכול להיווצר כאשר נוגדנים נקשרים יותר ויותר אנטיגנים יחד, וכתוצאה מכך פרסיפיטין (איור\(\PageIndex{1}\)). רוב בדיקות precipitin משתמשות באנטי-סרום פוליקלונלי ולא בנוגדנים חד שבטיים מכיוון שנוגדנים פוליקלוניים יכולים להיקשר לאפיטופים מרובים, מה שהופך את היווצרות הסריג לסבירות גבוהה יותר. למרות ש-mAbs עשויים לקשור כמה אנטיגנים, הקישור יתרחש בתדירות נמוכה יותר, מה שהופך את הסיכוי הרבה פחות שייווצר פרסיפיטין גלוי.
כמות המשקעים תלויה גם במספר גורמים נוספים. לדוגמה, המשקעים משופרים כאשר לנוגדנים יש זיקה גבוהה לאנטיגן. בעוד שרוב הנוגדנים קושרים אנטיגן בעל זיקה גבוהה, אפילו קישור בעל זיקה גבוהה משתמש בקשרים לא קוולנטיים חלשים יחסית, כך שלעתים קרובות אינטראקציות אינדיבידואליות ישברו ויתרחשו אינטראקציות חדשות.
בנוסף, כדי שהיווצרות precipitin תהיה גלויה, חייב להיות יחס אופטימלי של נוגדן לאנטיגן. היחס האופטימלי אינו צפוי להיות יחס אנטיגן לנוגדן 1:1; זה יכול להשתנות באופן דרמטי, בהתאם למספר האפיטופים על האנטיגן ולסוג הנוגדן. לאנטיגנים מסוימים עשויים להיות רק אפיטופים אחד או שניים המוכרים על ידי האנטי-סרום, בעוד שלאנטיגנים אחרים עשויים להיות אפיטופים רבים ושונים ו/או מקרים מרובים של אותו אפיטופ על מולקולת אנטיגן אחת.
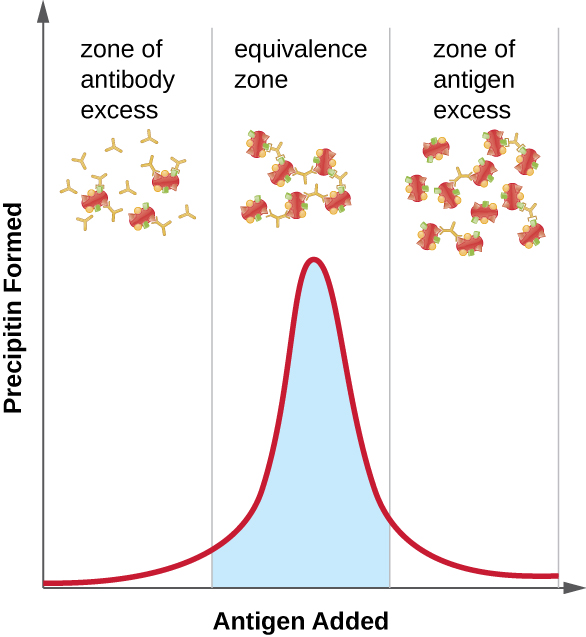
איור \(\PageIndex{2}\) ממחיש כיצד היחס בין אנטיגן ונוגדן משפיע על כמות המשקעים. כדי להשיג את היחס האופטימלי, אנטיגן מתווסף לאט לתמיסה המכילה נוגדנים, וכמות הפרסיפיטין נקבעת באופן איכותי. בתחילה, אין מספיק אנטיגן כדי לייצר היווצרות סריג גלוי; זה נקרא אזור עודף הנוגדנים. ככל שמוסיפים עוד אנטיגן, התגובה נכנסת לאזור השקילות (או אזור השקילות), שם מתרחשת גם האינטראקציה האופטימלית של אנטיגן-נוגדן וגם משקעים מקסימליים. אם יתווסף עוד יותר אנטיגן, כמות האנטיגן תהפוך מוגזמת ולמעשה תגרום לירידה בכמות המשקעים.
תרגיל \(\PageIndex{1}\)
- מה זה פרסיפיטין?
- מדוע אנטיסרה פוליקלונלית מייצרת תגובת פרסיפיטין טובה יותר?
מבחן טבעת פרסיפיטין
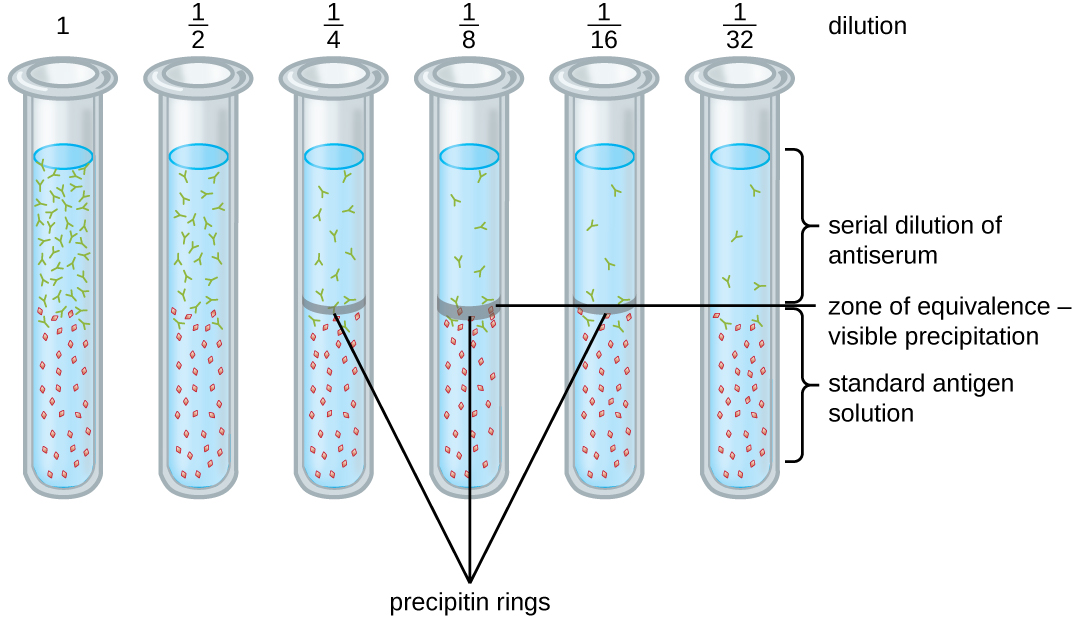
מגוון טכניקות מאפשרות לנו להשתמש ביצירת precipitin כדי לכמת את ריכוז האנטיגן או את כמות הנוגדנים הקיימת באנטי-סרום. טכניקה אחת כזו היא בדיקת טבעת precipitin (איור\(\PageIndex{3}\)), המשמשת לקביעת הכמות היחסית של נוגדן ספציפי לאנטיגן בדגימה של סרום. כדי לבצע בדיקה זו, קבוצה של מבחנות מוכן על ידי הוספת פתרון אנטיגן לתחתית של כל צינור. כל צינור מקבל את אותו נפח של פתרון, ואת הריכוז של אנטיגנים הוא קבוע (למשל, 1 מ"ג/מ"ל). לאחר מכן, גליצרול מתווסף לתמיסת האנטיגן בכל מבחנה, ואחריו דילול סדרתי של האנטי-סרום. הגליצרול מונע ערבוב של האנטי-סרום עם תמיסת האנטיגן, ומאפשר קישור אנטיגן-נוגדן להתרחש רק בממשק של שני הפתרונות. התוצאה היא טבעת גלויה של פרסיפיטין בצינורות שיש להם יחס אנטיגן-נוגדן בתוך אזור השקילות. הדילול הגבוה ביותר הזה עם טבעת גלויה משמש לקביעת טיטר הנוגדנים. הטיטר הוא ההדדי של הדילול הגבוה ביותר המציג תוצאה חיובית, המתבטאת במספר שלם. באיור\(\PageIndex{3}\), הטיטר הוא 16.
בעוד שמדידת טיטר אינה אומרת לנו במונחים מוחלטים כמה נוגדן קיים, היא אכן נותנת מדד לפעילות ביולוגית, שלעתים קרובות חשובה יותר מכמות מוחלטת. בדוגמה זו, לא יהיה מועיל לדעת איזו מסה של IgG קיימת באנטי-סרום, מכיוון שישנן ספציפיות רבות ושונות של נוגדנים; אך חשוב לנו לדעת כמה מפעילות הנוגדנים בסרום של המטופל מכוונת נגד האנטיגן המעניין (למשל, פתוגן או אלרגן מסוים).
מבחן אוכטרלוני
בעוד שבדיקת טבעת precipitin מספקת תובנות לגבי אינטראקציות נוגדן-אנטיגן, יש לה גם כמה חסרונות. זה דורש שימוש בכמויות גדולות של סרום, ויש להקפיד מאוד להימנע מערבוב התמיסות ושיבוש הטבעת. ביצוע בדיקה דומה במטריצת ג'ל אגר יכול למזער את הבעיות הללו. סוג זה של בדיקה נקרא באופן שונה אימונודיפוזיה כפולה או מבחן Ouchterlony עבור Orjan Ouchterlony, 1 שתיאר לראשונה את הטכניקה בשנת 1948.
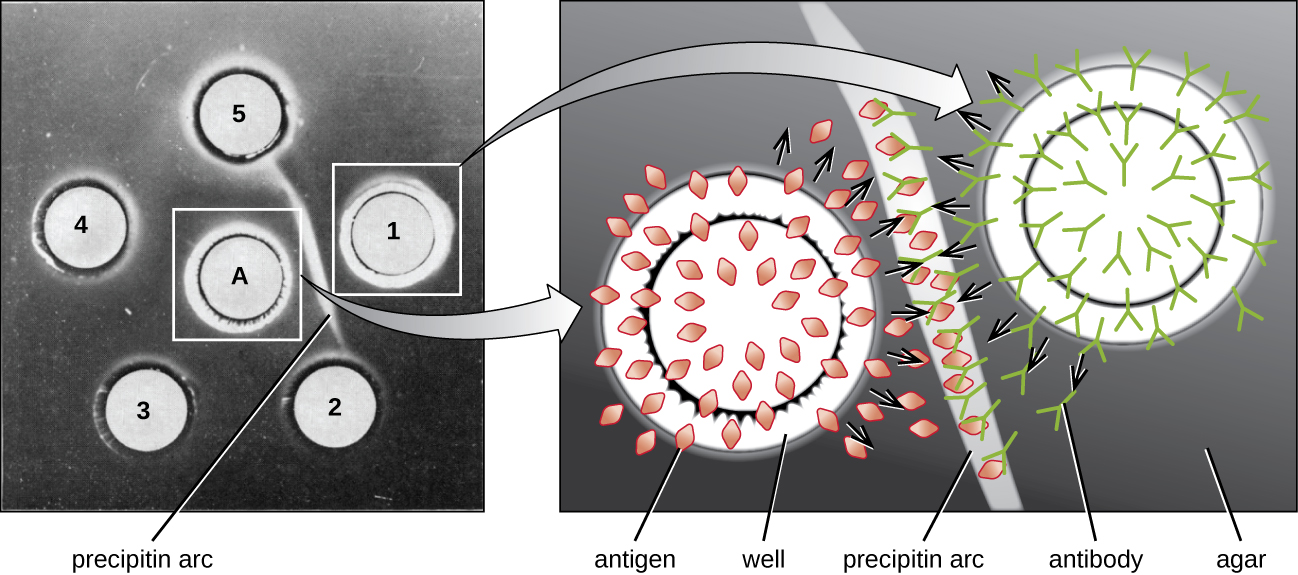
כאשר אגר מטוהר מאוד, הוא מייצר ג'ל צלול וחסר צבע. חורים מנוקבים בג'ל ליצירת בארות, ואנטיגן ואנטיסרה מתווספים לבארות השכנות. חלבונים מסוגלים להתפזר דרך הג'ל, וקשתות פרסיפיטין נוצרות בין הבארות באזור השוויון. מכיוון שסריג הפרסיפיטין גדול מכדי להתפזר דרך הג'ל, הקשתות נעולות היטב במקומן וקל לראות אותן (איור\(\PageIndex{4}\)).
למרות שישנן כיום שיטות רגישות וכמותיות יותר לאיתור אינטראקציות נוגדנים-אנטיגן, בדיקת Ouchterlony מספקת דרך מהירה ואיכותית לקבוע אם לאנטי-סרום יש נוגדנים כנגד אנטיגן מסוים. מבחן Ouchterlony שימושי במיוחד כאשר מחפשים תגובתיות צולבת. אנו יכולים לבדוק אנטי-סרום כנגד קבוצה של אנטיגנים קרובים ולראות אילו שילובים יוצרים קשתות פרציפיטין.
בדיקת אימונודיפוזיה רדיאלית
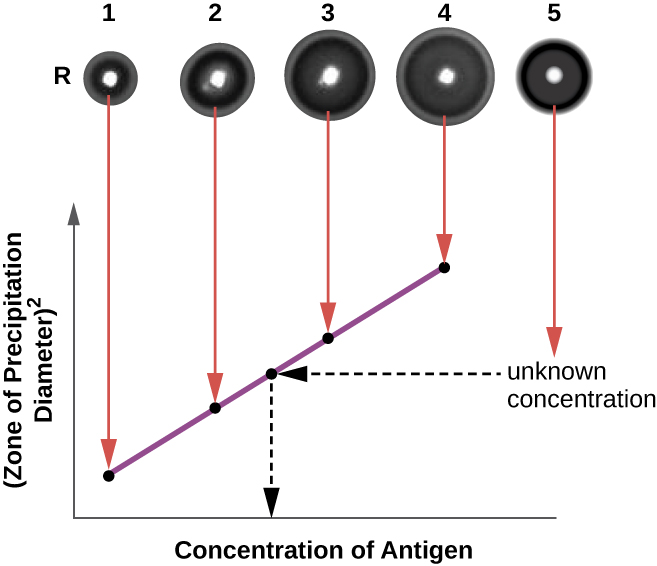
בדיקת האימונודיפוזיה הרדיאלית (RID) דומה למבחן Ouchterlony אך משמשת לכימות מדויק של ריכוז האנטיגן במקום להשוות אנטיגנים שונים. במבחן זה, האנטי-סרום מתווסף לאגר מחוסם (אגר נוזלי במעט מעל 45 מעלות צלזיוס), שנמזג לצלחת פטרי קטנה או על מגלשת זכוכית ומניחים להתקרר. בארות נחתכות באגר המצונן, ולאחר מכן מוסיפים אנטיגן לבארות ומניחים להתפזר. כאשר האנטיגן והנוגדן מתקשרים, הם יוצרים אזור של משקעים. ריבוע הקוטר של אזור המשקעים הוא ביחס ישר לריכוז האנטיגן. על ידי מדידת אזורי המשקעים המיוצרים על ידי דגימות בריכוז ידוע (ראה טבעת הדגימות החיצונית באיור\(\PageIndex{5}\)), אנו יכולים להכין עקומה סטנדרטית לקביעת ריכוז תמיסה לא ידועה. מבחן ה- RID הוא בדיקה שימושית גם לקביעת ריכוז חלבוני סרום רבים כמו חלבוני המשלים C3 ו- C4, בין היתר.
תרגיל \(\PageIndex{2}\)
- מדוע נוצרת טבעת פרסיפיטין בבדיקת טבעת פרסיפיטין, ומהן כמה סיבות לכך שטבעת לא תיווצר?
- השווה והשוואה בין הטכניקות המשמשות במבחן Ouchterlony ובדיקת אימונודיפוזיה רדיאלית.
מבחני פלוקולציה
בדיקת פלוקולציה דומה לתגובת precipitin פרט לכך שהיא כוללת אנטיגנים בלתי מסיסים כגון שומנים. פלוקולנט דומה לפרסיפיטין בכך שיש סריג גלוי של אנטיגן ונוגדן, אך מכיוון ששומנים אינם מסיסים בתמיסה מימית, הם אינם יכולים לזרז. במקום משקעים, נצפתה פלוקולציה (קצף) בנוזל המבחנה.
שימוש בפלוקולציה לבדיקת עגבת
עגבת היא זיהום המועבר במגע מיני שעלול לגרום למחלות כרוניות קשות אצל מבוגרים. בנוסף, הוא מועבר בקלות מאמהות נגועות ליילודים שלהן במהלך ההיריון והלידה, ולעתים קרובות גורם ללידת מת או לבעיות בריאותיות חמורות לטווח הארוך עבור התינוק. למרבה הצער, עגבת יכולה להיות קשה גם לאבחון אצל אמהות לעתיד, מכיוון שלעתים קרובות היא אסימפטומטית, במיוחד אצל נשים. בנוסף, הגורם הסיבתי, החיידק Treponema pallidum, קשה לגידול על אמצעי מעבדה קונבנציונליים וגם קטן מכדי לראות אותו באמצעות מיקרוסקופיה שגרתית. מסיבות אלה, אבחנות משוערות של עגבת מאושרות בדרך כלל בעקיפין במעבדה באמצעות בדיקות המזהות נוגדנים לאנטיגנים טרפונמליים.
בשנת 1906 הציג המדען הגרמני אוגוסט פון וסרמן (1866—1925) את הבדיקה הראשונה לעגבת שהסתמכה על גילוי נוגדנים אנטי-טרפונמליים בדם המטופל. הנוגדנים שהתגלו בבדיקת וסרמן היו נוגדנים אנטי פוספוליפידים שאינם ספציפיים ל T. pallidum. נוכחותם יכולה לסייע באבחון עגבת, אך מכיוון שהם אינם ספציפיים, הם יכולים גם להוביל לתוצאות חיוביות שגויות בחולים עם מחלות אחרות ומצבים אוטואימוניים. בדיקת וסרמן המקורית שונתה במהלך השנים כדי למזער תוצאות חיוביות שגויות והיא ידועה כיום כבדיקת המעבדה לחקר מחלות מין, הידועה יותר בראשי התיבות שלה, בדיקת VDRL.
לביצוע בדיקת VDRL, סרום המטופל או נוזל עמוד השדרה המוחי מונחים על שקופית עם תערובת של קרדיוליפין (פוספוליפיד אנטיגני המצוי בקרום המיטוכונדריאלי של פתוגנים שונים), לציטין וכולסטרול. הלציטין והכולסטרול מייצבים את התגובה ומפחיתים תוצאות חיוביות שגויות. נוגדנים אנטי-טרפונמליים מסרום של חולה נגוע יקשרו את הקרדיוליפין ויצרו פלוקולנט. למרות שבדיקת VDRL ספציפית יותר ממבחן וסרמן המקורי, עדיין עלולות להופיע תוצאות חיוביות שגויות בחולים עם מחלות אוטואימוניות הגורמות לנזק רב לתאים (למשל, זאבת אדמנתית מערכתית).
מבחן ניטרול
כדי לגרום לזיהום, וירוסים חייבים להיקשר לקולטנים בתאי המארח. נוגדנים אנטי-ויראליים יכולים לנטרל זיהומים ויראליים על ידי ציפוי הנגיפים, חסימת הקישור (איור 18.1.6). פעילות זו מנטרלת וירוסים ויכולה לגרום להיווצרות קומפלקסים גדולים של נוגדנים-וירוסים (אשר מוסרים בקלות על ידי פגוציטוזיס) או על ידי קשירת נוגדנים לנגיף וחסימת קשירתו לקולטני התא המארח. פעילות נטרול זו היא הבסיס של מבחני נטרול, מבחנים רגישים המשמשים לאבחון של זיהומים ויראליים.
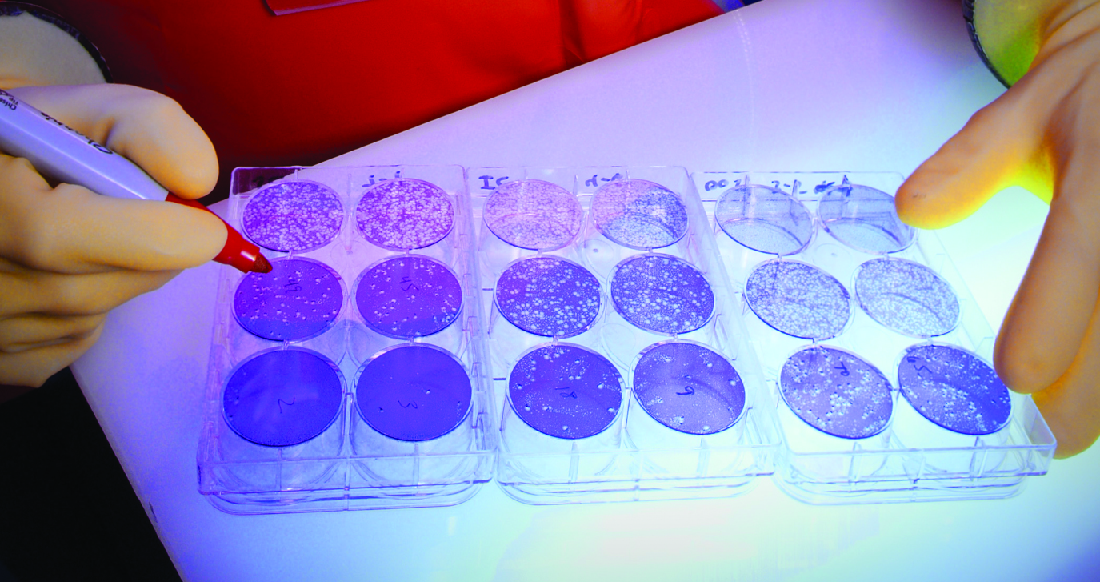
כאשר וירוסים מדביקים תאים, הם גורמים לעיתים קרובות לנזק (השפעות ציטופתיות) שעשוי לכלול תמוגה של התאים המארחים. ניתן לדמיין השפעות ציטופתיות על ידי גידול תאי מארח בצלחת פטרי, כיסוי התאים בשכבה דקה של אגר, ולאחר מכן הוספת וירוס (ראה בידוד, תרבות וזיהוי וירוסים). הנגיף יתפזר לאט מאוד דרך האגר. וירוס ייכנס לתא מארח, יתרבה (יגרום נזק לתאים), ישוחרר מהתא המארח המת, ולאחר מכן יעבור לתאים שכנים. ככל שיותר ויותר תאים מתים, ייווצרו פלאקים של תאים מתים (איור\(\PageIndex{6}\)).
במהלך זיהום ויראלי, המטופל יעלה תגובת נוגדנים לנגיף, ונוכל לכמת את הנוגדנים הללו באמצעות בדיקת הפחתת פלאק. כדי לבצע את הבדיקה, דילול סדרתי מתבצע על דגימת סרום. לאחר מכן מערבבים כל דילול עם כמות סטנדרטית של הנגיף החשוד. כל נוגדנים ספציפיים לנגיף בסרום ינטרלו חלק מהנגיף. המתלים מתווספים לאחר מכן לתאים המארחים בתרבית כדי לאפשר לכל וירוס לא מנוטרל להדביק את התאים וליצור פלאקים לאחר מספר ימים. הטיטר מוגדר כהדדיות של הדילול הגבוה ביותר המראה ירידה של 50% בפלאקים. Titer מתבטא תמיד כמספר שלם. לדוגמה, אם דילול 1/64 היה הדילול הגבוה ביותר שהראה 50% הפחתת פלאק, אז הטיטר הוא 64.
הימצאותם של נוגדנים בסרום המטופל אינה אומרת לנו אם החולה נגוע כרגע או נדבק בעבר. ניתן לזהות זיהומים שוטפים על ידי המתנה של שבועיים ובדיקת דגימת סרום נוספת. עלייה פי ארבעה בטיטר המנטרל במדגם שני זה מצביעה על זיהום חדש.
תרגיל \(\PageIndex{3}\)
במבחן נטרול, אם בסרום של מטופל יש מספר גבוה של נוגדנים אנטי-ויראליים, האם היית מצפה לראות יותר או פחות פלאקים?
אימונואלקטרופורזה
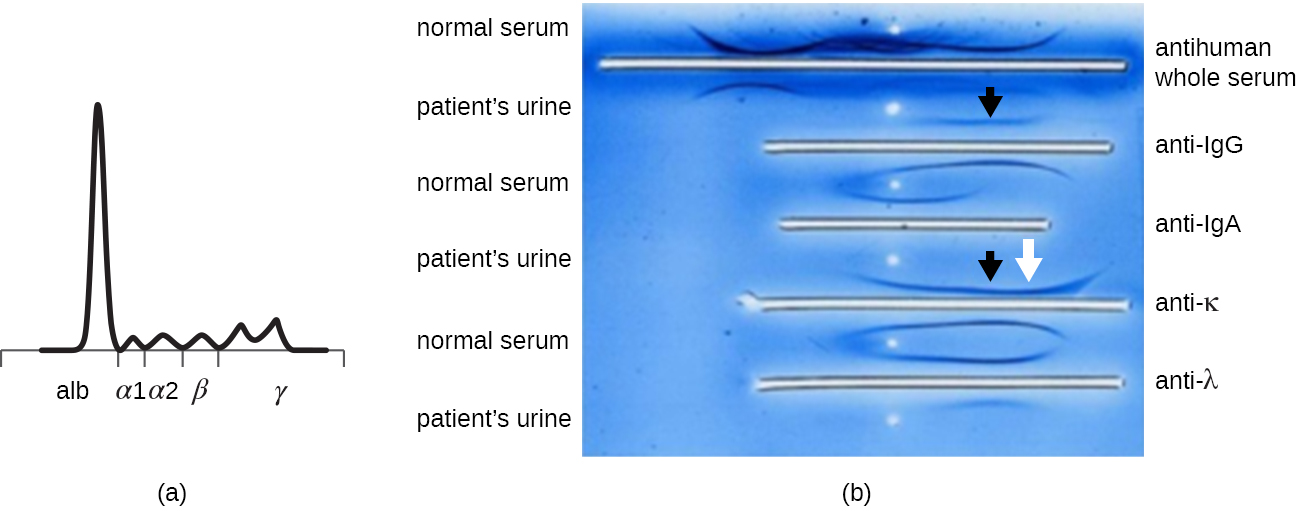
כאשר למטופל יש רמות חלבון גבוהות בדם או מאבד חלבון בשתן, רופא יזמין לעתים קרובות בדיקת אלקטרופורזה של ג'ל פוליאקרילאמיד (PAGE) (ראה הדמיה ואפיון של DNA, RNA וחלבון). בדיקה זו משווה את השפע היחסי של סוגי החלבונים השונים בסרום. ניתן ללמוד עוד דפוסי אלקטרופורזה חלבוניים חריגים באמצעות אימונואלקטרופורזה (IEP). ה- IEP מתחיל בהפעלת דף. אנטיסרה נגד חלבוני סרום נבחרים מתווספת לשקתות הפועלות במקביל למסלול האלקטרופורזה, ויוצרות קשתות פרסיפיטין הדומות לאלו שנראו במבחן Ouchterlony (איור). \(\PageIndex{7}\) זה מאפשר זיהוי של חלבוני אימונוגלובולין חריגים במדגם.
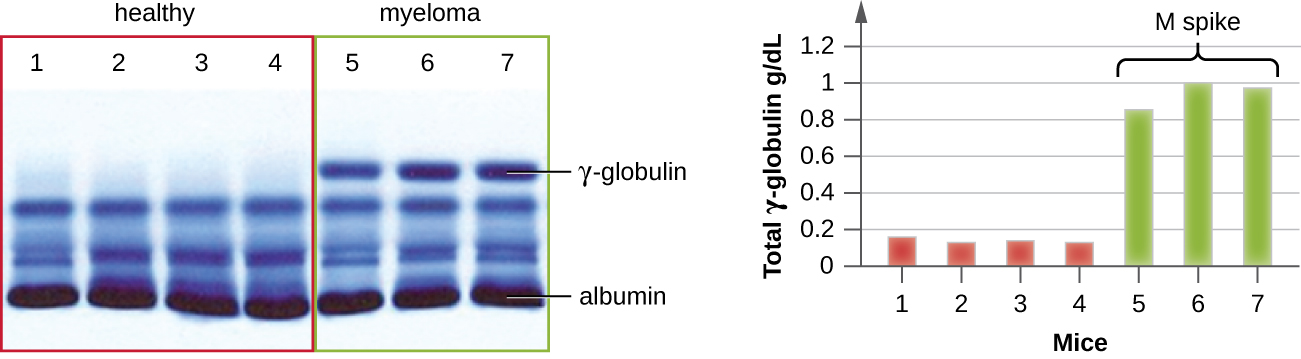
IEP שימושי במיוחד באבחון של מיאלומה נפוצה, סרטן של תאים המפרישים נוגדנים. חולים עם מיאלומה נפוצה אינם יכולים לייצר נוגדנים בריאים; במקום זאת הם מייצרים נוגדנים חריגים שהם חלבונים חד שבטיים (חלבוני M). לפיכך, חולים עם מיאלומה נפוצה יציגו רמות חלבון גבוהות בסרום המראות פס מובהק באזור הגמא גלובולין של ג'ל אלקטרופורזה של חלבון וספייק חד (בחלבון M) בסריקת הצפיפות ולא במריחה הרחבה הרגילה (איור). \(\PageIndex{7}\) כאשר משתמשים בנוגדנים כנגד הסוגים השונים של שרשראות כבדות וקלות של נוגדנים ליצירת קשתות פרסיפיטין, חלבון M יגרום לקשתות מוטות מובהקות כנגד סוג אחד של שרשרת כבדה ומחלקה אחת של שרשרת קלה כפי שניתן לראות באיור. \(\PageIndex{7}\)
אלקטרופורזה של חלבון ואפיון מבנה אימונוגלובולין
הופעת האלקטרופורזה הובילה בסופו של דבר למחקר והבנת מבנה הנוגדנים. כאשר הביוכימאי השוודי ארנה טיסליוס (1902—1971) פרסם את תוצאות האלקטרופורזה החלבונית הראשונות בשנת 1937, 2 הוא יכול היה לזהות את אלבומין החלבון (חלבון הסרום הקטן והשופע ביותר) לפי הרצועה החדה שהוא ייצר בג'ל. לא ניתן היה לפתור את חלבוני הסרום האחרים באלקטרופורזה חלבונית פשוטה, ולכן הוא כינה את שלוש הרצועות הרחבות, עם חלבונים רבים בכל פס, אלפא, בטא וגמא גלובולינים. שנתיים לאחר מכן, האימונולוג האמריקאי אלווין קבאט (1914—2000) נסע לשוודיה כדי לעבוד עם טיסליוס בטכניקה חדשה זו והראה כי נוגדנים נדדו כגלובולינים גמא. 3 עם הבנה חדשה זו ביד, חוקרים למדו עד מהרה כי מיאלומה נפוצה, מכיוון שמדובר בסרטן של תאים המפרישים נוגדנים, יכולה להיות מאובחנת באופן זמני על ידי נוכחות של ספייק M גדול באזור הגמא-גלובולין על ידי אלקטרופורזה של חלבון. לפני גילוי זה, מחקרים על מבנה אימונוגלובולינים היו מינימליים, בגלל הקושי להשיג דגימות טהורות ללמוד. סרה מחולי מיאלומה נפוצה הוכיחה את עצמה כמקור מצוין לאימונוגלובולין חד שבטי מועשר ביותר, וסיפקה את חומר הגלם למחקרים במהלך 20 השנים הבאות פלוס שהביאו להבהרת מבנה האימונוגלובולין.
תרגיל \(\PageIndex{4}\)
באופן כללי, מה משיגה בדיקת אימונואלקטרופורזה?
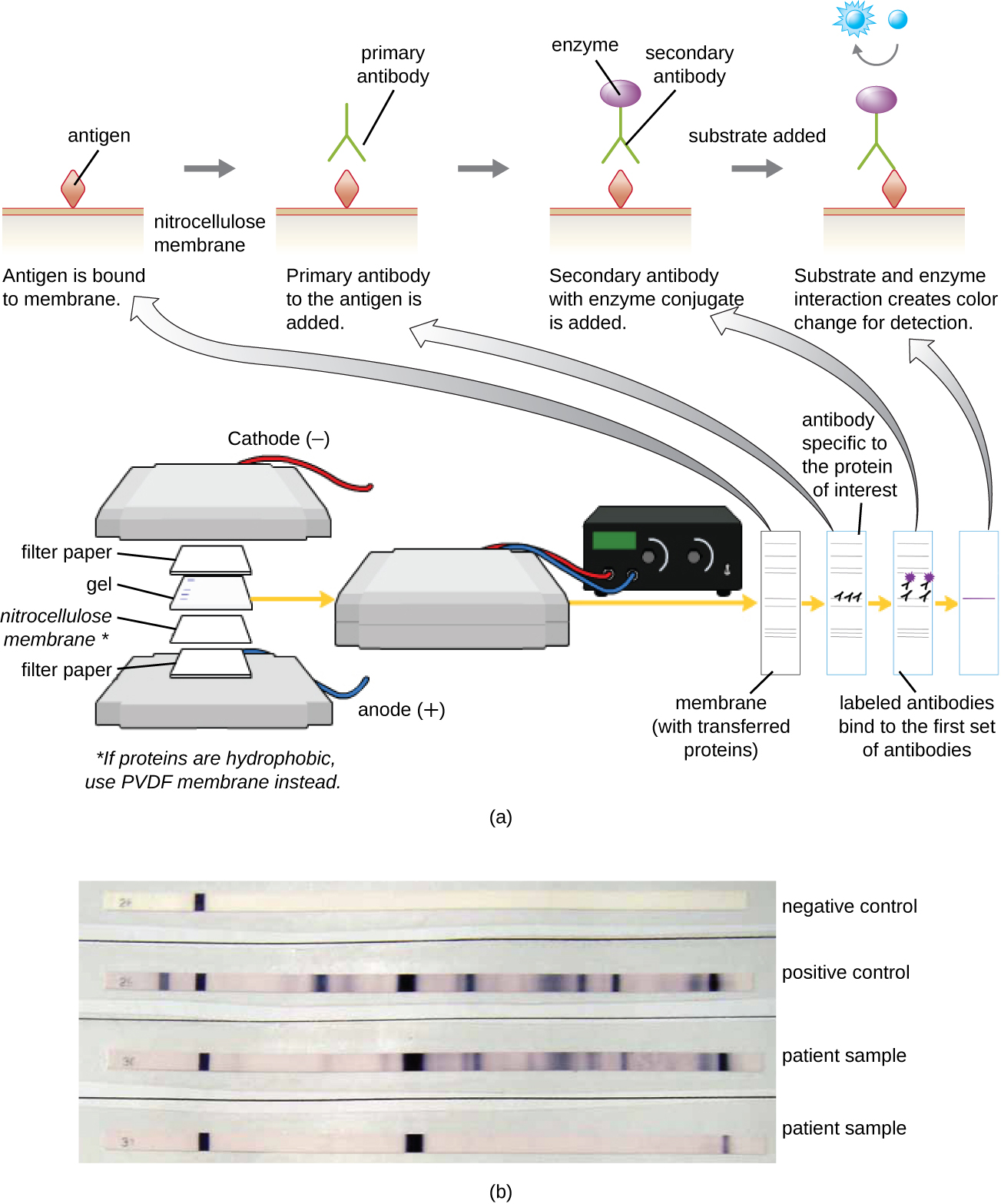
מבחן אימונובלוט: הכתם המערבי
לאחר ביצוע אלקטרופורזה של ג'ל חלבון, ניתן לזהות חלבונים ספציפיים בג'ל באמצעות נוגדנים. טכניקה זו ידועה בשם הכתם המערבי. לאחר הפרדת חלבונים על ידי PAGE, האנטיגנים החלבוניים בג'ל מועברים אל קרום ניטרוצלולוזה ומשותקים על גבי קרום ניטרוצלולוזה. לאחר מכן ניתן לחשוף קרום זה לנוגדן ראשוני המיוצר כדי להיקשר ספציפית לחלבון המעניין. נוגדן שני המצויד במגדלור מולקולרי ייקשר לאחר מכן לראשון. נוגדנים משניים אלה מחוברים למולקולה אחרת כגון אנזים או פלואורופור (מולקולה המאירה כאשר היא מתרגשת מאור). בעת שימוש בנוגדנים המשולבים לאנזימים, מתווסף מצע כרומוגני לאנזים. מצע זה בדרך כלל חסר צבע אך יפתח צבע בנוכחות הנוגדן. הקרינה או צביעת המצע מזהים את מיקומו של החלבון הספציפי בממברנה שאליה קשורים הנוגדנים (איור\(\PageIndex{9}\)).
בדרך כלל, נוגדנים פוליקלוניים משמשים למבחני כתם מערביים. הם רגישים יותר מ-mAbs בגלל יכולתם להיקשר לאפיטופים שונים של האנטיגן הראשוני, והאות מנוגדנים פוליקלוניים הוא בדרך כלל חזק יותר מזה של mAbs. ניתן להשתמש גם בנוגדנים מונוקלוניים; עם זאת, הם יקרים בהרבה לייצור והם פחות רגישים, מכיוון שהם מסוגלים לזהות רק אפיטופ ספציפי אחד.
מספר וריאציות של הכתם המערבי שימושיות במחקר. בכתם דרום-מערבי, חלבונים מופרדים על ידי SDS-PAGE, נמחקים על קרום ניטרוצלולוזה, מורשים להתחדש, ולאחר מכן נבדקים באמצעות בדיקת DNA מסומנת פלואורסצנטית או רדיואקטיבית; מטרת הדרום מערבי היא לזהות אינטראקציות ספציפיות של DNA-חלבון. כתמים מערביים רחוקים מבוצעים על מנת לקבוע אינטראקציות חלבון-חלבון בין חלבונים משותקים (מופרדים על ידי SDS-PAGE, נמחקים על קרום ניטרוצלולוזה ומאפשרים להם לחזור) לבין בדיקות חלבון שאינן נוגדנים. החלבונים שאינם נוגדנים הקשורים המקיימים אינטראקציה עם החלבונים המשותקים בכתם מערבי רחוק עשויים להתגלות על ידי תיוג רדיו, פלואורסצנטיות או שימוש בנוגדן עם משואה מולקולרית אנזימטית.
תרגיל \(\PageIndex{5}\)
מה תפקידו של האנזים במבחן האימונובלוט?
בדיקת חיסון בתיווך משלים
אחד מתפקידי המפתח של נוגדנים הוא הפעלה (קיבוע) של השלמה. כאשר נוגדן נקשר לחיידקים, למשל, חלבוני משלים מסוימים מזהים את הנוגדן הקשור ומפעילים את מפל המשלים. בתגובה, חלבוני משלים אחרים נקשרים לחיידקים כאשר חלקם משמשים כאופסונינים להגברת היעילות של פגוציטוזיס ואחרים יוצרים חורים בממברנות תאי חיידקים גרם שליליות, וגורמים לתמוגה. ניתן להשתמש בפעילות ליטית זו לאיתור נוכחות נוגדנים כנגד אנטיגנים ספציפיים בסרום.
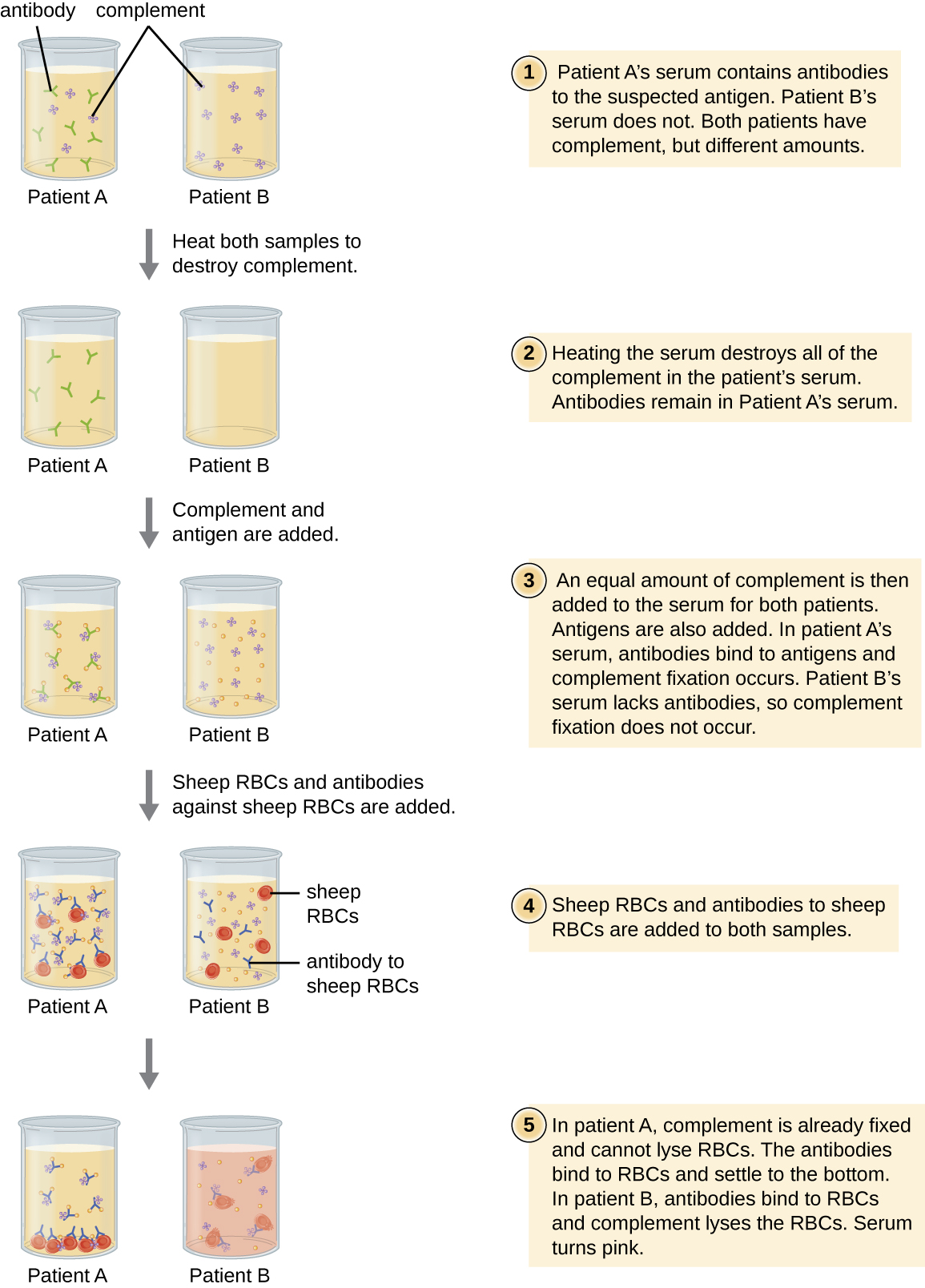
תאי דם אדומים הם תאי אינדיקטור טובים לשימוש בעת הערכת ציטוליזה בתיווך משלים. המוליזה של כדוריות דם אדומות משחררת המוגלובין, שהוא פיגמנט בצבע עז, והמוליזה של אפילו מספר קטן של תאים אדומים תגרום לתמיסה להיות ורודה במידה ניכרת (איור\(\PageIndex{10}\)). מאפיין זה ממלא תפקיד במבחן קיבוע המשלים, המאפשר איתור נוגדנים כנגד פתוגנים ספציפיים. ניתן להשתמש בבדיקת קיבוע המשלים לבדיקת נוגדנים כנגד פתוגנים שקשה לתרבות במעבדה כגון פטריות, וירוסים או החיידק כלמידיה.
כדי לבצע את בדיקת קיבוע המשלים, אנטיגן מפתוגן מתווסף לסרום המטופל. אם קיימים נוגדנים לאנטיגן, הנוגדן יקשור את האנטיגן ויתקן את כל המשלים הזמינים. כאשר לאחר מכן מוסיפים לתערובת תאי דם אדומים ונוגדנים כנגד כדוריות דם אדומות, לא יישאר שום השלמה לליזת התאים האדומים. לכן, אם הפתרון נשאר ברור, המבחן הוא חיובי. אם אין נוגדנים אנטי-פתוגניים בסרום של המטופל, הנוגדנים הנוספים יפעילו את המשלים כדי לזז את התאים האדומים, ויניבו בדיקה שלילית (איור\(\PageIndex{10}\)).
צפה בסרטון זה כדי לראות קווי מתאר של השלבים של מבחן קיבוע המשלים.
תרגיל \(\PageIndex{6}\)
בבדיקת קיבוע משלים, אם הסרום הופך לורוד, האם לחולה יש נוגדנים לאנטיגן או לא? תסבירי.
הטבלה \(\PageIndex{1}\) מסכמת את הסוגים השונים של מבחני נוגדנים-אנטיגן הנדונים בסעיף זה.
| סוג הבדיקה | מנגנון | דוגמאות |
|---|---|---|
| משקעים | נוגדן נקשר לאנטיגן מסיס ויוצר פרסיפיטין גלוי | בדיקת טבעת Precipitin כדי להמחיש היווצרות סריג בתמיסה |
| אימונואלקטרופורזה לבחינת התפלגות אנטיגנים בעקבות אלקטרופורזה | ||
| מבחן Ouchterlony להשוואת אנטיגנים מגוונים | ||
| בדיקת אימונודיפוזיה רדיאלית לכימות אנטיגנים | ||
| פלוקולציה | נוגדן נקשר למולקולות בלתי מסיסות בהשעיה, ויוצר אגרגטים גלויים | בדיקת VDRL לעגבת |
| ניטרול | נוגדן נקשר לנגיף, חוסם כניסה ויראלית לתאי המטרה ומונע היווצרות פלאקים | בדיקת הפחתת פלאק לאיתור נוכחות של נוגדנים מנטרלים בסרה של המטופל |
| הפעלת השלמה | נוגדן נקשר לאנטיגן, גורם להפעלת משלים ואינו משאיר שום השלמה לתאי דם אדומים | בדיקת קיבוע משלימה לנוגדנים לחולים כנגד חיידקים קשים לתרבות כגון כלמידיה |
מושגי מפתח וסיכום
- כאשר הם נמצאים ביחס הנכון, נוגדן ואנטיגן יהוו פרסיפיטין, או סריג שיוצא מהתמיסה.
- ניתן להשתמש בבדיקת טבעת precipitin כדי לדמיין היווצרות סריג בתמיסה. מבחן Ouchterlony מדגים היווצרות סריג בג'ל. מבחן האימונודיפוזיה הרדיאלי משמש לכימות אנטיגן על ידי מדידת גודל אזור משקעים בג'ל המושרה בנוגדנים.
- אנטיגנים בלתי מסיסים בהשעיה יווצרו פלוקולנטים כאשר הם קשורים לנוגדנים. זהו הבסיס לבדיקת VDRL לעגבת שבה נוגדנים אנטי-טרפונמליים נקשרים לקרדיוליפין בהשעיה.
- זיהומים ויראליים יכולים להיות מזוהים על ידי כימות נוגדנים מנטרלי וירוסים בסרום של המטופל.
- מחלקות נוגדנים שונות בפלזמה או בסרום מזוהות באמצעות אימונואלקטרופורזה.
- ניתן להדגים נוכחות של אנטיגנים ספציפיים (למשל, חלבונים חיידקיים או ויראליים) בסרום על ידי מבחני כתם מערבי, בהם החלבונים מועברים לקרום ניטרוצלולוזה ומזהים באמצעות נוגדנים מסומנים.
- בבדיקת קיבוע המשלים משתמשים במשלים לאיתור נוגדנים כנגד פתוגנים שונים.
הערות שוליים
- 1 Ouchterlony, Örjan, "שיטת חוץ גופית לבדיקת יכולת ייצור הרעלנים של חיידקי דיפתריה" אקטה פתולוגיקה מיקרוביולוגיה סקנדינביצה 26, מס '4 (1949): 516-24.
- 2 Tiselius, Arne, "אלקטרופורזה של גלובולין בסרום: ניתוח אלקטרופורטי של סרה רגילה וחיסונית", כתב עת ביוכימי 31, מס '9 (1937): 1464.
- 3 טיסליוס, ארנה ואלווין א 'קבאט. "מחקר אלקטרופורטי של סרה חיסונית ותכשירי נוגדנים מטוהרים", כתב העת לרפואה ניסיונית 69, מס '1 (1939): 119-31.


