19.1: רגישות יתר
- Page ID
- 209125
מטרות למידה
- זהה והשווה את המאפיינים המבדילים, המנגנונים והדוגמאות העיקריות לרגישות יתר מסוג I, II, III ו- IV
מיקוד קליני: חלק 1
קרי, טייסת חברת תעופה בת 40, קבעה פגישה עם הרופא הראשי שלה כדי לדון בפריחה שמתפתחת בכל פעם שהיא מבלה בשמש. כפי שהיא מסבירה לרופא שלה, זה לא נראה כמו כוויות שמש. היא נזהרת לא לבלות יותר מדי זמן בשמש והיא משתמשת בקרם הגנה. למרות אמצעי הזהירות הללו, הפריחה עדיין מופיעה, ומתבטאת ככתמים אדומים ומורמים שקשקשים מעט. הפריחה נמשכת 7 עד 10 ימים בכל פעם, ונראה שהיא נעלמת מעצמה במידה רבה. בזמן האחרון הפריחות החלו להופיע גם על לחייה ומעל עיניה משני צידי מצחה.
תרגיל \(\PageIndex{1}\)
- האם קרי צודקת להיות מודאגת, או שהיא צריכה פשוט להיזהר יותר מחשיפה לשמש?
- האם ישנם תנאים שעלולים להיגרם כתוצאה מחשיפה לשמש שהרופא של קרי צריך לשקול?
בהגנות מארח ספציפיות מסתגלות, דנו במנגנונים שבאמצעותם הגנות חיסוניות אדפטיביות, הומורליות ותאיות כאחד, מגנות עלינו מפני מחלות זיהומיות. עם זאת, אותן הגנות חיסוניות מגנות יכולות להיות אחראיות גם לתגובות לא רצויות הנקראות תגובות רגישות יתר. תגובות רגישות יתר מסווגות לפי מנגנון החיסון שלהן.
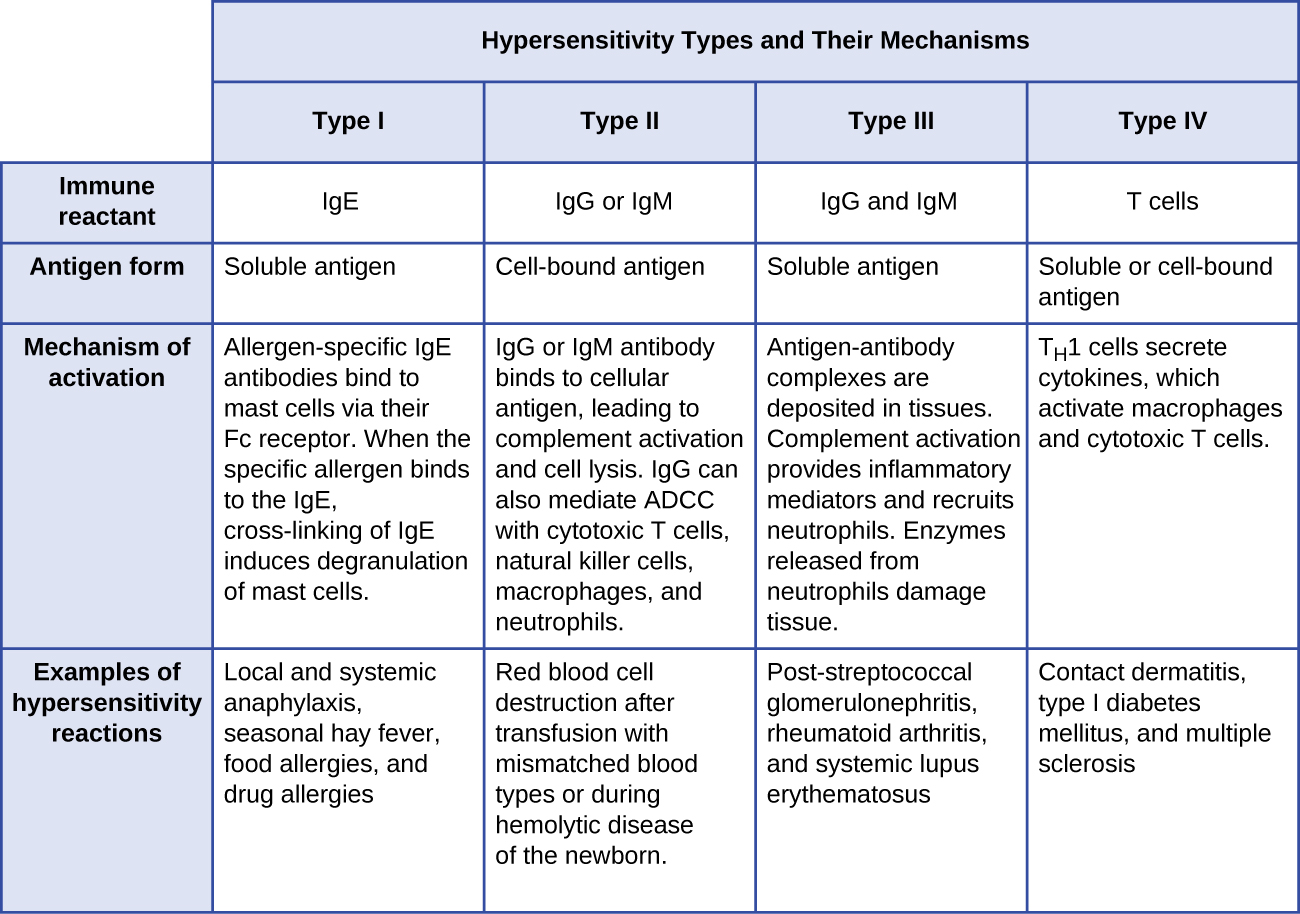
- תגובות רגישות יתר מסוג I כוללות נוגדן אימונוגלובולין E (IgE) נגד אנטיגן מסיס, מה שמעורר דה-גרנולציה של תאי פיטום.
- תגובות רגישות יתר מסוג II כוללות נוגדנים מסוג IgG ו- IgM המכוונים נגד אנטיגנים תאיים, מה שמוביל לנזק לתאים המתווך על ידי אפקטורים אחרים של מערכת החיסון.
- תגובות רגישות יתר מסוג III כוללות אינטראקציות של IgG, IgM, ומדי פעם נוגדנים מסוג IgA 1 עם אנטיגן ליצירת קומפלקסים חיסוניים. הצטברות של קומפלקסים חיסוניים ברקמה מובילה לנזק לרקמות המתווך על ידי אפקטורים אחרים של מערכת החיסון.
- תגובות רגישות יתר מסוג IV הן תגובות בתיווך תאי T שיכולות להיות כרוכות בנזק לרקמות המתווך על ידי מקרופאגים מופעלים ותאי T ציטוטוקסיים.
רגישות יתר מסוג I
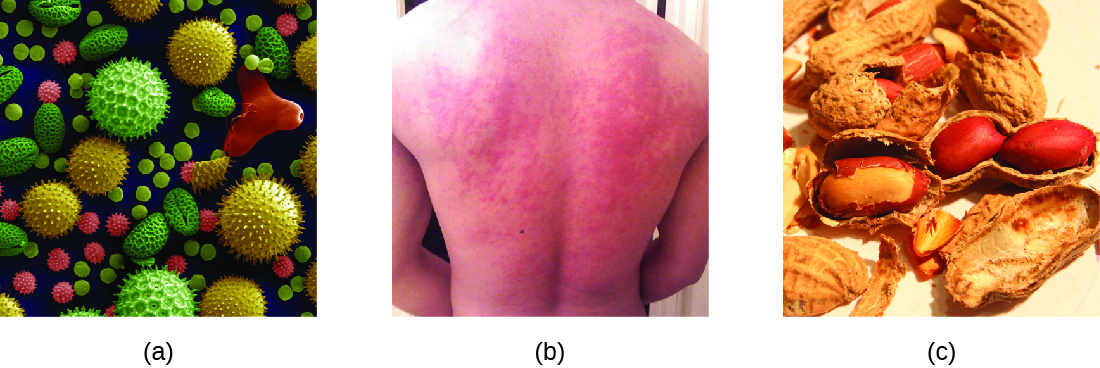
כאשר אדם מוצג נחשף לאלרגן, זה יכול להוביל לתגובה חיסונית מהירה המתרחשת כמעט מיד. תגובה כזו נקראת אלרגיה והיא מסווגת כרגישות יתר מסוג I. אלרגנים עשויים להיות חומרים מזיקים לכאורה כגון קשקשים של בעלי חיים, עובש או אבקה. אלרגנים עשויים להיות גם חומרים הנחשבים מסוכנים יותר באופן מולד, כגון ארס חרקים או תרופות טיפוליות. אי סבילות למזון יכולה גם להניב תגובות אלרגיות כאשר אנשים הופכים לרגישים למזונות כגון בוטנים או רכיכות (איור). \(\PageIndex{1}\) ללא קשר לאלרגן, החשיפה הראשונה מפעילה תגובה נוגדנית IgE ראשונית הגורמת לרגישות של אדם לתגובת רגישות יתר מסוג I בחשיפה שלאחר מכן.
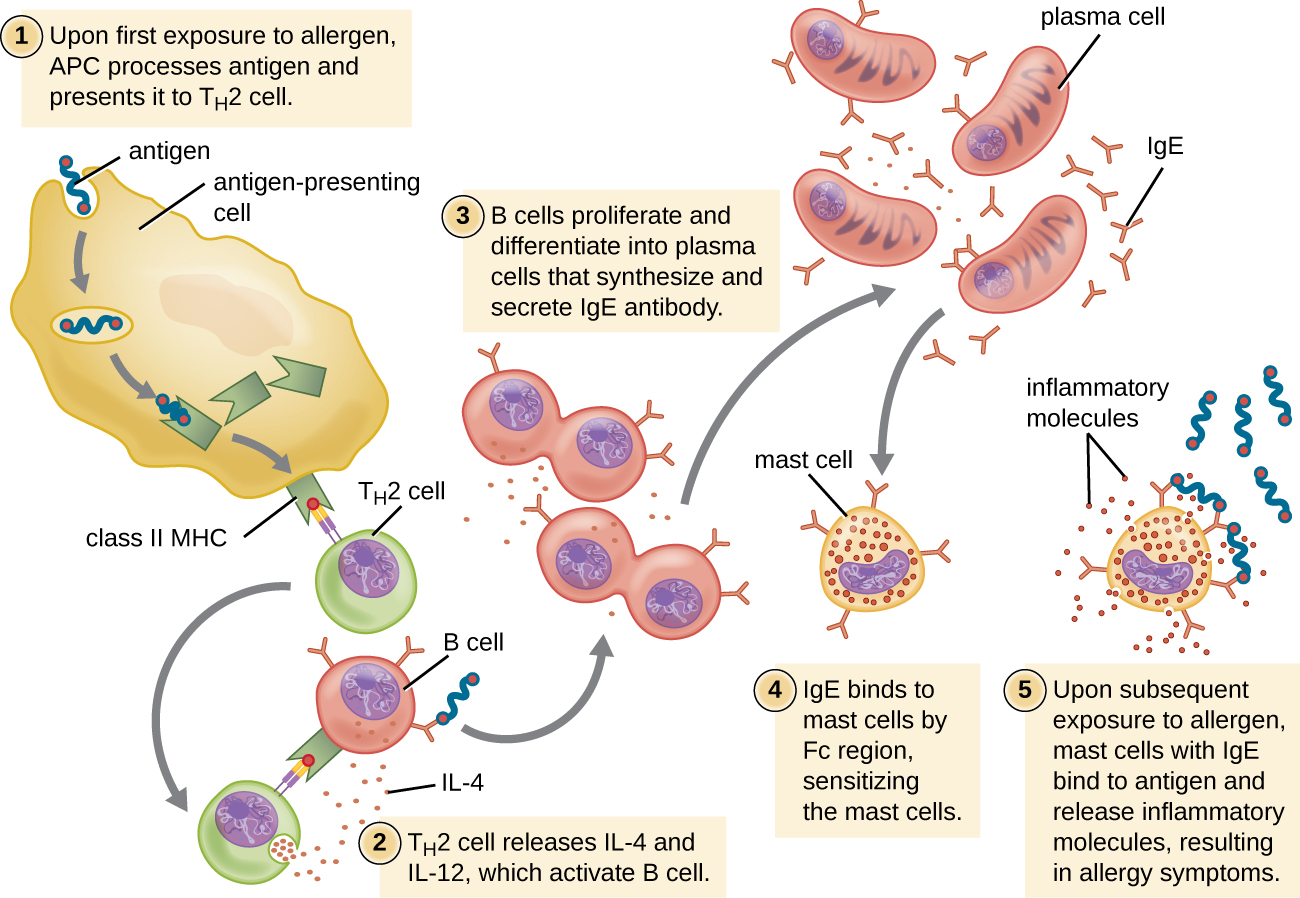
עבור אנשים רגישים, חשיפה ראשונה לאלרגן מפעילה תגובה חזקה של תאי T H 2 (איור\(\PageIndex{2}\)). ציטוקינים אינטרלוקין (IL) -4 ו-IL-13 מתאי T H 2 מפעילים תאי B ספציפיים לאותו אלרגן, וכתוצאה מכך שגשוג משובטים, התמיינות לתאי פלזמה ומעבר ברמת נוגדנים מייצור IgM לייצור IgE. האזורים המתגבשים (Fc) של נוגדני IgE נקשרים לקולטנים ספציפיים על פני תאי התורן בכל הגוף. ההערכה היא כי כל תא פיטום יכול לקשור עד 500,000 מולקולות IgE, כאשר לכל מולקולת IgE יש שני אתרי קשירת אנטיגן ספציפיים לאלרגן (Fab) הזמינים לקשירת אלרגן בחשיפות עוקבות. כשזה קורה, האלרגן לרוב כבר לא קיים ואין תגובה אלרגית, אך תאי התורן מוכנים לחשיפה שלאחר מכן והאדם רגיש לאלרגן.
בחשיפה שלאחר מכן, אלרגנים נקשרים למולקולות IgE מרובות על תאי פיטום, ומקשרים בין מולקולות IgE. תוך דקות, קישור צולב זה של IgE מפעיל את תאי התורן ומפעיל דה-גרנולציה, תגובה שבה תוכן הגרגירים בתא התורן משתחרר לסביבה החוץ-תאית. רכיבים מעוצבים מראש המשתחררים מגרגירים כוללים היסטמין, סרוטונין וברדיקינין (טבלה). \(\PageIndex{1}\) תאי התורן המופעלים משחררים גם מתווכי שומנים חדשים שנוצרו (לוקוטריאנים ופרוסטגלנדינים ממטבוליזם של חומצה אראצ'דונית ממברנה) וציטוקינים כגון גורם נמק הגידול (טבלה). \(\PageIndex{2}\)
| רכיב גרגיר | פעילות |
|---|---|
| הפרין | ממריץ את יצירת הברדיקינין הגורם לחדירות מוגברת של כלי הדם, הרחבת כלי הדם, היצרות הסימפונות והפרשת ריר מוגברת |
| היסטמין | גורם להתכווצות שרירים חלקים, מגביר את חדירות כלי הדם, מגביר את היווצרות הריר והדמעה |
| סרוטונין | מגביר את חדירות כלי הדם, גורם להרחבת כלי הדם והתכווצות שרירים חלקים |
המתווכים הכימיים המשתחררים על ידי תאי פיטום גורמים באופן קולקטיבי לדלקת ולסימנים והתסמינים הקשורים לתגובות רגישות יתר מסוג I. היסטמין מגרה הפרשת ריר במעברי האף והיווצרות דמעות מבלוטות דמעות, מקדם את נזלת ועיניים מימיות של אלרגיות. אינטראקציה של היסטמין עם קצות העצבים גורמת לגירוד ולהתעטשות. הרחבת כלי הדם הנגרמת על ידי כמה מהמתווכים עלולה לגרום לכוורות, כאבי ראש, אנגיואדמה (נפיחות הפוגעת לעתים קרובות בשפתיים, בגרון ובלשון) ולחץ דם נמוך (לחץ דם נמוך). היצרות ברונכיולה הנגרמת על ידי חלק מהמתווכים הכימיים מביאה לצפצופים, קוצר נשימה (קשיי נשימה), שיעול, ובמקרים חמורים יותר, ציאנוזה (צבע כחלחל לעור או לריריות). הקאות יכולות לנבוע מגירוי מרכז ההקאות במוח הקטן על ידי היסטמין וסרוטונין. היסטמין יכול גם לגרום להרפיה של שרירי החלק במעי ושלשולים.
| מתווך כימי | פעילות |
|---|---|
| לוקוט ריינה | גורם להתכווצות שרירים חלקים והפרשת ריר, מגביר את חדירות כלי הדם |
| פרוסטגלנדין | גורם להתכווצות שרירים חלקים ולהרחבת כלי הדם |
| TNF-α (ציטוקינים) | גורם לדלקת וממריץ ייצור ציטוקינים על ידי סוגי תאים אחרים |
תגובות רגישות יתר מסוג I יכולות להיות מקומיות או מערכתיות. תגובות רגישות יתר מסוג I מקומיות כוללות נזלת קדחת השחת, כוורות ואסטמה (טבלה\(\PageIndex{3}\)). תגובות רגישות יתר מערכתיות מסוג I מכונות אנפילקסיאו הלם אנפילקטי. למרות שאנפילקסיס חולקת תסמינים רבים הנפוצים בתגובות רגישות יתר מסוג I, נפיחות הלשון וקנה הנשימה, סתימת דרכי הנשימה, ירידה מסוכנת בלחץ הדם והתפתחות הלם עלולים להפוך את האנפילקסיס לחמור ומסכן חיים במיוחד. למעשה, מוות יכול להתרחש תוך דקות מרגע הופעת הסימנים והתסמינים.
תגובות בשלב מאוחר ברגישות יתר מסוג I עשויות להתפתח 4-12 שעות לאחר השלב המוקדם ומתווכות על ידי אאוזינופילים, נויטרופילים ולימפוציטים שגויסו על ידי גורמים כימוטקטיים המשתחררים מתאי פיטום. הפעלת תאים מגויסים אלה מובילה לשחרורם של מתווכים כימיים נוספים הגורמים לנזק לרקמות ותסמינים בשלב מאוחר של נפיחות ואודם בעור, שיעול, צפצופים והפרשות מהאף.
אנשים שיש להם גנים לתכונות לא הסתגלותיות, כגון תגובות רגישות יתר מסוג I למרכיבים לא מזיקים אחרת של הסביבה, צפויים לסבול מהצלחת רבייה מופחתת. עם סוג זה של לחץ סלקטיבי אבולוציוני, תכונות כאלה לא היו צפויות להימשך באוכלוסייה. זה מצביע על כך שלרגישות יתר מסוג I עשויה להיות פונקציה הסתגלותית. ישנן עדויות לכך שה-IgE המיוצר במהלך תגובות רגישות יתר מסוג I נועד למעשה להתמודד עם זיהומי הלמינת 2. הלמינתים הם אחד מהאורגניזמים הבודדים שיש להם חלבונים שממוקדים על ידי IgE. בנוסף, ישנן עדויות לכך שזיהומי הלמינת 'בגיל צעיר מפחיתים את הסבירות לרגישות יתר מסוג I לחומרים מזיקים בשלב מאוחר יותר בחיים. לפיכך יכול להיות שאלרגיות הן תוצאה מצערת של ברירה חזקה בשושלת היונקים או קודם לכן להגנה מפני תולעים טפיליות.
| שם נפוץ | סיבה | סימנים ותסמינים |
|---|---|---|
| אסטמה הנגרמת על ידי אלרגיה | שאיפת אלרגנים | צמצום של ברונכי, נשימה מאומצת, שיעול, צמרמורות, כאבי גוף |
| אנפילקסיס | תגובה מערכתית לאלרגנים | כוורות, גירוד, נפיחות בלשון ובגרון, בחילה, הקאות, לחץ דם נמוך, הלם |
| קדחת השחת | שאיפת עובש או אבקה | נזלת, עיניים דומעות, התעטשות |
| כוורות (אורטיקריה) | אלרגנים למזון או לתרופות, עקיצות חרקים | פריחה בעור מוגבהת וגבשושית עם גירוד; בליטות עלולות להתכנס לאזורים מוגבהים גדולים |
תרגיל \(\PageIndex{2}\)
- מהם התאים הגורמים לתגובת רגישות יתר מסוג I?
- תאר את ההבדלים בין תגובות רגישות יתר מיידיות ומאוחרות מסוג I.
- רשום את הסימנים והתסמינים של אנפילקסיס.
השערת ההיגיינה
ברוב החברות המודרניות, היגיינה טובה קשורה רחצה קבועה, ובריאות טובה עם ניקיון. אבל כמה מחקרים שנעשו לאחרונה מצביעים על כך שהקשר בין בריאות לחיים נקיים עשוי להיות פגום. חלקם מרחיקים לכת ומציעים שיש לעודד ילדים לשחק בעפר - או אפילו לאכול לכלוך 3 - לטובת בריאותם. המלצה זו מבוססת על מה שמכונה השערת היגיינה, המציעה שחשיפה בילדות לאנטיגנים ממגוון רחב של חיידקים מובילה למערכת חיסונית מתפקדת טוב יותר בהמשך החיים.
השערת ההיגיינה הוצעה לראשונה בשנת 1989 על ידי דיוויד סטראצ'ן 4, שצפה בקשר הפוך בין מספר הילדים הגדולים במשפחה לבין שכיחות קדחת השחת. למרות שקדחת השחת בילדים עלתה באופן דרמטי במהלך אמצע המאה ה -20, השכיחות הייתה נמוכה משמעותית במשפחות עם יותר ילדים. סטראצ'ן הציע כי שכיחות נמוכה יותר של אלרגיות במשפחות גדולות יכולה להיות קשורה לזיהומים שנרכשו מאחים גדולים, דבר המצביע על כך שזיהומים אלה גרמו לילדים להיות פחות רגישים לאלרגיות. סטראצ'ן טען גם כי מגמות כלפי משפחות קטנות יותר ודגש רב יותר על ניקיון במאה ה -20 הפחיתו את החשיפה לפתוגנים ובכך הובילו לשיעורים כלליים גבוהים יותר של אלרגיות, אסטמה והפרעות חיסוניות אחרות.
חוקרים אחרים הבחינו בקשר הפוך בין שכיחות הפרעות חיסוניות למחלות זיהומיות הנדירות כיום במדינות מתועשות אך עדיין נפוצות במדינות פחות מתועשות. 5 במדינות מפותחות, ילדים מתחת לגיל 5 אינם נחשפים לרבים מהחיידקים, המולקולות והאנטיגנים שהם כמעט בוודאות היו נתקלים בהם לפני מאה שנה. היעדר אתגרים מוקדמים למערכת החיסון על ידי אורגניזמים שאיתם התפתחו בני אדם ואבותיהם עלול לגרום לכשלים בתפקוד המערכת החיסונית בשלב מאוחר יותר בחיים.
רגישות יתר מסוג II (ציטוטוקסיות)
תגובות חיסוניות המסווגות כרגישות יתר מסוג II, או רגישות יתר ציטוטוקסית, מתווכות על ידי נוגדני IgG ו- IgM הנקשרים לאנטיגנים על פני התא או לאנטיגנים הקשורים למטריצה על ממברנות המרתף. נוגדנים אלה יכולים להפעיל משלים, וכתוצאה מכך תגובה דלקתית ותמוגה של התאים הממוקדים, או שהם יכולים להיות מעורבים בציטוטוקסיות בתיווך תאים תלויי נוגדנים (ADCC) עם תאי T ציטוטוקסיים.
במקרים מסוימים, האנטיגן עשוי להיות אנטיגן עצמי, ובמקרה זה התגובה תתואר גם כמחלה אוטואימונית. (מחלות אוטואימוניות מתוארות בהפרעות אוטואימוניות). במקרים אחרים, נוגדנים עשויים להיקשר למולקולות משטח התא המתרחשות באופן טבעי, אך אקסוגניות, כגון אנטיגנים הקשורים להקלדת דם הנמצאות על כדוריות דם אדומות (RBCs). זה מוביל לציפוי ה- RBCs על ידי נוגדנים, הפעלה של מפל המשלים ותמוגה מתווכת משלים של RBCs, כמו גם אופסוניזציה של RBCs לפגוציטוזיס. שתי דוגמאות לתגובות רגישות יתר מסוג II הכוללות RBCs הן תגובת עירוי המוליטית (HTR) ומחלה המוליטית של הרך הנולד (HDN). תגובות רגישות יתר מסוג II אלה, אשר יידונו בפירוט רב יותר, מסוכמות בטבלה\(\PageIndex{4}\).
אימונוהמטולוגיה היא חקר הדם והרקמה היוצרת דם ביחס לתגובה החיסונית. תגובות יזומות נוגדנים כנגד תאי דם הן רגישות יתר מסוג II, ובכך נופלות לתחום האימונוהמטולוגיה. עבור התלמידים הלומדים לראשונה על אימונוהמטולוגיה, הבנת המנגנונים האימונולוגיים המעורבים הופכת למאתגרת עוד יותר על ידי מערכת המינוח המורכבת המשמשת לזיהוי אנטיגנים שונים מקבוצת הדם, הנקראים לעתים קרובות סוגי דם. האנטיגנים הראשונים מקבוצת הדם השתמשו בשמות אלפביתיים או נקראו על שם האדם הראשון הידוע כמייצר נוגדנים לאנטיגן תאי הדם האדומים (למשל, קל, דאפי או דייגו). עם זאת, בשנת 1980, מפלגת העבודה הבינלאומית לעירוי דם (ISBT) בנושא טרמינולוגיה יצרה תקן לטרמינולוגיה של קבוצות דם בניסיון לזהות באופן עקבי יותר אנטיגנים מקבוצת הדם שהתגלו לאחרונה. אנטיגנים חדשים מקבלים כעת מספר ומוקצים למערכת קבוצת דם, אוסף או סדרה. עם זאת, אפילו במאמץ זה, המינוח של קבוצת הדם עדיין אינו עקבי.
| שם נפוץ | סיבה | סימנים ותסמינים |
|---|---|---|
| מחלה המוליטית של התינוק (HDN) | IgG מאם חוצה את השליה, מכוון את RBCs של העובר להשמדה | אנמיה, בצקת, כבד מוגדל או טחול, הידרופים (נוזל בחלל הגוף), המוביל למוות של יילוד במקרים חמורים |
| תגובות עירוי המוליטיות (HTR) | IgG ו-IgM נקשרים לאנטיגנים על RBCs שעברו עירוי, ומכוונים ל-RBCs של תורם להשמדה | חום, צהבת, יתר לחץ דם, קרישה תוך-וסקולרית מופצת, ואולי מובילה לאי ספיקת כליות ומוות |
אי התאמה לקבוצת הדם ABO
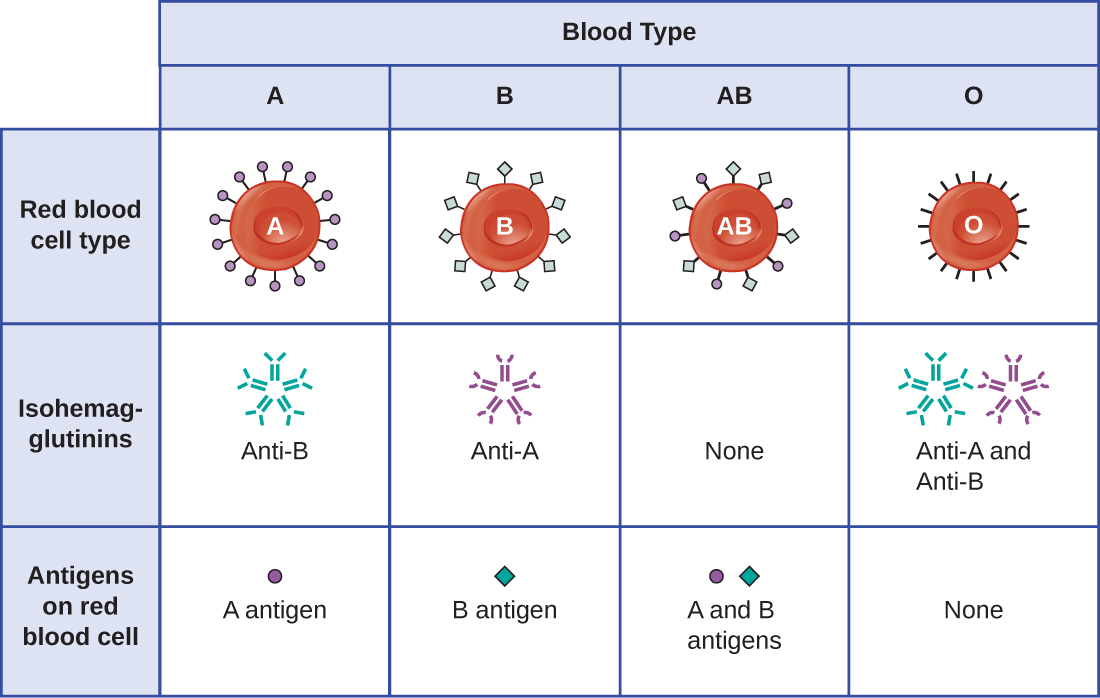
ההכרה בכך שלאנשים יש סוגי דם שונים תוארה לראשונה על ידי קארל לנדשטיינר (1868—1943) בתחילת המאה העשרים, בהתבסס על תצפיתו כי סרום מאדם אחד עלול לגרום להתגבשות של RBCs מאדם אחר. מחקרים אלה הובילו את לנדשטיינר לזיהוי ארבעה סוגי דם שונים. מחקר שנערך לאחר מכן על ידי מדענים אחרים קבע כי ארבעת סוגי הדם התבססו על נוכחות או היעדר גליקופרוטאינים על פני השטח "A" ו- "B", וזה סיפק את הבסיס למערכת קבוצת הדם ABO שעדיין נמצאת בשימוש כיום (איור\(\PageIndex{3}\)). הפונקציות של אנטיגנים אלה אינן ידועות, אך חלקן נקשרו לתפקודים ביוכימיים תקינים של התא. יתר על כן, סוגי דם ABO עוברים בתורשה כאללים (אחד מכל הורה), והם מציגים דפוסים של תורשה דומיננטית וקודומיננטית. האללים לסוגי דם A ו- B הם דומיננטיים זה לזה, ושניהם דומיננטיים ביחס לסוג הדם O. לכן, לאנשים עם גנוטיפים של AA או AO יש דם מסוג A ומבטאים את אנטיגן הגליקופרוטאין A על פני השטח של ה- RBCs שלהם. לאנשים עם גנוטיפים של BB או BO יש דם מסוג B ומבטאים את אנטיגן הגליקופרוטאין B על פני השטח של ה- RBCs שלהם. לבעלי גנוטיפ של AB יש דם מסוג AB ומבטאים אנטיגנים גליקופרוטאין A ו- B על פני השטח של ה- RBCs שלהם. לבסוף, לאנשים עם גנוטיפ של OO יש דם מסוג O וחסרים גליקופרוטאינים A ו-B על פני השטח של ה-RBCs שלהם.
חשוב לציין כי ה- RBCs של כל ארבעת סוגי הדם ABO חולקים מולקולת קולטן חלבון נפוצה, ותוספת של פחמימות ספציפיות לקולטני החלבון היא שקובעת את סוגי הדם A, B ו- AB. הגנים שעוברים בתורשה לסוגי הדם A, B ו- AB מקודדים לאנזימים המוסיפים את מרכיב הפחמימות לקולטן החלבון. לאנשים עם סוג דם O עדיין יש את הקולטן לחלבון אך חסרים להם אנזימים שיוסיפו פחמימות שיהפכו את תאי הדם האדומים שלהם לסוג A, B או AB.
נוגדני IgM בפלזמה המגיבים צולבים עם אנטיגנים מקבוצת הדם שאינם קיימים ב- RBCs של הפרט נקראים isohemagglutinins (איור). \(\PageIndex{3}\) איזוהמגלוטינינים מיוצרים בשבועות הראשונים לאחר הלידה ונמשכים לאורך כל החיים. נוגדנים אלה מיוצרים בתגובה לחשיפה לאנטיגנים סביבתיים ממזון ומיקרואורגניזמים. לאדם עם דם מסוג A יש אנטיגנים A על פני השטח של ה- RBCs שלו והוא יפיק נוגדנים נגד B לאנטיגנים סביבתיים הדומים למרכיב הפחמימות של אנטיגנים B. לאדם עם דם מסוג B יש אנטיגנים B על פני השטח של ה- RBCs שלו והוא יפיק נוגדנים אנטי-A לאנטיגנים סביבתיים הדומים למרכיב הפחמימות של אנטיגנים A. לאנשים עם סוג דם O חסרים אנטיגנים A ו-B ב-RBCs שלהם, ולכן מייצרים נוגדנים אנטי-A ואנטי-B כאחד. לעומת זאת, לאנשים עם סוג דם AB יש אנטיגנים A ו-B על ה-RBCs שלהם, ולכן חסרים נוגדנים אנטי-A ואנטי-B.
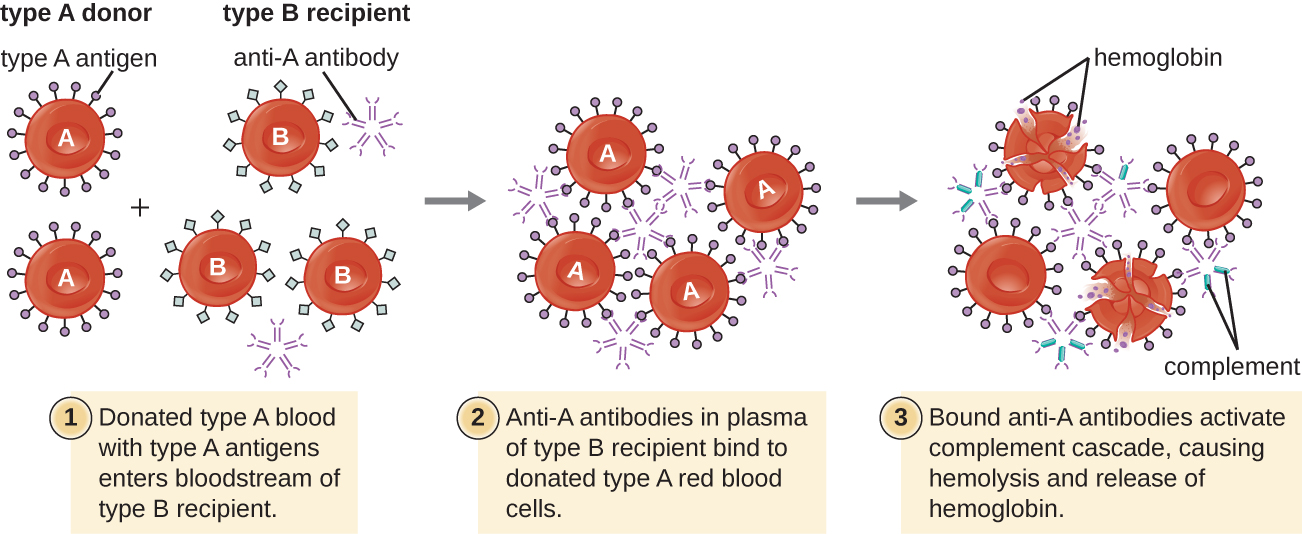
מטופל עשוי לדרוש עירוי דם מכיוון שחסרים לו מספיק RBCs (אנמיה) או בגלל שחווה אובדן משמעותי של נפח הדם באמצעות טראומה או מחלה. למרות עירוי הדם ניתן כדי לעזור למטופל, חיוני שהמטופל יקבל עירוי עם סוג דם ABO תואם. עירוי עם סוג דם ABO שאינו תואם עלול להוביל לתגובה ציטוטוקסית חזקה שעלולה להיות קטלנית מסוג II הנקראת תגובת עירוי המוליטית (HTR) (איור). \(\PageIndex{4}\)
לדוגמה, אם אדם עם דם מסוג B מקבל עירוי של דם מסוג A, הנוגדנים האנטי-A שלו ייקשרו ויגבירו את ה- RBCs שהועברו. בנוסף, הפעלה של מפל המשלים הקלאסי תוביל לתגובה דלקתית חזקה, ומתחם התקפת הממברנה המשלים (MAC) יתווך המוליזה מסיבית של RBCs שהועברו. הפסולת מ- RBCs פגומים ונהרסים עלולה לחסום כלי דם באלוואולי של הריאות ובגלומרולי של הכליות. תוך 1 עד 24 שעות של עירוי לא תואם, החולה חווה חום, צמרמורות, גירוד (גירוד), אורטיקריה (כוורות), קוצר נשימה, המוגלובינוריה (המוגלובין בשתן) ויתר לחץ דם (לחץ דם נמוך). בתגובות החמורות ביותר, לחץ דם נמוך באופן מסוכן עלול להוביל להלם, לאי ספיקת איברים ולמוות של המטופל.
בתי חולים, מרכזים רפואיים ומעבדות קליניות נלוות משתמשים בדרך כלל במערכות hemovigilance כדי למזער את הסיכון ל- HTR עקב טעות פקידותית. מערכות Hemovigilance הן פרוצדורות העוקבות אחר מידע עירוי ממקור התורם ומוצרי הדם המתקבלים למעקב אחר חולים המקבלים. מערכות Hemovigilance המשמשות במדינות רבות מזהות HTR ותוצאותיהן באמצעות דיווח חובה (למשל, למנהל המזון והתרופות בארצות הברית), ומידע זה הוא בעל ערך כדי לסייע במניעת התרחשויות כאלה בעתיד. לדוגמה, אם נמצא כי HTR הוא תוצאה של טעות מעבדה או פקידותית, ניתן לאתר ולתייג מוצרי דם נוספים שנאספו מהתורם באותה עת כדי למנוע HTRs נוספים. כתוצאה מאמצעים אלה, מקרי מוות הקשורים ל- HTR בארצות הברית מתרחשים בכ -1 לכל 2 מיליון יחידות שעברו עירוי. 6
גורמי Rh
סוגים רבים ושונים של אנטיגנים אריתרוציטים התגלו מאז תיאור האנטיגנים של התא האדום ABO. האנטיגנים השני המתואר בתדירות הגבוהה ביותר של RBC הם גורמי Rh, הנקראים על שם גורמי מקוק הרזוס (Macaca mulatta) שזוהו על ידי קרל לנדשטיינר ואלכסנדר ויינר בשנת 1940. מערכת Rh של אנטיגנים RBC היא מערכת קבוצת הדם המורכבת והאימונוגנית ביותר, עם יותר מ -50 ספציפיות שזוהו עד כה. מבין כל האנטיגנים של Rh, זה שנקרא Rho (Weiner) או D (Fisher-Race) הוא האימונוגני ביותר. תאים מסווגים כ- Rh חיובי (Rh+) אם האנטיגן Rh/D קיים או כ- Rh שלילי (Rh−) אם אנטיגן Rh/D נעדר. בניגוד למולקולות הפחמימות המבדילות את קבוצות הדם ABO ומהוות את המטרות של איזוהמגלוטינינים IgM ב- HTRs, האנטיגנים של גורם Rh הם חלבונים. כפי שנדון בלימפוציטים B וחסינות הומורלית, אנטיגנים חלבוניים מפעילים תאי B וייצור נוגדנים באמצעות מנגנון תלוי תאי T, ותאי T H 2 מעוררים מעבר מחלקה מ- IgM לשיעורי נוגדנים אחרים. במקרה של אנטיגנים של גורם Rh, תאי T H 2 מעוררים מעבר מחלקה ל-IgG, ויש לכך השלכות חשובות על המנגנון של HDN.
בדומה לחוסר תאימות של ABO, עירויי דם מתורם עם אנטיגנים שגויים של גורם Rh עלולים לגרום לרגישות יתר מסוג II HTR. עם זאת, בניגוד לאיזוהמגלוטינינים IgM המיוצרים בשלב מוקדם בחיים באמצעות חשיפה לאנטיגנים סביבתיים, ייצור נוגדנים נגד גורם Rh דורש חשיפה של אדם עם דם Rh ל- Rh+ RBCs חיוביים והפעלת תגובת נוגדנים ראשונית. למרות שתגובת נוגדנים ראשונית זו יכולה לגרום ל- HTR בחולה העירוי, התגובה המוליטית תתעכב עד שבועיים במהלך תקופת ההשהיה הממושכת של תגובת נוגדנים ראשונית (B לימפוציטים וחסינות הומורלית). עם זאת, אם המטופל יקבל עירוי לאחר מכן עם Rh+ RBCs, HTR מהיר יותר יתרחש עם נוגדן גורם אנטי-Rh שכבר קיים בדם. יתר על כן, תגובת הנוגדנים המשנית המהירה תספק עוד יותר נוגדנים נגד גורם Rh עבור HTR.
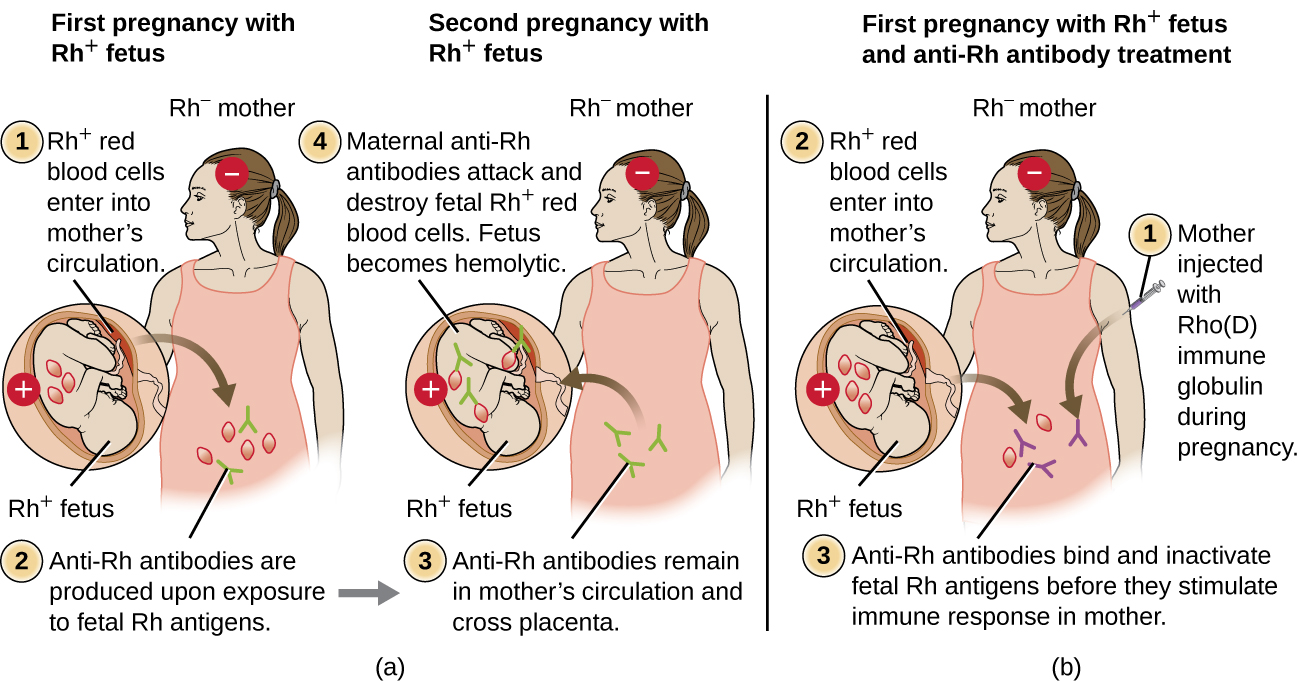
אי התאמה של גורם Rh בין האם לעובר יכולה גם לגרום לתגובה המוליטית של רגישות יתר מסוג II, המכונה מחלה המוליטית של הרך הנולד (HDN) (איור). \(\PageIndex{5}\) אם אישה Rh− נושאת תינוק Rh+ ללידה, המערכת החיסונית של האם יכולה להיחשף לתאי דם אדומים עובריים Rh+. חשיפה זו תתרחש בדרך כלל בשליש האחרון להריון ובתהליך הלידה. אם חשיפה זו מתרחשת, Rh+ RBCs עוברי יפעילו תגובה חיסונית אדפטיבית ראשונית אצל האם, ונוגדנים מסוג IgG נגד Rh ייווצרו. נוגדני IgG הם המעמד היחיד של נוגדנים שיכולים לחצות את השליה מאם לעובר; עם זאת, ברוב המקרים, התינוק Rh+ הראשון אינו מושפע מנוגדנים אלה מכיוון שהחשיפה הראשונה מתרחשת בדרך כלל מאוחר מספיק בהריון, כך שלאם אין זמן להעלות תגובה נוגדנית ראשונית מספקת לפני שנולד התינוק.
עם זאת, אם מתרחש הריון לאחר מכן עם עובר Rh+, החשיפה השנייה של האם לאנטיגנים של גורם Rh גורמת לתגובת נוגדנים משנית חזקה המייצרת כמויות גדולות יותר של גורם אנטי-Rh IgG. נוגדנים אלה יכולים לחצות את השליה מאם לעובר ולגרום ל- HDN, מצב שעלול להיות קטלני לתינוק (איור\(\PageIndex{5}\)).
לפני פיתוח טכניקות לאבחון ומניעה, אי התאמה בין גורמי Rh הייתה הגורם השכיח ביותר ל- HDN, וכתוצאה מכך אלפי מקרי מוות של תינוקות בכל שנה ברחבי העולם. 7 מסיבה זו, גורמי Rh של הורים פוטנציאליים נבדקים באופן קבוע, וטיפולים פותחו כדי למנוע HDN הנגרמת על ידי חוסר תאימות Rh. כדי למנוע HDN בתיווך גורם Rh, גלובולין חיסוני Rho (D) אנושי (למשל RhoGAM) מוזרק לאם תוך ורידי או תוך שרירי במהלך השבוע ה -28 להריון ותוך 72 שעות לאחר הלידה. מינונים נוספים עשויים להינתן לאחר אירועים שעלולים לגרום לדימום טרנספלנטלי (למשל, דגימת דם טבורי, דגימת וילות כוריונית, טראומת בטן, בדיקת מי שפיר). טיפול זה מתחיל במהלך ההריון הראשון עם עובר Rh+. הנוגדנים נגד Rh בגלובולין החיסוני Rho (D) ייקשרו לגורם Rh של כל RBCs עוברי שמקבלים גישה לזרם הדם של האם, וימנעו מתאי Rh+ אלה להפעיל את תגובת הנוגדנים העיקרית של האם. ללא תגובה נוגדנית ראשונית נגד גורם Rh, להריון הבא עם Rh+ יהיה סיכון מינימלי ל- HDN. עם זאת, האם תצטרך לסגת עם גלובולין חיסוני Rho (D) במהלך אותו הריון כדי למנוע תגובה נוגדנית ראשונית נגד Rh שעלולה לאיים על הריונות הבאים.
השתמש במשחק הקלדת דם אינטראקטיבי זה כדי לחזק את הידע שלך על הקלדת דם.
תרגיל \(\PageIndex{3}\)
- מה קורה לתאים שיש להם אנטיגנים לא תואמים בתגובת רגישות יתר מסוג II?
- תאר מחלה המוליטית של הרך הנולד והסבר כיצד ניתן למנוע אותה.
מיקוד קליני: חלק 2
הרופאה הראשית של קרי אינה בטוחה מדוע נראה כי קרי מפתחת פריחות לאחר בילוי בשמש, ולכן היא מזמינה בדיקת שתן ובדיקות דם בסיסיות. מהתוצאות עולה כי לקרי יש פרוטאינוריה (רמות חלבון לא תקינות בשתן), המוגלובינוריה (עודף המוגלובין בשתן) והמטוקריט נמוך (ספירת RBC). מבדיקות אלו עולה כי קרי סובל מהתקף קל של אנמיה המוליטית. הרופא חושד שהבעיה עשויה להיות אוטואימונית, ולכן היא מפנה את קרי לראומטולוג לבדיקות ואבחון נוספים.
תרגיל \(\PageIndex{4}\)
ראומטולוגים מתמחים במחלות שרירים ושלד כמו דלקת פרקים, אוסטאופורוזיס וכאבי פרקים. מדוע הרופא של קרי עשוי להפנות אותה למומחה מסוג זה למרות שהיא לא מציגה אף אחד מהתסמינים הללו?
רגישות יתר מסוג III
רגישות יתר מסוג III הן תגובות חיסוניות-מורכבות שהתאפיינו לראשונה על ידי ניקולה מוריס ארתוס (1862—1945) בשנת 1903. כדי לייצר נוגדנים להליכים ניסיוניים, ארתוס חיסן ארנבות על ידי הזרקת סרום מסוסים. עם זאת, בעת שחיסן ארנבות שוב ושוב בסרום סוסים, ארתוס הבחין בדימום תת עורי מקומי שלא דווח ובלתי צפוי בעבר עם בצקת במקום ההזרקה. תגובה זו התפתחה תוך 3 עד 10 שעות לאחר ההזרקה. תגובה מקומית זו לחלבוני סרום שאינם עצמיים נקראה תגובת ארתוס. תגובת ארתוס מתרחשת כאשר אנטיגנים מסיסים נקשרים ל-IgG ביחס שגורם להצטברות של אגרגטים של אנטיגן-נוגדנים הנקראים קומפלקסים חיסוניים.
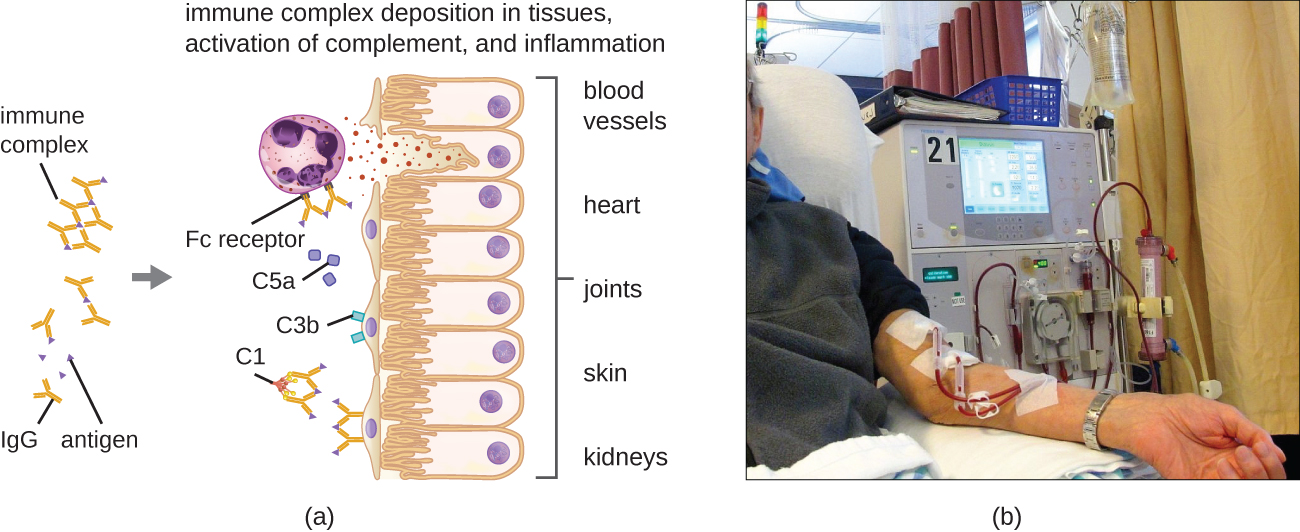
מאפיין ייחודי של רגישות יתר מסוג III הוא עודף נוגדנים (בעיקר IgG), יחד עם ריכוז נמוך יחסית של אנטיגן, וכתוצאה מכך נוצרים קומפלקסים חיסוניים קטנים המשתקעים על פני תאי האפיתל המצפים את הלומן הפנימי של כלי דם קטנים או על משטחי הרקמות (איור\(\PageIndex{6}\)). הצטברות מורכבת חיסונית זו מובילה למפל של אירועים דלקתיים הכוללים את הדברים הבאים:
- IgG נקשר לקולטני נוגדנים על תאי פיטום מקומיים, וכתוצאה מכך ניוון תאי תורן
- הפעלת השלמה עם ייצור של C3a ו- C5a פרו-דלקתיים (ראה הגנות כימיות)
- חדירות מוגברת של כלי דם עם גיוס כימוטקטי של נויטרופילים ומקרופאגים
מכיוון שמתחמי החיסון הללו אינם בגודל אופטימלי ומופקדים על משטחי התא, לא ניתן לפגוציטוזה בדרך הרגילה על ידי נויטרופילים ומקרופאגים, אשר בתורם מתוארים לעתים קרובות כ"מתוסכלים". למרות שפגוציטוזיס אינה מתרחשת, דגרנולציה של נויטרופילים גורמת לשחרור אנזימים ליזוזומליים הגורמים להרס חוץ תאי של המתחם החיסוני, ופוגעים בתאים מקומיים בתהליך. הפעלה של מסלולי קרישה מתרחשת גם כן, וכתוצאה מכך פקקת (קרישי דם) הסוגרים כלי דם וגורמים לאיסכמיה שעלולה להוביל לנמק כלי דם ולדימום מקומי.
רגישות יתר מערכתית מסוג III (מחלת סרום) מתרחשת כאשר מתחמי חיסון מופקדים באתרי גוף שונים, וכתוצאה מכך תגובה דלקתית מערכתית כללית יותר. קומפלקסים חיסוניים אלה כוללים חלבונים שאינם עצמיים כגון נוגדנים המיוצרים בבעלי חיים לחסינות פסיבית מלאכותית (ראה חיסונים), תרופות מסוימות או אנטיגנים מיקרוביאליים המשתחררים ברציפות לאורך זמן במהלך זיהומים כרוניים (למשל, אנדוקרדיטיס חיידקית תת-חריפה, דלקת כבד נגיפית כרונית). מנגנוני מחלת הסרום דומים לאלה המתוארים ברגישות יתר מקומית מסוג III אך כרוכים בהפעלה נרחבת של תאי פיטום, משלים, נויטרופילים ומקרופאגים, הגורמים להרס רקמות באזורים כמו הכליות, המפרקים וכלי הדם. כתוצאה מהרס רקמות, תסמינים של מחלת סרום כוללים צמרמורות, חום, פריחה, דלקת כלי הדם ודלקת פרקים. פיתוח של גלומרולונפריטיס או הפטיטיס הוא גם אפשרי.
מחלות אוטואימוניות כגון זאבת אדמנתית מערכתית (SLE) ודלקת מפרקים שגרונית יכולות להיות כרוכות גם בתגובות רגישות יתר מסוג III כאשר נוגדנים אוטומטיים יוצרים קומפלקסים חיסוניים עם אנטיגנים עצמיים. מצבים אלה נדונים בהפרעות אוטואימוניות.
תרגיל \(\PageIndex{5}\)
- מדוע עודף נוגדנים חשוב ברגישות יתר מסוג III?
- תאר את ההבדלים בין תגובת ארתוס לחולי סרום.
דיפתריה אנטיטוקסין
סרה אנטיבקטריאלית נפוצה הרבה פחות כיום מאשר בעבר, לאחר שהוחלפה בחיסונים טוקסידים. עם זאת, אנטיטוקסין דיפטריה המיוצר בסוסים הוא דוגמה אחת לטיפול כזה שעדיין משמש באזורים מסוימים בעולם. למרות שהוא אינו מורשה על ידי ה- FDA לשימוש בארצות הברית, ניתן להשתמש באנטיטוקסין דיפתריה לטיפול במקרים של דיפתריה, הנגרמים על ידי החיידק Corynebacterium diphtheriae. 8 עם זאת, הטיפול אינו נטול סיכונים. מחלת סרום יכולה להתרחש כאשר המטופל מפתח תגובה חיסונית לחלבוני סוס שאינם עצמיים. מתחמי חיסון נוצרים בין חלבוני הסוס לנוגדנים המסתובבים כאשר השניים קיימים בפרופורציות מסוימות. מתחמי חיסון אלה יכולים להפקיד באיברים ולגרום לנזק כמו דלקת פרקים, נפריטיס, פריחה וחום. מחלת סרום היא בדרך כלל חולפת ללא נזק קבוע אלא אם כן המטופל נחשף באופן כרוני לאנטיגן, מה שעלול לגרום לנזק בלתי הפיך לאתרי הגוף כגון מפרקים וכליות. עם הזמן, תאים פגוציטים כמו מקרופאגים מסוגלים לנקות את האנטיגנים בסרום הסוס, מה שמביא לשיפור במצבו של המטופל וירידה בתסמינים ככל שהתגובה החיסונית מתפוגגת.
מיקוד קליני: חלק 3
קרי לא מגיע לראומטולוג. יש לה התקף כשהיא עוזבת את משרד הרופא הראשי שלה. היא מובהלת במהירות למחלקת החירום, שם הרופא הראשי שלה מספר את ההיסטוריה הרפואית שלה ואת תוצאות הבדיקה האחרונות. רופא מחלקת החירום קורא לראומטולוג לצוות בבית החולים להתייעצות. בהתבסס על הסימפטומים ותוצאות הבדיקה, הראומטולוג חושד כי לקרי יש זאבת ומזמין זוג בדיקות דם: בדיקת נוגדנים אנטי-גרעיניים (ANA) כדי לחפש נוגדנים הנקשרים ל- DNA ובדיקה נוספת המחפשת נוגדנים הנקשרים לאנטיגן עצמי הנקרא אנטיגן סמית '(Sm).
תרגיל \(\PageIndex{6}\)
בהתבסס על בדיקות הדם שהוזמנו, איזה סוג תגובה חושד הראומטולוג שגורם להתקף של קרי?
רגישות יתר מסוג IV
רגישות יתר מסוג IV אינה מתווכת על ידי נוגדנים כמו שלושת הסוגים האחרים של רגישות יתר. במקום זאת, רגישות יתר מסוג IV מווסתת על ידי תאי T וכרוכה בפעולה של תאי אפקטור. ניתן לארגן סוגים אלה של רגישות יתר לשלוש קטגוריות משנה המבוססות על תת-סוג תאי T, סוג האנטיגן ומנגנון האפקטור המתקבל (טבלה). \(\PageIndex{5}\)
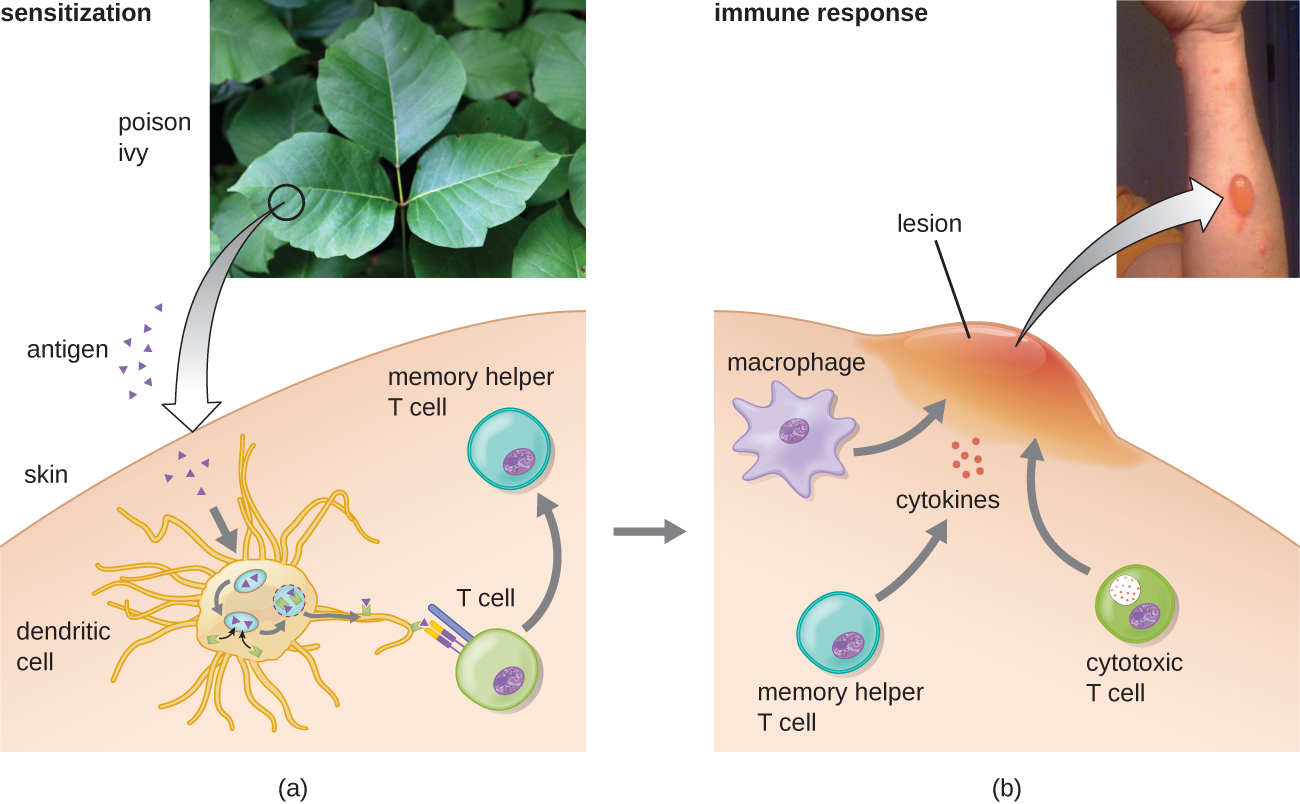
בתת הקטגוריה הראשונה מסוג IV, תגובות מתווכות CD4 T H 1 מתוארות כרגישות יתר מסוג מושהה (DTH). שלב הרגישות כולל הכנסת אנטיגן לעור ופגוציטוזיס על ידי תאים מציגי אנטיגן מקומיים (APC). ה- APCs מפעילים תאי T עוזרים, וממריצים התפשטות שיבוטים והתמיינות לתאי T H 1 זיכרון. עם חשיפה לאחר מכן לאנטיגן, תאי T H 1 רגישים אלה משחררים ציטוקינים המפעילים מקרופאגים, ומקרופאגים מופעלים אחראים לחלק ניכר מהנזק לרקמות. דוגמאות לרגישות יתר בתיווך T H 1 נצפות בשחפת בבדיקת העור של Mantoux ודלקת עור במגע, כמו למשל בתגובות אלרגיה לטקס.
בתת הקטגוריה השנייה מסוג IV, תגובות מתווכות CD4 T H 2 גורמות לאסטמה כרונית או לנזלת אלרגית כרונית. במקרים אלה, האנטיגן המסיס נשאף לראשונה, וכתוצאה מכך גיוס והפעלה של אאוזינופילים עם שחרור ציטוקינים ומתווכים דלקתיים.
בתת-הקטגוריה השלישית מסוג IV, תגובות מתווכות לימפוציטים T ציטוטוקסיות CD8 (CTL) קשורות לדחיית השתלת רקמות ולדרמטיטיס במגע (איור). \(\PageIndex{7}\) עבור צורה זו של רגישות יתר בתיווך תאים, APCs מעבדים ומציגים את האנטיגן עם MHC I לתאי CD8 T נאיביים. כאשר תאי CD8 T נאיביים אלה מופעלים, הם מתרבים ומתמיינים ל- CTL. תאי T H 1 מופעלים יכולים גם לשפר את ההפעלה של CTLs. לאחר מכן, ה-CTLs המופעלים מכוונים ומעוררים אפופטוזיס בתיווך גרנזים בתאים המציגים את אותו אנטיגן עם MHC I. תאי מטרה אלה יכולים להיות תאים "עצמיים" שספגו את האנטיגן הזר (כגון עם דרמטיטיס במגע עקב קיסוס רעיל), או שהם יכולים להיות תאי רקמה מושתלים המציגים אנטיגן זר מהתורם.
| קטגוריית משנה | אנטיגן | מנגנון אפקטור | דוגמאות |
|---|---|---|---|
| 1 | אנטיגן מסיס | מקרופאגים מופעלים פוגעים ברקמות ומקדמים תגובה דלקתית | דרמטיטיס מגע (למשל, חשיפה לטקס) ורגישות יתר מסוג מושהה (למשל, תגובת שחפת) |
| 2 | אנטיגן מסיס | גיוס והפעלה של אאוזינופילים משחררים ציטוקינים וכימיקלים פרו-דלקתיים | אסטמה כרונית ונזלת אלרגית כרונית |
| 3 | אנטיגן הקשור לתאים | ציטוטוקסיות בתיווך CTL | דרמטיטיס במגע (למשל מגע עם קיסוס רעיל) ודחיית השתלת רקמות |
תרגיל \(\PageIndex{7}\)
- תאר את שלושת תת הסוגים של רגישות יתר מסוג IV.
- הסבר כיצד תאי T תורמים לנזק לרקמות ברגישות יתר מסוג IV.
שימוש ברגישות יתר מאוחרת לבדיקת שחפת
רופא הילדים האוסטרי קלמנס פון פירקט (1874—1929) תיאר לראשונה מנגנוני אלרגיה, כולל מחלת סרום מסוג III. 9 התעניינותו הובילה לפיתוח בדיקה לשחפת (TB), תוך שימוש באנטיגן השחפת, המבוססת על עבודה קודמת בזיהוי פתוגן השחפת שביצע רוברט קוך. השיטה של פירקט כללה צלקת, מה שמביא לנקבים מרובים בו זמנית, באמצעות מכשיר עם מערך מחטים לשבירת העור פעמים רבות באזור קטן. המכשיר בו השתמש Pirquet היה דומה למכשיר בדיקת השיניים עם ארבע מחטים שנראו באיור. \(\PageIndex{8}\)
קצות כל המחטים במערך מצופים בשחפת, תמצית חלבון של חיידקי שחפת, ומכניסים ביעילות את השחפת לעור. יום עד שלושה ימים לאחר מכן ניתן לבדוק את האזור לתגובת רגישות יתר מאוחרת, שסימניה כוללים נפיחות ואודם.
כפי שאתה יכול לדמיין, הצטלקות לא הייתה חוויה נעימה, 10 ונקבי העור הרבים העמידו את המטופל בסיכון לפתח זיהום חיידקי בעור. Mantoux שינה את הבדיקה של Pirquet כדי להשתמש בזריקה תת עורית אחת של חומר שחפת מטוהר. בדיקה חיובית, אשר מסומנת על ידי נפיחות מקומית מאוחרת באתר ההזרקה, לא בהכרח אומר כי החולה נגוע כיום בשחפת פעילה. מכיוון שרגישות יתר מסוג IV (סוג מושהה) מתווכת על ידי הפעלה מחדש של תאי T זיכרון, ייתכן שתאים כאלה נוצרו לאחרונה (עקב זיהום פעיל בזרם) או שנים קודם לכן (אם לחולה היה שחפת ופינה אותה באופן ספונטני, או אם זה עבר זמן חביון). עם זאת, הבדיקה יכולה לשמש כדי לאשר זיהום במקרים בהם הסימפטומים של המטופל או ממצאים על רדיוגרף מצביעים על נוכחותה.

דלקת ריאות רגישות יתר
מחלות מסוימות הנגרמות על ידי רגישות יתר אינן נגרמות אך ורק על ידי סוג אחד. לדוגמא, דלקת ריאות רגישות יתר (HP), שהיא לרוב מחלה תעסוקתית או סביבתית, מתרחשת כאשר הריאות נדלקות כתוצאה מתגובה אלרגית לאבק בשאיפה, אנדוספורים, נוצות ציפורים, גללי ציפורים, עובש או כימיקלים. HP נקראת בשמות רבים ושונים הקשורים לצורות חשיפה שונות (איור\(\PageIndex{9}\)). HP הקשורה לשלשת ציפורים נקראת לפעמים ריאה של חובבי יונים או ריאה של עובדי עופות - שניהם נפוצים בקרב מגדלי ציפורים ומטפלים. מחלת מטפל בגבינות, ריאות איכר, מחלת נוטלי סאונה וריאות ג'קוזי הם שמות אחרים עבור HP הקשורים לחשיפה לעובשים בסביבות שונות.
פתולוגיה הקשורה ל- HP יכולה לנבוע הן מרגישות יתר מסוג III (בתיווך קומפלקסים חיסוניים) והן מסוג IV (בתיווך תאי T H 1 ומקרופאגים). חשיפה חוזרת לאלרגנים עלולה לגרום לאלוווליטיס כתוצאה מהיווצרותם של קומפלקסים חיסוניים בדופן האלוואולרית של הריאה המלווה בהצטברות נוזלים, ויצירת גרנולומות ונגעים אחרים בריאה כתוצאה מהפעלת מקרופאג בתיווך T H 1. Alveolitis עם היווצרות נוזלים וגרנולומה מביא לזלוף חמצן לקוי באלוואולי, אשר בתורו יכול לגרום לתסמינים כמו שיעול, קוצר נשימה, צמרמורות, חום, הזעה, מיאלגיות, כאבי ראש ובחילה. התסמינים עשויים להופיע במהירות של שעתיים לאחר החשיפה ויכולים להימשך שבועות אם הם לא מטופלים.

תרגיל \(\PageIndex{8}\)
הסבירו מדוע דלקת ריאות רגישות יתר נחשבת למחלת מקצוע.
איור \(\PageIndex{10}\) מסכם את המנגנונים וההשפעות של כל סוג של רגישות יתר שנדון בסעיף זה.
אבחון רגישות יתר
אבחון רגישות יתר מסוג I הוא תהליך מורכב הדורש מספר בדיקות אבחון בנוסף להיסטוריה מתועדת היטב של המטופל. ניתן למדוד רמות IgE בסרום, אך IgE מוגבר בלבד אינו מאשר מחלה אלרגית. כחלק מתהליך זיהוי האנטיגנים האחראים לאלרגיה לתגובה מסוג I, ניתן לבצע בדיקות באמצעות בדיקת עור לנקב (PPST) או בדיקה תוך-עורית. PPST מתבצע עם הכנסת אלרגנים בסדרה של דקירות עור שטחיות על גבו או זרועותיו של המטופל (איור\(\PageIndex{11}\)). PPST נחשבים לדרך הנוחה והפחות יקרה לאבחון אלרגיות, על פי המועצה המשותפת לאלרגיה בארה"ב והאקדמיה האירופית לאלרגיה ואימונולוגיה. הסוג השני של הבדיקה, הבדיקה התוך-עורית, דורש הזרקה לדרמיס בעזרת מחט קטנה. מחט זו, המכונה גם מחט שחפת, מחוברת למזרק המכיל כמות קטנה של אלרגן. הן ה- PPST והן הבדיקות התוך-עוריות נצפות במשך 15-20 דקות לתגובת התלקחות חיטה לאלרגנים. מדידה של כל צפצפה (בליטה מוגבהת ומגרדת) והתלקחות (אדמומיות) תוך דקות מצביעה על רגישות יתר מסוג I, וככל שתגובת התלקחות החיטה גדולה יותר, כך הרגישות של המטופל לאלרגן גדולה יותר.
לעתים קרובות ניתן לאבחן רגישות יתר מסוג III בגלל אופיים הדלקתי הלא ספציפי. הסימפטומים נראים בקלות, אבל הם עשויים להיות קשורים עם כל אחת ממספר מחלות אחרות. היסטוריה חזקה ומקיפה של מטופלים חיונית לאבחון נכון ומדויק. בדיקות המשמשות לביסוס האבחנה של דלקת ריאות רגישות יתר (הנובעת מרגישות יתר מסוג III) כוללות שטיפה ברונכואלוואולרית (BAL), בדיקות תפקודי ריאה וטומוגרפיה ממוחשבת ברזולוציה גבוהה (HRCT).
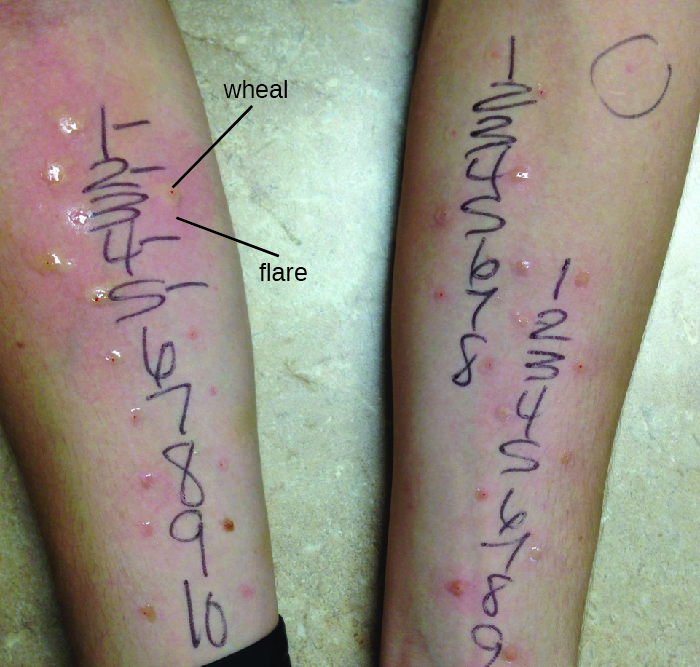
תרגיל \(\PageIndex{9}\)
- תאר את בדיקת עור הדקירה.
- הסבר מדוע רגישות יתר מסוג III יכולה להיות קשה לאבחון
טיפולים של רגישות יתר
תגובות אלרגיות ניתן לטפל בדרכים שונות. מניעה של תגובות אלרגיות יכולה להיות מושגת על ידי טיפול desensitization (hyposensitization), אשר ניתן להשתמש בהם כדי להפחית את תגובת רגישות יתר באמצעות זריקות חוזרות של אלרגנים. ריכוזים מדוללים במיוחד של אלרגנים ידועים (שנקבעו מבדיקות האלרגן) מוזרקים למטופל במרווחים שנקבעו (למשל, שבועי). כמות האלרגן המועברת על ידי הזריקות גדלה לאט לאורך תקופת הצטברות עד לקביעת מינון יעיל ושמירה על מינון זה למשך הטיפול, שיכול להימשך שנים. בדרך כלל מעודדים חולים להישאר במשרד הרופא למשך 30 דקות לאחר קבלת הזריקה למקרה שהאלרגנים הניתנים גורמים לתגובה מערכתית קשה. משרדי רופאים המנהלים טיפול בחוסר רגישות חייבים להיות מוכנים לספק החייאה וטיפול תרופתי במקרה של אירוע כזה.
טיפול בחוסר רגישות משמש לאלרגיות לעקיצת חרקים ואלרגיות סביבתיות. זריקות האלרגיה מעוררות ייצור של אינטרלוקינים ותגובות נוגדני IgG שונות במקום IgE. כאשר נוצרים עודפי נוגדני IgG ספציפיים לאלרגן ונקשרים לאלרגן, הם יכולים לפעול כנוגדנים חוסמים לנטרול האלרגן לפני שהוא יכול לקשור IgE על תאי פיטום. ישנם מחקרים מוקדמים המשתמשים בטיפול דרך הפה לצורך רגישות לאלרגיות למזון המבטיחות. 11 12 מחקרים אלה כוללים האכלת ילדים הסובלים מאלרגיות בכמויות זעירות של האלרגן (למשל קמח בוטנים) או חלבונים קשורים לאורך זמן. רבים מהנבדקים מראים חומרת תגובה מופחתת לאלרגן המזון לאחר הטיפול.
ישנם גם טיפולים המיועדים לטיפול בתגובות אלרגיות קשות. אנפילקסיס מערכתי חירום מטופל בתחילה בזריקת אפינפרין, שיכולה לנטרל את הירידה בלחץ הדם. אנשים הסובלים מאלרגיות חמורות ידועות נושאים לעיתים קרובות מזרק אוטומטי הניתן לניהול עצמי שניתן להשתמש בו במקרה של חשיפה לאלרגן (למשל, עקיצת חרקים או בליעה בשוגג של מזון הגורם לתגובה קשה). על ידי מתן עצמי של זריקת אפינפרין (או לפעמים שתיים), המטופל יכול לעצור את התגובה מספיק זמן כדי לפנות לטיפול רפואי. טיפול מעקב כולל בדרך כלל מתן למטופל אנטיהיסטמינים וקורטיקוסטרואידים הפועלים באיטיות במשך מספר ימים לאחר התגובה למניעת תגובות אפשריות בשלב מאוחר. עם זאת, ההשפעות של טיפול אנטי-היסטמין וקורטיקוסטרואידים אינן נחקרות היטב ומשמשות על סמך שיקולים תיאורטיים.
טיפול בתגובות אלרגיות קלות יותר כרוך בדרך כלל באנטי-היסטמינים ותרופות אנטי דלקתיות אחרות. ניתן להשיג מגוון תרופות אנטי-היסטמין, הן בחוזקות מרשם והן בחוזקות ללא מרשם רופא. ישנן גם תרופות אנטי-לוקוטריניות ואנטי-פרוסטגלנדין שניתן להשתמש בהן במקביל לתרופות אנטי-היסטמין במשטר טיפולי משולב (ויעיל יותר).
טיפולים ברגישות יתר מסוג III כוללים מניעת חשיפה נוספת לאנטיגן ושימוש בתרופות אנטי דלקתיות. ניתן לפתור מצבים מסוימים כאשר מונעים חשיפה לאנטיגן. ניתן להשתמש במשאפים קורטיקוסטרואידים אנטי דלקתיים גם להפחתת הדלקת כדי לאפשר לנגעי ריאה להחלים. טיפול סיסטמי בסטרואידים, דרך הפה או תוך ורידי, נפוץ גם לרגישות יתר מסוג III המשפיעות על מערכות הגוף. טיפול בדלקת ריאות רגישות יתר כולל הימנעות מהאלרגן, יחד עם תוספת אפשרית של סטרואידים מרשם כמו פרדניזון להפחתת הדלקת.
הטיפול ברגישות יתר מסוג IV כולל אנטיהיסטמינים, תרופות אנטי דלקתיות, משככי כאבים, ובמידת האפשר ביטול חשיפה נוספת לאנטיגן.
תרגיל \(\PageIndex{10}\)
- תאר טיפול בחוסר רגישות.
- הסבר את תפקיד האפינפרין בטיפול בתגובות רגישות יתר.
מושגי מפתח וסיכום
- אלרגיה היא תגובה חיסונית אדפטיבית, לעיתים מסכנת חיים, לאלרגן.
- רגישות יתר מסוג I דורשת רגישות של תאי פיטום עם IgE, הכוללת תגובה ראשונית של נוגדן IgE והתקשרות IgE לתאי פיטום. בחשיפה שנייה לאלרגן, קישור צולב של מולקולות IgE על תאי פיטום מעורר דה-גרנולציה ושחרור של מתווכים כימיים שנוצרו לאחרונה של דלקת. רגישות יתר מסוג I עשויה להיות מקומית וקטנה יחסית (כוורות וקדחת השחת) או מערכתית ומסוכנת (אנפילקסיס מערכתית).
- רגישות יתר מסוג II נובעת מנוגדנים הנקשרים לאנטיגנים בתאים ומתחילים תגובות ציטוטוקסיות. דוגמאות לכך כוללות תגובת עירוי המוליטית ומחלה המוליטית של הרך הנולד.
- רגישות יתר מסוג III נובעת מהיווצרות והצטברות של קומפלקסים חיסוניים ברקמות, ומעוררות תגובות דלקתיות מזיקות.
- רגישות יתר מסוג IV אינה מתווכת על ידי נוגדנים, אלא על ידי הפעלת תאי T עוזרים של מקרופאגים, אאוזינופילים ותאי T ציטוטוקסיים.
הערות שוליים
- 1 ד"ש סטרייר ואח '(עורכים). הפתולוגיה של רובין: יסודות קליניקופתולוגיים לרפואה. מהדורה 7 2 פילדלפיה, הרשות הפלסטינית: ליפינקוט, וויליאמס ווילקינס, 2014.
- 2 CM פיצסימונס ואח '. "אלרגנים הלמינת ', IgE ספציפי לטפיל ותפקידו המגן בחסינות האדם." גבול באימונולוגיה 5 (2015) :47.
- 3 ס. ט. וייס. "לאכול לכלוך - השערת ההיגיינה ומחלות אלרגיות." כתב העת לרפואה של ניו אינגלנד 347 מס '12 (2002): 930—931.
- 4 D.P. Strachan "קדחת השחת, היגיינה וגודל משק הבית." כתב העת הרפואי הבריטי 299 מס '6710 (1989) :1259.
- 5 ח 'אוקדה ואח '. "'השערת ההיגיינה 'למחלות אוטואימוניות ואלרגיות: עדכון." אימונולוגיה קלינית וניסויית 160 מס '1 (2010) :1—9.
- 6 E.C. Vamvakas, MA בליישמן. "תמותה הקשורה לעירוי: הסיכונים המתמשכים של עירוי דם אלוגני והאסטרטגיות הזמינות למניעתן." דם 113 מס '15 (2009): 3406—3417.
- 7 ג 'ריאלי. "ארבעים שנה של אימונופרופילקסיס נגד D." עירוי דם 5 מס '1 (2007): 3-6.
- 8 מרכזים לבקרת מחלות ומניעתן. "דיפתריה אנטיטוקסין". http://www.cdc.gov/diphtheria/dat.html. גישה ל- 25 במרץ 2016.
- 9 ב 'הובר "100 שנה אלרג'י: קלמנס פון פירקט — סיין אלרגיבריף ודס איהם זוגרונד ליד קרנקהייטסתורנס." וינר קלינישה ווכנשריפט 118 מס '19—20 (2006) :573—579.
- 10 C.A. סטיוארט. "מבחן הפירקט: השוואה בין הצלקות ושיטות היישום לנקב." ארכיונים לרפואת ילדים ורפואת מתבגרים 35 מס '3 (1928): 388—391.
- 11 CL שניידר ואח '. "מחקר פיילוט של Omalizumab כדי להקל על רגישות מהירה דרך הפה בחולים אלרגיים לבוטנים בסיכון גבוה." כתב העת לאלרגיה ואימונולוגיה קלינית 132 מס '6 (2013) :1368—1374.
- 12 פ 'ורשני ואח '. "מחקר מבוקר אקראי של אימונותרפיה דרך הפה של בוטנים: רגישות קלינית ואפנון התגובה האלרגית." כתב העת לאלרגיה ואימונולוגיה קלינית 127 מס '3 (2011) :654—660.


