17.2: הגנות כימיות
- Page ID
- 209181
מטרות למידה
- תאר כיצד אנזימים בנוזלי הגוף מספקים הגנה מפני זיהום או מחלות
- רשום ותאר את תפקודם של פפטידים אנטי-מיקרוביאליים, רכיבי משלים, ציטוקינים וחלבונים בשלב אקוטי
- תאר קווי דמיון והבדלים בין מסלולי השלמה קלאסיים, חלופיים ולקטין
בנוסף להגנות פיזיות, מערכת החיסון הלא ספציפית המולדת משתמשת במספר מתווכים כימיים המעכבים פולשים מיקרוביאליים. המונח "מתווכים כימיים" מקיף מגוון רחב של חומרים המצויים בנוזלי גוף ורקמות שונות בכל הגוף. מתווכים כימיים עשויים לעבוד לבד או בשילוב זה עם זה כדי לעכב התיישבות וזיהום מיקרוביאלי.
כמה מתווכים כימיים מיוצרים באופן אנדוגני, כלומר הם מיוצרים על ידי תאי גוף האדם; אחרים מיוצרים באופן אקסוגני, כלומר הם מיוצרים על ידי חיידקים מסוימים המהווים חלק מהמיקרוביום. חלק מהמתווכים מיוצרים ללא הרף, רוחצים את האזור בחומר האנטי-מיקרוביאלי; אחרים מיוצרים או מופעלים בעיקר בתגובה לגירוי כלשהו, כגון נוכחות של חיידקים.
מתווכים כימיים ואנזימטיים הנמצאים בנוזלי גוף
נוזלים המיוצרים על ידי העור כוללים דוגמאות למתווכים אנדוגניים ואקסוגניים כאחד. בלוטות החלב בדרמיס מפרישות שמן הנקרא סבום המשתחרר על פני העור דרך זקיקי השיער. חלב זה הוא מתווך אנדוגני, המספק שכבת הגנה נוספת על ידי סיוע באיטום נקבוביות זקיק השערה, ומונע מחיידקים על פני העור לפלוש לבלוטות הזיעה ולרקמות הסובבות (איור\(\PageIndex{1}\)). חברים מסוימים במיקרוביום, כמו החיידק Propionibacterium acnes והפטרייה Malassezia, בין היתר, יכולים להשתמש באנזימי ליפאז כדי להשפיל את החלב, ולהשתמש בו כמקור מזון. זה מייצר חומצה אולאית, היוצרת סביבה חומצית קלה על פני העור שאינה מסבירת פנים לחיידקים פתוגניים רבים. חומצה אולאית היא דוגמה למתווך המיוצר אקסוגני מכיוון שהיא מיוצרת על ידי חיידקים תושבים ולא ישירות על ידי תאי גוף.
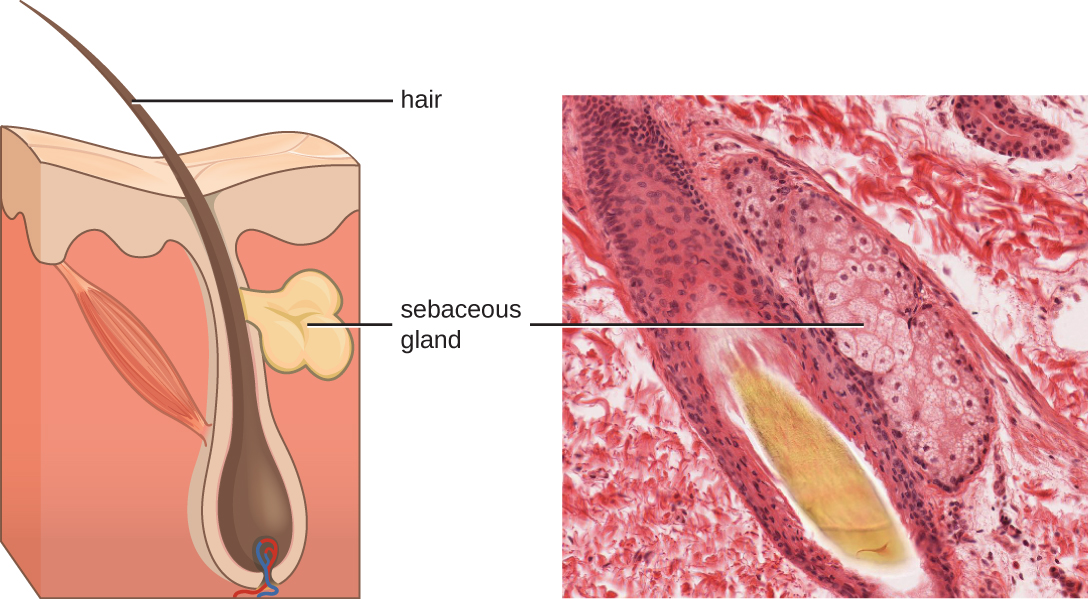
גורמים סביבתיים המשפיעים על המיקרוביוטה של העור יכולים להשפיע ישירות על ייצור מתווכים כימיים. לחות נמוכה או ירידה בייצור סבום, למשל, עלולים להפוך את העור פחות למגורים עבור חיידקים המייצרים חומצה אולאית, ובכך להפוך את העור לרגיש יותר לפתוגנים המעוכבים בדרך כלל על ידי ה- pH הנמוך של העור. קרם לחות לעור רבים מנוסחים כדי להתמודד עם השפעות כאלה על ידי החזרת לחות ושמנים אתרים לעור.
מערכת העיכול מייצרת גם מספר רב של מתווכים כימיים המעכבים או הורגים חיידקים. בחלל הפה הרוק מכיל מתווכים כמו אנזימי לקטופרוקסידאז, והריר המופרש על ידי הוושט מכיל את האנזים האנטיבקטריאלי ליזוזים. בקיבה, נוזל קיבה חומצי מאוד הורג את רוב החיידקים. במערכת העיכול התחתונה, במעיים יש אנזימי לבלב ומעי, פפטידים אנטיבקטריאליים (קריפטינים), מרה המופקת מהכבד ותאי Paneth מיוחדים המייצרים ליזוזים. יחד, מתווכים אלה מסוגלים לחסל את רוב הפתוגנים שמצליחים לשרוד את הסביבה החומצית של הקיבה.
בדרכי השתן השתן שוטף חיידקים מהגוף בזמן מתן שתן. יתר על כן, החומציות הקלה של השתן (ה- pH הממוצע הוא בערך 6) מעכבת את צמיחתם של חיידקים רבים ופתוגנים פוטנציאליים בדרכי השתן.
מערכת הרבייה הנשית מעסיקה לקטט, מתווך כימי המיוצר אקסוגני, כדי לעכב את צמיחת החיידקים. התאים ושכבות הרקמות המרכיבות את הנרתיק מייצרים גליקוגן, פולימר מסועף ומורכב יותר של גלוקוז. לקטובצילים באזור מתסיסים גליקוגן לייצור לקטט, מורידים את ה- pH בנרתיק ומעכבים מיקרוביוטה חולפת, פתוגנים אופורטוניסטיים כמו קנדידה (שמרים הקשורים לזיהומים בנרתיק) ופתוגנים אחרים האחראים למחלות מין.
בעיניים, דמעות מכילות את המתווכים הכימיים ליזוזים ולקטופרין, שניהם מסוגלים לחסל חיידקים שמצאו את דרכם אל פני העיניים. ליזוזים מבקע את הקשר בין NAG ל- NAM בפפטידוגליקן, מרכיב בדופן התא בחיידקים. זה יעיל יותר נגד חיידקים חיוביים לגרם, אשר חסרים את הממברנה החיצונית המגנה הקשורה לחיידקים גרם שליליים. לקטופרין מעכב צמיחה מיקרוביאלית על ידי קשירה כימית וסגירת ברזל. זה למעשה מרעיב חיידקים רבים הדורשים ברזל לצמיחה.
באוזניים, cerumen (earwax) מציג תכונות מיקרוביאלית בשל נוכחות של חומצות שומן, אשר מורידים את ה- pH בין 3 ל 5.
דרכי הנשימה משתמשות במתווכים כימיים שונים במעברי האף, קנה הנשימה והריאות. הריר המיוצר במעברי האף מכיל תערובת של מולקולות אנטי-מיקרוביאליות הדומות לאלו המצויות בדמעות וברוק (למשל, ליזוזים, לקטופרין, לקטופרוקסידאז). הפרשות בקנה הנשימה והריאות מכילות גם ליזוזים ולקטופרין, כמו גם קבוצה מגוונת של מתווכים כימיים נוספים, כמו מתחם הליפופרוטאין הנקרא חומר פעילי שטח, בעל תכונות אנטיבקטריאליות.
תרגיל \(\PageIndex{1}\)
- הסבר את ההבדל בין מתווכים אנדוגניים לאקסוגניים
- תאר כיצד pH משפיע על הגנות אנטי-מיקרוביאליות
פפטידים אנטי-מיקרוביאליים
הפפטידים האנטי-מיקרוביאליים (AMP) הם סוג מיוחד של מתווכים לא ספציפיים שמקורם בתאים בעלי תכונות אנטי-מיקרוביאליות רחבות טווח. חלק מה- AMP מיוצרים באופן שגרתי על ידי הגוף, בעוד שאחרים מיוצרים בעיקר (או מיוצרים בכמויות גדולות יותר) בתגובה לנוכחות פתוגן פולש. מחקר החל לחקור כיצד ניתן להשתמש ב- AMP באבחון וטיפול במחלות.
AMPs עלולים לגרום לנזק לתאים במיקרואורגניזמים במגוון דרכים, כולל על ידי גרימת נזק לממברנות, השמדת DNA ו- RNA או הפרעה לסינתזה של דופן התא. בהתאם למנגנון האנטי-מיקרוביאלי הספציפי, AMP מסוים עשוי לעכב רק קבוצות מסוימות של חיידקים (למשל, חיידקים גרם חיוביים או גרם שליליים) או שהוא עשוי להיות יעיל יותר נגד חיידקים, פטריות, פרוטוזואה ווירוסים. AMPs רבים נמצאים על העור, אך ניתן למצוא אותם גם באזורים אחרים בגוף.
משפחה של AMPs הנקראים דפנסינים יכולה להיות מיוצרת על ידי תאי אפיתל בכל הגוף וכן על ידי הגנות סלולריות כגון מקרופאגים ונויטרופילים (ראה הגנות סלולריות). דפנסינים עשויים להיות מופרשים או לפעול בתוך תאי מארח; הם נלחמים במיקרואורגניזמים על ידי פגיעה בממברנות הפלזמה שלהם. AMPs הנקראים בקטריוצינים מיוצרים באופן אקסוגני על ידי חברים מסוימים במיקרוביוטה התושבת בתוך מערכת העיכול. הגנים המקודדים לסוגים אלה של AMPs נישאים לעתים קרובות על פלסמידים וניתן להעביר אותם בין מינים שונים בתוך המיקרוביוטה התושבת באמצעות העברת גנים לרוחב או אופקי.
ישנם AMP רבים אחרים בכל הגוף. המאפיינים של כמה מה- AMP המשמעותיים יותר מסוכמים בטבלה\(\PageIndex{1}\).
| מגבר | מופרש על ידי | אתר גוף | פתוגנים מעוכבים | מצב פעולה |
|---|---|---|---|---|
| בקטריוצינים | מיקרוביוטה תושבת | דרכי העיכול | חיידקים | לשבש את הממברנה |
| קתליסידין | תאי אפיתל, מקרופאגים וסוגי תאים אחרים | עור | חיידקים ופטריות | משבש את הממברנה |
| דפנסינים | תאי אפיתל, מקרופאגים, נויטרופילים | בכל הגוף | פטריות, חיידקים ווירוסים רבים | לשבש את הממברנה |
| דרמיצידין | בלוטות זיעה | עור | חיידקים ופטריות | משבש את שלמות הממברנה ואת תעלות היונים |
| היסטטינים | בלוטות הרוק | חלל הפה | פטריות | לשבש את התפקוד התוך תאי |
תרגיל \(\PageIndex{2}\)
מדוע פפטידים אנטי-מיקרוביאליים (AMP) נחשבים להגנה לא ספציפית?
מתווכי חלבון פלזמה
גורמים חיסוניים מולדים לא ספציפיים רבים נמצאים בפלזמה, החלק הנוזלי של הדם. הפלזמה מכילה אלקטרוליטים, סוכרים, שומנים וחלבונים, שכל אחד מהם מסייע בשמירה על הומאוסטזיס (כלומר, תפקוד גוף פנימי יציב), ומכיל את החלבונים המעורבים בקרישת הדם. חלבונים נוספים הנמצאים בפלסמת הדם, כגון חלבונים בשלב אקוטי, חלבונים משלימים וציטוקינים, מעורבים בתגובה החיסונית המולדת הלא ספציפית.
פלזמה לעומת סרום
ישנם שני מונחים עבור החלק הנוזלי של הדם: פלזמה וסרום. במה הם נבדלים אם שניהם נוזלים וחסרי תאים? החלק הנוזלי של הדם שנותר לאחר קרישה (קרישת תאי דם) התרחש הוא סרום. למרות שמולקולות כמו ויטמינים רבים, אלקטרוליטים, סוכרים מסוימים, חלבונים משלימים ונוגדנים עדיין קיימות בסרום, גורמי הקרישה מתרוקנים במידה רבה. פלזמה, לעומת זאת, עדיין מכיל את כל יסודות הקרישה. כדי להשיג פלזמה מהדם, יש להשתמש בנוגדי קרישה למניעת קרישה. דוגמאות לנוגדי קרישה כוללות הפרין וחומצה טטרה-אצטית אתילן דיאמין (EDTA). מכיוון שהקרישה מעוכבת, לאחר שהושגה, יש לסובב את הדגימה בעדינות בצנטריפוגה. תאי הדם הכבדים והצפופים יותר יוצרים גלולה בתחתית צינור צנטריפוגה, בעוד שחלק הפלזמה הנוזלי, שהוא קל יותר ופחות צפוף, נשאר מעל גלולת התא.
חלבונים בשלב אקוטי
החלבונים בשלב החריף הם סוג נוסף של מתווכים אנטי-מיקרוביאליים. חלבונים בשלב אקוטי מיוצרים בעיקר בכבד ומופרשים לדם בתגובה למולקולות דלקתיות ממערכת החיסון. דוגמאות לחלבונים בשלב אקוטי כוללים חלבון תגובתי C, עמילואיד A בסרום, פריטין, טרנספרין, פיברינוגן ולקטין מחייב מנוז. לכל אחד מהחלבונים הללו מבנה כימי שונה ומעכב או הורס חיידקים בדרך כלשהי (טבלה\(\PageIndex{1}\)).
| כמה חלבונים בשלב אקוטי ותפקידיהם | |
|---|---|
| C- תגובתי חלבון | מצפה חיידקים (אופסוניזציה), מכין אותם לבליעה על ידי פגוציטים |
| סרום עמילואיד A | |
| פריטין | לאגד ולפרק ברזל, ובכך לעכב את הצמיחה של פתוגנים |
| טרנספרין | |
| פיברינוגן | מעורב ביצירת קרישי דם הלוכדים פתוגנים חיידקיים |
| לקטין מחייב מנוז | מפעיל מפל משלים |
מערכת המשלים
מערכת המשלים היא קבוצה של מתווכי חלבון פלזמה שיכולים לפעול כהגנה לא ספציפית מולדת ובמקביל לשמש לחיבור חסינות מולדת ומסתגלת (נדון בפרק הבא). מערכת המשלים מורכבת מיותר מ-30 חלבונים (כולל C1 עד C9) שבדרך כלל מסתובבים כחלבונים מקדימים בדם. חלבונים מקדימים אלה מופעלים כאשר הם מעוררים או מופעלים על ידי מגוון גורמים, כולל נוכחות של מיקרואורגניזמים. חלבונים משלימים נחשבים לחלק מחסינות לא ספציפית מולדת מכיוון שהם תמיד קיימים בדם ובנוזלי הרקמות, ומאפשרים להפעיל אותם במהירות. כמו כן, כאשר הם מופעלים דרך המסלול החלופי (המתואר בהמשך סעיף זה), חלבונים משלימים מכוונים לפתוגנים באופן לא ספציפי.
התהליך שבו מבשרי המשלים במחזור הופכים לתפקודיים נקרא הפעלת משלים. תהליך זה הוא מפל שיכול להיות מופעל על ידי אחד משלושה מנגנונים שונים, המכונים מסלולי האלטרנטיבה, הקלאסית והלקטין.
המסלול האלטרנטיבי מתחיל על ידי הפעלה ספונטנית של חלבון המשלים C3. הידרוליזה של C3 מייצרת שני מוצרים, C3a ו- C3b. כאשר אין חיידקים פולשים, C3b מתפרק מהר מאוד בתגובת הידרוליזה באמצעות המים בדם. עם זאת, אם קיימים חיידקים פולשים, C3b מתחבר לפני השטח של חיידקים אלה. לאחר הצמדתו, C3b יגייס חלבוני משלים אחרים במפל (איור\(\PageIndex{2}\)).
המסלול הקלאסי מספק מנגנון יעיל יותר להפעלת מפל המשלים, אך הוא תלוי בייצור נוגדנים על ידי ההגנה החיסונית ההסתגלותית הספציפית. כדי ליזום את המסלול הקלאסי, נוגדן ספציפי חייב להיקשר תחילה לפתוגן כדי ליצור קומפלקס נוגדן-אנטיגן. זה מפעיל את החלבון הראשון במפל המשלים, קומפלקס C1. קומפלקס C1 הוא קומפלקס חלבון מרובה חלקים, וכל רכיב משתתף בהפעלה מלאה של המתחם הכולל. לאחר גיוס והפעלה של קומפלקס C1, שאר חלבוני השלמת המסלול הקלאסי מגויסים ומופעלים ברצף מדורג (איור\(\PageIndex{2}\)).
מסלול הפעלת הלקטין דומה למסלול הקלאסי, אך הוא מופעל על ידי קישור של לקטין קושר מנוז, חלבון בשלב אקוטי, לפחמימות על פני השטח המיקרוביאלי. בדומה לחלבונים אחרים בשלב אקוטי, לקטינים מיוצרים על ידי תאי כבד והם בדרך כלל מווסתים בתגובה לאותות דלקתיים המתקבלים על ידי הגוף במהלך זיהום (איור). \(\PageIndex{2}\)
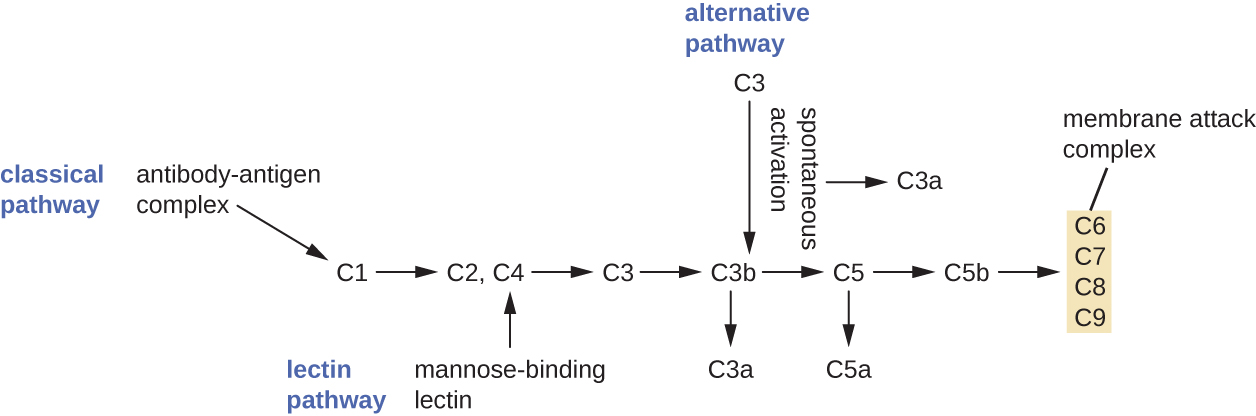
למרות שכל מסלול הפעלת משלים מתחיל בצורה אחרת, כולם מספקים את אותן תוצאות הגנה: אופסוניזציה, דלקת, כימוטקסיס וציטוליזה. המונח אופסוניזציה מתייחס לציפוי של פתוגן על ידי חומר כימי (הנקרא אופסונין) המאפשר לתאים פגוציטים לזהות, לבלוע ולהשמיד אותו ביתר קלות. אופסונינים ממפל המשלים כוללים C1q, C3b ו- C4b. אופסונינים חשובים נוספים כוללים חלבונים קושרי מנוז ונוגדנים. שברי המשלים C3a ו- C5a הם אנפילטוקסינים מאופיינים היטב עם פונקציות פרו-דלקתיות חזקות. אנפילטוקסינים מפעילים תאי פיטום, וגורמים לדגרנולציה ולשחרור אותות כימיים דלקתיים, כולל מתווכים הגורמים להתרחבות כלי הדם ולהגברת חדירות כלי הדם. C5a הוא גם אחד הכימו-מושכים החזקים ביותר עבור נויטרופילים ותאי דם לבנים אחרים, הגנות תאיות שיידונו בסעיף הבא.
חלבוני המשלים C6, C7, C8 ו-C9 מתאספים לקומפלקס התקפת קרום (MAC), המאפשר ל-C9 להתפלמר לנקבוביות בממברנות של חיידקים גרם שליליים. נקבוביות אלו מאפשרות למים, יונים ומולקולות אחרות לנוע בחופשיות פנימה והחוצה מהתאים הממוקדים, ובסופו של דבר מובילות לתמוגה של תאים ולמוות של הפתוגן (איור\(\PageIndex{2}\)). עם זאת, ה- MAC יעיל רק נגד חיידקים גרם שליליים; הוא אינו יכול לחדור לשכבה העבה של פפטידוגליקן הקשורה לדפנות התא של חיידקים גרם חיוביים. מכיוון שה-MAC אינו מהווה איום קטלני על פתוגנים חיידקיים חיוביים לגרם, אופסוניזציה בתיווך משלים חשובה יותר לפינוי שלהם.
ציטוקינים
ציטוקינים הם חלבונים מסיסים הפועלים כאותות תקשורת בין תאים. בתגובה חיסונית מולדת לא ספציפית, ציטוקינים שונים עשויים להשתחרר כדי לעורר ייצור של מתווכים כימיים או תפקודי תאים אחרים, כגון התפשטות תאים, התמיינות תאים, עיכוב חלוקת תאים, אפופטוזיס וכימוטקסיס.
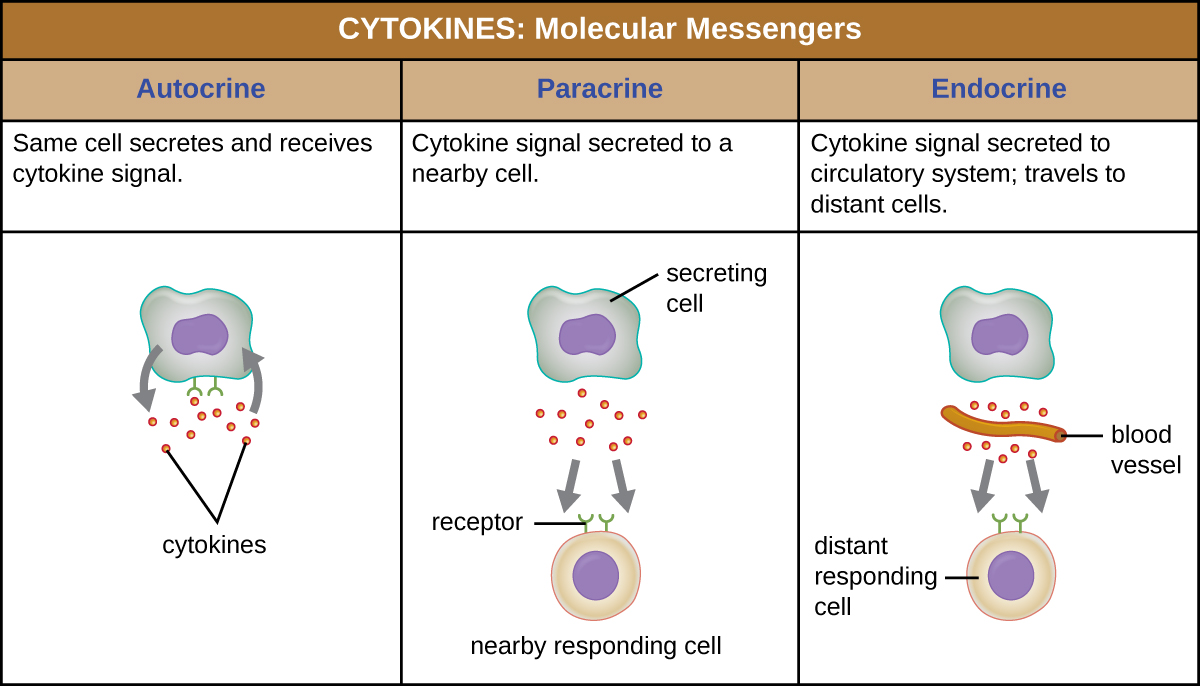
כאשר ציטוקין נקשר לקולטן המטרה שלו, ההשפעה יכולה להשתנות במידה רבה בהתאם לסוג הציטוקין וסוג התא או הקולטן שאליו הוא נקשר. ניתן לתאר את תפקודו של ציטוקין מסוים כאוטוקריני, פאראקרין או אנדוקריני (איור). \(\PageIndex{3}\) בתפקוד האוטוקריני, אותו תא שמשחרר את הציטוקין הוא מקבל האות; במילים אחרות, תפקוד אוטוקריני הוא סוג של גירוי עצמי על ידי תא. לעומת זאת, תפקוד פאראקריני כרוך בשחרור ציטוקינים מתא אחד לתאים סמוכים אחרים, ומעורר תגובה מסוימת מהתאים המקבלים. לבסוף, תפקוד אנדוקריני מתרחש כאשר תאים משחררים ציטוקינים לזרם הדם כדי להינשא לתאי המטרה הרבה יותר רחוקים.
שלושה סוגים חשובים של ציטוקינים הם האינטרלוקינים, הכימוקינים והאינטרפרונים. במקור חשבו שהאינטרלוקינים מיוצרים רק על ידי לויקוציטים (תאי דם לבנים) וכדי לעורר רק לויקוציטים, ובכך הסיבות לשמם. למרות שאינטרלוקינים מעורבים בוויסות כמעט כל תפקוד של מערכת החיסון, תפקידם בגוף אינו מוגבל לחסינות. אינטרלוקינים מיוצרים גם על ידי וממריצים מגוון תאים שאינם קשורים להגנה חיסונית.
הכימוקינים הם גורמים כימוטקטיים המגייסים לויקוציטים לאתרי זיהום, נזק לרקמות ודלקת. בניגוד לגורמים כימוטקטיים כלליים יותר, כמו גורם משלים C5a, הכימוקינים הם מאוד ספציפיים בתת-הקבוצות של לויקוציטים שהם מגייסים.
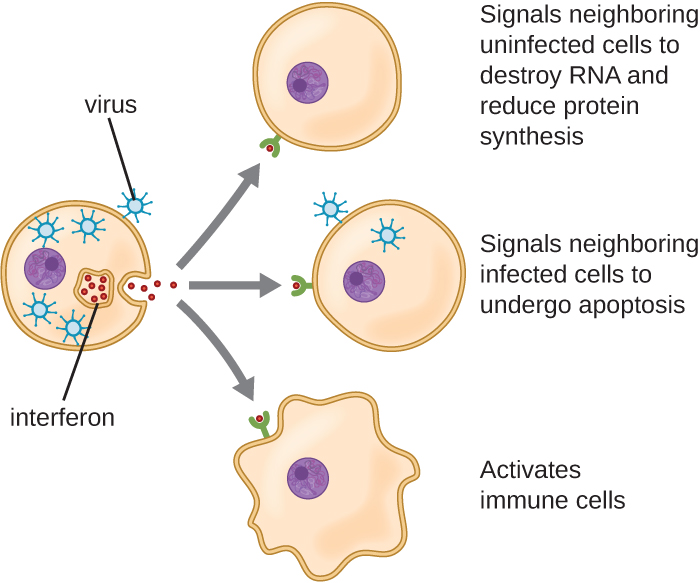
אינטרפרונים הם קבוצה מגוונת של מולקולות איתות חיסוניות וחשובים במיוחד בהגנה שלנו מפני וירוסים. אינטרפרונים מסוג I (אינטרפרון-α ואינטרפרון-β) מיוצרים ומשתחררים על ידי תאים הנגועים בנגיף. אינטרפרונים אלה מעוררים תאים סמוכים להפסיק את ייצור ה- mRNA, להרוס RNA שכבר מיוצר ולהפחית את סינתזת החלבון. שינויים תאיים אלה מעכבים שכפול ויראלי וייצור של וירוס בוגר, ומאטים את התפשטות הנגיף. אינטרפרונים מסוג I גם מעוררים תאי חיסון שונים המעורבים בפינוי ויראלי לתקוף בצורה אגרסיבית יותר תאים נגועים בנגיף. אינטרפרון מסוג II (אינטרפרון-γ) הוא מפעיל חשוב של תאי חיסון (איור). \(\PageIndex{4}\)
מתווכים מעוררי דלקת
רבים מהמתווכים הכימיים הנדונים בסעיף זה תורמים בדרך כלשהי לדלקת ולחום, שהן תגובות חיסוניות לא ספציפיות שנדונו ביתר פירוט בדלקת וחום. ציטוקינים מעוררים ייצור של חלבונים בשלב אקוטי כגון חלבון תגובתי C ולקטין מחייב מנוז בכבד. חלבונים בשלב אקוטי אלה פועלים כאופסונינים, ומפעילים מפל משלים דרך מסלול הלקטין.
חלק מהציטוקינים קושרים גם תאי פיטום ובזופילים, וגורמים להם לשחרר היסטמין, תרכובת פרו-דלקתית. קולטני היסטמין נמצאים במגוון תאים ומתווכים אירועים פרו-דלקתיים, כגון התכווצות הסימפונות (הידוק דרכי הנשימה) והתכווצות שרירים חלקים.
בנוסף להיסטמין, תאי פיטום עשויים לשחרר מתווכים כימיים אחרים, כגון לוקוטריאנים. Leukotrienes הם מתווכים פרו-דלקתיים מבוססי שומנים המיוצרים ממטבוליזם של חומצה ארכידונית בקרום התא של לויקוציטים ותאי רקמה. בהשוואה להשפעות הפרו-דלקתיות של היסטמין, אלו של לוקוטריאנים חזקים יותר ועמידים יותר. יחד, מתווכים כימיים אלה יכולים לגרום לשיעול, הקאות ושלשולים, המשמשים לגירוש פתוגנים מהגוף.
ציטוקינים מסוימים מעוררים גם ייצור פרוסטגלנדינים, מתווכים כימיים המקדמים את ההשפעות הדלקתיות של קינינים והיסטמינים. פרוסטגלנדינים יכולים גם לסייע בהגדרת טמפרטורת הגוף גבוהה יותר, מה שמוביל לחום, המקדם את פעילות תאי הדם הלבנים ומעכב מעט את צמיחתם של חיידקים פתוגניים (ראה דלקת וחום).
מתווך דלקתי נוסף, ברדיקינין, תורם לבצקת, המתרחשת כאשר נוזלים ולוקוציטים דולפים ממחזור הדם ולרקמות. הוא נקשר לקולטנים על תאים בדפנות הנימים, וגורם לנימים להתרחב ולהיות חדירים יותר לנוזלים.
תרגיל \(\PageIndex{3}\)
- מה משותף לשלושת מסלולי ההפעלה המשלימים?
- הסבר אותות אוטוקריניים, פאראקריניים ואנדוקריניים.
- ציין שני מתווכים חשובים המעוררים דלקת.
מיקוד קליני: חלק 2
כדי להקל על היצרות דרכי הנשימה שלה, אנג'לה מטופלת מייד באנטי-היסטמינים וניתנת קורטיקוסטרואידים באמצעות משאף, ואז מנוטרת למשך תקופה מסוימת. למרות שמצבה אינו מחמיר, נראה כי התרופות אינן מקלות על מצבה. היא מאושפזת בבית החולים להמשך התבוננות, בדיקה וטיפול.
לאחר הקבלה, קלינאית עורכת בדיקות אלרגיה כדי לנסות לקבוע אם משהו בסביבתה עשוי לעורר תגובה דלקתית אלרגית. רופא מורה על ניתוח דם כדי לבדוק אם יש רמות של ציטוקינים מסוימים. דגימת כיח נלקחת גם ונשלחת למעבדה לצורך צביעה מיקרוביאלית, טיפוח וזיהוי של פתוגנים שעלולים לגרום לזיהום.
תרגיל \(\PageIndex{4}\)
- אילו היבטים של מערכת החיסון המולדת יכולים לתרום להתכווצות דרכי הנשימה של אנג'לה?
- מדוע טופלה אנג'לה באנטי-היסטמינים?
- מדוע שהרופא יתעניין ברמות ציטוקינים בדם של אנג'לה?
הטבלה \(\PageIndex{3}\) מספקת סיכום של ההגנות הכימיות הנדונות בסעיף זה.
| הגנה | דוגמאות | פונקציה |
|---|---|---|
| כימיקלים ואנזימים בנוזלי גוף | חלב מבלוטות החלב | מספק מחסום שמן המגן על נקבוביות זקיקי השיער מפני פתוגנים |
| חומצה אולאית מסבום ומיקרוביוטה בעור | מוריד את ה- pH כדי לעכב פתוגנים | |
| ליזוזים בהפרשות | הורג חיידקים על ידי תקיפת דופן התא | |
| חומצה בקיבה, בשתן ובנרתיק | מעכב או הורג חיידקים | |
| אנזימי עיכול ומרה | להרוג חיידקים | |
| לקטופרין וטרנספרין | לאגד ולפרק ברזל, מעכב את צמיחת החיידקים | |
| חומר פעילי שטח בריאות | הורג חיידקים | |
| פפטידים אנטי-מיקרוביאליים | דפנסינים, בקטריוצינים, דרמיצידין, קתליצידין, היסטטינים, | להרוג חיידקים על ידי תקיפת ממברנות או הפרעה לתפקודי התא |
| מתווכי חלבון פלזמה | חלבונים בשלב אקוטי (חלבון תגובתי C, עמילואיד A בסרום, פריטין, פיברינוגן, טרנספרין ולקטין מחייב מנוז) | לעכב את צמיחת החיידקים ולסייע בלכידה והרג של חיידקים |
| משלים C3b ו- C4b | אופסוניזציה של פתוגנים כדי לסייע לפגוציטוזיס | |
| משלים C5a | כימואטרקטנט לפגוציטים | |
| משלים C3a ו- C5a | אנפילטוקסינים פרו-דלקתיים | |
| ציטוקינים | אינטרלוקינים | לעורר ולווסת את רוב הפונקציות של מערכת החיסון |
| כימוקינים | לגייס תאי דם לבנים לאזור נגוע | |
| אינטרפרונים | התריע על תאים לזיהום ויראלי, לגרום לאפופטוזיס של תאים נגועים בנגיף, לגרום להגנה אנטי-ויראלית בתאים נגועים ולא נגועים בקרבת מקום, לעורר תאי חיסון לתקוף תאים נגועים בנגיף | |
| מתווכים מעוררי דלקת | היסטמין | מקדם הרחבת כלי דם, ברונכוקונסטרקטיון, התכווצות שרירים חלקים, הפרשה מוגברת וייצור ריר |
| לוקוטריאנים | לקדם דלקת; חזק יותר ועמיד יותר מאשר היסטמין | |
| פרוסטגלנדינים | לקדם דלקת וחום | |
| ברדיקינין | מגביר את התרחבות כלי הדם וחדירות כלי הדם, מה שמוביל לבצקת |
מושגי מפתח וסיכום
- מתווכים כימיים רבים המיוצרים באופן אנדוגני ואקסוגני מציגים פונקציות אנטי-מיקרוביאליות לא ספציפיות.
- מתווכים כימיים רבים נמצאים בנוזלי גוף כמו סבום, רוק, ריר, נוזלי קיבה ומעי, שתן, קרעים, סרום והפרשות בנרתיק.
- פפטידים אנטי-מיקרוביאליים (AMP) הנמצאים על העור ובאזורים אחרים בגוף מיוצרים במידה רבה בתגובה לנוכחות פתוגנים. אלה כוללים דרמצידין, קתליצידין, דפנסינים, היסטטינים ובקטריוצינים.
- הפלזמה מכילה חלבונים שונים המשמשים כמתווכים כימיים, כולל חלבונים בשלב אקוטי, חלבונים משלימים וציטוקינים.
- מערכת המשלים כוללת חלבונים קודמים רבים המסתובבים בפלזמה. חלבונים אלה מופעלים ברצף מדורג בנוכחות חיידקים, וכתוצאה מכך אופסוניזציה של פתוגנים, כימומשיכה של לויקוציטים, אינדוקציה של דלקת וציטוליזה באמצעות היווצרות קומפלקס התקפת קרום (MAC).
- ציטוקינים הם חלבונים המאפשרים תגובות לא ספציפיות שונות על ידי תאי חיסון מולדים, כולל ייצור של מתווכים כימיים אחרים, התפשטות תאים, מוות תאים והתמיינות.
- ציטוקינים ממלאים תפקיד מפתח בתגובה הדלקתית, ומעוררים ייצור של מתווכים מעוררי דלקת כגון חלבונים בשלב אקוטי, היסטמין, לויקוטריאנים, פרוסטגלנדינים וברדיקינין.


