15.3: גורמי ארסיות
- Page ID
- 208940
מטרות למידה
- הסבר כיצד גורמי ארסיות תורמים לסימנים ותסמינים של מחלות זיהומיות
- הבדילו בין אנדוטוקסינים לאקסוטוקסינים
- תאר והבדיל בין סוגים שונים של אקסוטוקסינים
- תאר את המנגנונים שבהם משתמשים וירוסים להדבקה ושונות אנטיגנית
בחלק הקודם הסברנו שחלק מהפתוגנים הם ארסיים יותר מאחרים. זאת בשל גורמי הארסיות הייחודיים המיוצרים על ידי פתוגנים בודדים, הקובעים את היקף וחומרת המחלה שהם עלולים לגרום. גורמי הארסיות של פתוגן מקודדים על ידי גנים שניתן לזהות באמצעות ההנחות המולקולריות של קוך. כאשר גנים המקודדים לגורמי ארסיות מושבתים, הארסיות בפתוגן פוחתת. בחלק זה, אנו בוחנים סוגים שונים ודוגמאות ספציפיות לגורמי ארסיות וכיצד הם תורמים לכל שלב בפתוגנזה.
גורמי ארסיות להדבקה
כפי שנדון בסעיף הקודם, שני השלבים הראשונים בפתוגנזה הם חשיפה והידבקות. נזכיר כי אדהזין הוא חלבון או גליקופרוטאין המצוי על פני השטח של פתוגן המתחבר לקולטנים בתא המארח. דבקים נמצאים על פתוגנים חיידקיים, ויראליים, פטרייתיים ופרוטוזואנים. דוגמה אחת לאדהזין חיידקי היא אדהזין פימבריאלי מסוג 1, מולקולה שנמצאת בקצות הפימבריה של E. coli enterotoxigenic (ETEC). נזכיר כי פימבריה הם זיפי חלבון דמויי שיער על פני התא. אדהזין פימבריאלי מסוג 1 מאפשר לפימבריה של תאי ETEC להיצמד לגליקנים המנוזים המתבטאים בתאי אפיתל המעי. הטבלה \(\PageIndex{1}\) מפרטת דבקים נפוצים שנמצאו בחלק מהפתוגנים שדנו בהם או שנראה בהמשך פרק זה.
| פתוגן | מחלה | אדהזין | אתר מצורף |
|---|---|---|---|
| סטרפטוקוקוס פיוגנס | דלקת גרון | חלבון F | תאי אפיתל נשימתיים |
| סטרפטוקוקוס מוטאנס | עששת שיניים | אדהזין P1 | שיניים |
| ניסריה זיבה | זיבה | סוג IV פילה | תאי אפיתל בשופכה |
| אי - קולי אנטרוטוקסיגני (ETEC) | שלשול של מטייל | סוג 1 פימבריה | תאי אפיתל מעיים |
| ויבריו כולרה | כולרה | N-מתילפנילאלנין פילי | תאי אפיתל מעיים |
מיקוד קליני: חלק 3
נוכחותם של חיידקים בדם של מייקל היא סימן לזיהום, מכיוון שדם בדרך כלל סטרילי. אין שום אינדיקציה לכך שהחיידקים נכנסו לדם דרך פציעה. במקום זאת, נראה כי פורטל הכניסה היה מסלול העיכול. בהתבסס על הסימפטומים של מייקל, תוצאות בדיקת הדם שלו והעובדה שמייקל היה היחיד במשפחה שהשתתף בנקניקיות, הרופא חושד שמייקל סובל ממקרה של ליסטריוזיס.
ליסטריה מונוציטוגנים, הפתוגן התוך תאי הפקולטטיבי הגורם לליסטריוזיס, הוא מזהם נפוץ במזונות מוכנים לאכילה כמו בשרים לארוחת צהריים ומוצרי חלב. לאחר הבליעה, חיידקים אלה פולשים לתאי אפיתל מעיים ומועברים לכבד, שם הם גדלים בתוך תאי הכבד. ליסטריוזיס היא קטלנית אצל אחד מכל חמישה אנשים בריאים נורמליים, ושיעורי התמותה מעט גבוהים יותר בחולים עם מצבים קיימים המחלישים את התגובה החיסונית. מקבץ של גנים ארסיים המקודדים באי פתוגניות אחראי לפתוגניות של L. monocytogenes. גנים אלה מוסדרים על ידי גורם תעתיק המכונה גורם שחרור שרשרת פפטיד 1 (PrFa). אחד הגנים המווסתים על ידי PrFa הוא hyl, המקודד לרעלן המכונה ליסטריוליסין O (LLO), המאפשר לחיידק להימלט מוואקוולים עם כניסתו לתא מארח. גן שני המווסת על ידי pRfA הוא ActA, המקודד לחלבון פני השטח המכונה חלבון המעורר הרכבה של אקטין (ActA). ActA מתבטא על פני השטח של ליסטריה ומפלמר את האקטין המארח. זה מאפשר לחיידק לייצר זנבות אקטין, לנוע סביב הציטופלזמה של התא ולהתפשט מתא לתא מבלי לצאת לתא החוץ -תאי.
מצבו של מייקל החל להחמיר. עכשיו הוא חווה צוואר נוקשה hemiparesis (חולשה של צד אחד של הגוף). מודאג כי הזיהום מתפשט, הרופא מחליט לבצע בדיקות נוספות כדי לקבוע מה גורם לתסמינים חדשים אלה.
תרגיל \(\PageIndex{1}\)
- איזה סוג של פתוגן גורם ליסטריוזיס, ואילו גורמי ארסיות תורמים לסימנים והתסמינים שמייקל חווה?
- האם סביר שהזיהום יתפשט מדמו של מייקל? אם כן, איך זה יכול להסביר את הסימפטומים החדשים שלו?
אקסואנזימים חיידקיים ורעלים כגורמי ארסיות
לאחר חשיפה והידבקות, השלב הבא בפתוגנזה הוא פלישה, שיכולה לכלול אנזימים ורעלים. פתוגנים רבים משיגים פלישה על ידי כניסה לזרם הדם, אמצעי הפצה יעיל מכיוון שכלי הדם עוברים קרוב לכל תא בגוף. החיסרון של מנגנון זה של פיזור הוא כי הדם כולל גם אלמנטים רבים של המערכת החיסונית. מונחים שונים המסתיימים ב- —emia משמשים לתיאור נוכחותם של פתוגנים בזרם הדם. נוכחותם של חיידקים בדם נקראת בקטרמיה. בקטריה הכוללת פיוגנים (חיידקים היוצרים מוגלה) נקראת פימיה. כאשר וירוסים נמצאים בדם, זה נקרא וירמיה. המונח toxemiadesמציין את המצב כאשר רעלים נמצאים בדם. אם חיידקים נמצאים ומתרבים בדם, מצב זה נקרא ספטימיה.
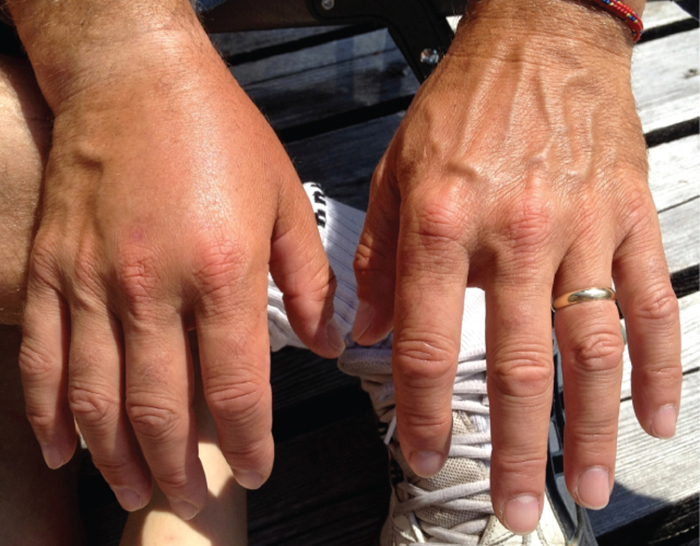
חולים עם ספטימיה מתוארים כספיגה, מה שעלול להוביל להלם, ירידה מסכנת חיים בלחץ הדם (לחץ סיסטולי <90 מ"מ כספית) המונעת מתאים ואיברים לקבל מספיק חמצן וחומרים מזינים. חיידקים מסוימים יכולים לגרום לזעזוע באמצעות שחרור רעלים (גורמי ארסיות העלולים לגרום לנזק לרקמות) ולהוביל ללחץ דם נמוך. חיידקים גראם שליליים נבלעים על ידי פגוציטים של מערכת החיסון, המשחררים לאחר מכן גורם נמק הגידול, מולקולה המעורבת בדלקת וחום. גורם נמק הגידול נקשר לנימי הדם כדי להגביר את חדירותם, ומאפשר לנוזלים לעבור מכלי הדם ולרקמות, ולגרום לנפיחות או בצקת (איור\(\PageIndex{1}\)). עם ריכוזים גבוהים של גורם נמק הגידול, התגובה הדלקתית חמורה ומספיק נוזלים הולכים לאיבוד ממערכת הדם שלחץ הדם יורד לרמות נמוכות בצורה מסוכנת. יכולות להיות לכך השלכות קשות מכיוון שהלב, הריאות והכליות מסתמכים על לחץ דם תקין לצורך תפקוד תקין; לפיכך, עלולים להתרחש אי ספיקת רב איברים, הלם ומוות.
אקסואנזימים
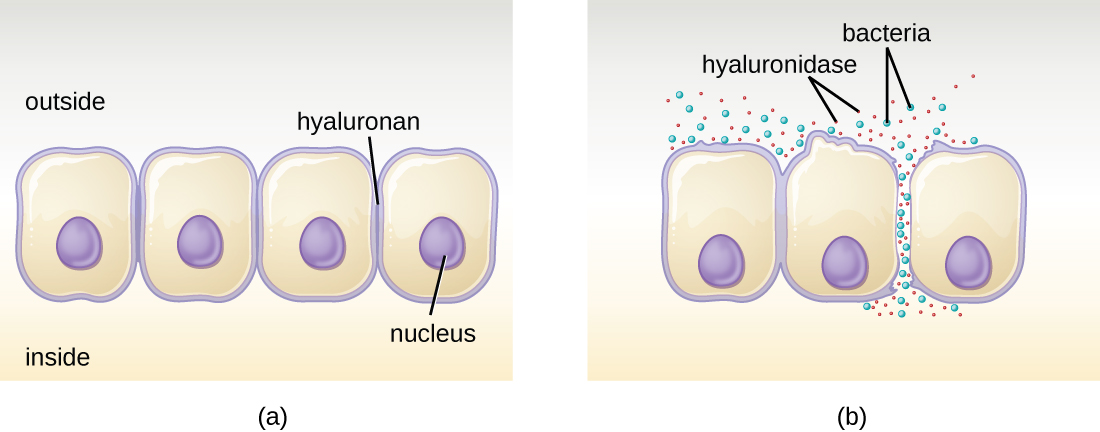
חלק מהפתוגנים מייצרים אנזימים חוץ-תאיים, או אקסואנזימים, המאפשרים להם לפלוש לתאי מארח ולרקמות עמוקות יותר. לאקסואנזימים יש מגוון רחב של מטרות. כמה סוגים כלליים של אקסואנזימים ופתוגנים קשורים מפורטים בטבלה\(\PageIndex{2}\). כל אחד מהאקסואנזימים הללו מתפקד בהקשר של מבנה רקמה מסוים כדי להקל על פלישה או לתמוך בצמיחה שלו ולהגן מפני מערכת החיסון. לדוגמה, היאלורונידאז S, אנזים המיוצר על ידי פתוגנים כמו Staphylococcus aureus, Streptococcus pyogenes, ו Clostridium perfringens, מפרק את הגליקוזיד הילאורונאן (חומצה היאלורונית), הפועל כמלט בין תאי בין תאים סמוכים ברקמת החיבור (איור). \(\PageIndex{2}\) זה מאפשר לפתוגן לעבור דרך שכבות הרקמה בפורטל הכניסה ולהפיץ במקומות אחרים בגוף (איור\(\PageIndex{2}\)).
| כיתה | דוגמא | פונקציה |
|---|---|---|
| גליקוהידרולאזים | היאלורונידאז S בסטפילוקוקוס אאורוס | משפיל חומצה היאלורונית המליטה תאים יחד כדי לקדם התפשטות דרך רקמות |
| נוקלאזות | DNase המיוצר על ידי ס. אאורוס | משפיל DNA המשתחרר על ידי תאים גוססים (חיידקים ותאי מארח) שיכולים ללכוד את החיידקים, ובכך לקדם התפשטות |
| פוספוליפאזים | פוספוליפאז C של באצילוס אנתרקיס | מפרק את דו שכבת הפוספוליפידים של תאי מארח, גורם לתמוגה תאית, ומפרק את הממברנה של הפגוזומים כדי לאפשר בריחה לתוך הציטופלזמה |
| פרוטאזות | קולגנאז בקלוסטרידיום פרפרנגנס | משפיל קולגן ברקמת החיבור כדי לקדם התפשטות |
נוקלאזות המיוצרות על ידי פתוגן, כגון DNase המיוצר על ידי S. aureus, משפילים את ה-DNA החוץ תאי כאמצעי בריחה והתפשטות דרך רקמות. כאשר תאי חיידקים ומארח מתים במקום ההדבקה, הם משננים ומשחררים את התוכן התוך תאי שלהם. כרומוזום ה- DNA הוא הגדול מבין המולקולות התוך-תאיות, והמוני DNA החוץ -תאי יכולים ללכוד חיידקים ולמנוע את התפשטותם. S. aureus מייצר DNase כדי לפרק את רשת ה- DNA החוץ -תאי כך שהוא יכול לברוח ולהתפשט לרקמות סמוכות. אסטרטגיה זו משמשת גם S. aureus ופתוגנים אחרים כדי לפרק ולברוח מקורים של DNA חוץ תאי המיוצר על ידי פגוציטים של מערכת החיסון כדי ללכוד את החיידקים.
אנזימים המפרקים את הפוספוליפידים של ממברנות התא נקראים פוספוליפאזים. פעולותיהם ספציפיות ביחס לסוג הפוספוליפידים עליהם הם פועלים והיכן הם מבקעים אנזימטית את המולקולות. הפתוגן האחראי לאנתרקס, B. anthracis, מייצר פוספוליפאז ג. כאשר B. anthracis נבלע על ידי תאים פגוציטים של מערכת החיסון, פוספוליפאז C מפרק את קרום הפגוזום לפני שהוא יכול להתמזג עם הליזוזום, ומאפשר לפתוגן לברוח לציטופלזמה ולהתרבות. פוספוליפאזים יכולים גם למקד את הממברנה העוטפת את הפגוזום בתוך תאים פגוציטים. כפי שתואר קודם לכן בפרק זה, זהו המנגנון המשמש פתוגנים תוך תאיים כגון L. monocytogenes ו Rickettsia לברוח מהפאגוזום ולהתרבות בתוך הציטופלזמה של תאים פגוציטים. תפקידם של פוספוליפאזים בארסיות חיידקית אינו מוגבל לבריחה פגוזומלית. פתוגנים רבים מייצרים פוספוליפאזים הפועלים לפירוק ממברנות התא וגורמים לתמוגה של תאי המטרה. פוספוליפאזים אלה מעורבים בתמוגה של כדוריות דם אדומות, תאי דם לבנים ותאי רקמה.
פתוגנים חיידקיים מייצרים גם אנזימים שונים המעכלים חלבון, או פרוטאזות. ניתן לסווג פרוטאזות לפי יעד המצע שלהן (למשל, פרוטאזות סרין מכוונות לחלבונים עם חומצת האמינו סרין) או אם הן מכילות מתכות באתר הפעיל שלהן (למשל, מטלופרוטאזות אבץ מכילות יון אבץ, הדרוש לפעילות אנזימטית).
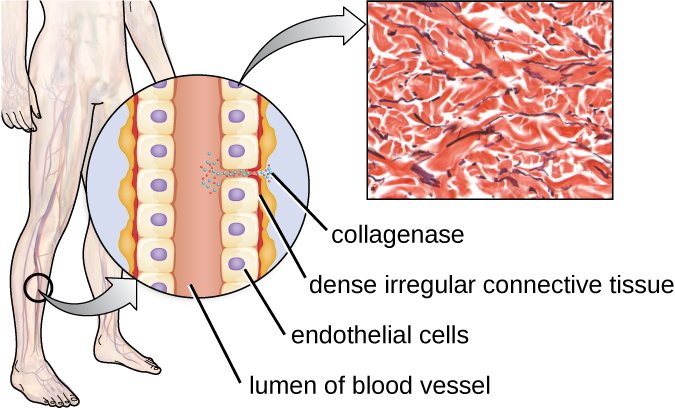
דוגמה אחת לפרוטאז המכיל יון מתכת היא האקזואנזים קולגנאז. קולגנאז מעכל קולגן, החלבון הדומיננטי ברקמת החיבור. ניתן למצוא קולגן במטריצה החוץ תאית, במיוחד ליד ממברנות ריריות, כלי דם, עצבים ובשכבות העור. בדומה להיאלורונידאז, קולגןאז מאפשר לפתוגן לחדור ולהתפשט דרך רקמת המארח על ידי עיכול חלבון רקמת חיבור זה. הקולגנאז המיוצר על ידי החיידק החיובי לגרם Clostridium perfringens, למשל, מאפשר לחיידק לפלס את דרכו בשכבות הרקמה ובהמשך להיכנס ולהתרבות בדם (ספיגה). לאחר מכן C. perfringens משתמש ברעלים ובפוספוליפאז כדי לגרום לתמוגה תאית ונמק. לאחר שהתאים המארחים מתו, החיידק מייצר גז על ידי תסיסה של פחמימות השריר. הנמק הנרחב של רקמות וגז נלווה אופייני למצב המכונה גנגרן גז (איור\(\PageIndex{3}\)).
רעלנים
בנוסף לאקסואנזימים, פתוגנים מסוימים מסוגלים לייצר רעלים, רעלים ביולוגיים המסייעים ביכולתם לפלוש ולגרום נזק לרקמות. היכולת של פתוגן לייצר רעלים לגרום נזק לתאי המארח נקראת רעילות.
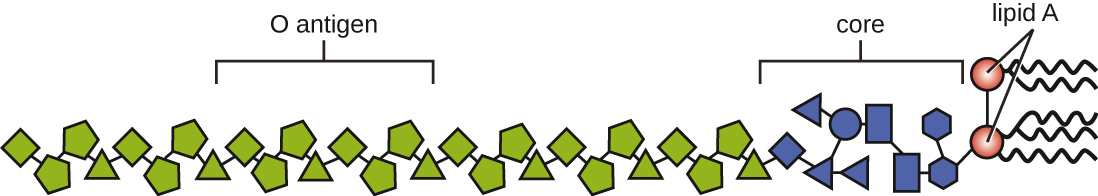
ניתן לסווג רעלים כאנדוטוקסינים או אקסוטוקסינים. הליפופוליסכריד (LPS) המצוי על הממברנה החיצונית של חיידקים גרם שליליים נקרא אנדוטוקסין (איור). \(\PageIndex{4}\) במהלך זיהום ומחלות, פתוגנים חיידקיים שליליים גרם משחררים אנדוטוקסין או כאשר התא מת, וכתוצאה מכך התפרקות הממברנה, או כאשר החיידק עובר ביקוע בינארי. מרכיב השומנים באנדוטוקסין, ליפיד A, אחראי לתכונות הרעילות של מולקולת ה- LPS. ליפיד A נשמר יחסית על פני סוגים שונים של חיידקים גרם שליליים; לכן, התכונות הרעילות של שומנים A דומות ללא קשר לפתוגן גרם שלילי. באופן דומה לזה של גורם נמק הגידול, ליפיד A מעורר את התגובה הדלקתית של מערכת החיסון (ראה דלקת וחום). אם ריכוז האנדוטוקסין בגוף נמוך, התגובה הדלקתית עשויה לספק למארח הגנה יעילה מפני זיהום; מצד שני, ריכוזים גבוהים של אנדוטוקסין בדם עלולים לגרום לתגובה דלקתית מוגזמת, מה שמוביל לירידה קשה בלחץ הדם, אי ספיקת איברים ומוות.
שיטה קלאסית לאיתור אנדוטוקסין היא באמצעות בדיקת Limulus amebocyte lysate (LAL). בהליך זה, תאי הדם (אמבוציטים) של סרטן הפרסה (Limulus polyphemus) מעורבבים בסרום של המטופל. האמבוציטים יגיבו לנוכחות כל אנדוטוקסין. ניתן לראות תגובה זו באופן כרומוגני (צבע) או על ידי חיפוש קרישה (תגובת קרישה) שתתרחש בתוך הסרום. שיטה חלופית בה נעשה שימוש היא בדיקת אימונוסורבנט מקושרת לאנזים (ELISA) המשתמשת בנוגדנים כדי לזהות נוכחות של אנדוטוקסין.
שלא כמו השומנים הרעילים A של אנדוטוקסין, אקסוטוקסינים הם מולקולות חלבון המיוצרות על ידי מגוון רחב של חיידקים פתוגניים חיים. למרות שחלק מהפתוגנים השליליים גרם מייצרים אקסוטוקסינים, הרוב מיוצרים על ידי פתוגנים חיוביים לגרם. אקסוטוקסינים שונים מאנדוטוקסין במספר מאפיינים מרכזיים אחרים, המסוכמים בטבלה. \(\PageIndex{3}\) בניגוד לאנדוטוקסין, המעורר תגובה דלקתית מערכתית כללית בעת שחרורו, אקסוטוקסינים הם הרבה יותר ספציפיים בפעולתם ובתאים איתם הם מתקשרים. כל אקסוטוקסין מכוון לקולטנים ספציפיים בתאים ספציפיים ופוגע בתאים אלה באמצעות מנגנונים מולקולריים ייחודיים. אנדוטוקסין נשאר יציב בטמפרטורות גבוהות, ודורש חימום ב-121 מעלות צלזיוס (250 מעלות צלזיוס) למשך 45 דקות כדי להשבית. לעומת זאת, רוב האקסוטוקסינים הם עמידים בחום בגלל מבנה החלבון שלהם, ורבים מהם מפוגרים (מומתים) בטמפרטורות מעל 41 מעלות צלזיוס (106 מעלות צלזיוס). כפי שנדון קודם לכן, אנדוטוקסין יכול לעורר תגובה דלקתית קטלנית בריכוזים גבוהים מאוד ויש לו LD 50 נמדד של 0.24 מ"ג/ק"ג. לעומת זאת, ריכוזים קטנים מאוד של אקסוטוקסינים יכולים להיות קטלניים. לדוגמה, לרעלן הבוטולינום, הגורם לבוטוליזם, יש LD 50 של 0.000001 מ"ג/ק"ג (פי 240,000 קטלני יותר מאנדוטוקסין).
| מאפיין | אנדוטוקסין | אקסוטוקסין |
|---|---|---|
| מקור | חיידקים גראם שליליים | חיידקים גראם חיוביים (בעיקר) וחיידקים גרם שליליים |
| הרכב | ליפיד מרכיב של ליפופוליסכריד | חלבון |
| השפעה על המארח | תסמינים מערכתיים כלליים של דלקת וחום | נזק ספציפי לתאים התלוי במיקוד תאים בתיווך קולטן ובמנגנוני פעולה ספציפיים |
| יציבות חום | יציב בחום | רובם עמידים בחום, אך חלקם יציבים בחום |
| LD 50 | גבוה | נמוך |
ניתן לקבץ את האקסוטוקסינים לשלוש קטגוריות על סמך מטרתם: מיקוד תוך תאי, שיבוש ממברנה וסופר-אנטיגנים. הטבלה \(\PageIndex{4}\) מספקת דוגמאות לרעלים המאופיינים היטב בכל אחת משלוש הקטגוריות הללו.
| קטגוריה | דוגמא | פתוגן | מנגנון ומחלות |
|---|---|---|---|
| רעלים המכוונים תוך תאיים | רעלן כולרה | ויבריו כולרה | הפעלה של אדנילט ציקלאז בתאי מעיים, הגורמת לרמות מוגברות של אדנוסין מונופוספט מחזורי (cAMP) והפרשת נוזלים ואלקטרוליטים מחוץ לתא, וגורמת לשלשול |
| רעלן טטנוס | קלוסטרידיום טטה ני | מעכב את שחרורם של נוירוטרנסמיטורים מעכבים במערכת העצבים המרכזית וגורם לשיתוק ספסטי | |
| רעלן בוטולינום | קלוסטרידיום בוטולינום | מעכב שחרור של הנוירוטרנסמיטר אצטילכולין מנוירונים, וכתוצאה מכך שיתוק רפוי | |
| רעלן דיפתריה | דיפתריה קורינבקטריום | עיכוב של סינתזת חלבון, גרימת מוות סלולרי | |
| רעלים משבשי קרום | סטרפטוליסין | סטרפטוקוקוס פיוגנס | חלבונים המתאספים לנקבוביות בקרומי התא, משבשים את תפקודם והורגים את התא |
| פנאומוליסין | סטרפטוקוקוס דלקת ריאות | ||
| אלפא טוקסין | סטפילוקוקוס אאורוס | ||
| אלפא טוקסין | קלוסטרידיום פרפרינגן | פוספוליפאזים המפרקים פוספוליפידים של קרום התא, משבשים את תפקוד הממברנה והורגים את התא | |
| פוספוליפאז C | פסאודומונס אירוגינוזה | ||
| רעלן בטא | סטפילוקוקוס אאורוס | ||
| סופר אנטיגנים | רעלן תסמונת הלם רעיל | סטפילוקוקוס אאורוס | ממריץ הפעלה מוגזמת של תאי מערכת החיסון ושחרור ציטוקינים (מתווכים כימיים) מתאי מערכת החיסון. קדחת מסכנת חיים, דלקת והלם הם התוצאה. |
| אקסוטוקסין מיטוגני סטרפטוקוקלי | סטרפטוקוקוס פיוגנס | ||
| רעלים פירוגניים סטרפטוקוקליים | סטרפטוקוקוס פיוגנס |
רעלני המיקוד התוך תאיים כוללים שני מרכיבים: A לפעילות ו- B לקשירה. לפיכך, סוגים אלה של רעלים ידועים בשם אקסוטוקסינים A-B (איור\(\PageIndex{5}\)). רכיב B אחראי על הספציפיות התאית של הרעלן ומתווך את ההתקשרות הראשונית של הרעלן לקולטנים ספציפיים של פני התא. ברגע שהרעלן A-B נקשר לתא המארח, הוא מובא לתא על ידי אנדוציטוזה ונלכד בוואקום. יחידות המשנה A ו- B נפרדות כאשר הוואקום מחמצן. לאחר מכן יחידת המשנה A נכנסת לציטופלזמה של התא ומפריעה לתפקוד הסלולרי הפנימי הספציפי אליו היא מכוונת.
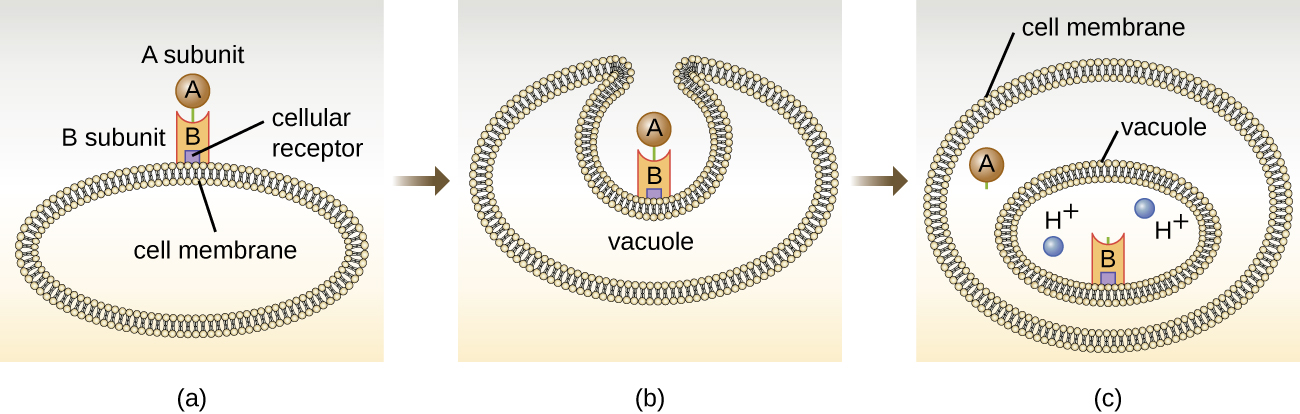
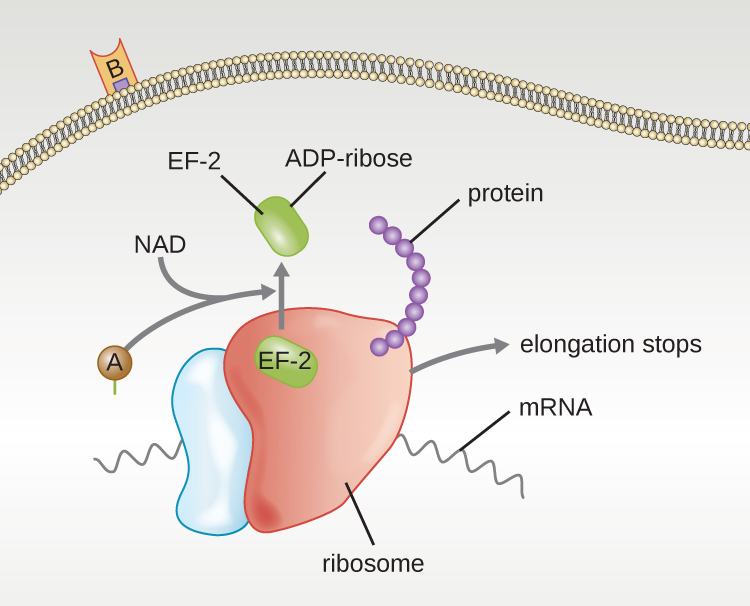
ארבע דוגמאות ייחודיות לרעלני A-B הן רעלני דיפטריה, כולרה, בוטולינום וטטנוס. רעלן הדיפטריה מיוצר על ידי החיידק החיובי לגרם Corynebacterium diphtheriae, הגורם הסיבתי לדיפטריה של האף והלוע. לאחר שתת-היחידה A של רעלן הדיפטריה נפרדת ומקבלת גישה לציטופלזמה, היא מקלה על העברת אדנוסין דיפוספט (ADP) -ריבוז לחלבון גורם התארכות (EF-2) הדרוש לסינתזת חלבון. לפיכך, רעלן דיפתריה מעכב את סינתזת החלבון בתא המארח, ובסופו של דבר הורג את התא (איור\(\PageIndex{6}\)).
רעלן כולרה הוא אנטרוטוקסין המיוצר על ידי החיידק הגראם-שלילי Vibrio cholerae והוא מורכב מיחידת משנה אחת A וחמש יחידות משנה B. מנגנון הפעולה של רעלן כולרה הוא מורכב. יחידות המשנה B נקשרות לקולטנים בתא האפיתל במעי של המעי הדק. לאחר כניסה לציטופלזמה של תא האפיתל, יחידת המשנה A מפעילה חלבון G תוך תאי. חלבון ה- G המופעל, בתורו, מוביל להפעלת האנזים אדניל ציקלאז, שמתחיל לייצר עלייה בריכוז ה- AMP המחזורי (מולקולת שליח משנית). ה- cAMP המוגבר משבש את הפיזיולוגיה התקינה של תאי האפיתל במעי וגורם להם להפריש כמויות מוגזמות של נוזלים ואלקטרוליטים לומן של מערכת המעי, וכתוצאה מכך שלשול חמור של "צואה אורז-מים" האופייני לכולרה.
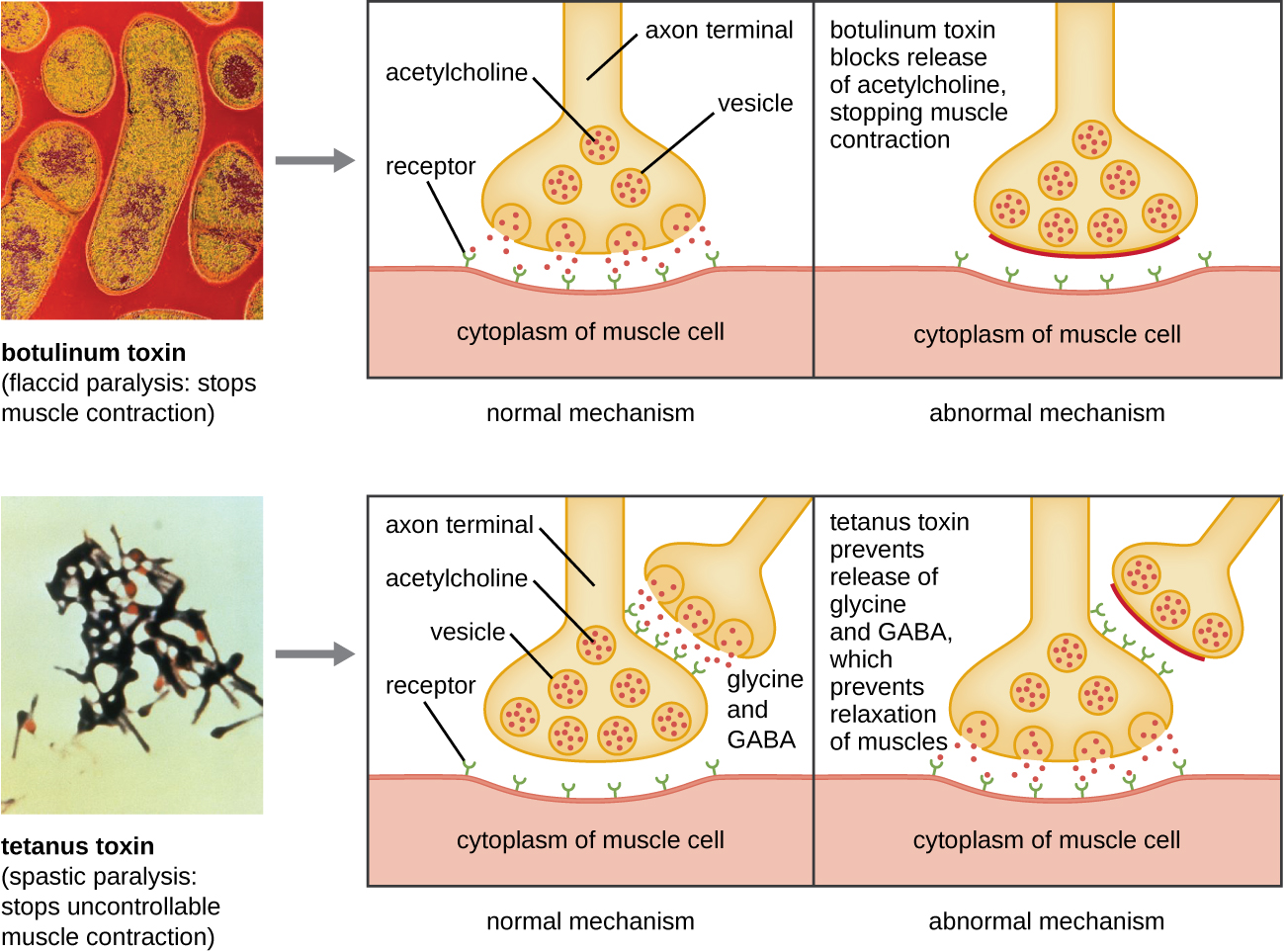
רעלן בוטולינום (הידוע גם בשם בוטוקס) הוא נוירוטוקסין המיוצר על ידי החיידק החיובי לגרם קלוסטרידיום בוטולינום. זהו החומר הרעיל ביותר הידוע עד כה. הרעלן מורכב מיחידת משנה קלה A ותת-יחידת B של שרשרת חלבון כבדה. יחידת המשנה B נקשרת לנוירונים כדי לאפשר לרעלן בוטולינום להיכנס לנוירונים בצומת הנוירו-שרירי. יחידת המשנה A פועלת כפרוטאז, המבקעת חלבונים המעורבים בשחרור הנוירון של אצטילכולין, מולקולת נוירוטרנסמיטר. בדרך כלל, נוירונים משחררים אצטילכולין כדי לגרום להתכווצויות סיבי שריר. יכולתו של הרעלן לחסום שחרור אצטילכולין גורמת לעיכוב התכווצויות השרירים, מה שמוביל להרפיית שרירים. יש לזה פוטנציאל להפסיק לנשום ולגרום למוות. בגלל פעולתו, ריכוזים נמוכים של בוטוקס משמשים להליכים קוסמטיים ורפואיים, כולל הסרת קמטים וטיפול בשלפוחית השתן יתר.
נוירוטוקסין נוסף הוא רעלן טטנוס, המיוצר על ידי החיידק החיובי לגרם קלוסטרידיום טטני. לרעלן זה יש גם יחידת משנה קלה A ותת-יחידה B של שרשרת חלבון כבדה. שלא כמו רעלן בוטולינום, רעלן טטנוס נקשר לאינטרנוירונים מעכבים, האחראים לשחרור הנוירוטרנסמיטורים המעכבים גליצין וחומצה גמא-אמינו-בוטירית (GABA). בדרך כלל, נוירוטרנסמיטורים אלה נקשרים לנוירונים בצומת הנוירו-שרירי, וכתוצאה מכך עיכוב שחרור האצטילכולין. רעלן טטנוס מעכב את שחרור גליצין ו- GABA מהאינטרנורון, וכתוצאה מכך התכווצות שרירים קבועה. התסמין הראשון הוא בדרך כלל נוקשות הלסת (lockjaw). התכווצויות שרירים אלימות בחלקים אחרים של הגוף עוקבות אחריהן, בדרך כלל מגיעות לשיאן עם אי ספיקת נשימה ומוות. איור \(\PageIndex{7}\) מציג את הפעולות של רעלני בוטולינום וטטנוס כאחד.
רעלים משבשי ממברנה משפיעים על תפקוד קרום התא על ידי יצירת נקבוביות או על ידי שיבוש דו שכבת הפוספוליפידים בממברנות התא המארח. שני סוגים של אקסוטוקסינים המשבשים קרום הם המוליזינים ולוקוצידינים, היוצרים נקבוביות בקרומי התא, וגורמים לדליפה של התוכן הציטופלזמי ולתמוגה של התא. במקור חשבו כי רעלים אלה מכוונים לתאי דם אדומים (אריתרוציטים) ותאי דם לבנים (לויקוציטים), בהתאמה, אך כעת אנו יודעים שהם יכולים להשפיע גם על תאים אחרים. החיידק החיובי לגרם Streptococcus pyogenes מייצר סטרפטוליזינים, המוליזינים מסיסים במים הנקשרים לחלקי הכולסטרול בקרום התא המארח ליצירת נקבובית. שני סוגי הסטרפטוליזינים, O ו- S, מסווגים לפי יכולתם לגרום למוליזה באריתרוציטים בהיעדר או נוכחות של חמצן. סטרפטוליסין O אינו פעיל בנוכחות חמצן, ואילו סטרפטוליסין S פעיל בנוכחות חמצן. רעלים חשובים אחרים המשבשים קרום יוצרי נקבוביות כוללים רעלן אלפא של סטפילוקוקוס אאורוס ופנאומוליסין של סטרפטוקוקוס דלקת ריאות.
פוספוליפאזים חיידקיים הם רעלים משבשי קרום המפרקים את דו שכבת הפוספוליפידים של ממברנות התא במקום ליצור נקבוביות. כבר דנו בפוספוליפאזות הקשורות ל B. anthracis, L. pneumophila, ו ריקטסיה מינים המאפשרים לחיידקים אלה להשפיע על תמוגה של פגוזומים. אותם פוספוליפאזים הם גם המוליזינים. פוספוליפאזות אחרות המתפקדות כמוליזינים כוללות את רעלן האלפא של קלוסטרידיום פרפרינגן, פוספוליפאז C של P. aeruginosa, ורעלן בטא של סטפילוקוקוס אאורוס.
כמה זנים של S. aureus מייצרים גם לוקוצידין הנקרא פנטון-ולנטיין לוקוצידין (PVL). PVL מורכב משתי יחידות משנה, S ו-F רכיב S פועל כמו תת-יחידת B של אקסוטוקסין A-B בכך שהוא נקשר לגליקוליפידים על קרום הפלזמה החיצוני של תאי בעלי חיים. רכיב F פועל כמו יחידת משנה A של אקסוטוקסין A-B ונושא את הפעילות האנזימטית. הרעלן מחדיר ומתאסף לנקבובית בקרום. גנים המקודדים ל- PVL נמצאים בתדירות גבוהה יותר ב S. aureus זנים הגורמים לזיהומי עור ודלקת ריאות. 1 PVL מקדם דלקות עור על ידי גרימת בצקת, אריתמה (אדמומיות העור כתוצאה מהתרחבות כלי הדם) ונמק בעור. כמו כן, הוכח כי PVL גורם לדלקת ריאות נמקית. PVL מקדם השפעות פרו-דלקתיות וציטוטוקסיות על לויקוציטים מכתשיים. התוצאה היא שחרור אנזימים מהלוקוציטים, אשר בתורם גורמים נזק לרקמת הריאה.
המעמד השלישי של אקסוטוקסינים הוא הסופר-אנטיגנים. אלה אקסוטוקסינים המפעילים גירוי מוגזם ולא ספציפי של תאי חיסון להפרשת ציטוקינים (שליחים כימיים). ייצור מוגזם של ציטוקינים, המכונה לעתים קרובות סערת ציטוקינים, מעורר תגובה חיסונית ודלקתית חזקה שעלולה לגרום לחום גבוה מסכן חיים, לחץ דם נמוך, כשל רב איברים, הלם ומוות. אב הטיפוס סופראנטיגן הוא רעלן תסמונת ההלם הרעיל של S. aureus. רוב מקרי תסמונת ההלם הרעיל קשורים להתיישבות בנרתיק על ידי ייצור רעלים S. aureus אצל נשים במחזור החודשי; עם זאת, קולוניזציה של אתרי גוף אחרים יכולה להתרחש גם כן. זנים מסוימים של סטרפטוקוקוס פיוגנים מייצרים גם סופר-אנטיגנים; הם מכונים אקסוטוקסינים מיטוגניים סטרפטוקוקליים והרעלים הפירוגניים הסטרפטוקוקליים.
תרגיל \(\PageIndex{2}\)
- תאר כיצד אקסואנזימים תורמים לפלישת חיידקים.
- הסבר את ההבדל בין אקסוטוקסינים לאנדוטוקסין.
- ציין את שלושת המחלקות של אקסוטוקסינים.
גורמי ארסיות להישרדות במארח והתחמקות חיסונית
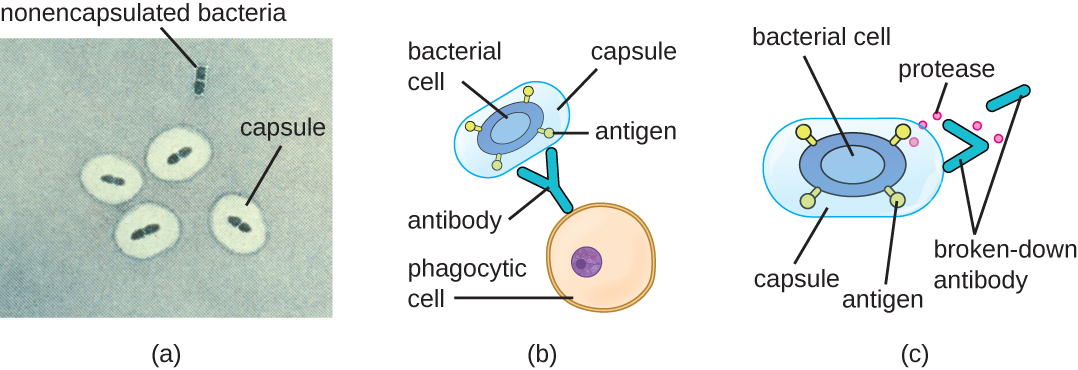
התחמקות ממערכת החיסון חשובה גם לפולשנות. חיידקים משתמשים במגוון גורמי ארסיות כדי להתחמק מפגוציטוזיס על ידי תאי מערכת החיסון. לדוגמה, חיידקים רבים מייצרים כמוסות, המשמשות להדבקה אך גם מסייעות בהתחמקות חיסונית על ידי מניעת בליעה על ידי פגוציטים. הרכב הקפסולה מונע מתאי החיסון להיות מסוגלים להידבק ואז לפגוציטוזה של התא. בנוסף, הקפסולה הופכת את תא החיידק לגדול בהרבה, מה שמקשה על תאי החיסון לבלוע את הפתוגן (איור\(\PageIndex{8}\)). חיידק בולט המייצר כמוסות הוא הפתוגן החיובי לגרם Streptococcus pneumoniae, הגורם לדלקת ריאות פנאומוקוקלית, דלקת קרום המוח, ספטימיה וזיהומים אחרים בדרכי הנשימה. זנים מכוסים של S. pneumoniae הם ארסיים יותר מזנים שאינם מכוסים ויש סיכוי גבוה יותר לפלוש לזרם הדם ולגרום לספיחת דם ודלקת קרום המוח.
פתוגנים מסוימים יכולים גם לייצר פרוטאזות כדי להגן על עצמם מפני פגוציטוזיס. כפי שמתואר בהגנות מארח ספציפיות מסתגלות, מערכת החיסון האנושית מייצרת נוגדנים הנקשרים למולקולות פני השטח הנמצאות על חיידקים ספציפיים (למשל כמוסות, פימבריה, flagella, LPS). כריכה זו יוזמת פגוציטוזיס ומנגנונים אחרים של הרג ופינוי אנטיבקטריאלי. פרוטאזות נלחמות בהרג ופינוי בתיווך נוגדנים על ידי תקיפה ועיכול של מולקולות הנוגדנים (איור). \(\PageIndex{8}\)
בנוסף לכמוסות ופרוטאזות, חלק מהפתוגנים החיידקיים מייצרים גורמי ארסיות אחרים המאפשרים להם להתחמק ממערכת החיסון. הפימבריה של מינים מסוימים של סטרפטוקוקוס מכילים חלבון M, המשנה את פני השטח של סטרפטוקוקוס ומעכב פגוציטוזיס על ידי חסימת הקישור של מולקולות המשלים המסייעות לפגוציטים בבליעת פתוגנים חיידקיים. החיידק המהיר בחומצה Mycobacterium tuberculosis (הגורם הסיבתי לשחפת) מייצר חומר שעווה המכונה חומצה מיקולית במעטפת התא שלו. כאשר הוא נבלע על ידי פגוציטים בריאה, מעטפת החומצה המיקולית המגנה מאפשרת לחיידק להתנגד לחלק ממנגנוני ההרג בתוך הפגוליסוזום.
חלק מהחיידקים מייצרים גורמי ארסיות המקדמים זיהום על ידי ניצול מולקולות המיוצרות באופן טבעי על ידי המארח. לדוגמה, רוב הזנים של Staphylococcus aureus מייצרים את exoenzyme coagulase, המנצל את המנגנון הטבעי של קרישת הדם כדי להתחמק ממערכת החיסון. בדרך כלל, קרישת הדם מופעלת בתגובה לנזק בכלי הדם; טסיות הדם מתחילות לחבר את הקריש, ומתרחש מפל של תגובות בהן פיברינוגן, חלבון מסיס המיוצר על ידי הכבד, נבקע לפיברין. פיברין הוא חלבון בלתי מסיס דמוי חוט הנקשר לטסיות דם, קישורים צולבים ומתכווץ ליצירת רשת של טסיות דם מגושמות ותאי דם אדומים. הקריש שנוצר מונע אובדן נוסף של דם מכלי הדם הפגועים. עם זאת, אם חיידקים משחררים קואגולאז לזרם הדם, מפל הפיברינוגן לפיברין מופעל בהיעדר נזק לכלי הדם. הקריש שנוצר מצפה את החיידקים בפיברין, ומגן על החיידקים מפני חשיפה לתאי חיסון פגוציטים המסתובבים בזרם הדם.
בעוד שקואגולאז גורם לקרישת דם, לקינאזות יש השפעה הפוכה על ידי הפעלת ההמרה של פלסמינוגן לפלסמין, המעורב בעיכול קרישי הפיברין. על ידי עיכול קריש, קינאזות מאפשרות לפתוגנים הכלואים בקריש לברוח ולהתפשט, בדומה לאופן שבו קולגנאז, היאלורונידאז ו-DNase מקלים על התפשטות הזיהום. דוגמאות לקינאזות כוללות סטפילוקינאזות וסטרפטוקינאזות, המיוצרות על ידי Staphylococcus aureus ו סטרפטוקוקוס פיוגנים, בהתאמה. זה מסקרן ש S. aureus יכול לייצר גם קואגולאז לקידום קרישה וגם סטפילוקינאז כדי לעורר את עיכול הקרישים. פעולת הקואגולאז מספקת מחסום הגנה חשוב ממערכת החיסון, אך כאשר אספקת התזונה פוחתת או מצבים אחרים מאותתים על צורך בפתוגן לברוח ולהתפשט, ייצור סטפילוקינאז יכול ליזום תהליך זה.
מנגנון סופי שפתוגנים יכולים להשתמש בו כדי להגן על עצמם מפני מערכת החיסון נקרא וריאציה אנטיגנית, שהיא שינוי חלבוני השטח כך שפתוגן כבר לא יוכר על ידי מערכת החיסון של המארח. לדוגמה, החיידק Borrelia burgdorferi, הגורם הסיבתי למחלת ליים, מכיל ליפופרוטאין על פני השטח המכונה VlSe. בגלל רקומבינציה גנטית במהלך שכפול ותיקון DNA, חלבון חיידקי זה עובר וריאציה אנטיגנית. בכל פעם שמתרחשת חום, חלבון VlSe ב B. burgdorferi יכול להיות שונה עד כדי כך שנוגדנים כנגד רצפי VlSe קודמים אינם יעילים. ההערכה היא כי וריאציה זו ב- VlSE תורמת ליכולת B. burgdorferi לגרום למחלות כרוניות. פתוגן חיידקי אנושי חשוב נוסף המשתמש בשונות אנטיגנית בכדי להימנע ממערכת החיסון הוא Neisseria gonorrhoeae הגורם למחלת המין זיבה. חיידק זה ידוע ביכולתו לעבור וריאציה אנטיגנית של פילי מסוג IV שלו כדי להימנע מהגנות חיסוניות.
תרגיל \(\PageIndex{3}\)
- ציין לפחות שתי דרכים בהן קפסולה מספקת הגנה מפני מערכת החיסון.
- מלבד כמוסות, ציין שני גורמי ארסיות אחרים המשמשים חיידקים כדי להתחמק ממערכת החיסון.
מיקוד קליני: רזולוציה
בהתבסס על התסמינים המדווחים של מייקל על צוואר נוקשה והמיפרזיס, הרופא חושד שהזיהום התפשט למערכת העצבים שלו. הרופא מחליט להזמין ברז בעמוד השדרה כדי לחפש כל חיידק שעלול לפלוש לקרום המוח ולנוזל השדרתי (CSF), שבדרך כלל יהיה סטרילי. כדי לבצע את הברז בעמוד השדרה, הגב התחתון של מייקל מנופח בחומר חיטוי יוד ואז מכוסה בסדין סטרילי. המחט מוסרת באופן אספטי מאריזת הפלסטיק האטומה של היצרן על ידי ידיו הכפפות של המטפל. המחט מוחדרת ונפח קטן של נוזל נמשך לתוך צינור מדגם מצורף. הצינור מוסר, מכוסה ותווית מוכנה עם הנתונים של מייקל מודבקת אליו. דגימת STAT זו (נדרש ניתוח דחוף או מיידי) מחולקת לשלושה צינורות סטריליים נפרדים, כל אחד עם 1 מ"ל של CSF. צינורות אלה נלקחים מיד למעבדה של בית החולים, שם הם מנותחים במחלקות הכימיה הקלינית, המטולוגיה והמיקרוביולוגיה. התוצאות הראשוניות מכל שלוש המחלקות מצביעות על התרחשות זיהום מוחי, כאשר המחלקה למיקרוביולוגיה מדווחת על נוכחות של מוט חיובי גרם ב- CSF של מייקל.
תוצאות אלו מאשרות את מה שחשד הרופא שלו: הסימפטומים החדשים של מייקל הם תוצאה של דלקת קרום המוח, דלקת חריפה בקרומים המגנים על המוח וחוט השדרה. מכיוון שדלקת קרום המוח יכולה להיות מסכנת חיים ומכיוון שהטיפול האנטיביוטי הראשון לא היה יעיל במניעת התפשטות הזיהום, נקבע למייקל מסלול אגרסיבי של שני אנטיביוטיקה, אמפיצילין וגנטמיצין, שיועבר תוך ורידי. מיכאל נשאר בבית החולים מספר ימים לטיפול תומך ולהתבוננות. לאחר שבוע מותר לו לחזור הביתה למנוחה במיטה ולאנטיביוטיקה דרך הפה. לאחר 3 שבועות של טיפול זה, הוא עושה התאוששות מלאה.
ארסיות נגיפית
למרות שפתוגנים ויראליים אינם דומים לפתוגנים חיידקיים מבחינת המבנה, חלק מהתכונות התורמות לארסיותם דומות. וירוסים משתמשים באדהזינים כדי להקל על הידבקות לתאי המארח, ווירוסים עטופים מסוימים מסתמכים על וריאציה אנטיגנית כדי להימנע מההגנה החיסונית של המארח. גורמי ארסיות אלה נדונים ביתר פירוט בסעיפים הבאים.
דבקים נגיפיים
אחד הצעדים הראשונים בכל זיהום ויראלי הוא הידבקות של הנגיף לקולטנים ספציפיים על פני השטח של תאים. תהליך זה מתווך על ידי דבקים המהווים חלק מהקפסיד הנגיפי או מעטפת הממברנה. האינטראקציה של דבקים ויראליים עם קולטני תאים ספציפיים מגדירה את הטרופיזם (מיקוד מועדף) של וירוסים לתאים, רקמות ואיברים ספציפיים בגוף. חלבון הספייק המגלוטינין שנמצא ב- Influenzavirus הוא דוגמה לאדהזין ויראלי; הוא מאפשר לנגיף להיקשר לחומצה הסיאלית על הממברנה של תאי הנשימה והמעיים המארחים. אדהזין ויראלי נוסף הוא הגליקופרוטאין gp20, שנמצא ב- HIV. כדי ש- HIV ידביק תאים של מערכת החיסון, עליו לקיים אינטראקציה עם שני קולטנים על פני התאים. האינטראקציה הראשונה כוללת קישור בין gp120 לסמן הסלולר CD4 שנמצא בכמה תאי מערכת חיסון חיוניים. עם זאת, לפני כניסה ויראלית לתא יכולה להתרחש, חייבת להתרחש אינטראקציה שנייה בין gp120 לאחד משני קולטני הכימוקין (CCR5 ו- CXCR4). הטבלה \(\PageIndex{5}\) מפרטת את הדבקים עבור כמה פתוגנים ויראליים נפוצים ואת האתרים הספציפיים שאליהם דבקים אלה מאפשרים לנגיפים להיצמד.
| פתוגן | מחלה | אדהזין | אתר מצורף |
|---|---|---|---|
| וירוס שפעת | שפעת | המגלוטינין | חומצה סיאלית של תאי נשימה ומעי |
| נגיף הרפס סימפלקס I או II | הרפס אוראלי, הרפס גניטלי | גליקופרוטאינים gB, gC, gD | Heparan סולפט על משטחים ריריים של הפה ואיברי המין |
| נגיף הכשל החיסוני האנושי | HIV/איידס | גליקופרוטאין gp120 | CD4 ו- CCR5 או CXCR4 של תאי מערכת החיסון |
וריאציה אנטיגנית בנגיפים
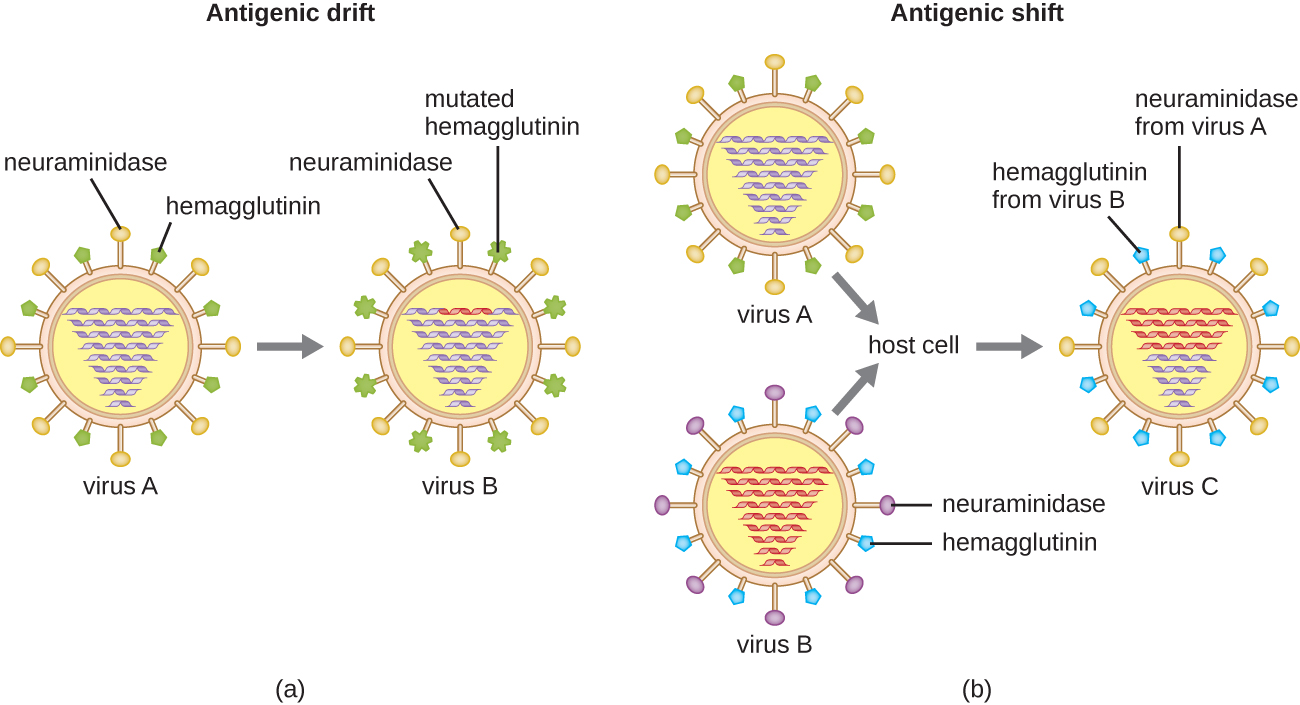
וריאציה אנטיגנית מתרחשת גם בסוגים מסוימים של וירוסים עטופים, כולל נגיפי שפעת, המציגים שתי צורות של וריאציה אנטיגנית: סחף אנטיגני ושינוי אנטיגני (איור). \(\PageIndex{9}\) סחף אנטיגני הוא תוצאה של מוטציות נקודתיות הגורמות לשינויים קלים בחלבוני הספייק המגלוטינין (H) ובנוירמינידאז (N). מצד שני, שינוי אנטיגני הוא שינוי משמעותי בחלבוני ספייק עקב מבחר גנים מחדש. מבחר מחדש זה לשינוי אנטיגני מתרחש בדרך כלל כאשר שני נגיפי שפעת שונים מדביקים את אותו מארח.
שיעור השונות האנטיגנית בנגיפי השפעת הוא גבוה מאוד, מה שמקשה על מערכת החיסון לזהות את הזנים הרבים והשונים של נגיף השפעת. למרות שהגוף עשוי לפתח חסינות לזן אחד באמצעות חשיפה טבעית או חיסון, וריאציה אנטיגנית גורמת להופעתם המתמשכת של זנים חדשים שמערכת החיסון לא תזהה. זו הסיבה העיקרית לכך שיש לתת חיסונים נגד נגיף השפעת מדי שנה. חיסון נגד שפעת בכל שנה מספק הגנה מפני הזנים הנפוצים ביותר באותה שנה, אך זנים חדשים או שונים עשויים להיות נפוצים יותר בשנה שלאחר מכן.
להסבר נוסף על האופן שבו מתרחשים שינוי וסחף אנטיגני, צפו בסרטון זה.
תרגיל \(\PageIndex{4}\)
- תאר את תפקידם של דבקים בטרופיזם ויראלי.
- הסבר את ההבדל בין סחף אנטיגני לשינוי אנטיגני.
מושגי מפתח וסיכום
גורמי ארסיות תורמים ליכולתו של הפתוגן לגרום למחלות. אקסואנזימים ורעלים מאפשרים לפתוגנים לפלוש לרקמת המארח ולגרום לנזק לרקמות. אקסואנזימים מסווגים לפי המקרומולקולה שאליה הם מכוונים ואקסוטוקסינים מסווגים על סמך מנגנון הפעולה שלהם. רעלים חיידקיים כוללים אנדוטוקסין ואקסוטוקסינים. אנדוטוקסין הוא מרכיב השומנים A של ה- LPS של מעטפת התא הגראם-שלילית. אקסוטוקסינים הם חלבונים המופרשים בעיקר על ידי חיידקים חיוביים לגרם, אך גם מופרשים על ידי חיידקים גרם שליליים. פתוגנים חיידקיים עשויים להתחמק מהתגובה החיסונית של המארח על ידי ייצור כמוסות כדי למנוע פגוציטוזיס, לשרוד את הסביבה התוך תאית של פגוציטים, נוגדנים משפילים או באמצעות וריאציה אנטיגנית. פתוגנים ויראליים משתמשים באדהזינים ליזום זיהומים ושונות אנטיגנית כדי למנוע הגנה חיסונית. נגיפי שפעת משתמשים הן בסחף אנטיגני והן בשינוי אנטיגני כדי להימנע מהכרה על ידי המערכת החיסונית.
הערות שוליים
- 1 V. מקה. "פנטון-ולנטיין לוקוצידין". http://www.antimicrobe.org/h04c.file...L-S-aureus.asp


