12.2: הדמיה ואפיון DNA
- Page ID
- 209146
מטרות למידה
- הסבר את השימוש בבדיקות חומצת גרעין כדי להמחיש רצפי DNA ספציפיים
- הסבר את השימוש באלקטרופורזה של ג'ל להפרדת שברי DNA
- הסבר את העיקרון של ניתוח פולימורפיזם באורך שברי הגבלה והשימושים בו
- השווה והשוואה בין כתמים דרומיים וצפוניים
- הסבר את העקרונות והשימושים של ניתוח מיקרו-מערכים
- תאר את השיטות בהן נעשה שימוש כדי להפריד ולהמחיש גרסאות חלבון
- הסבר את השיטה והשימושים בתגובת שרשרת פולימראז ורצף DNA
הרצף של מולקולת DNA יכול לעזור לנו לזהות אורגניזם בהשוואה לרצפים ידועים השוכנים במסד נתונים. הרצף יכול גם לספר לנו משהו על תפקודו של חלק מסוים ב- DNA, כגון האם הוא מקודד לחלבון מסוים. השוואת חתימות חלבון - רמות הביטוי של מערכים ספציפיים של חלבונים - בין דגימות היא שיטה חשובה להערכת תגובות הסלולר למספר רב של גורמים סביבתיים ומתחים. ניתוח חתימות חלבון יכול לחשוף את זהותו של אורגניזם או כיצד תא מגיב במהלך המחלה.
ה-DNA והחלבונים המעניינים הם מיקרוסקופיים ובדרך כלל מעורבבים עם מולקולות רבות אחרות כולל DNA או חלבונים שאינם רלוונטיים לאינטרסים שלנו. טכניקות רבות פותחו כדי לבודד ולאפיין מולקולות של עניין. שיטות אלה פותחו במקור למטרות מחקר, אך במקרים רבים הן פשטו עד כדי כך שאפשר להשתמש קליני שגרתי. לדוגמא, ניתן לאתר פתוגנים רבים, כמו החיידק הליקובקטר פילורי הגורם לכיב בקיבה, באמצעות בדיקות מבוססות חלבון. בנוסף, מספר גדל והולך של מבחני זיהוי מבוססי הגברה של DNA ספציפיים ומדויקים יכולים כעת לזהות פתוגנים כגון חיידקים אנטריים עמידים לאנטיביוטיקה, וירוס הרפס סימפלקס, וירוס אבעבועות רוח ועוד רבים אחרים.
ניתוח מולקולרי של DNA
בסעיף קטן זה, נתאר כמה מהשיטות הבסיסיות המשמשות להפרדה והדמיה של שברי DNA ספציפיים המעניינים מדען. חלק משיטות אלה אינן דורשות ידע על הרצף המלא של מולקולת ה- DNA. לפני הופעת רצף ה- DNA המהיר, שיטות אלה היו היחידות הזמינות לעבודה עם DNA, אך הן עדיין מהוות את ארסנל הכלים הבסיסי המשמש גנטיקאים מולקולריים לחקר תגובות הגוף למחלות מיקרוביאליות ואחרות.
בדיקת חומצות גרעין
מולקולות ה- DNA קטנות, והמידע הכלול ברצף שלהן אינו נראה. כיצד חוקר מבודד קטע מסוים של DNA, או לאחר שבודד אותו, קובע מאיזה אורגניזם הוא, מה הרצף שלו או מה תפקידו? שיטה אחת לזיהוי נוכחות של רצף DNA מסוים משתמשת בחתיכות DNA שנבנו באופן מלאכותי הנקראות בדיקות. ניתן להשתמש בבדיקות לזיהוי מיני חיידקים שונים בסביבה ובדיקות DNA רבות זמינות כעת לאיתור פתוגנים קלינית. לדוגמה, בדיקות DNA משמשות לאיתור הפתוגנים הנרתיקיים קנדידה אלביקנס, גרדנרלה וגינליס וטריכומונאס וגינליס.
כדי לסנן ספרייה גנומית עבור גן מסוים או רצף של עניין, החוקרים חייבים לדעת משהו על הגן הזה. אם לחוקרים יש חלק מרצף ה-DNA עבור הגן המעניין, הם יכולים לתכנן בדיקת DNA, שבר DNA חד-גדילי המשלים לחלק מהגן המעניין ושונה מרצפי DNA אחרים בדגימה. בדיקת ה- DNA עשויה להיות מסונתזת כימית על ידי מעבדות מסחריות, או שהיא עשויה להיווצר על ידי שיבוט, בידוד ודנטורציה של שבר DNA מאורגניזם חי. בכל מקרה, בדיקת ה-DNA חייבת להיות מסומנת בתג מולקולרי או משואה, כגון אטום זרחן רדיואקטיבי (כפי שמשמש לאוטורדיוגרפיה) או צבע פלואורסצנטי (כפי שמשמש בהכלאה פלואורסצנטית באתרו, או FISH), כך שניתן לראות את הגשושית ואת ה-DNA שאליו הוא נקשר (איור). \(\PageIndex{1}\) יש גם לבצע דנטורציה של דגימת ה-DNA הנבדקת כדי להפוך אותה חד-גדילית כך שבדיקת ה-DNA החד-גדילית תוכל לחלחל לדגימת ה-DNA החד-גדילית במקומות שבהם הרצפים שלהם משלימים. בעוד טכניקות אלה הן בעלות ערך לאבחון, השימוש הישיר שלהם על כיח ודגימות גוף אחרות עשוי להיות בעייתי בשל האופי המורכב של דגימות אלה. לעתים קרובות יש לבודד תחילה DNA מדגימות גוף באמצעות שיטות מיצוי כימיות לפני שניתן להשתמש בבדיקת DNA לזיהוי פתוגנים.
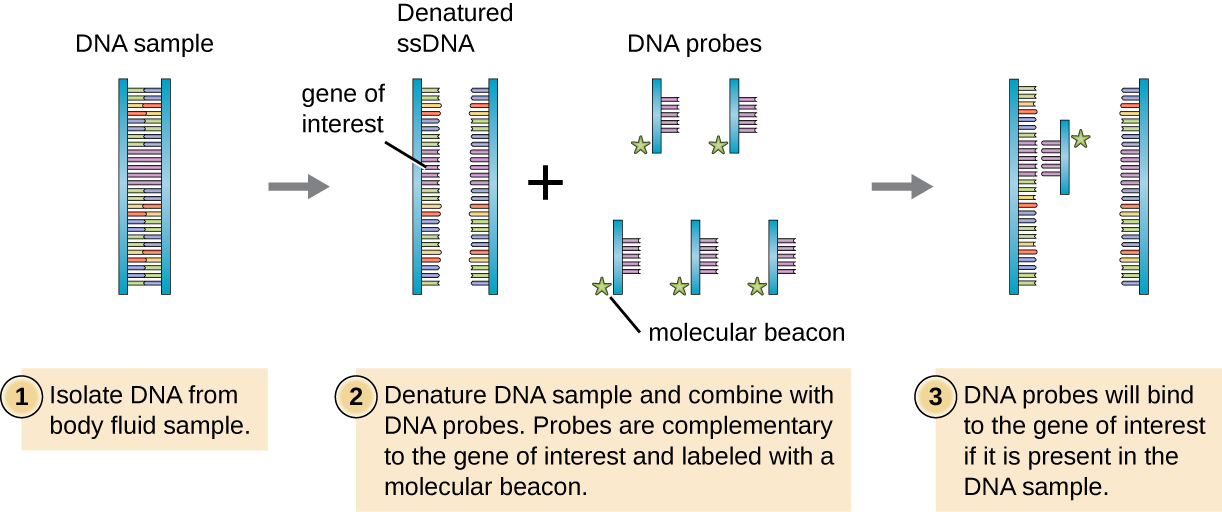
מיקוד קליני: חלק 2
התסמינים הקלים דמויי השפעת שקיילה חווה עלולים להיגרם על ידי מספר כלשהו של גורמים זיהומיים. בנוסף, למספר מצבים אוטואימוניים שאינם זיהומיים, כגון טרשת נפוצה, זאבת אדמנתית מערכתית (SLE) וטרשת לרוחב אמיוטרופית (ALS), יש גם תסמינים התואמים את הסימפטומים המוקדמים של קיילה. עם זאת, במהלך מספר שבועות, הסימפטומים של קיילה החמירו. היא החלה לחוות כאבי פרקים בברכיה, דפיקות לב וצליעה מוזרה בשרירי פניה. בנוסף, היא סבלה מצוואר נוקשה וכאבי ראש כואבים. בחוסר רצון, היא החליטה שהגיע הזמן לפנות לטיפול רפואי.
תרגיל \(\PageIndex{1}\)
- האם התסמינים החדשים של קיילה מספקים רמזים לגבי סוג הזיהום או מצב רפואי אחר שיש לה?
- באילו בדיקות או כלים יכול ספק שירותי בריאות להשתמש כדי לאתר את הפתוגן הגורם לתסמינים של קיילה?
אלקטרופורזה של ג'ל אגרוז
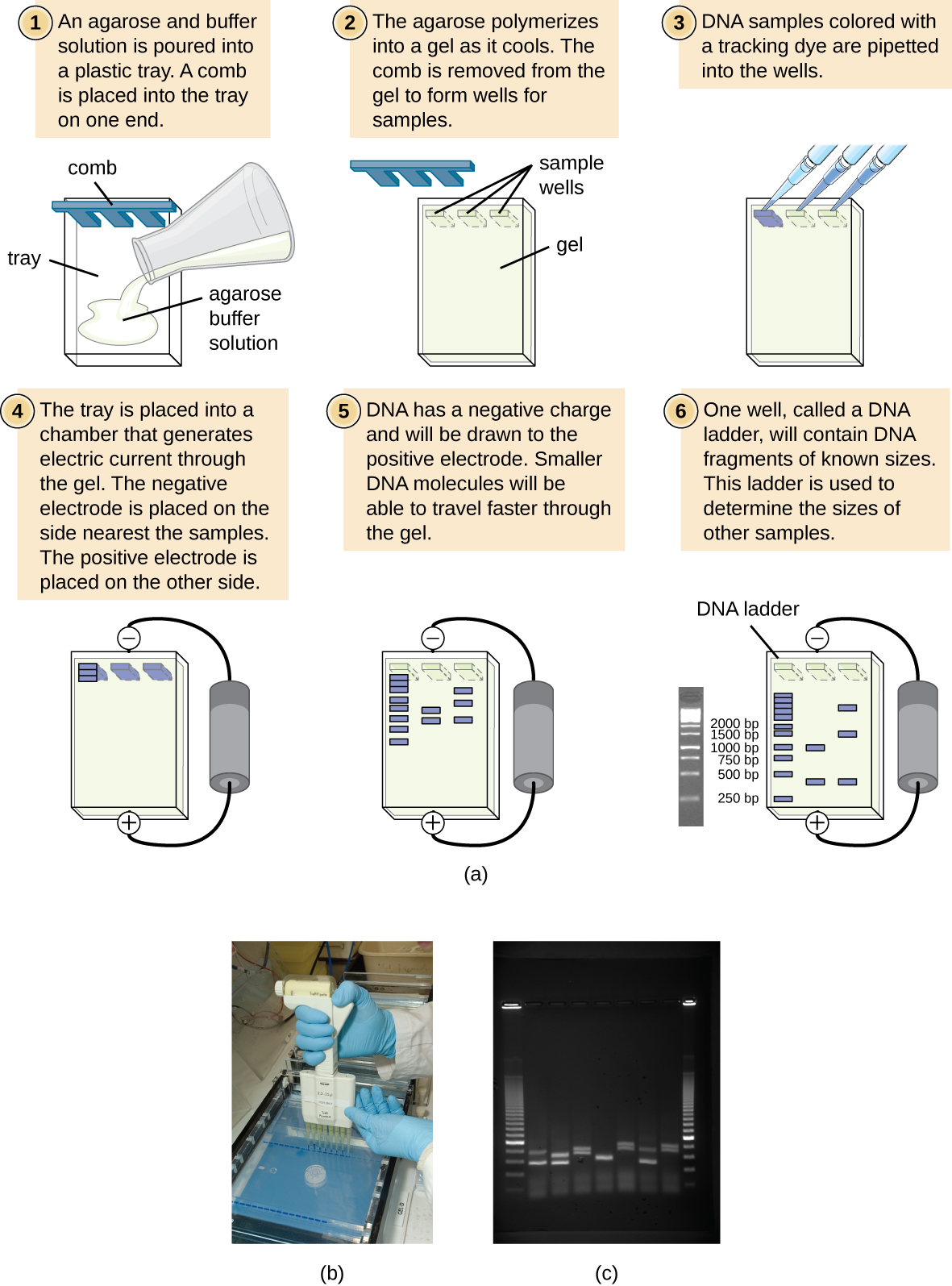
ישנם מספר מצבים בהם חוקר עשוי לרצות להפריד פיזית אוסף של שברי DNA בגדלים שונים. חוקר עשוי גם לעכל דגימת DNA עם אנזים הגבלה ליצירת שברים. הגודל ודפוס התפלגות הקטעים המתקבלים יכולים לעתים קרובות להניב מידע שימושי על רצף בסיסי ה-DNA שניתן להשתמש בהם, בדומה לסריקת ברקוד, כדי לזהות את הפרט או המין שאליו שייך ה-DNA.
אלקטרופורזה של ג'ל היא טכניקה הנפוצה להפרדת מולקולות ביולוגיות המבוססות על גודל ומאפיינים ביוכימיים, כגון מטען וקוטביות. אלקטרופורזה של ג'ל אגרוז נמצאת בשימוש נרחב להפרדת DNA (או RNA) בגדלים משתנים שעלולים להיווצר על ידי עיכול אנזים הגבלה או באמצעים אחרים, כגון ה- PCR (איור\(\PageIndex{2}\)).
בשל עמוד השדרה הטעון שלילי שלו, ה- DNA נמשך מאוד לאלקטרודה חיובית. באלקטרופורזה של ג'ל אגרוז, הג'ל מכוון אופקית בתמיסת חיץ. דגימות נטענות לבארות מדגם בצד הג'ל הקרוב ביותר לאלקטרודה השלילית, ואז נמשכות דרך המסננת המולקולרית של מטריצת האגרוז לכיוון האלקטרודה החיובית. מטריצת האגרוז מעכבת את תנועתן של מולקולות גדולות יותר דרך הג'ל, בעוד שמולקולות קטנות יותר עוברות בקלות רבה יותר. לפיכך, מרחק הנדידה נמצא בקורלציה הפוכה לגודל שבר ה- DNA, כאשר שברים קטנים יותר עוברים מרחק רב יותר דרך הג'ל. ניתן להעריך גדלים של שברי DNA בתוך דגימה בהשוואה לשברים בגודל ידוע בסולם DNA הפועלים גם על אותו ג'ל. כדי להפריד שברי DNA גדולים מאוד, כגון כרומוזומים או גנומים ויראליים, ניתן לשנות אלקטרופורזה של ג'ל אגרוז על ידי החלפה מעת לעת של כיוון השדה החשמלי במהלך אלקטרופורזה של ג'ל בשדה דופק (PFGE). ב-PFGE, שברים קטנים יותר יכולים לכוון את עצמם מחדש ולנדוד מעט מהר יותר משברים גדולים יותר וטכניקה זו יכולה אפוא לשמש להפרדת שברים גדולים מאוד שאחרת היו נוסעים יחד במהלך אלקטרופורזה סטנדרטית של ג'ל אגרוז. בכל אחת מטכניקות האלקטרופורזה הללו ניתן לזהות את מיקומי שברי ה- DNA או ה- RNA בג'ל בשיטות שונות. שיטה נפוצה אחת היא הוספת אתידיום ברומיד, כתם המוחדר לחומצות הגרעין במקומות לא ספציפיים וניתן לדמיין אותו כאשר הוא נחשף לאור אולטרה סגול. כתמים אחרים בטוחים יותר מאתידיום ברומיד, מסרטן פוטנציאלי, זמינים כעת.
ניתוח פולימורפיזם באורך שברי הגבלה (RFLP)
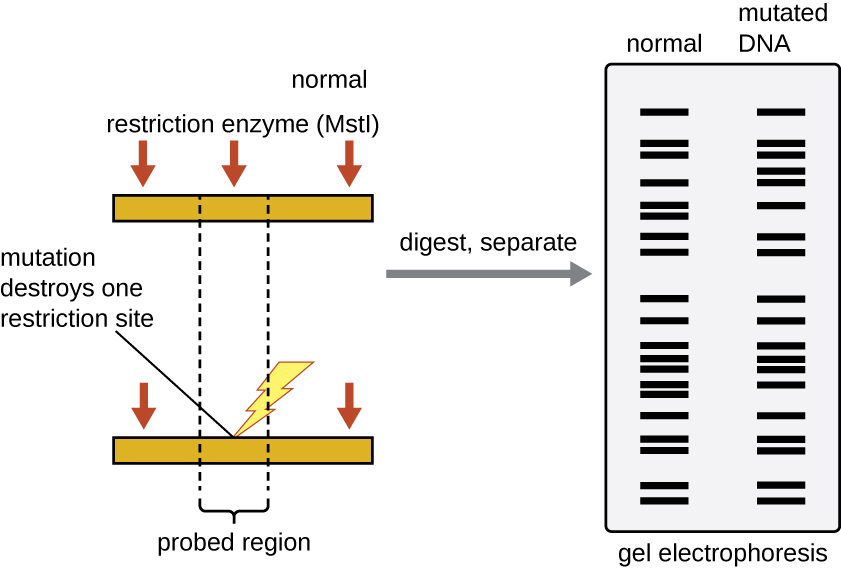
אתרי זיהוי אנזימי הגבלה קצרים (רק כמה נוקלאוטידים ארוכים), פלינדרומים ספציפיים לרצף, ועשויים להימצא בכל הגנום. לפיכך, הבדלים ברצפי ה-DNA בגנום של פרטים יובילו להבדלים בהתפלגות של אתרי זיהוי אנזים הגבלה שניתן לדמיין כדפוסי פסים מובחנים על ג'ל לאחר אלקטרופורזה של ג'ל אגרוז. ניתוח פולימורפיזם באורך שברי הגבלה (RFLP) משווה דפוסי פסי DNA של דגימות DNA שונות לאחר עיכול הגבלה (איור). \(\PageIndex{3}\)
לניתוח RFLP יש יישומים מעשיים רבים הן ברפואה והן במדע הפלילי. לדוגמה, אפידמיולוגים משתמשים בניתוח RFLP כדי לעקוב ולזהות את המקור של מיקרואורגניזמים ספציפיים המעורבים בהתפרצויות של הרעלת מזון או מחלות זיהומיות מסוימות. ניתן להשתמש בניתוח RFLP גם על DNA אנושי כדי לקבוע דפוסי תורשה של כרומוזומים עם גנים משתנים, כולל אלה הקשורים למחלות תורשתיות או לביסוס אבהות.
מדענים משפטיים משתמשים בניתוח RFLP כצורה של טביעת אצבע של DNA, אשר שימושית לניתוח DNA המתקבל מזירות פשע, חשודים וקורבנות. דגימות DNA נאספות, מספר העותקים של מולקולות ה-DNA לדוגמה גדל באמצעות PCR, ולאחר מכן נתון לעיכול אנזים הגבלה ואלקטרופורזה של ג'ל אגרוז ליצירת דפוסי פסים ספציפיים. על ידי השוואת דפוסי החיבור של דגימות שנאספו מזירת הפשע מול אלה שנאספו מחשודים או קורבנות, החוקרים יכולים לקבוע באופן סופי אם ראיות DNA שנאספו במקום הושארו מאחור על ידי חשודים או קורבנות.
כתמים ושינויים דרומיים
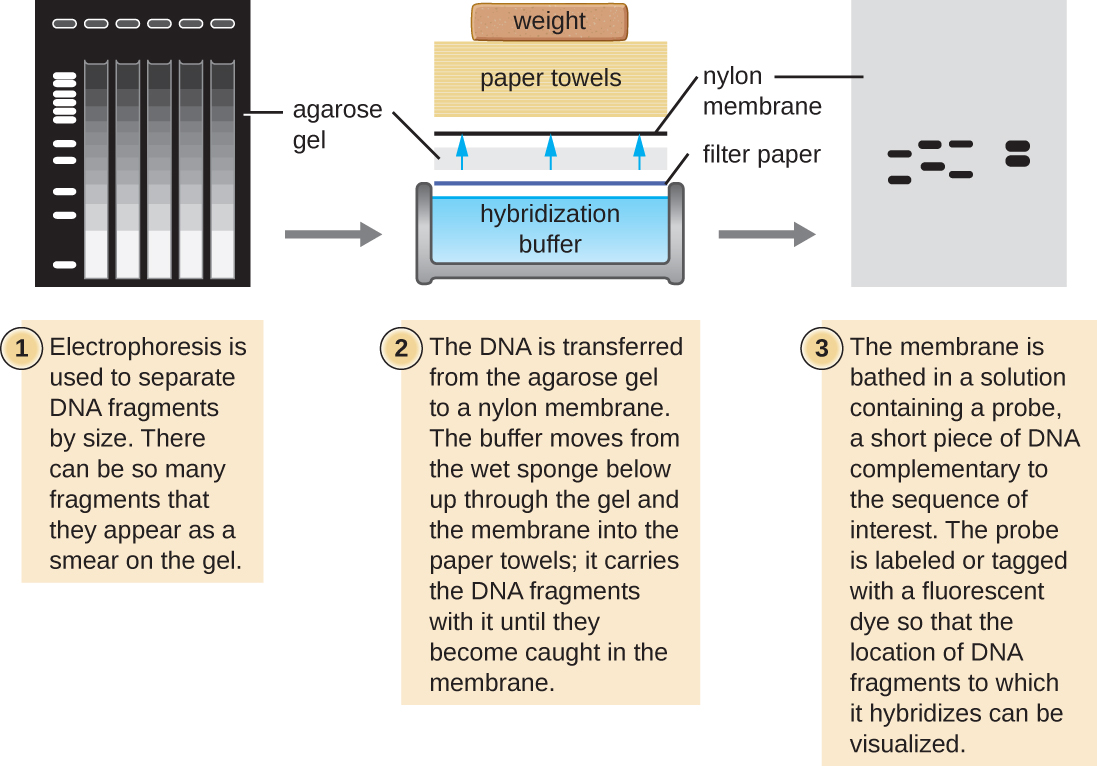
מספר טכניקות מולקולריות מנצלות השלמת רצף והכלאה בין חומצות גרעין של דגימה ובדיקות DNA. בדרך כלל, בדיקת דגימות חומצת גרעין בתוך ג'ל אינה מוצלחת מכיוון שכאשר בדיקת ה- DNA נספגת בג'ל, חומצות הגרעין המדגימות בתוך הג'ל מתפזרות החוצה. לפיכך, טכניקות סופג משמשות בדרך כלל להעברת חומצות גרעין לממברנה דקה וטעונה חיובית העשויה מניטרוצלולוזה או ניילון. בטכניקת הכתם הדרומית, שפותחה על ידי סר אדווין סאות'רן בשנת 1975, שברי DNA בתוך דגימה מופרדים תחילה על ידי אלקטרופורזה של ג'ל אגרוז ולאחר מכן מועברים לממברנה באמצעות פעולה נימית (איור). \(\PageIndex{4}\) שברי ה-DNA הנקשרים לפני השטח של הממברנה נחשפים לאחר מכן לבדיקת DNA חד-גדילית ספציפית המסומנת במגדלור מולקולרי רדיואקטיבי או פלואורסצנטי כדי לסייע בזיהוי. ניתן להשתמש בכתמים דרומיים כדי לזהות נוכחות של רצפי DNA מסוימים בדגימת DNA נתונה. לאחר הדמיה של DNA המטרה בתוך הממברנה, חוקרים יכולים לחתוך את החלק של הממברנה המכילה את השבר כדי לשחזר את שבר ה- DNA המעניין.
וריאציות של הכתם הדרומי - כתם הנקודות, כתם החריץ וכתם הנקודה - אינן כרוכות באלקטרופורזה, אלא מרכזות DNA מדגימה למיקום קטן על קרום. לאחר הכלאה עם בדיקת DNA, נמדדת עוצמת האות שזוהתה, ומאפשרת לחוקר להעריך את כמות ה- DNA היעד הקיים בתוך הדגימה.
כתם מושבה הוא וריאציה נוספת של הכתם הדרומי שבו מושבות המייצגות שיבוטים שונים בספרייה גנומית מועברות לקרום על ידי לחיצה על הממברנה על צלחת התרבות. התאים על הממברנה מסולקים ולאחר מכן ניתן לחקור את הממברנה כדי לקבוע אילו מושבות בתוך ספרייה גנומית מחזיקות את גן המטרה. מכיוון שהמושבות בצלחת עדיין גדלות, ניתן לבודד את תאי העניין מהצלחת.
בכתם הצפוני, וריאציה נוספת של הכתם הדרומי, RNA (לא DNA) משותקת על הממברנה ונבדקת. כתמים צפוניים משמשים בדרך כלל לאיתור כמות ה- mRNA המיוצרת באמצעות ביטוי גנים בתוך דגימת רקמה או אורגניזם.
ניתוח מיקרו-מערכים
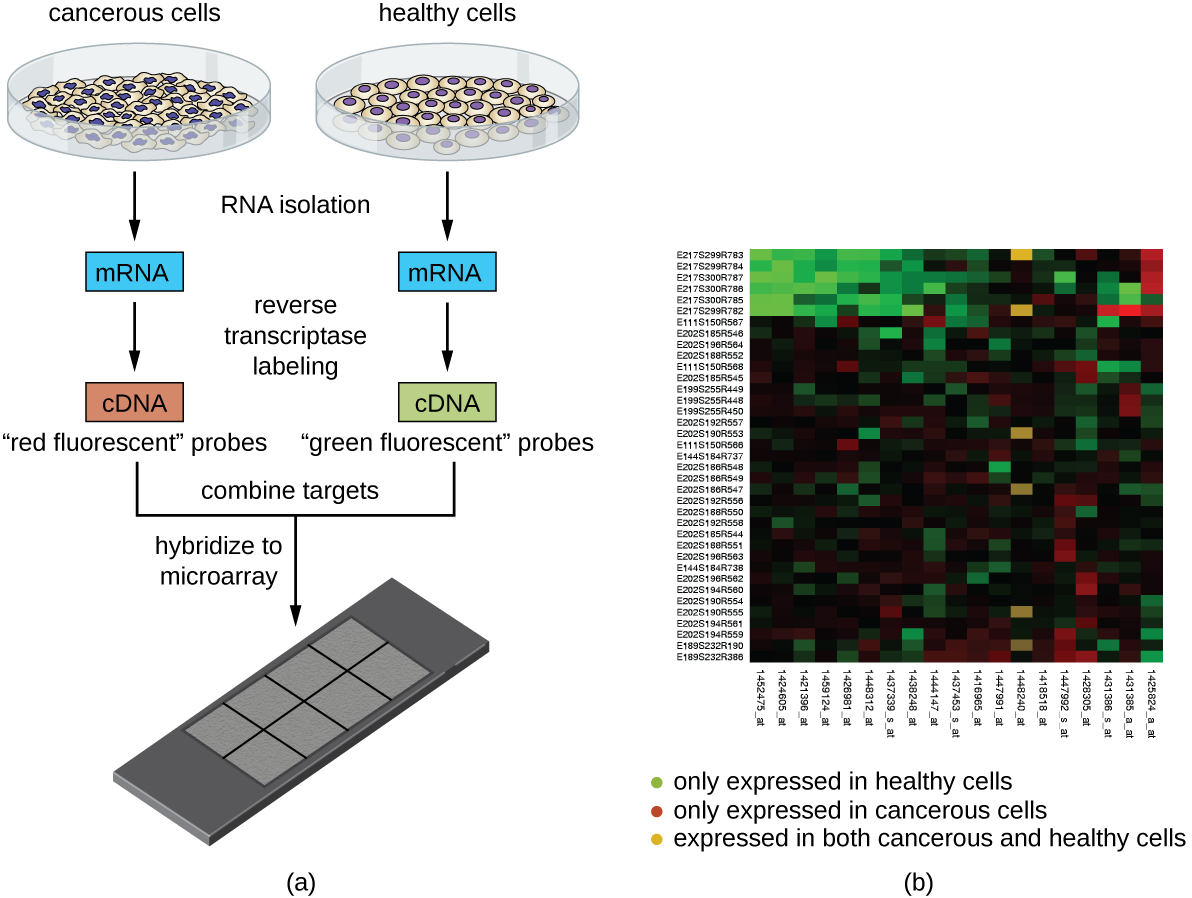
טכניקה נוספת המנצלת את ההכלאה בין רצפי חומצות גרעין משלימות נקראת ניתוח מיקרו מערך. ניתוח מיקרו-מערך שימושי להשוואה בין דפוסי ביטוי גנים בין סוגי תאים שונים - למשל, תאים הנגועים בנגיף לעומת תאים לא נגועים, או תאים סרטניים לעומת תאים בריאים (איור). \(\PageIndex{5}\)
בדרך כלל, DNA או cDNA מדגימה ניסיונית מופקדים על שקופית זכוכית לצד רצפי DNA ידועים. כל שקופית יכולה להכיל יותר מ -30,000 סוגי שברי DNA שונים. ניתן לזהות בנפרד שברי DNA מובחנים (המקיפים את כל הספרייה הגנומית של האורגניזם) או שברי cDNA (המתאימים להשלמת הגנים המובעים של האורגניזם) בשקופית זכוכית.
לאחר ההפקדה בשקופית, ניתן לבודד DNA גנומי או mRNA משתי הדגימות להשוואה. אם mRNA מבודד, הוא מועתק לאחור ל- cDNA באמצעות טרנסקריפטאז הפוך. לאחר מכן שתי הדגימות של DNA גנומי או cDNA מסומנות בצבעי ניאון שונים (בדרך כלל אדום וירוק). דגימות ה- DNA הגנומיות המסומנות משולבות לאחר מכן בכמויות שוות, מתווספות לשבב המיקרו-מערך ומאפשרות להכלאה לנקודות משלימות במיקרו-מערך.
הכלאה של מולקולות DNA גנומיות מדגם ניתן לנטר על ידי מדידת עוצמת הקרינה בנקודות מסוימות על microarray. ניתן להבחין בקלות בהבדלים בכמות ההכלאה בין הדגימות. אם רק חומצות הגרעין של דגימה אחת מכלאות לנקודה מסוימת במיקרו מערך, אז הנקודה הזו תופיע ירוקה או אדומה. עם זאת, אם חומצות הגרעין של שתי הדגימות מכלאות, אז הנקודה תיראה צהובה בשל השילוב של הצבעים האדומים והירוקים.
למרות שטכנולוגיית המיקרו-מערך מאפשרת השוואה הוליסטית בין שתי דגימות בזמן קצר, היא דורשת ציוד זיהוי מתוחכם (ויקר) ותוכנת ניתוח. בגלל ההוצאה, טכנולוגיה זו מוגבלת בדרך כלל להגדרות מחקר. חוקרים השתמשו בניתוח מיקרו-מערכים כדי לחקור כיצד ביטוי גנים מושפע באורגניזמים הנגועים בחיידקים או בנגיפים או נתונים לטיפולים כימיים מסוימים.
חקור את טכנולוגיית המיקרו-שבבים באתר אינטראקטיבי זה.
תרגיל \(\PageIndex{2}\)
- ממה מורכבת בדיקת DNA?
- מדוע משתמשים בכתם דרומי לאחר אלקטרופורזה של ג'ל של עיכול DNA?
ניתוח מולקולרי של חלבונים
במקרים רבים יתכן שלא יהיה רצוי או אפשרי ללמוד DNA או RNA ישירות. חלבונים יכולים לספק מידע ספציפי למין לזיהוי וכן מידע חשוב על האופן והאם תא או רקמה מגיבים לנוכחות של מיקרואורגניזם פתוגני. חלבונים שונים דורשים שיטות שונות לבידוד ואפיון.
אלקטרופורזה ג'ל פוליאקרילאמיד
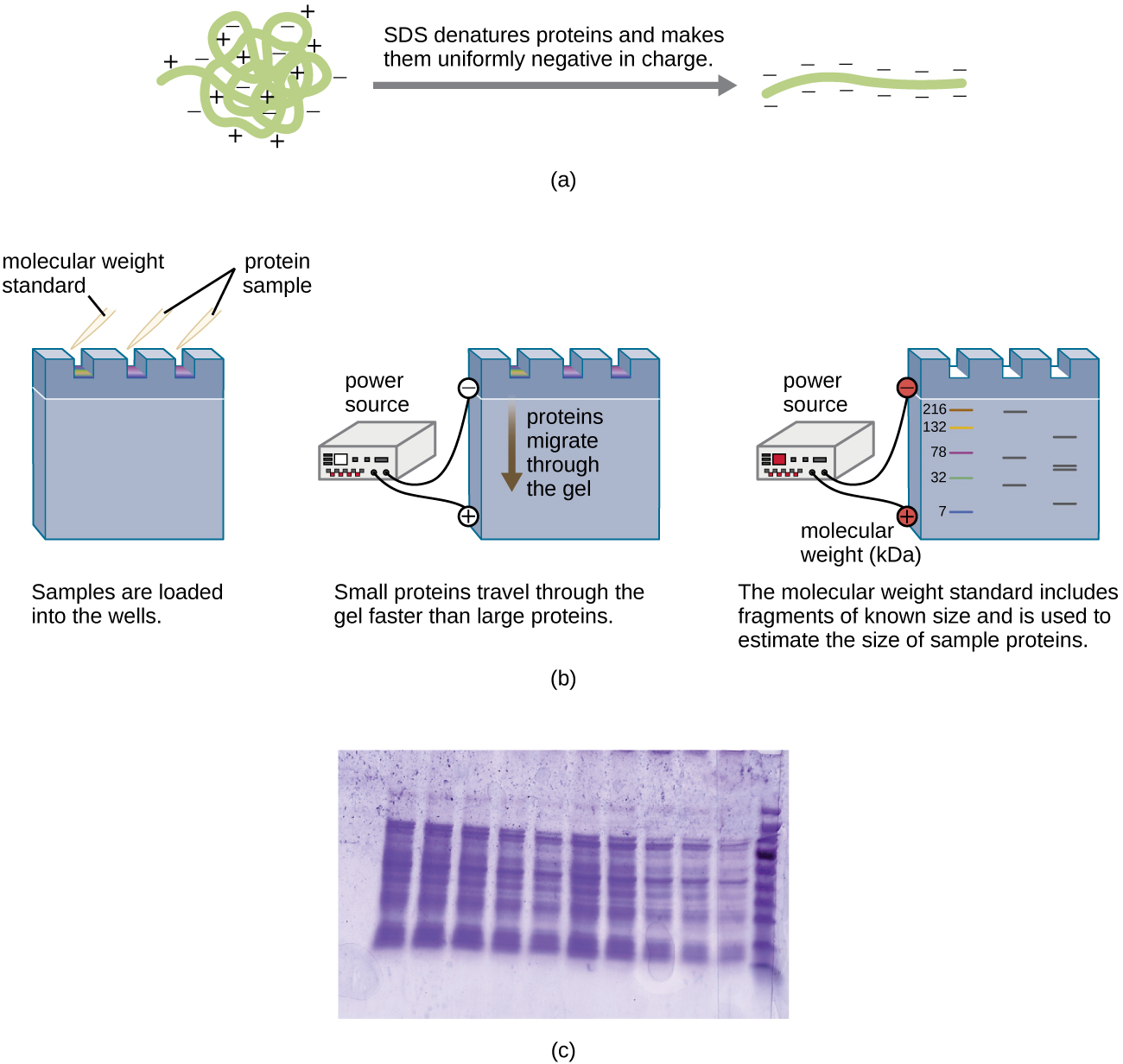
וריאציה של אלקטרופורזה של ג'ל, הנקראת אלקטרופורזה של ג'ל פוליאקרילאמיד (PAGE), משמשת בדרך כלל להפרדת חלבונים. ב-PAGE, מטריצת הג'ל עדינה יותר ומורכבת מפוליאקרילאמיד במקום אגרוז. בנוסף, PAGE מבוצע בדרך כלל באמצעות מנגנון ג'ל אנכי (איור\(\PageIndex{6}\)). בגלל המטענים המשתנים הקשורים לשרשראות צד של חומצות אמינו, ניתן להשתמש ב-PAGE להפרדת חלבונים שלמים על סמך המטענים נטו שלהם. לחלופין, ניתן לפטור חלבונים ולציפוי בחומר ניקוי טעון שלילי הנקרא נתרן דודציל סולפט (SDS), להסוות את המטענים המקומיים ולאפשר הפרדה על בסיס גודל בלבד. ניתן לשנות עוד יותר את PAGE להפרדת חלבונים על סמך שני מאפיינים, כגון המטענים שלהם ב-pH שונים וכן גודלם, באמצעות שימוש ב-PAGE דו-ממדי. בכל אחד מהמקרים הללו, בעקבות אלקטרופורזה, חלבונים מוצגים באמצעות צביעה, בדרך כלל עם כחול קומאסי או כתם כסף.
תרגיל \(\PageIndex{3}\)
על סמך מה מופרדים חלבונים ב- SDS-PAGE?
מיקוד קליני: חלק 3
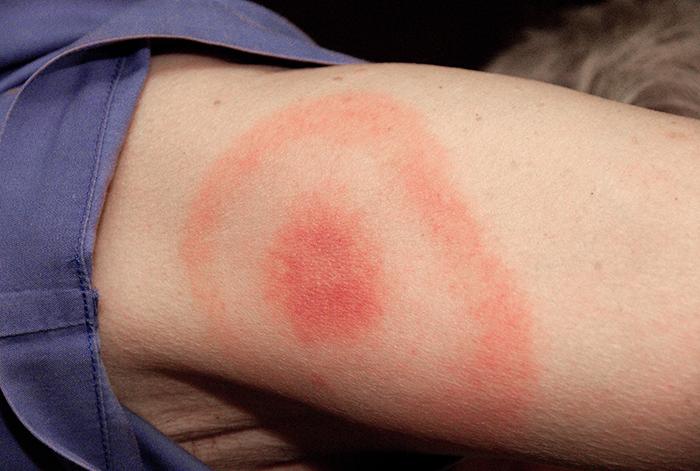
כשקיילה תיארה את הסימפטומים שלה, הרופא שלה חשד תחילה בדלקת קרום המוח החיידקית, התואמת את כאבי הראש והצוואר הנוקשה שלה. עם זאת, עד מהרה היא שללה זאת כאפשרות מכיוון שדלקת קרום המוח בדרך כלל מתקדמת מהר יותר ממה שחוותה קיילה. רבים מהתסמינים שלה עדיין מקבילים לאלה של טרשת לרוחב אמיוטרופית (ALS) וזאבת אדמנתית מערכתית (SLE), והרופא גם ראה במחלת ליים אפשרות בהתחשב בכמה זמן קיילה מבלה ביער. קיילה לא זכרה עקיצות קרציות אחרונות (האמצעי האופייני שבו מועברת מחלת ליים) ולא הייתה לה פריחה טיפוסית בעין השור הקשורה למחלת ליים (איור). \(\PageIndex{7}\) עם זאת, 20-30% מהחולים במחלת ליים לעולם אינם מפתחים פריחה זו, ולכן הרופא לא רצה לשלול זאת.
הרופא של קיילה הזמין בדיקת MRI של המוח שלה, ספירת דם מלאה לבדיקת אנמיה, בדיקות דם המעריכות את תפקודי הכבד והכליות, ובדיקות נוספות לאישור או לשלול מחלת SLE או ליים. תוצאות הבדיקה שלה לא היו עקביות הן עם SLE והן עם ALS, והתוצאה של הבדיקה שחיפשה נוגדנים למחלת ליים הייתה "חד משמעית", כלומר לא חד משמעית. לאחר שפסל ALS ו- SLE, הרופא של קיילה החליט לבצע בדיקות נוספות למחלת ליים.
תרגיל \(\PageIndex{4}\)
- מדוע הרופא של קיילה עדיין יחשוד במחלת ליים גם אם תוצאות הבדיקה לא זיהו נוגדנים ליים בדם?
- איזה סוג של בדיקה מולקולרית עשוי לשמש לאיתור נוגדנים בדם למחלת ליים?
שיטות ניתוח DNA מבוססות הגברה
ניתן להשתמש בשיטות שונות להשגת רצפי DNA, אשר מועילים לחקר אורגניזמים הגורמים למחלות. עם הופעתה של טכנולוגיית רצף מהיר, בסיס הידע שלנו על כל הגנום של אורגניזמים פתוגניים גדל בצורה פנומנלית. אנו מתחילים בתיאור של תגובת שרשרת הפולימראז, שאינה שיטת רצף אך אפשרה לחוקרים ולרופאים להשיג את הכמויות הגדולות של ה- DNA הדרושות לרצף ולמחקרים אחרים. תגובת שרשרת הפולימראז מבטלת את התלות שהייתה לנו פעם בתאים ליצירת עותקים מרובים של DNA, ומשיגה את אותה תוצאה באמצעות תגובות פשוטות יחסית מחוץ לתא.
תגובת שרשרת פולימראז (PCR)
רוב השיטות לניתוח DNA, כגון עיכול אנזים הגבלה ואלקטרופורזה של ג'ל אגרוז, או רצף DNA דורשות כמויות גדולות של שבר DNA ספציפי. בעבר, כמויות גדולות של DNA הופקו על ידי גידול התאים המארחים של ספרייה גנומית. עם זאת, לספריות לוקח זמן ומאמץ להתכונן ודגימות DNA מעניינות מגיעות לעתים קרובות בכמויות זעירות. תגובת שרשרת הפולימראז (PCR) מאפשרת הגברה מהירה במספר העותקים של רצפי DNA ספציפיים לניתוח נוסף (איור\(\PageIndex{8}\)). אחת הטכניקות החזקות ביותר בביולוגיה מולקולרית, PCR פותחה בשנת 1983 על ידי קארי מוליס בעודו בתאגיד Cetus. ל- PCR יש יישומים ספציפיים במעבדות מחקר, משפטיות וקליניות, כולל:
- קביעת רצף הנוקלאוטידים באזור ספציפי של DNA
- הגברת אזור מטרה של DNA לשיבוט לתוך וקטור פלסמיד
- זיהוי המקור לדגימת DNA שהושארה בזירת פשע
- ניתוח דגימות לקביעת אבהות
- השוואת דגימות של DNA עתיק עם אורגניזמים מודרניים
- קביעת נוכחותם של מיקרואורגניזמים קשים לתרבות, או בלתי ניתנים לתרבות, בבני אדם או בדגימות סביבתיות
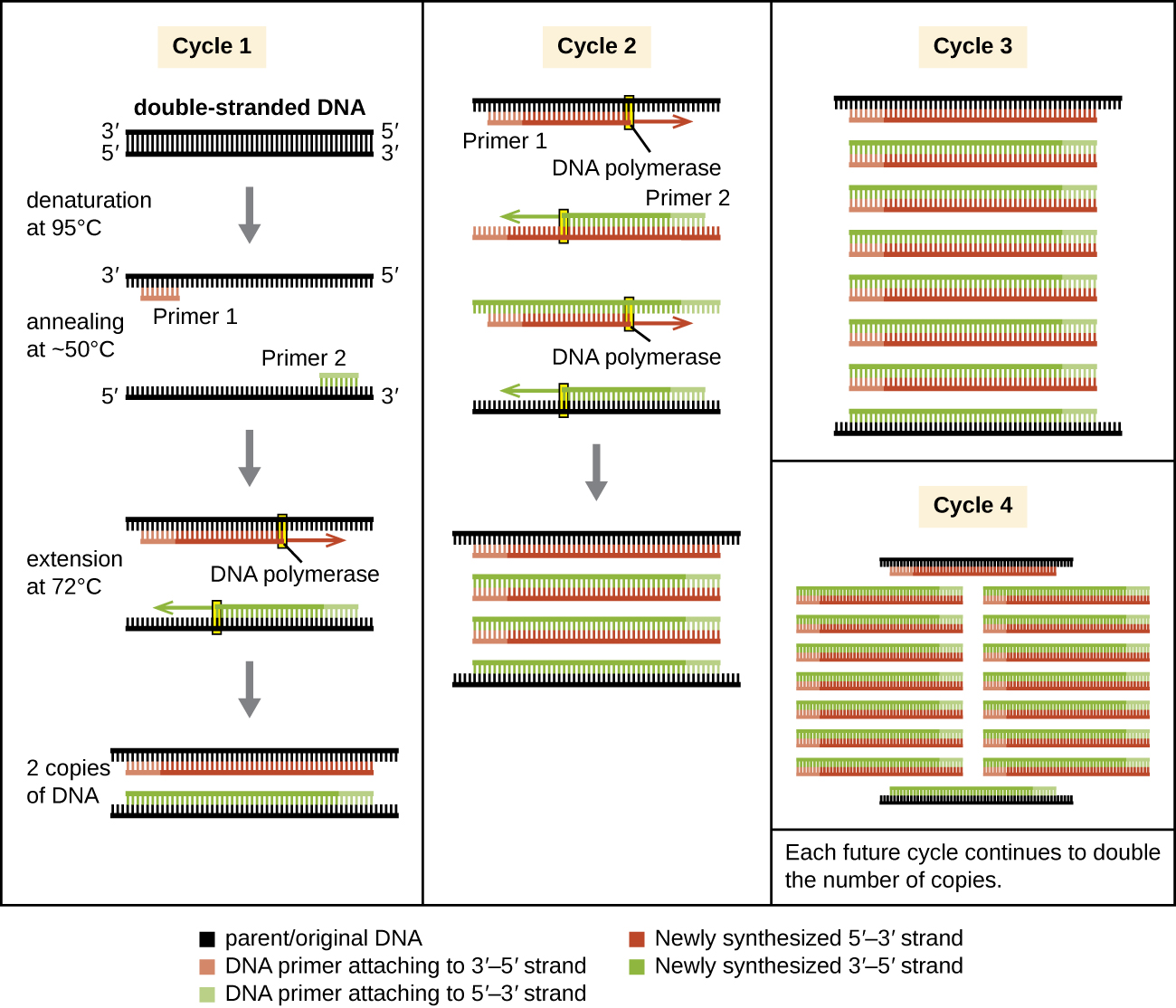
PCR היא טכניקת מעבדה חוץ גופית המנצלת את התהליך הטבעי של שכפול ה- DNA. אנזימי ה-DNA פולימראז יציבים בחום המשמשים ב-PCR נגזרים מפרוקריוטים היפרתרמופיליים. טאק DNA פולימראז, הנפוץ ב- PCR, נגזר מחיידק Thermus aquaticus המבודד ממעיין חם בפארק הלאומי ילוסטון. שכפול DNA מחייב שימוש בפריימרים לתחילת השכפול כדי שיהיו קבוצות 3'-הידרוקסיל חופשיות זמינות להוספת נוקלאוטידים על ידי DNA פולימראז. עם זאת, בעוד פריימרים המורכבים מ- RNA משמשים בדרך כלל בתאים, פריימרים של DNA משמשים ל- PCR. פריימרים של DNA עדיפים בשל יציבותם, וניתן לסנתז כימית פריימרים של DNA עם רצפים ידועים המכוונים לאזור DNA ספציפי. פריימרים אלה של DNA דומים מבחינה תפקודית לבדיקות ה- DNA המשמשות לטכניקות ההכלאה השונות שתוארו קודם לכן, נקשרות למטרות ספציפיות עקב השלמה בין רצף ה- DNA היעד לפריימר.
PCR מתרחש על פני מחזורים מרובים, שכל אחד מהם מכיל שלושה שלבים: דנטורציה, חישול והרחבה. מכונות הנקראות מחזוריות תרמיות משמשות ל- PCR; ניתן לתכנת מכונות אלה למחזור אוטומטי בין הטמפרטורות הנדרשות בכל שלב (איור 12.1). ראשית, DNA תבנית דו-גדילי המכיל את רצף המטרה עובר דנטורציה בכ-95 מעלות צלזיוס הטמפרטורה הגבוהה הנדרשת להפרדה פיזית (ולא אנזימטית) של גדילי ה-DNA היא הסיבה שנדרש פולימראז DNA יציב בחום. לאחר מכן, הטמפרטורה יורדת לכ-50 מעלות צלזיוס זה מאפשר לפריימרים של ה-DNA המשלימים לקצוות רצף המטרה לחלחל (להיצמד) לגדילי התבנית, עם פריימר אחד חישול לכל גדיל. לבסוף, הטמפרטורה מוגברת ל-72 מעלות צלזיוס, הטמפרטורה האופטימלית לפעילות פולימראז ה-DNA היציב בחום, המאפשרת הוספת נוקלאוטידים לפריימר באמצעות המטרה החד-גדילית כתבנית. כל מחזור מכפיל את מספר עותקי ה-DNA של המטרה הדו-גדילית. בדרך כלל, פרוטוקולי PCR כוללים 25-40 מחזורים, המאפשרים הגברה של רצף יעד יחיד בעשרות מיליונים ליותר מטריליון.
שכפול DNA טבעי נועד להעתיק את הגנום כולו, ומתחיל באתרי מוצא אחד או יותר. פריימרים נבנים במהלך השכפול, לא לפני כן, ואינם מורכבים מכמה רצפים ספציפיים. PCR מכוון לאזורים ספציפיים של דגימת DNA באמצעות פריימרים ספציפיים לרצף. בשנים האחרונות פותחו מגוון שיטות הגברה איזותרמיות של PCR העוקפות את הצורך ברכיבה תרמית, תוך ניצול חלבונים נלווים המסייעים בתהליך שכפול ה-DNA. ככל שהפיתוח של שיטות אלה נמשך והשימוש בהן הופך נפוץ יותר במעבדות מחקר, זיהוי פלילי ומעבדות קליניות, מחזוריות תרמיות עלולות להתיישן.
העמיק את ההבנה שלך לגבי תגובת שרשרת הפולימראז על ידי צפייה באנימציה זו ועבודה באמצעות תרגיל אינטראקטיבי.
וריאציות PCR
מספר שינויים מאוחרים יותר ל- PCR מגדילים עוד יותר את התועלת של טכניקה זו. PCR טרנסקריפטאז הפוך (RT-PCR) משמש להשגת עותקי DNA של מולקולת mRNA ספציפית. RT-PCR מתחיל בשימוש באנזים הטרנסקריפטאז ההפוך להמרת מולקולות mRNA ל- cDNA. cDNA זה משמש לאחר מכן כתבנית להגברת PCR מסורתית. RT-PCR יכול לזהות אם גן ספציפי בא לידי ביטוי במדגם. יישום נוסף של PCR לאחרונה הוא PCR בזמן אמת, המכונה גם PCR כמותי (qPCR). פרוטוקולי PCR ו- RT-PCR סטנדרטיים אינם כמותיים מכיוון שכל אחד מהריאגנטים עשוי להיות מגביל לפני השלמת כל המחזורים בפרוטוקול, ודגימות מנותחות רק בסוף. מכיוון שלא ניתן לקבוע מתי בפרוטוקול PCR או RT-PCR ריאגנט נתון הפך למגביל, לא ניתן לדעת כמה מחזורים הושלמו לפני נקודה זו, ולכן לא ניתן לקבוע כמה מולקולות תבנית מקוריות היו נוכחים במדגם בתחילת PCR. ב- qPCR, לעומת זאת, השימוש בפלואורסצנטיות מאפשר לנטר את העלייה בתבנית דו-גדילית במהלך תגובת PCR כפי שהיא מתרחשת. לאחר מכן ניתן להשתמש בנתוני קינטיקה אלה כדי לכמת את כמות רצף היעד המקורי. השימוש ב- qPCR בשנים האחרונות הרחיב עוד יותר את יכולות ה- PCR, ומאפשר לחוקרים לקבוע את מספר עותקי ה- DNA, ולעיתים אורגניזמים, הקיימים במדגם. במסגרות קליניות, qRT-PCR משמש לקביעת עומס נגיפי בחולים חיוביים ל- HIV כדי להעריך את יעילות הטיפול שלהם.
רצף DNA
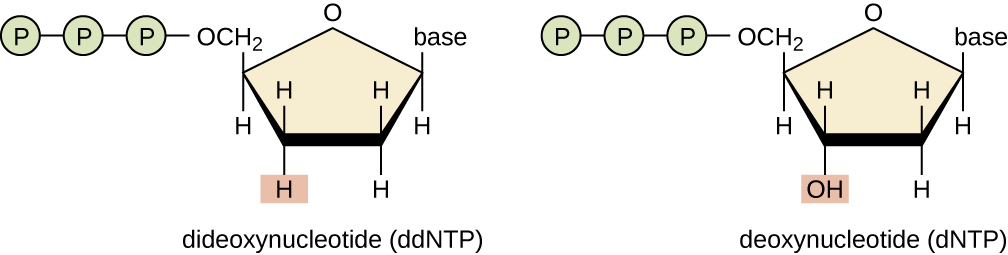
טכניקת רצף בסיסית היא שיטת סיום השרשרת, הידועה גם כשיטת דידאוקסי או שיטת רצף ה- DNA של סנגר, שפותחה על ידי פרדריק סנגר בשנת 1972. שיטת סיום השרשרת כוללת שכפול DNA של תבנית חד-גדילית עם שימוש בפריימר DNA ליזום סינתזה של גדיל משלים, פולימראז DNA, תערובת של ארבעת המונומרים הרגילים של deoxynucleotide (dNTP), וחלק קטן של דידאוקסינוקלאוטידים (ddNTPs), כל אחד מסומן עם משואה מולקולרית. ה-ddNTPs הם מונומרים שחסרים קבוצת הידרוקסיל (—OH) באתר שבו נוקלאוטיד אחר מתחבר בדרך כלל ליצירת שרשרת (איור). \(\PageIndex{9}\) בכל פעם ש-ddNTP משולב באופן אקראי בגדיל המשלים הגדל, הוא מסיים את תהליך שכפול ה-DNA עבור הגדיל המסוים הזה. התוצאה היא מספר גדילים קצרים של DNA משוכפל שכל אחד מהם מסתיים בנקודה אחרת במהלך השכפול. כאשר תערובת התגובה נתונה לאלקטרופורזה של ג'ל, גדילי ה-DNA המרובים ששוכפלו לאחרונה יוצרים סולם בגדלים שונים. מכיוון ש- ddNTP מסומנים, כל רצועה בג'ל משקפת את גודל גדיל ה- DNA כאשר ה- ddNTP סיים את התגובה.
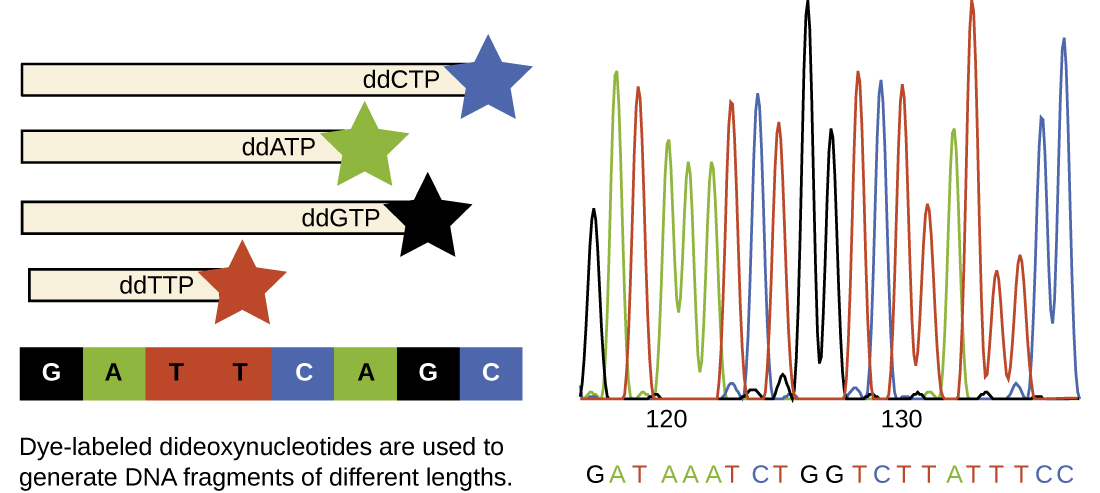
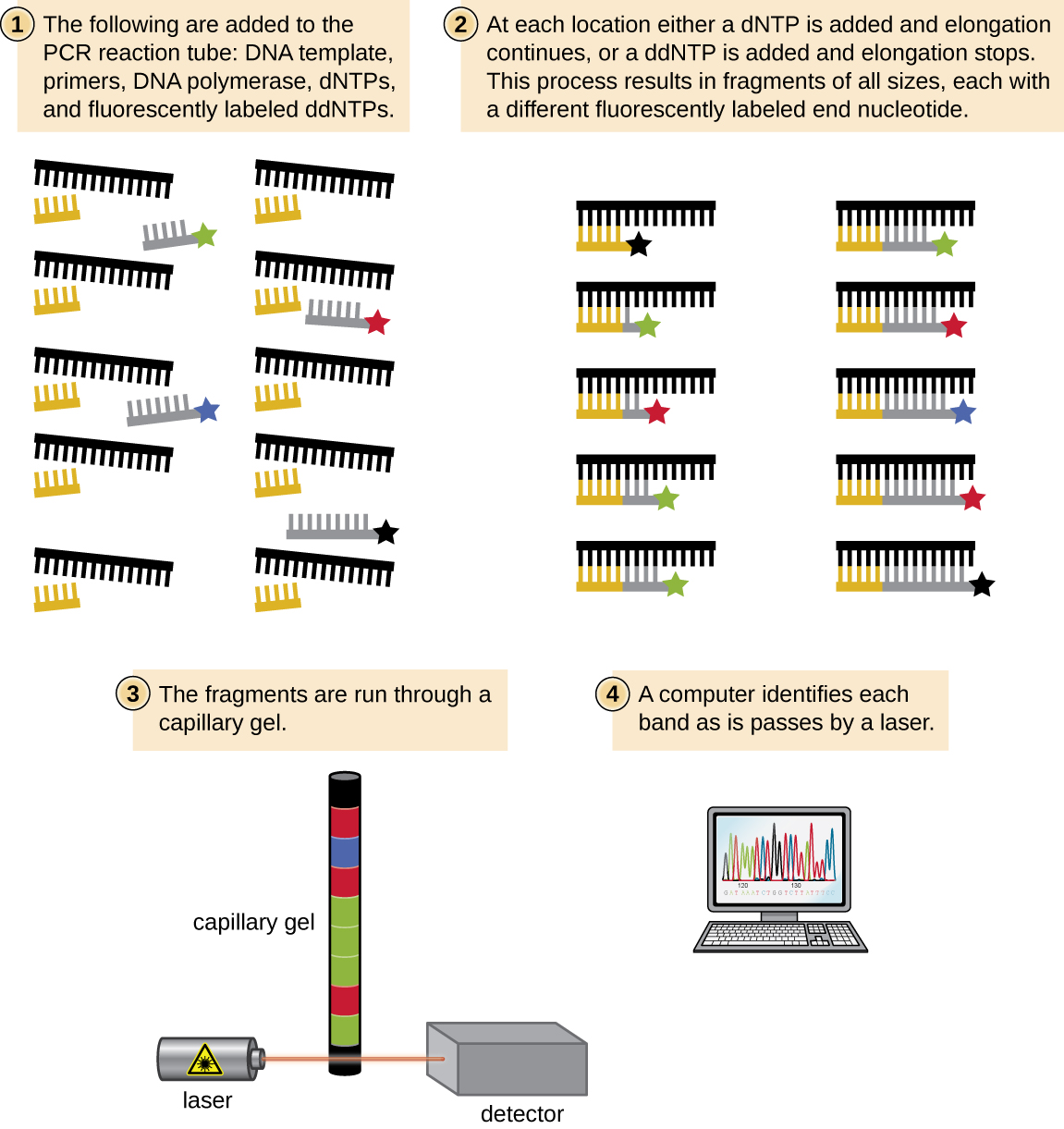
בימיו של סנגר, נקבעו ארבע תגובות לכל מולקולת DNA ברצף, כל תגובה מכילה רק אחד מארבעת ddNTPs האפשריים. כל ddNTP סומן במולקולת זרחן רדיואקטיבית. התוצרים של ארבע התגובות הופעלו לאחר מכן בנתיבים נפרדים זה לצד זה על ג'לים PAGE ארוכים וצרים, והפסים באורכים משתנים זוהו על ידי אוטורדיוגרפיה. כיום, תהליך זה פשט עם השימוש ב-ddNTPs, שכל אחד מהם מסומן בצבע פלואורסצנטי בצבע שונה או פלואורוכרום (איור\(\PageIndex{10}\)), בתגובת רצף אחת המכילה את כל ארבעת ה-ddNTPs האפשריים עבור כל מולקולת DNA ברצף (איור). \(\PageIndex{11}\) פלואורוכרומים אלה מזוהים על ידי ספקטרוסקופיה פלואורסצנטית. קביעת צבע הפלואורסצנטיות של כל להקה כשהיא עוברת ליד הגלאי מייצרת את רצף הנוקלאוטידים של גדיל התבנית.
מאז 2005, טכניקות רצף אוטומטיות המשמשות מעבדות נופלות תחת המטריה של רצף הדור הבא, שהיא קבוצה של טכניקות אוטומטיות המשמשות לרצף DNA מהיר. שיטות אלה חוללו מהפכה בתחום הגנטיקה המולקולרית מכיוון שהרצפים בעלות נמוכה יכולים ליצור רצפים של מאות אלפי או מיליוני שברים קצרים (25 עד 600 זוגות בסיס) רק ביום אחד. למרות שמספר גרסאות של טכנולוגיות רצף מהדור הבא מיוצרות על ידי חברות שונות (לדוגמה, 454 הפירוסקוונסינג של מדעי החיים וטכנולוגיית Solexa של Illumina), כולן מאפשרות לרצף מיליוני בסיסים במהירות, מה שהופך את רצף הגנום כולו לקל יחסית, זול, ו מְשׁוּבָל. ברצף 454 (פירוסקוונסינג), למשל, דגימת DNA מקוטעת לשברים חד-גדילים של 400-600-bp, שונה עם הוספת מתאמי DNA לשני הקצוות של כל שבר. כל שבר DNA משותק לאחר מכן על חרוז ומוגבר על ידי PCR, באמצעות פריימרים שנועדו לחלחל למתאמים, ויוצר חרוז המכיל עותקים רבים של אותו שבר DNA. לאחר מכן מכניסים כל חרוז לבאר נפרדת המכילה אנזימי רצף. לבאר, כל אחד מארבעת הנוקלאוטידים מתווסף בזה אחר זה; כאשר כל אחד מהם משולב, פירופוספט משתחרר כתוצר לוואי של פילמור, ופולט הבזק אור קטן שנרשם על ידי גלאי. זה מספק את סדר הנוקלאוטידים המשולבים כאשר נוצר גדיל חדש של DNA ומהווה דוגמה לרצף סינתזה. רצפי הדור הבא משתמשים בתוכנה מתוחכמת כדי לעבור את התהליך המסורבל של סדר בכל השברים. בסך הכל, טכנולוגיות אלה ממשיכות להתקדם במהירות, מורידות את עלות הרצף ומגדילות את הזמינות של נתוני רצף ממגוון רחב של אורגניזמים במהירות.
המרכז הלאומי למידע על ביוטכנולוגיה מכיל מאגר נתונים של רצפים גנטיים בשימוש נרחב בשם GenBankWhere חוקרים מפקידים מידע גנטי לשימוש ציבורי. עם פרסום נתוני רצף, חוקרים מעלים אותם ל- GenBank, ומעניקים לחוקרים אחרים גישה למידע. שיתוף הפעולה מאפשר לחוקרים להשוות מידע רצף מדגם שהתגלה לאחרונה או לא ידוע עם המערך העצום של נתוני הרצף שכבר קיים.
צפה באנימציה על רצף 454 כדי להעמיק את ההבנה שלך בשיטה זו.
שימוש ב- NAAT לאבחון זיהום C. difficile
חאבייר, חולה בן 80 עם היסטוריה של מחלות לב, חזר לאחרונה הביתה מבית החולים לאחר שעבר הליך אנגיופלסטיקה להכנסת סטנט לעורק לב. כדי למזער את האפשרות של זיהום, חאבייר קיבל אנטיביוטיקה רחבת טווח תוך ורידי במהלך וזמן קצר לאחר ההליך שלו. הוא שוחרר ארבעה ימים לאחר ההליך, אך כעבור שבוע החל לחוות התכווצויות בטן קלות ושלשול מימי מספר פעמים ביום. הוא איבד את התיאבון, התייבש קשות ופיתח חום. הוא גם הבחין בדם בצואה שלו. אשתו של חאבייר התקשרה לרופא, שהורה לה לקחת אותו מיד לחדר המיון.
צוות בית החולים ערך מספר בדיקות ומצא שרמות הקריאטינין בכליות של חאבייר היו גבוהות בהשוואה לרמות בדמו, מה שמצביע על כך שהכליות שלו לא מתפקדות היטב. הסימפטומים של חאבייר הציעו זיהום אפשרי ב- Clostridium difficile, חיידק העמיד בפני אנטיביוטיקה רבים. בית החולים אסף ותרבת דגימת צואה כדי לחפש ייצור רעלים A ו- B על ידי C. difficile, אך התוצאות חזרו שליליות. עם זאת, התוצאות השליליות לא הספיקו כדי לשלול זיהום C. difficile מכיוון שגידול של C. difficile וזיהוי הרעלים האופייניים לו יכול להיות קשה, במיוחד בסוגים מסוימים של דגימות. כדי להיות בטוחים, הם המשיכו בבדיקת הגברה של חומצות גרעין אבחנתיות (NAAT). נכון לעכשיו NAATs הם תקן הזהב של המאבחן הקליני לאיתור החומר הגנטי של פתוגן. במקרה של חאבייר, qPCR שימש לחיפוש הגן המקודד C. difficile רעלן B (TCDB). כאשר ניתוח qPCR חזר חיובי, הרופא המטפל הגיע למסקנה שחאבייר אכן סובל מזיהום C. difficile ומיד רשם את האנטיביוטיקה ונקומיצין, שיינתן תוך ורידי. האנטיביוטיקה פינתה את הזיהום וחאבייר החלים לחלוטין.
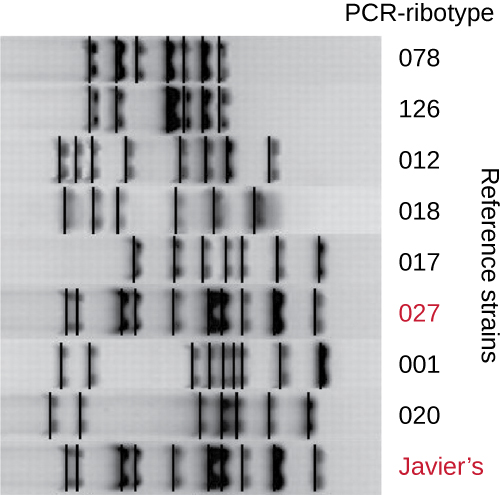
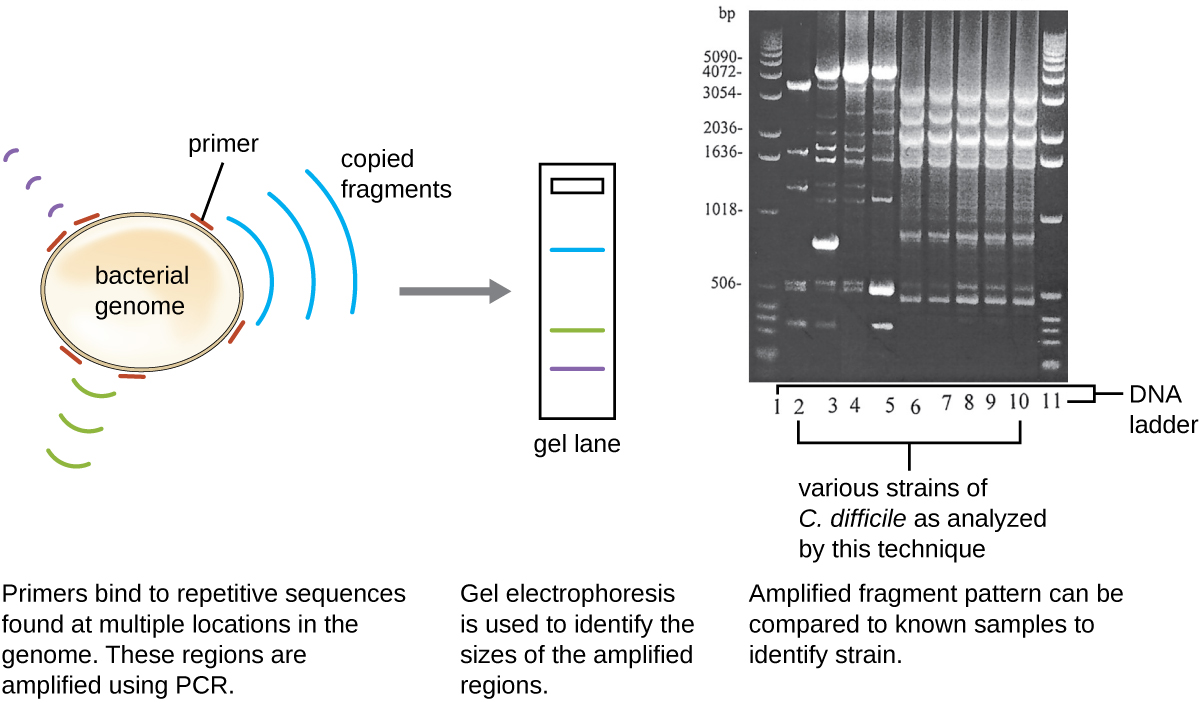
מכיוון שזיהומים עם C. difficile הפכו לנפוצים בקהילה של חאבייר, המדגם שלו נותח עוד יותר כדי לראות אם ניתן לזהות את הזן הספציפי של C. difficile. דגימת הצואה של חאבייר הייתה נתונה לריבוטיפ וניתוח PCR מבוסס רצף (Rep-PCR) חוזר ונשנה. בריבוטיפ, רצף קצר של DNA בין הגנים 16S rRNA ו- 23S rRNA מוגבר ונתון לעיכול הגבלה (איור). \(\PageIndex{12}\) רצף זה משתנה בין זנים של C. difficile, כך שאנזימי הגבלה יחתכו במקומות שונים. ב- Rep-PCR, פריימרים של DNA שנועדו להיקשר לרצפים קצרים שנמצאים בדרך כלל חוזרים על עצמם בתוך C. difficile הגנום שימשו ל- PCR. לאחר עיכול הגבלה, אלקטרופורזה של ג'ל אגרוז בוצעה בשני סוגי הניתוח כדי לבחון את דפוסי הפסים שנבעו מכל הליך (איור\(\PageIndex{13}\)). Rep-PCR יכול לשמש לתת-סוג נוסף של ריבוטיפים שונים, הגדלת הרזולוציה לאיתור הבדלים בין זנים. הריבוטיפ של הזן המדביק את חאבייר נמצא כריבוטיפ 27, זן הידוע בארסיות המוגברת שלו, בעמידותו לאנטיביוטיקה ובשכיחות מוגברת בארצות הברית, קנדה, יפן ואירופה. 1
תרגיל \(\PageIndex{5}\)
- במה נבדלים דפוסי הפסים בין זנים של C. difficile?
- מדוע לדעתך בדיקות מעבדה לא הצליחו לזהות ייצור רעלים ישירות?
תרגיל \(\PageIndex{6}\)
- כיצד PCR דומה לתהליך שכפול ה- DNA הטבעי בתאים? איך זה שונה?
- השווה RT-PCR ו- qPCR במונחים של מטרותיהם בהתאמה.
- ברצף סיום שרשרת, כיצד נקבעת זהותו של כל נוקלאוטיד ברצף?
מושגי מפתח וסיכום
- מציאת גן מעניין בתוך דגימה מחייבת שימוש בבדיקת DNA חד-גדילית המסומנת במגדלור מולקולרי (בדרך כלל רדיואקטיביות או פלואורסצנטיות) שיכולה להכליא עם חומצת גרעין חד-גדילית משלימה בדגימה.
- אלקטרופורזה של ג'ל אגרוז מאפשרת הפרדה של מולקולות DNA על בסיס גודל.
- ניתוח פולימורפיזם באורך שברי הגבלה (RFLP) מאפשר הדמיה על ידי אלקטרופורזה של ג'ל אגרוז של גרסאות שונות של רצף DNA הנגרמות על ידי הבדלים באתרי הגבלה.
- ניתוח הכתם הדרומי מאפשר לחוקרים למצוא רצף DNA מסוים בתוך דגימה ואילו ניתוח כתם צפוני מאפשר לחוקרים לזהות רצף mRNA מסוים המתבטא בדגימה.
- טכנולוגיית Microarray היא טכניקת הכלאה של חומצות גרעין המאפשרת בדיקה של אלפים רבים של גנים בבת אחת כדי למצוא הבדלים בגנים או בדפוסי ביטוי גנים בין שתי דגימות של DNA גנומי או cDNA,
- אלקטרופורזה של ג'ל פוליאקרילאמיד (PAGE) מאפשרת הפרדה של חלבונים לפי גודל, במיוחד אם מטעני חלבון מקומיים מוסווים באמצעות טיפול מקדים ב- SDS.
- תגובת שרשרת פולימראז מאפשרת הגברה מהירה של רצף DNA ספציפי. ניתן להשתמש בווריאציות של PCR כדי לזהות ביטוי mRNA (PCR טרנסקריפטאז הפוך) או לכמת רצף מסוים במדגם המקורי (PCR בזמן אמת).
- למרות שפיתוח רצף ה- DNA של סנגר היה מהפכני, ההתקדמות ברצף הדור הבא מאפשרת רצף מהיר וזול של הגנום של אורגניזמים רבים, מה שמאיץ את נפח נתוני הרצף החדשים.
הערות שוליים
- 1 פטריציה ספיגליה, פבריציו ברבנטי, אנה מריה דיוניסי ופאולה מסטרנטוניו. "Clostridium difficile מבודדים עמידים בפני פלואורוקווינולונים באיטליה: הופעת ריבוטיפ PCR 018." כתב העת למיקרוביולוגיה קלינית 48 מס '8 (2010): 2892—2896.


