12.1: חיידקים וכלים להנדסה גנטית
- Page ID
- 209139
מטרות למידה
- זיהוי כלים של גנטיקה מולקולרית שמקורם במיקרואורגניזמים
- תאר את השיטות המשמשות ליצירת מולקולות DNA רקומביננטיות
- תאר שיטות המשמשות להחדרת DNA לתאים פרוקריוטים
- רשום את סוגי הספריות הגנומיות ותאר את השימושים בהן
- תאר את השיטות המשמשות להחדרת DNA לתאים אוקריוטיים
מיקוד קליני: חלק 1
קיילה, מהנדסת חשמל בת 24 וחובבת ריצה, עברה זה עתה מאריזון לניו המפשייר כדי לקחת עבודה חדשה. בסופי השבוע החופשיים שלה, היא אוהבת לחקור את סביבתה החדשה, לצאת לריצות ארוכות ביערות האורנים. ביולי בילתה שבוע בטיולים בהרים. בתחילת אוגוסט, קיילה פיתחה חום נמוך, כאבי ראש וכאבי שרירים קלים, והיא הרגישה קצת עייפה. לא חשבה הרבה על זה, היא לקחה קצת איבופרופן כדי להילחם בסימפטומים שלה ונשבעה לנוח יותר.
תרגיל \(\PageIndex{1}\)
אילו סוגים של מצבים רפואיים עשויים להיות אחראים לתסמינים של קיילה?
המדע של שימוש במערכות חיות לטובת האנושות נקרא ביוטכנולוגיה. מבחינה טכנית, ביות של צמחים ובעלי חיים באמצעות שיטות חקלאות וגידול הוא סוג של ביוטכנולוגיה. עם זאת, במובן העכשווי, אנו מקשרים בין ביוטכנולוגיה לשינוי ישיר של הגנטיקה של האורגניזם להשגת תכונות רצויות בתהליך ההנדסה הגנטית. הנדסה גנטית כוללת שימוש בטכנולוגיית DNA רקומביננטי, התהליך שבו מתבצע מניפולציה של רצף DNA בַּמַבחֵנָה, ובכך נוצר מולקולות DNA רקומביננטיות שיש להן שילובים חדשים של חומר גנטי. לאחר מכן מוחדר ה-DNA הרקומביננטי לאורגניזם מארח. אם ה-DNA המוחדר מגיע ממין אחר, האורגניזם המארח נחשב כיום למהונדס.
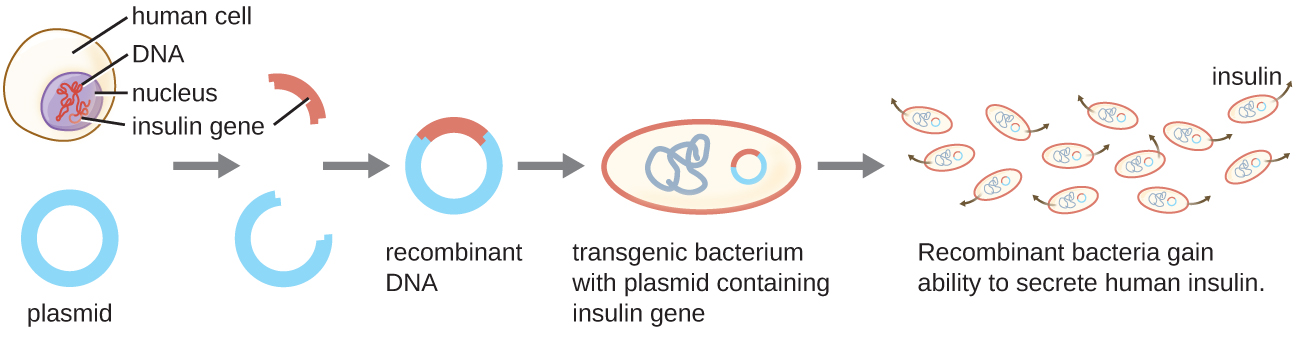
דוגמה אחת למיקרואורגניזם מהונדס היא זן החיידקים המייצר אינסולין אנושי (איור\(\PageIndex{1}\)). גן האינסולין מבני אדם הוכנס לפלסמיד. פלסמיד DNA רקומביננטי זה הוכנס לאחר מכן לחיידקים. כתוצאה מכך, חיידקים מהונדסים אלה מסוגלים לייצר ולהפריש אינסולין אנושי. פרוקריוטים רבים מסוגלים לרכוש DNA זר ולשלב גנים פונקציונליים בגנום שלהם באמצעות "הזדווגות" עם תאים אחרים (צימוד), זיהום ויראלי (התמרה) וקליטת DNA מהסביבה (טרנספורמציה). נזכיר שמנגנונים אלה הם דוגמאות להעברת גנים אופקית - העברת חומר גנטי בין תאים מאותו דור.
שיבוט מולקולרי
הרברט בויר וסטנלי כהן הדגימו לראשונה את תהליך השיבוט המולקולרי המלא בשנת 1973 כאשר שיבטו בהצלחה גנים מהצפרדע הטופר האפריקאית (Xenopus laevis) לפלסמיד חיידקי שהוכנס לאחר מכן למארח החיידקים Escherichia coli. שיבוט מולקולרי הוא מערך של שיטות המשמשות לבניית DNA רקומביננטי ושילובו באורגניזם מארח; הוא עושה שימוש במספר כלים מולקולריים שמקורם במיקרואורגניזמים.
אנזימי הגבלה וליגאזות
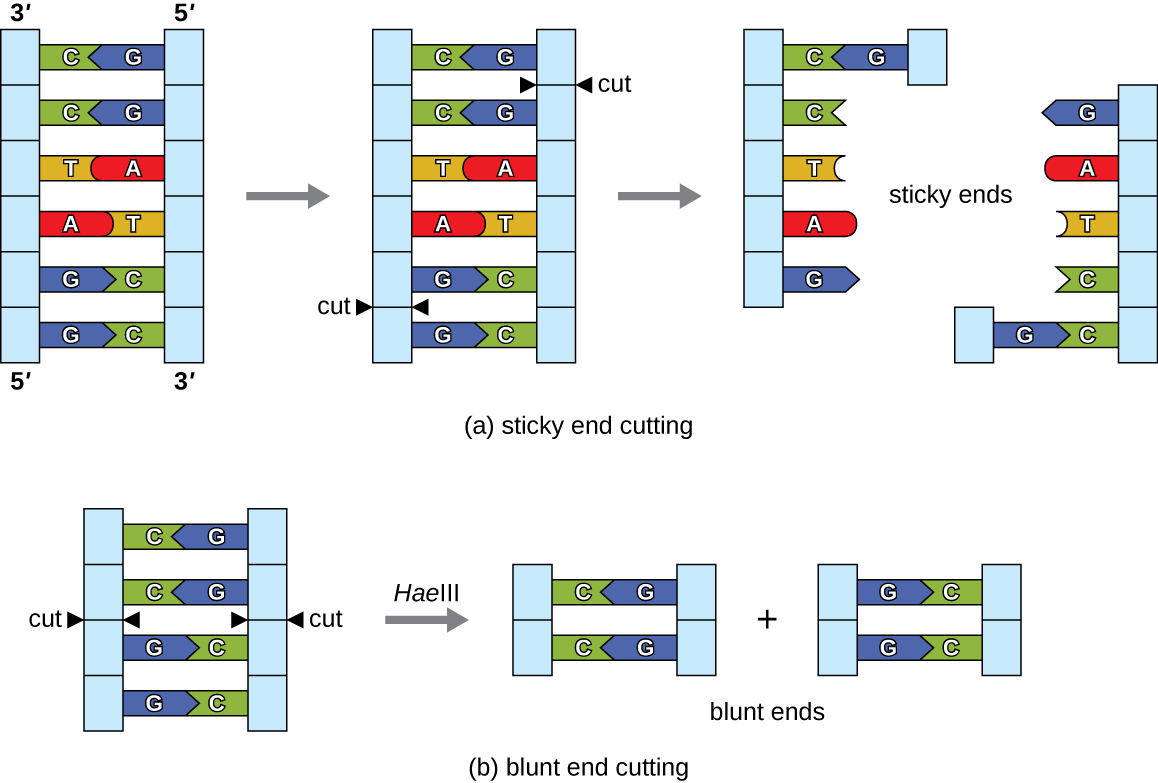
בטכנולוגיית DNA רקומביננטי, מולקולות DNA עוברות מניפולציה באמצעות אנזימים טבעיים שמקורם בעיקר מחיידקים ווירוסים. יצירת מולקולות DNA רקומביננטיות אפשרית עקב שימוש באנדונוקלאזות הגבלה טבעיות (אנזימי הגבלה), אנזימים חיידקיים המיוצרים כמנגנון הגנה לחיתוך והשמדת DNA ציטופלזמי זר שהוא לרוב תוצאה של זיהום בקטריופאג '. סטיוארט לין וורנר ארבר גילו אנזימי הגבלה במחקריהם משנות השישים של האופן שבו E. coli מגביל את שכפול הבקטריופאגים בזיהום. כיום, אנו משתמשים באנזימי הגבלה בהרחבה לחיתוך שברי DNA שניתן לאחר מכן לחבר למולקולת DNA אחרת ליצירת מולקולות רקומביננטיות. כל אנזים הגבלה חותך DNA באתר זיהוי אופייני, רצף DNA ספציפי, בדרך כלל פלינדרומי, בדרך כלל באורך של בין ארבעה לשישה זוגות בסיסים. פלינדרום הוא רצף של אותיות שקורא אותו קדימה כמו אחורה. (המילה "רמה" היא דוגמה לפלינדרום.) רצפי DNA פלינדרומיים מכילים את אותם רצפי בסיס בכיוון 5עד 3על גדיל אחד כמו בכיוון 5עד 3על הגדיל המשלים. אנזים הגבלה מזהה את פלינדרום ה- DNA וחותך כל עמוד שדרה במיקומים זהים בפלינדרום. חלק מאנזימי ההגבלה חותכים כדי לייצר מולקולות בעלות תלייה משלימה (קצוות דביקים) בעוד שאחרים חותכים מבלי ליצור תליונים כאלה, במקום לייצר קצוות בוטים (איור\(\PageIndex{2}\)).
מולקולות בעלות קצוות דביקים משלימים יכולות לחשל בקלות, או ליצור קשרי מימן בין בסיסים משלימים, בקצותיהן הדביקים. שלב החישול מאפשר הכלאה של התלויים החד-גדיליים. הכלאה מתייחסת לחיבור של שני גדילים בודדים משלימים של DNA. קצוות בוטים יכולים גם להתחבר זה לזה, אך פחות יעיל מקצוות דביקים בגלל היעדר מתלים משלימים המקלים על התהליך. בכל מקרה, קשירהבאמצעות ליגאז DNA יכולה לאחר מכן לחבר מחדש את שני עמודי השדרה של הסוכר-פוספט של ה-DNA באמצעות קשר קוולנטי, מה שהופך את המולקולה לגדיל כפול רציף. בשנת 1972, פול ברג, ביוכימאי מסטנפורד, היה הראשון שייצר מולקולת DNA רקומביננטית בטכניקה זו, המשלבת את נגיף הקוף SV40 עם E. coli bacteriophage lambda ליצירת הכלאה.
פלסמידים
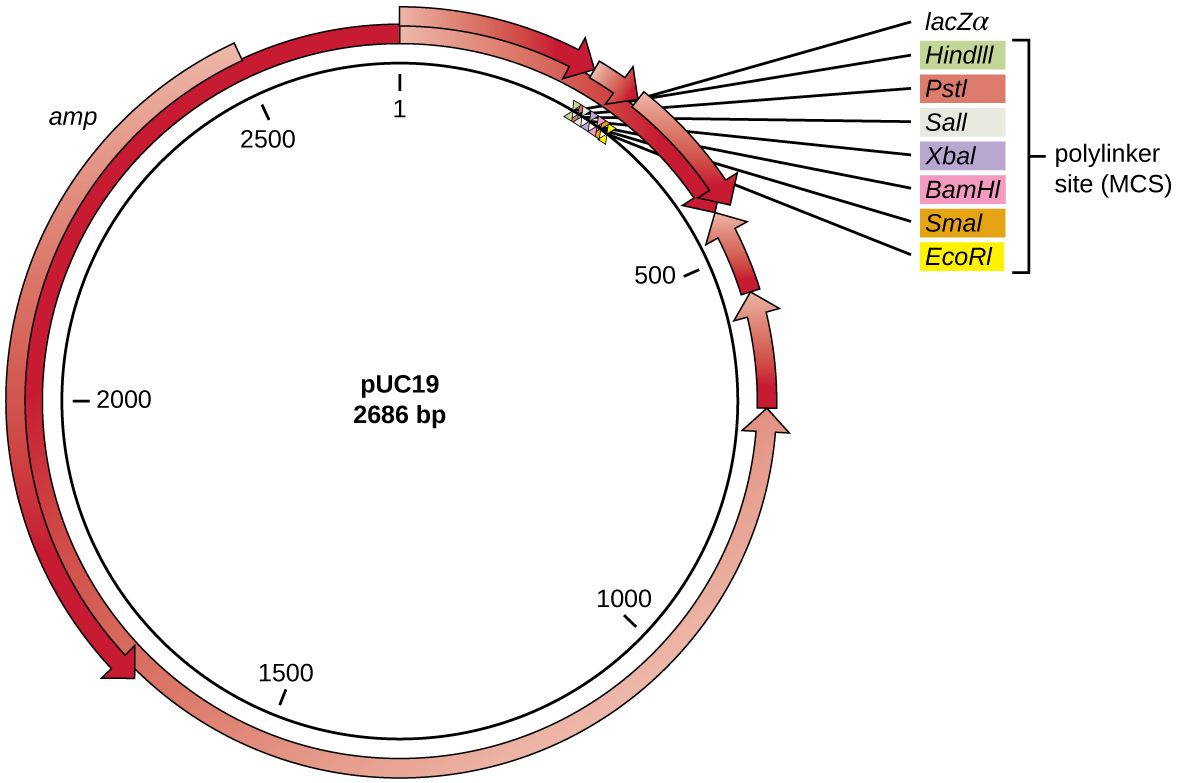
לאחר עיכול הגבלה, גנים מעניינים מוכנסים בדרך כלל לפלסמידים, חתיכות קטנות של DNA מעגלי דו-גדילי בדרך כלל המשתכפלים ללא תלות בכרומוזום החיידקי (ראה מאפיינים ייחודיים של תאים פרוקריוטיים). בטכנולוגיית DNA רקומביננטי, פלסמידים משמשים לעתים קרובות כווקטורים, מולקולות DNA הנושאות שברי DNA מאורגניזם אחד למשנהו. פלסמידים המשמשים כווקטורים יכולים להיות מהונדסים גנטית על ידי חוקרים וחברות אספקה מדעיות כדי שיהיו להם תכונות מיוחדות, כפי שמודגם על ידי וקטור הפלסמיד הנפוץ pUC19 (איור). \(\PageIndex{3}\) כמה וקטורי פלסמיד מכילים גנים המעניקים עמידות לאנטיביוטיקה; גנים עמידים אלה מאפשרים לחוקרים למצוא בקלות מושבות המכילות פלסמיד על ידי ציפוין על מדיה המכילה את האנטיביוטיקה המתאימה. האנטיביוטיקה הורגת את כל תאי המארח שאינם מכילים את וקטור הפלסמיד הרצוי, אך אלה המכילים את הווקטור מסוגלים לשרוד ולצמוח.
לווקטורי פלסמיד המשמשים לשיבוט יש בדרך כלל אתר פולילינקר, או אתר שיבוט מרובה (MCS). אתר פולילינקר הוא רצף קצר המכיל מספר אתרי זיהוי אנזימי הגבלה ייחודיים המשמשים להחדרת DNA לפלסמיד לאחר עיכול הגבלה הן של ה-DNA והן של הפלסמיד. קיום אתרי זיהוי אנזימי הגבלה מרובים אלה בתוך אתר הפולילינקר הופך את וקטור הפלסמיד למגוון, כך שניתן להשתמש בו לניסויי שיבוט רבים ושונים הכוללים אנזימי הגבלה שונים.
אתר פולילינקר זה נמצא לעתים קרובות בתוך גן מדווח, רצף גנים נוסף שהונדס באופן מלאכותי לתוך הפלסמיד המקודד לחלבון המאפשר הדמיה של החדרת DNA. הגן הכתב מאפשר לחוקר להבחין בין תאי מארח המכילים פלסמידים רקומביננטיים עם שברי DNA משובטים מתאי מארח המכילים רק את וקטור הפלסמיד הלא רקומביננטי. גן הכתב הנפוץ ביותר המשמש בווקטורי פלסמיד הוא הגן החיידקי lacZ המקודד לבטא-גלקטוזידאז, אנזים שמפרק באופן טבעי לקטוז אך יכול גם לפרק X-gal אנלוגי סינתטי חסר צבע, ובכך לייצר מושבות כחולות על מדיה המכילה X-Gal. הגן הכתב lacZ מושבת כאשר ה-DNA הרקומביננטי מחובר לתוך הפלסמיד. מכיוון שחלבון lacZ אינו מיוצר כאשר הגן מושבת, X-gal אינו מתפרק ומיוצרות מושבות לבנות, אשר לאחר מכן ניתן לבודד. שיטת סינון כחול-לבן זו מתוארת מאוחר יותר ומוצגת באיור\(\PageIndex{4}\). בנוסף לתכונות אלה, חלק מהפלסמידים מגיעים מעוכלים מראש ועם אנזים המקושר לפלסמיד הלינארי כדי לסייע בקשירה לאחר החדרת שברי DNA זרים.
שיבוט מולקולרי באמצעות טרנספורמציה
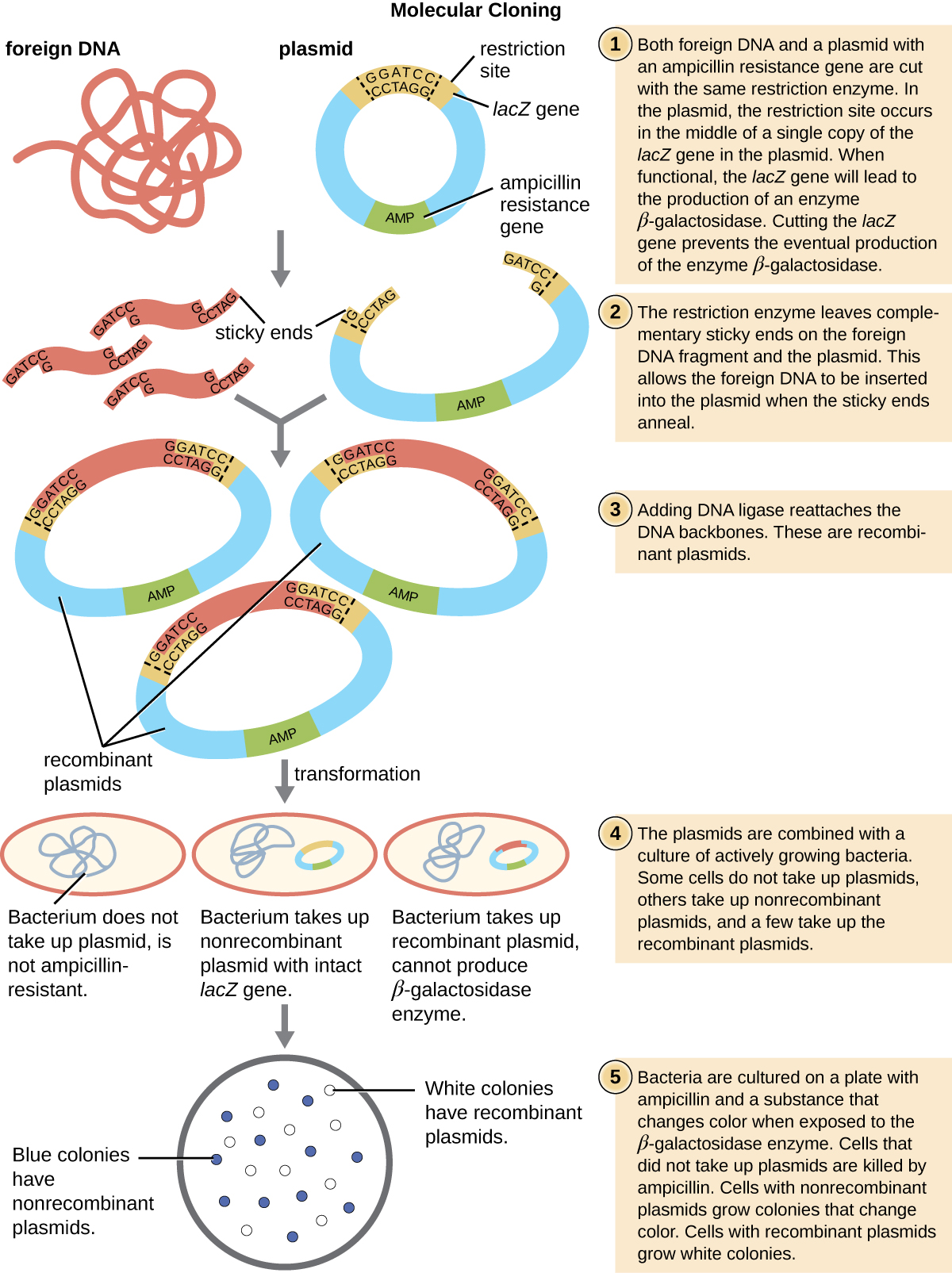
המנגנון הנפוץ ביותר להחדרת פלסמידים מהונדסים לתא חיידקי הוא טרנספורמציה, תהליך שבו חיידקים קולטים DNA חופשי מסביבתם. בטבע, DNA חופשי מגיע בדרך כלל מתאי חיידקים מלוזים אחרים; במעבדה, DNA חופשי בצורת פלסמידים רקומביננטיים מוצג לסביבת התא.
חיידקים מסוימים, כגון Bacillus spp., הם מוכשרים באופן טבעי, כלומר הם מסוגלים לקלוט DNA זר. עם זאת, לא כל החיידקים מוכשרים באופן טבעי. ברוב המקרים, יש להפוך את החיידקים למוכשרים באופן מלאכותי במעבדה על ידי הגברת החדירות של קרום התא. ניתן להשיג זאת באמצעות טיפולים כימיים המנטרלים מטענים על קרום התא או על ידי חשיפת החיידקים לשדה חשמלי היוצר נקבוביות מיקרוסקופיות בקרום התא. שיטות אלה מניבות חיידקים בעלי יכולת כימית או אלקטרו-קומפטנט, בהתאמה.
בעקבות פרוטוקול הטרנספורמציה, תאים חיידקיים מצופים על מדיום המכיל אנטיביוטיקה כדי לעכב את הצמיחה של התאים המארחים הרבים שלא השתנו על ידי הפלסמיד המעניק עמידות לאנטיביוטיקה. לאחר מכן משתמשים בטכניקה הנקראת סינון כחול-לבן עבור וקטורי פלסמיד המקודדים LacZ כגון pUC19. למושבות כחולות יש אנזים בטא-גלקטוזידאז פונקציונלי מכיוון שהגן lacZ אינו מופרע, ללא DNA זר המוחדר לאתר הפולילינקר. מושבות אלה נובעות בדרך כלל מהפלסמיד המעוכל והלינארי מחדש לעצמו. עם זאת, למושבות לבנות חסר אנזים בטא-גלקטוזידאז פונקציונלי, המצביע על החדרת DNA זר לאתר הפולילינקר של וקטור הפלסמיד, ובכך משבש את הגן lacZ. לפיכך, מושבות לבנות הנובעות מהקרנה כחולה-לבנה זו מכילות פלסמידים עם תוספת וניתן לסנן אותן עוד יותר כדי לאפיין את ה-DNA הזר. כדי להיות בטוח שה-DNA הנכון שולב בפלסמיד, לאחר מכן ניתן לרצף את הוספת ה-DNA.
צפה באנימציה של שיבוט מולקולרי ממרכז הלמידה של DNA.
תרגיל \(\PageIndex{2}\)
בהקרנה כחולה-לבנה, מה המשמעות של מושבה כחולה ומדוע היא כחולה?
שיבוט מולקולרי באמצעות צימוד או התמרה
ניתן לתפעל את התהליך החיידקי של הצמידה (ראה כיצד פרוקריוטים א-מיניים משיגים גיוון גנטי) לשיבוט מולקולרי. פלסמידים F, או פלסמידים פוריות, מועברים בין תאי חיידקים בתהליך של צימוד. ניתן להעביר DNA רקומביננטי על ידי צימוד כאשר תאים חיידקיים המכילים פלסמיד F רקומביננטי מעורבבים עם תאים חיידקיים תואמים חסרי הפלסמיד. פלסמידים F מקודדים למבנה פני השטח הנקרא F pilus המאפשר מגע בין תא המכיל פלסמיד F ואחד ללא פלסמיד F. במגע נוצר גשר ציטופלזמי בין שני התאים והתא המכיל פלסמיד F משכפל את הפלסמיד שלו, ומעביר עותק של פלסמיד F רקומביננטי לתא הנמען. לאחר שקיבל את פלסמיד F רקומביננטי, התא הנמען יכול לייצר פילוס F משלו ולהקל על העברת פלסמיד F רקומביננטי לתא נוסף. השימוש בצימוד להעברת פלסמידים F רקומביננטיים לתאי הנמען הוא דרך יעילה נוספת להחדרת מולקולות DNA רקומביננטיות לתאי המארח.
לחלופין, ניתן להשתמש בבקטריופאגים להחדרת DNA רקומביננטי לתאי חיידקים מארחים באמצעות מניפולציה של תהליך ההולכה (ראה כיצד פרוקריוטים א-מיניים משיגים גיוון גנטי). במעבדה ניתן להנדס שברי DNA מעניינים לפגמידים, שהם פלסמידים שיש להם רצפי פאגים המאפשרים לארוז אותם בבקטריופאגים. לאחר מכן ניתן להידבק בתאים חיידקיים בבקטריופאגים אלה כך שניתן יהיה להכניס את הפאגמידים הרקומביננטיים לתאי החיידק. בהתאם לסוג הפאג, ה-DNA הרקומביננטי עשוי להשתלב בגנום החיידקי המארח (ליזוגניה), או שהוא עשוי להתקיים כפלסמיד בציטופלזמה של המארח.
תרגיל \(\PageIndex{2}\)
- מה תפקידו המקורי של אנזים הגבלה?
- אילו שני תהליכים מנוצלים כדי להכניס DNA רקומביננטי לתא מארח חיידקי?
- הבחין בין השימושים של גן עמידות לאנטיביוטיקה וגן מדווח בווקטור פלסמיד.
יצירת ספרייה גנומית
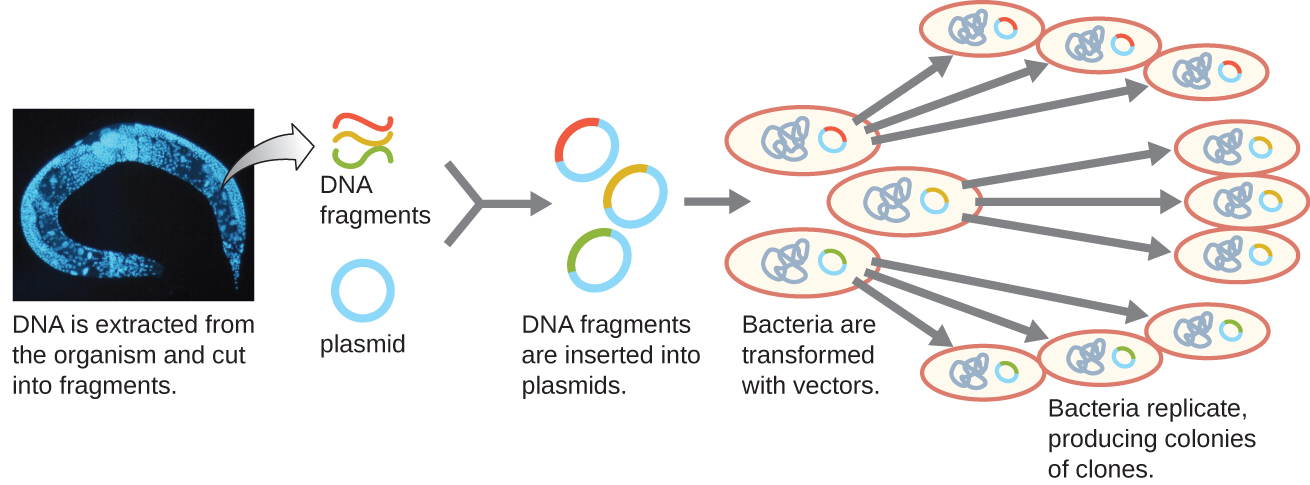
שיבוט מולקולרי עשוי לשמש גם ליצירת ספרייה גנומית. הספרייה היא עותק שלם (או כמעט שלם) של הגנום של אורגניזם הכלול כפלסמידים DNA רקומביננטיים שהונדסו לשיבוטים ייחודיים של חיידקים. קיום ספרייה כזו מאפשר לחוקר ליצור כמויות גדולות של כל שבר על ידי גידול המארח החיידקי עבור אותו שבר. ניתן להשתמש בשברים אלה כדי לקבוע את רצף ה- DNA ואת תפקודם של כל הגנים הקיימים.
שיטה אחת ליצירת ספרייה גנומית היא לקשור שברים גנומיים מעוכלים באנזים הגבלה בודדים לוקטורים פלסמידים שנחתכו עם אותו אנזים הגבלה (איור). \(\PageIndex{5}\) לאחר הפיכתו למארח חיידקי, כל תא חיידקי שעבר טרנספורמציה תופס פלסמיד רקומביננטי יחיד וגדל למושבה של תאים. כל התאים במושבה זו הם שיבוטים זהים ונושאים את אותו פלסמיד רקומביננטי. הספרייה המתקבלת היא אוסף של מושבות, שכל אחת מהן מכילה שבר מהגנום של האורגניזם המקורי, שכל אחת מהן נפרדת ומובחנת וניתן להשתמש בהן למחקר נוסף. זה מאפשר לחוקרים לסנן את השיבוטים השונים הללו כדי לגלות את זה המכיל גן מעניין מהגנום של האורגניזם המקורי.
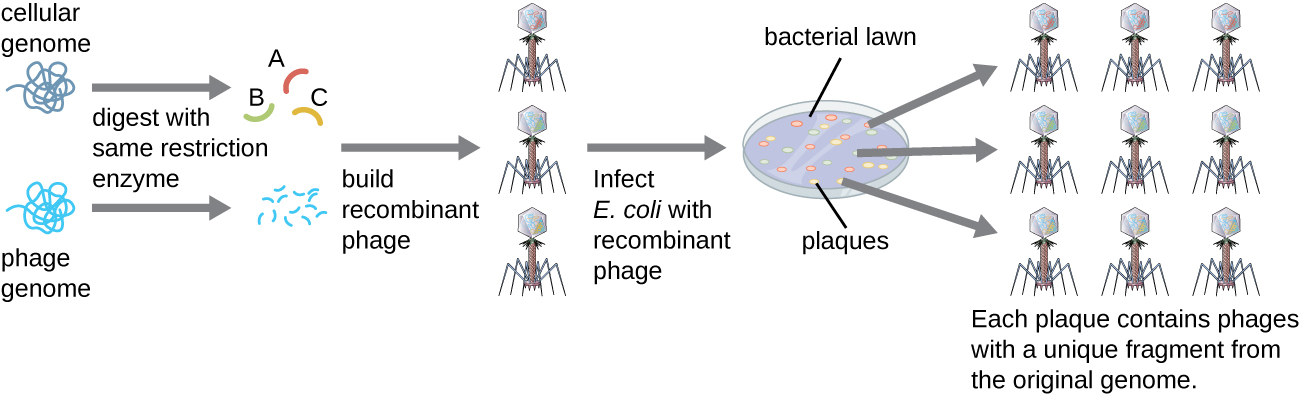
כדי לבנות ספרייה גנומית באמצעות שברים גדולים יותר של DNA גנומי, חיידק E. coli, כגון למבדה, יכול לשמש כמארח (איור). \(\PageIndex{6}\) ניתן לגזור DNA גנומי או לעכל אנזימטית ולקשור אותו לווקטור DNA של בקטריופאג למבדה מעוכל מראש. לאחר מכן, ניתן לארוז את מולקולות ה-DNA הפאג' רקומביננטיות הללו לחלקיקי פאג ולהשתמש בהן להדבקת תאי מארח E. coli בצלחת. במהלך ההדבקה בתוך כל תא, כל פאג רקומביננטי ייצור עותקים רבים של עצמו ויעשה את מדשאת E. coli, ויוצר רובד. לפיכך, כל רובד מספריית פאגים מייצג פאג רקומביננטי ייחודי המכיל שבר DNA גנומי מובהק. לאחר מכן ניתן לבדוק את הלוחות עוד יותר כדי לחפש גנים מעניינים. יתרון אחד לייצור ספרייה באמצעות פאגים במקום פלסמידים הוא שחלקיק פאג מכיל הכנסה גדולה בהרבה של DNA זר בהשוואה לווקטור פלסמיד, ובכך דורש מספר קטן בהרבה של תרבויות כדי לייצג באופן מלא את כל הגנום של האורגניזם המקורי.
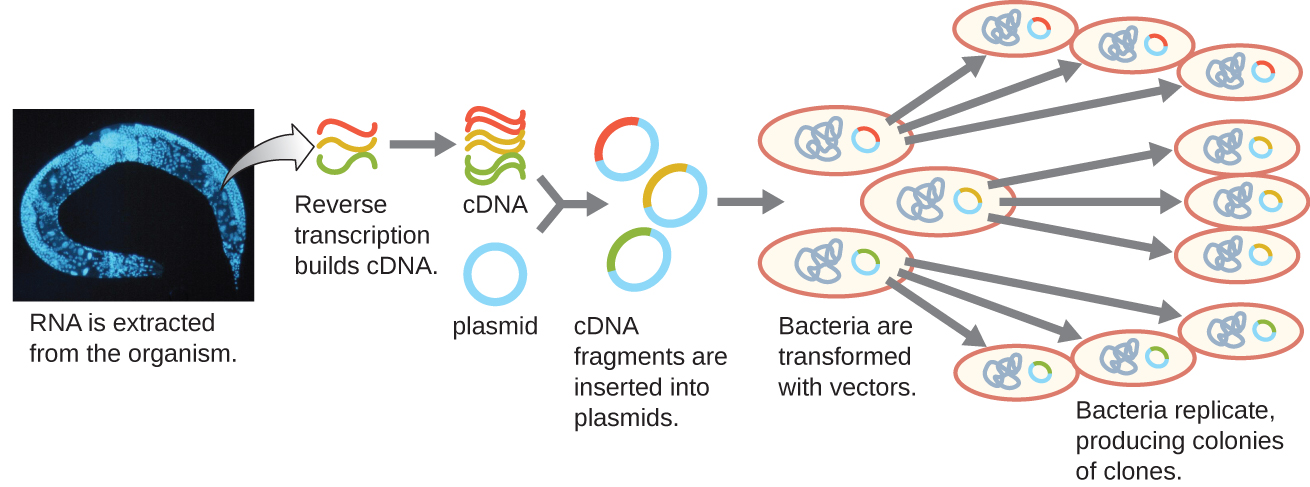
כדי להתמקד בגנים המובעים באורגניזם או אפילו ברקמה, חוקרים בונים ספריות באמצעות RNA השליח של האורגניזם (mRNA) ולא ב- DNA הגנומי שלו. בעוד שלכל התאים באורגניזם בודד יהיה אותו DNA גנומי, רקמות שונות מבטאות גנים שונים, ומייצרות השלמות שונות של mRNA. לדוגמה, ה- DNA הגנומי של כל התאים האנושיים מכיל את הגן לאינסולין, אך רק תאים בלבלב מבטאים mRNA המכוון את ייצור האינסולין. מכיוון שלא ניתן לשכפל mRNA ישירות, במעבדה יש להשתמש ב-mRNA כתבנית על ידי האנזים הרטרו-ויראלי הפוך טרנסקריפטאז ליצירת DNA משלים (cDNA). ניתן לתמלל הפוך את המשלים המלא של התא של mRNA למולקולות cDNA, אשר יכולות לשמש כתבנית לפולימראז DNA ליצירת עותקי DNA דו-גדילי; לאחר מכן ניתן לקשור שברים אלה לווקטורי פלסמיד או לבקטריופאג כדי לייצר ספריית cDNA. היתרון של ספריית cDNA הוא בכך שהיא מכילה DNA רק מהגנים המובעים בתא. המשמעות היא שהאינטרונים, רצפי הבקרה כגון מקדמים ו-DNA שלא נועדו לתרגם לחלבונים אינם מיוצגים בספרייה. ההתמקדות ברצפים מתורגמים פירושה שלא ניתן להשתמש בספרייה לחקר הרצף והמבנה של הגנום בשלמותו. בניית ספרייה גנומית cDNA מוצגת באיור\(\PageIndex{7}\).
תרגיל \(\PageIndex{3}\)
- מהם המארחים של הספריות הגנומיות המתוארות?
- מה זה cDNA?
הכנסת מולקולות רקומביננטיות למארחים אוקריוטיים
השימוש במארחים חיידקיים להנדסה גנטית הניח את הבסיס לטכנולוגיית DNA רקומביננטי; עם זאת, לחוקרים היה עניין רב גם בהנדסה גנטית של תאים אוקריוטיים, במיוחד אלה של צמחים ובעלי חיים. הכנסת מולקולות DNA רקומביננטיות למארחים אוקריוטיים נקראת טרנספקציה. צמחים מהונדסים גנטית, הנקראים צמחים מהונדסים, הם בעלי עניין משמעותי למטרות חקלאיות ותרופות. הצמח המהונדס הראשון שנמכר באופן מסחרי היה העגבנייה הבשלה מאוחרת של Flavr Savr, שהגיעה לשוק בשנת 1994. בעלי חיים מהונדסים גנטית יוצרו בהצלחה, וכתוצאה מכך, למשל, בחזירים בעלי ערך תזונתי מוגבר 1 ועזים המפרישות מוצרים פרמצבטיים בחלב שלהם. 2
אלקטרופורציה
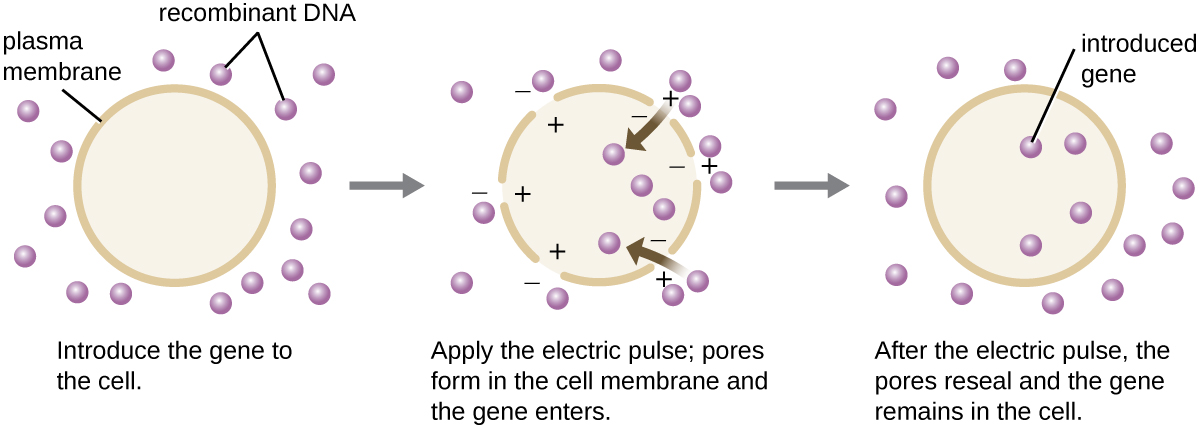
בהשוואה לתאים חיידקיים, תאים אוקריוטיים נוטים להיות פחות נוחים כמארחים למולקולות DNA רקומביננטיות. מכיוון שאאוקריוטים בדרך כלל אינם מוכשרים לקלוט DNA זר ואינם מסוגלים לשמור על פלסמידים, טרנספקציה של מארחים אוקריוטיים מאתגרת הרבה יותר ודורשת טכניקות פולשניות יותר להצלחה. שיטה אחת המשמשת להעברת תאים בתרבית תאים נקראת אלקטרופורציה. דופק חשמלי קצר גורם להיווצרות נקבוביות חולפות בשכבות הפוספוליפידים של התאים שדרכן ניתן להכניס את הגן. במקביל, הדופק החשמלי מייצר מטען חיובי קצר מועד בצד אחד של פנים התא ומטען שלילי בצד הנגדי; הפרש המטען מושך מולקולות DNA טעונות שלילי לתא (איור\(\PageIndex{8}\)).
הזרקת מיקרו
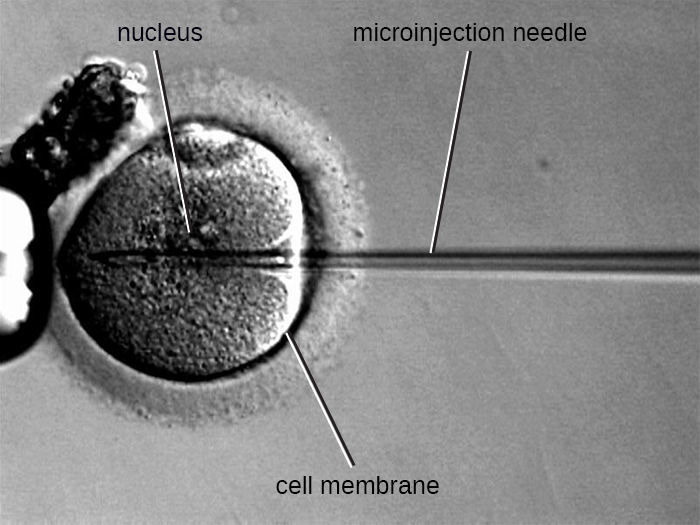
שיטה חלופית של טרנספקטציה נקראת מיקרו-הזרקה. מכיוון שתאים אוקריוטיים בדרך כלל גדולים יותר מאלו של פרוקריוטים, לפעמים ניתן להזריק שברי DNA ישירות לציטופלזמה באמצעות מיקרופיפט זכוכית, כפי שמוצג באיור. \(\PageIndex{9}\)
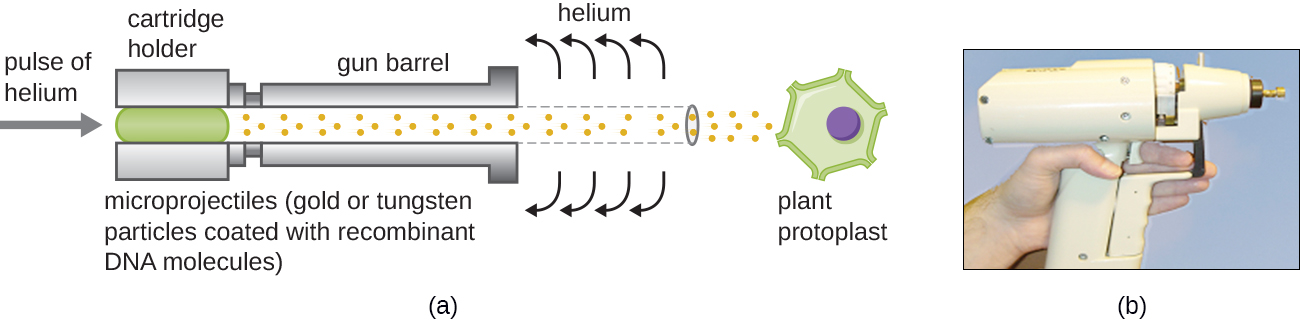
אקדחי ג'ין
העברת תאי צמחים יכולה להיות קשה אפילו יותר מתאי בעלי חיים בגלל דפנות התא העבות שלהם. גישה אחת כוללת טיפול בתאי צמחים באנזימים להסרת דפנות התא שלהם, ייצור פרוטופלסטים. לאחר מכן, אקדח גנים משמש לירות חלקיקי זהב או טונגסטן מצופים במולקולות DNA רקומביננטיות לתוך פרוטופלסטים צמחיים במהירויות גבוהות. תאי פרוטופלסט הנמען יכולים להתאושש ולהשתמש בהם ליצירת צמחים מהונדסים חדשים (איור). \(\PageIndex{10}\)
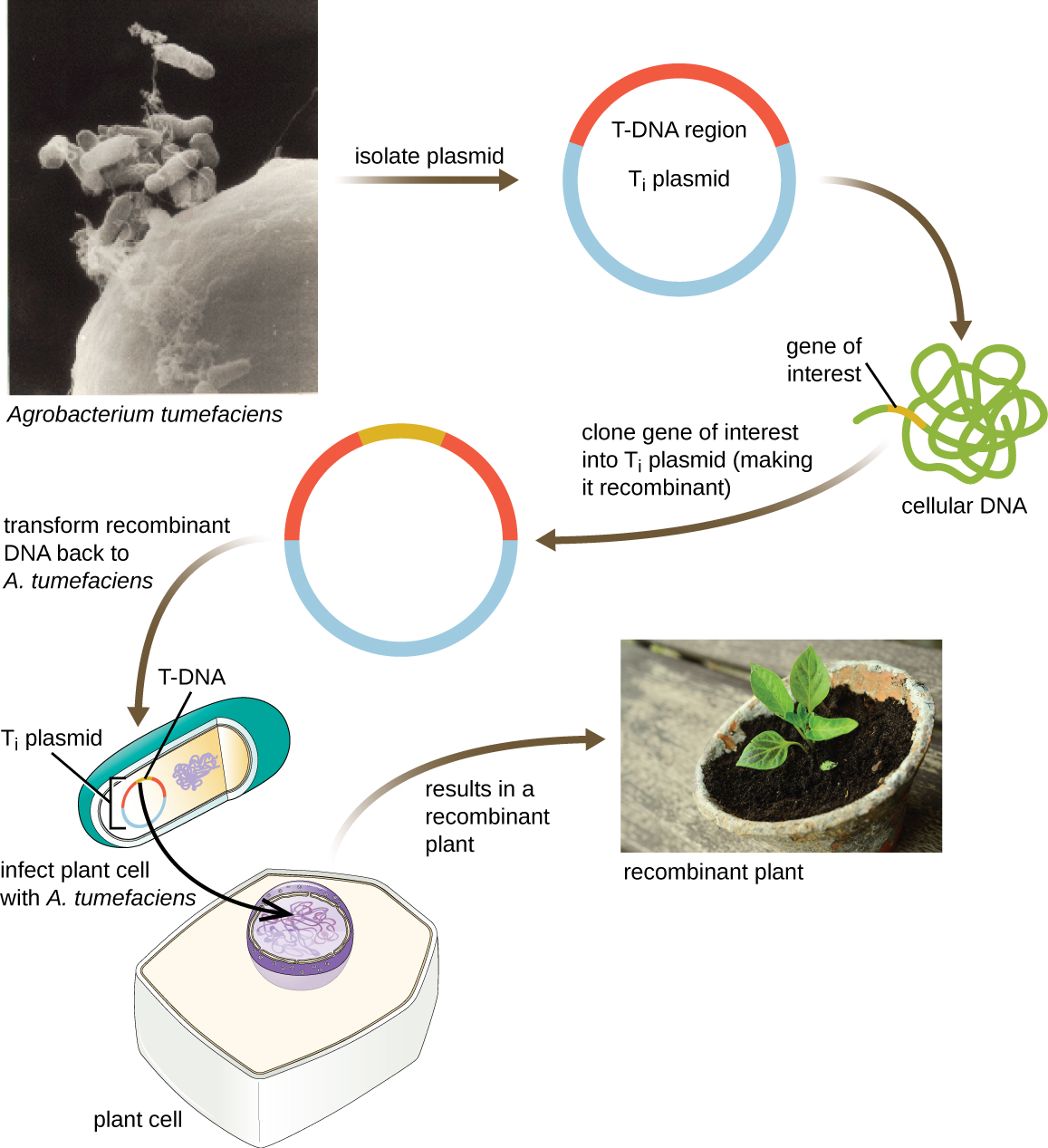
וקטורי מעבורת
שיטה נוספת להעברת צמחים כוללת וקטורי מעבורת, פלסמידים שיכולים לנוע בין תאים חיידקיים לאיקריוטים. הפלסמידים מעוררי הגידול (T i) שמקורם בחיידק Agrobacterium tumefaciens משמשים בדרך כלל כווקטורי מעבורת לשילוב גנים בצמחים (איור). \(\PageIndex{11}\) בטבע, פלסמידים T i של A. tumefaciens גורמים לצמחים לפתח גידולים כאשר הם מועברים מתאי חיידקים לתאי צמחים. חוקרים הצליחו לתפעל את הפלסמידים הטבעיים הללו כדי להסיר את הגנים הגורמים לגידול שלהם ולהכניס שברי DNA רצויים. ניתן להעביר את פלסמידים T i רקומביננטיים המתקבלים לגנום הצמח באמצעות העברה טבעית של פלסמידים T i מהחיידק למארח הצמח. ברגע שנכנס לתא המארח של הצמח, הגן המעניין מתחבר מחדש לגנום של תא הצמח.
וקטורים ויראליים
וקטורים ויראליים יכולים לשמש גם כדי להעביר תאים אוקריוטיים. למעשה, שיטה זו משמשת לעתים קרובות בטיפול גנטי (ראה טיפול גנטי) להכנסת גנים בריאים לחולים אנושיים הסובלים ממחלות הנובעות ממוטציות גנטיות. ניתן למחוק גנים נגיפיים ולהחליף אותם בגן שיועבר למטופל; 3 הנגיף מדביק אז את התא המארח ומעביר את ה- DNA הזר לגנום של התא הממוקד. אדנווירוסים משמשים לעתים קרובות למטרה זו מכיוון שניתן לגדל אותם לטיטר גבוה ויכולים להדביק תאים מארח שאינם מתחלקים ומתחלקים כאחד. עם זאת, שימוש בוקטורים ויראליים לטיפול גנטי יכול להוות סיכונים מסוימים לחולים, כפי שנדון בטיפול גנטי.
תרגיל \(\PageIndex{4}\)
- מהן השיטות המשמשות להחדרת וקטורי DNA רקומביננטיים לתאי בעלי חיים?
- השווה והשוואה בין וקטורי מעבורת וקטורים ויראליים.
מושגי מפתח וסיכום
- ביוטכנולוגיה היא המדע של ניצול מערכות חיים לטובת האנושות. בשנים האחרונות התאפשרה היכולת לשנות ישירות את הגנום של האורגניזם באמצעות הנדסה גנטית עקב התקדמות בטכנולוגיית ה- DNA רקומביננטי, המאפשרת לחוקרים ליצור מולקולות DNA רקומביננטיות עם שילובים חדשים של חומר גנטי.
- שיבוט מולקולרי כולל שיטות המשמשות לבניית DNA רקומביננטי ולהקל על שכפולן באורגניזמים מארחים. שיטות אלה כוללות שימוש באנזימי הגבלה (לחיתוך DNA זר וגם וקטורי פלסמיד), קשירה (להדבקת שברי DNA יחד) והכנסת DNA רקומביננטי לאורגניזם מארח (לרוב חיידקים).
- סקר כחול-לבן מאפשר בחירה של טרנספורמנטים חיידקיים המכילים פלסמידים רקומביננטיים באמצעות הפנוטיפ של גן מדווח המושבת על ידי החדרת שבר ה- DNA.
- ניתן ליצור ספריות גנומיות על ידי שיבוט שברים גנומיים מאורגניזם אחד לווקטורי פלסמיד או לבקטריופאג '.
- ניתן ליצור ספריות cDNA כדי לייצג את מולקולות ה- mRNA המתבטאות בתא בנקודה נתונה.
- ניתן להשיג טרנספקציה של מארחים אוקריוטיים באמצעות שיטות שונות באמצעות אלקטרופורציה, אקדחי גנים, הזרקת מיקרו, וקטורי מעבורת וקטורים ויראליים.
הערות שוליים
- 1 ליאנגקסו לאי, ג'ינג אקס קאנג, רונגפנג לי, ג'ינג-דונג וואנג, וויליאם טי ויט, הואן יול יונג, יאנהונג האו ואח '. "דור חזירים מהונדסים משובטים העשירים בחומצות שומן אומגה 3." טבע ביוטכנולוגיה 24 מס '4 (2006): 435—436.
- 2 ריילין ראמוס מורה, לוסיאנה מגלהס מלו, וויסנטה חוסה דה פיגוארו פרייטס. "ייצור חלבונים רקומביננטיים בחלב של עזים מהונדסות ולא מהונדסות." הארכיון הברזילאי לביולוגיה וטכנולוגיה 54 מס '5 (2011): 927—938.
- 3 ויליאם ס 'וולד וקארולי טות. "וקטורי אדנווירוס לטיפול גנטי, חיסון וטיפול גנטי בסרטן." טיפול גנטי נוכחי 13 מס '6 (2013): 421.


