7.4: חלבונים
- Page ID
- 209027
מטרות למידה
- תאר את המבנה הבסיסי של חומצת אמינו
- תאר את המבנים הכימיים של חלבונים
- סכמו את המאפיינים הייחודיים של חלבונים
בתחילת פרק זה תואר ניסוי מפורסם בו מדענים סינתזו חומצות אמינו בתנאים המדמים את הנוכחים על פני כדור הארץ הרבה לפני התפתחות החיים כפי שאנו מכירים אותם. תרכובות אלו מסוגלות להתחבר יחד למעשה בכל מספר, ולהניב מולקולות בכל גודל בעצם בעלות מגוון רחב של תכונות פיזיקליות וכימיות ומבצעות פונקציות רבות החיוניות לכל האורגניזמים. המולקולות שמקורן בחומצות אמינו יכולות לתפקד כמרכיבים מבניים של תאים וישויות תת-תאיות, כמקורות לחומרים מזינים, כמאגרי אגירת אטומים ואנרגיה, וכמינים פונקציונליים כגון הורמונים, אנזימים, קולטנים ומולקולות הובלה.
חומצות אמינו וקשרי פפטיד
חומצת אמינו היא מולקולה אורגנית שבה אטום מימן, קבוצת קרבוקסיל (—COOH) וקבוצת אמינו (—NH 2) קשורים כולם לאותו אטום פחמן, מה שנקרא פחמן α. הקבוצה הרביעית הקשורה לפחמן α משתנה בין חומצות האמינו השונות ונקראת א שאריות או שרשרת צדדית, המיוצגת בנוסחאות מבניות על ידי האות R. שארית היא מונומר שנוצר כאשר שתי חומצות אמינו או יותר משלבות ומסירות מולקולות מים. המבנה העיקרי של חלבון, שרשרת פפטיד, עשוי משאריות חומצות אמינו. המאפיינים הייחודיים של הקבוצות הפונקציונליות וקבוצות R מאפשרים למרכיבים אלה של חומצות האמינו ליצור קשרי מימן, יוני ודיסולפיד, יחד עם אינטראקציות קוטביות/לא קוטביות הדרושות ליצירת מבני חלבון משניים, שלישוניים ורבעוניים. קבוצות אלה מורכבות בעיקר מפחמן, מימן, חמצן, חנקן וגופרית, בצורה של פחמימנים, חומצות, אמידים, אלכוהולים ואמינים. כמה דוגמאות הממחישות אפשרויות אלה ניתנות באיור\(\PageIndex{1}\).
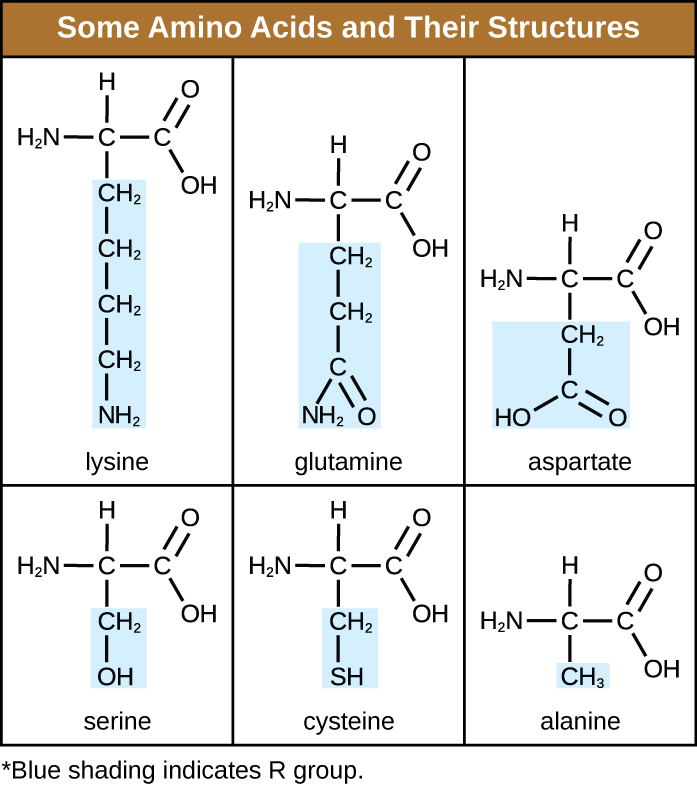
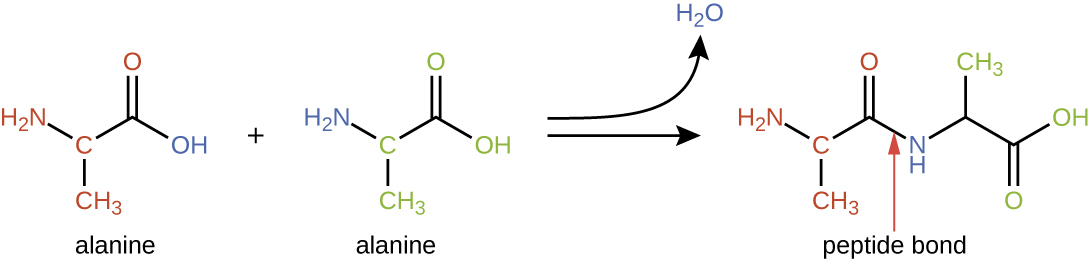
חומצות אמינו עשויות להיקשר כימית יחד על ידי תגובה של קבוצת החומצה הקרבוקסילית של מולקולה אחת עם קבוצת האמין של אחרת. תגובה זו יוצרת קשר פפטיד ומולקולת מים והיא דוגמה נוספת לסינתזת התייבשות (איור\(\PageIndex{2}\)). מולקולות הנוצרות על ידי קישור כימי של מספרים צנועים יחסית של חומצות אמינו (כ-50 או פחות) נקראות פפטידים, וקידומות משמשות לעתים קרובות לציון מספרים אלה: דיפפטידים (שתי חומצות אמינו), טריפפטידים (שלוש חומצות אמינו) וכן הלאה. באופן כללי יותר, המספר המשוער של חומצות אמינו מיועד: אוליגופפטידים נוצרים על ידי חיבור של עד כ-20 חומצות אמינו, ואילו פוליפפטידים מסונתזים מכ-50 חומצות אמינו. כאשר מספר חומצות האמינו המקושרות זו לזו הופך להיות גדול מאוד, או כאשר משתמשים במספר פוליפפטידים כבניית יחידות משנה, המקרומולקולות הנובעות נקראות חלבונים. האורך המשתנה ברציפות (מספר המונומרים) של הביופולימרים הללו, יחד עם מגוון קבוצות ה - R האפשריות על כל חומצת אמינו, מאפשר גיוון כמעט בלתי מוגבל בסוגי החלבונים שעלולים להיווצר.
תרגיל \(\PageIndex{1}\)
כמה חומצות אמינו יש בפוליפפטידים?
מבנה חלבון
הגודל (אורך) ורצף חומצות האמינו הספציפיות של חלבון הם הקובעים העיקריים לצורתו, וצורת החלבון היא קריטית לתפקודו. לדוגמה, בתהליך של קיבוע חנקן ביולוגי (ראה מחזורים ביוגיאוכימיים), מיקרואורגניזמים בקרקע הידועים ביחד בשם rhizobia מקיימים אינטראקציה סימביוטית עם שורשים של צמחי קטניות כגון פולי סויה, בוטנים או שעועית ליצירת מבנה חדש הנקרא גוש על שורשי הצמח. לאחר מכן הצמח מייצר חלבון נשא הנקרא leghemoglobin, חלבון הנושא חנקן או חמצן. Leghemoglobin נקשר עם זיקה גבוהה מאוד לחמצן המצע שלו באזור מסוים של החלבון שבו הצורה ורצף חומצות האמינו מתאימים (האתר הפעיל). אם הצורה או הסביבה הכימית של האתר הפעיל משתנים, אפילו מעט, ייתכן שהמצע לא יוכל להיקשר באותה עוצמה, או שהוא עלול לא להיקשר כלל. לפיכך, כדי שהחלבון יהיה פעיל לחלוטין, עליו להיות בעל הצורה המתאימה לתפקודו.
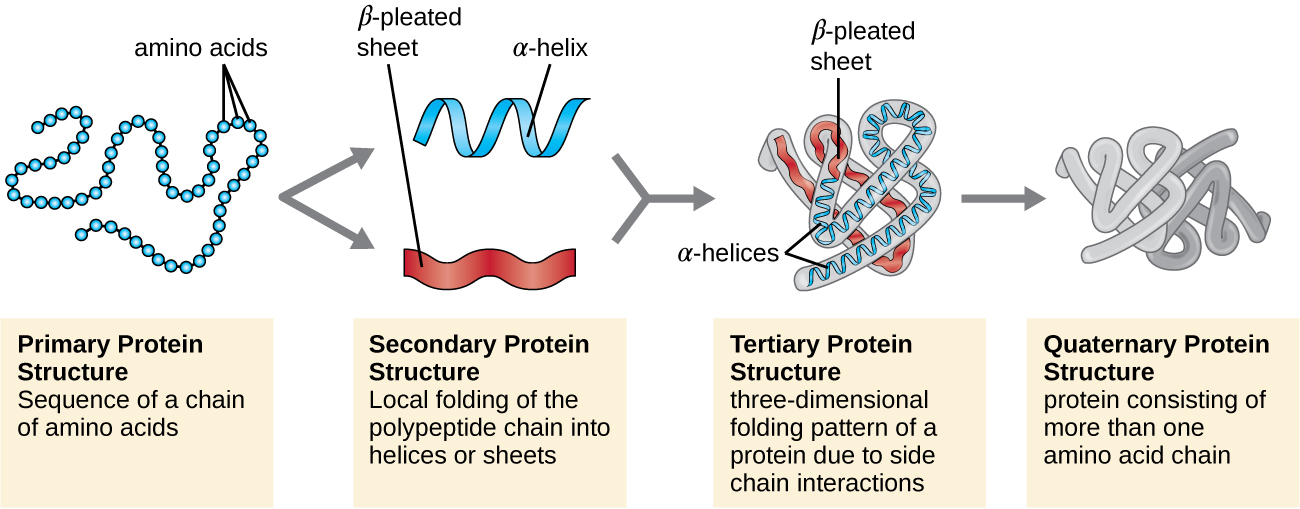
מבנה החלבון מסווג במונחים של ארבע רמות: ראשוני, משני, שלישוני ורבעוני. המבנה העיקרי הוא פשוט רצף חומצות האמינו המרכיבות את שרשרת הפוליפפטיד. איור \(\PageIndex{3}\) מתאר את המבנה העיקרי של חלבון.
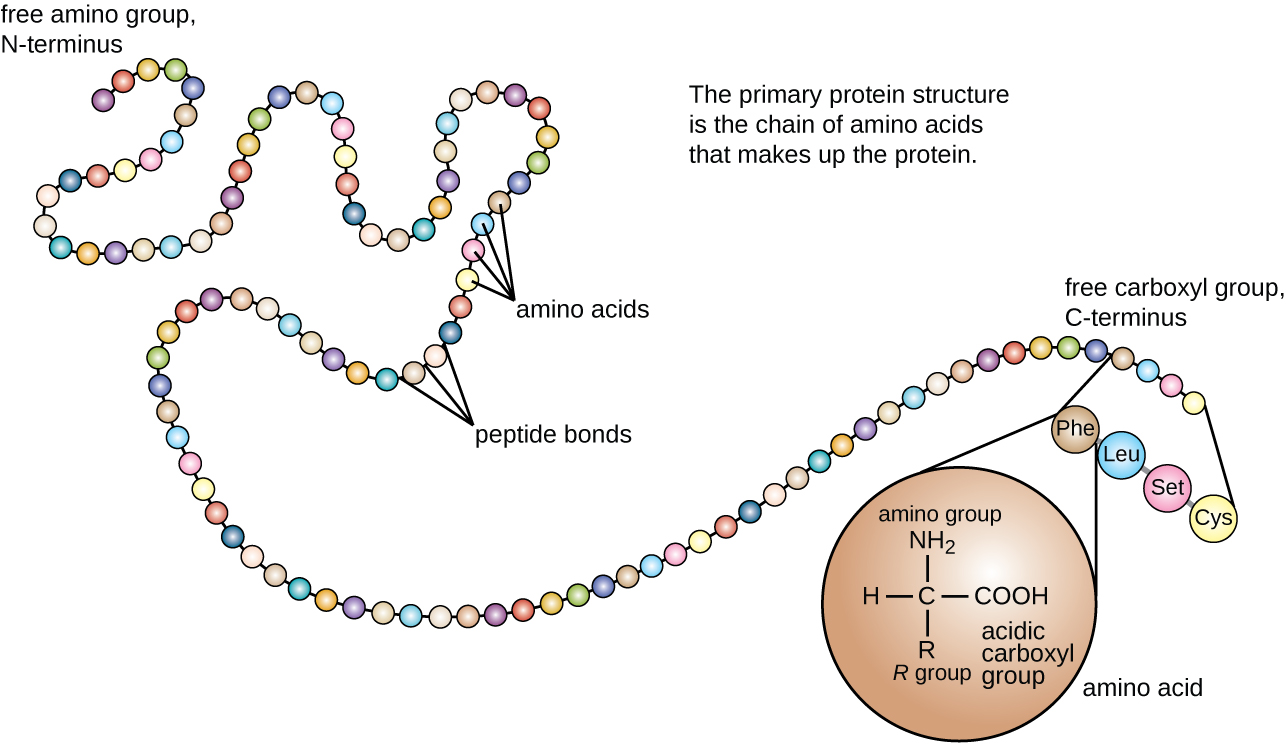
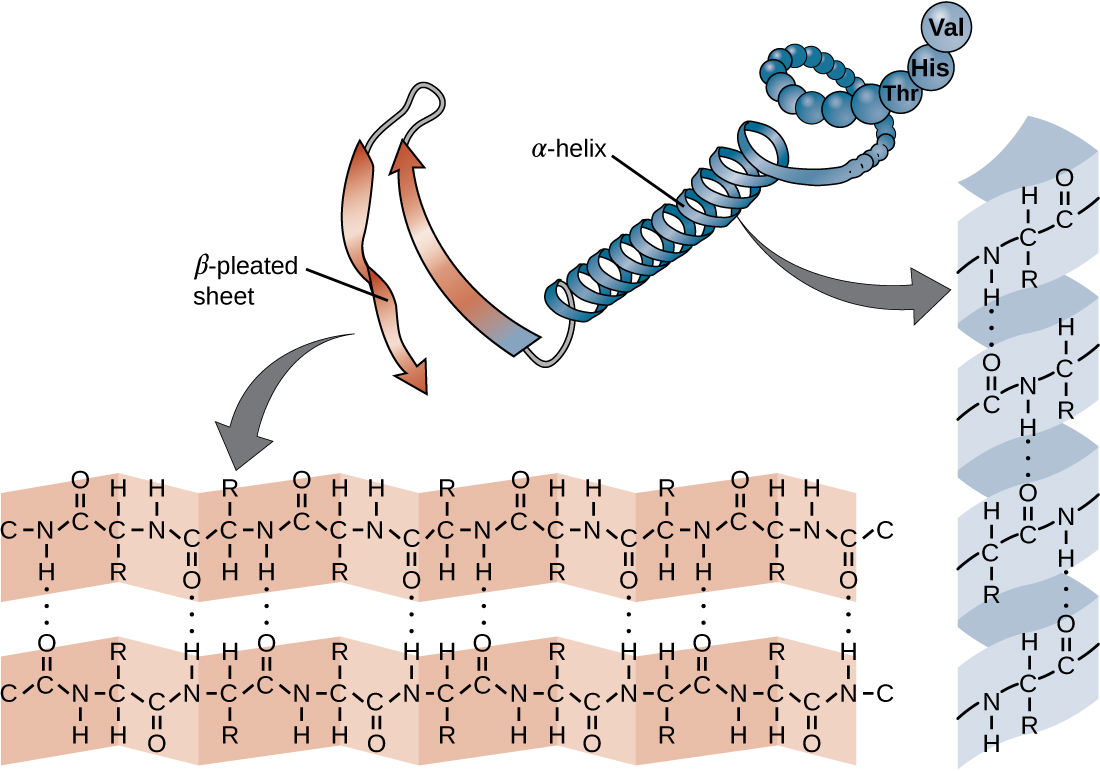
שרשרת חומצות האמינו המגדירה את המבנה העיקרי של חלבון אינה נוקשה, אלא גמישה בגלל אופי הקשרים המחזיקים את חומצות האמינו יחד. כאשר השרשרת ארוכה מספיק, עלול להתרחש קשר מימן בין קבוצות פונקציונליות של אמין וקרבוניל בתוך עמוד השדרה של הפפטיד (למעט קבוצת הצד R), וכתוצאה מכך קיפול מקומי של שרשרת הפוליפפטיד לסלילים ויריעות. צורות אלו מהוות את המבנה המשני של חלבון. המבנים המשניים הנפוצים ביותר הם יריעת α-helix ו-β-קפלים. במבנה α-helix, הסליל מוחזק על ידי קשרי מימן בין אטום החמצן בקבוצת קרבוניל של חומצת אמינו אחת לבין אטום המימן של קבוצת האמינו שנמצא רק ארבע יחידות חומצות אמינו רחוקות יותר לאורך השרשרת. בגיליון הקפלים β, הקפלים נוצרים על ידי קשרי מימן דומים בין רצפים רציפים של קרבוניל וקבוצות אמינו המופרדות עוד יותר על עמוד השדרה של שרשרת הפוליפפטיד (איור). \(\PageIndex{4}\)
הרמה הבאה של ארגון החלבון היא המבנה השלישוני, שהוא הצורה התלת מימדית בקנה מידה גדול של שרשרת פוליפפטיד אחת. המבנה השלישוני נקבע על ידי אינטראקציות בין שאריות חומצות אמינו המרוחקות זו מזו בשרשרת. מגוון אינטראקציות מולידות מבנה שלישוני חלבון, כגון גשרי דיסולפיד, שהם קשרים בין הקבוצות הפונקציונליות sulfhydryl (-SH) בקבוצות צד של חומצות אמינו; קשרי מימן; קשרים יוניים; ואינטראקציות הידרופוביות בין שרשראות צד לא קוטביות. כל האינטראקציות הללו, חלשות וחזקות, משתלבות כדי לקבוע את הצורה התלת מימדית הסופית של החלבון ותפקודו (איור\(\PageIndex{5}\)).
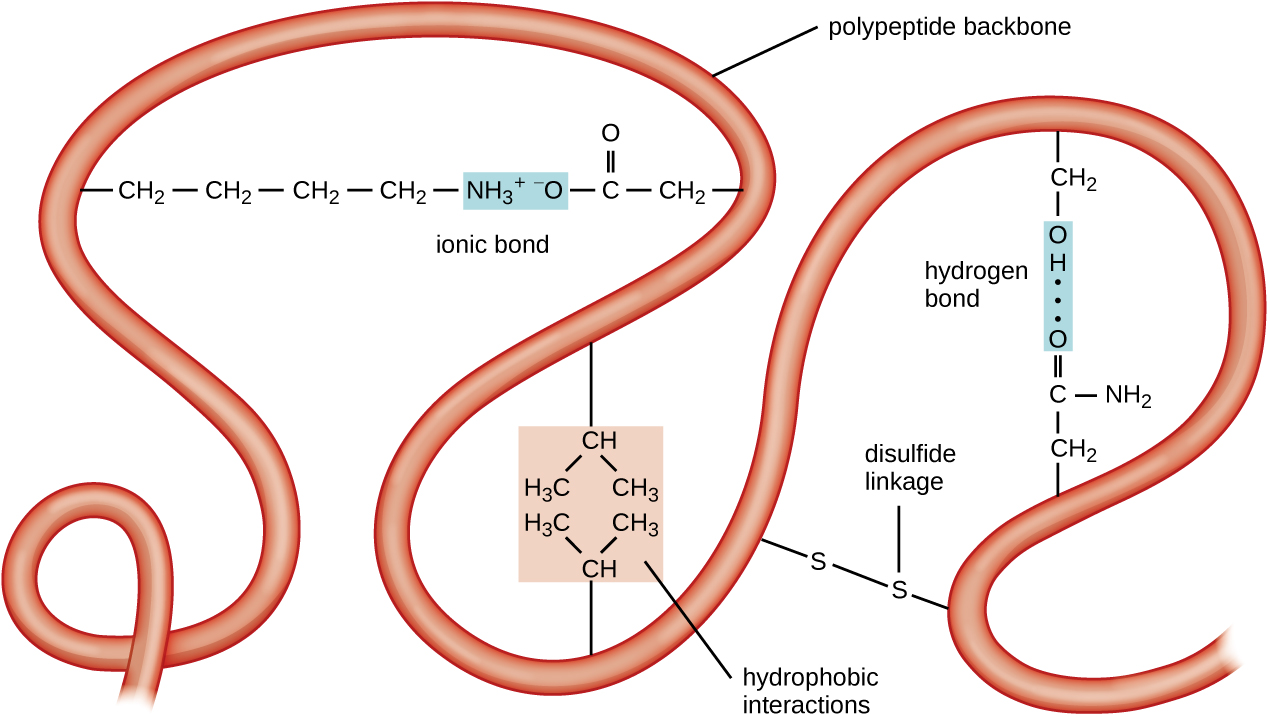
התהליך שבו שרשרת פוליפפטיד מקבלת צורה תלת מימדית בקנה מידה גדול נקרא קיפול חלבונים. אומרים כי חלבונים מקופלים המתפקדים במלואם בתפקידם הביולוגי הרגיל הם בעלי מבנה מקומי. כאשר חלבון מאבד את צורתו התלת מימדית, יתכן שהוא כבר לא מתפקד. חלבונים אלה שנפרשו עוברים דנטורציה. דנטורציה מרמזת על אובדן המבנה המשני והמבנה השלישוני (ואם קיים, המבנה הרבעוני) ללא אובדן המבנה הראשוני.
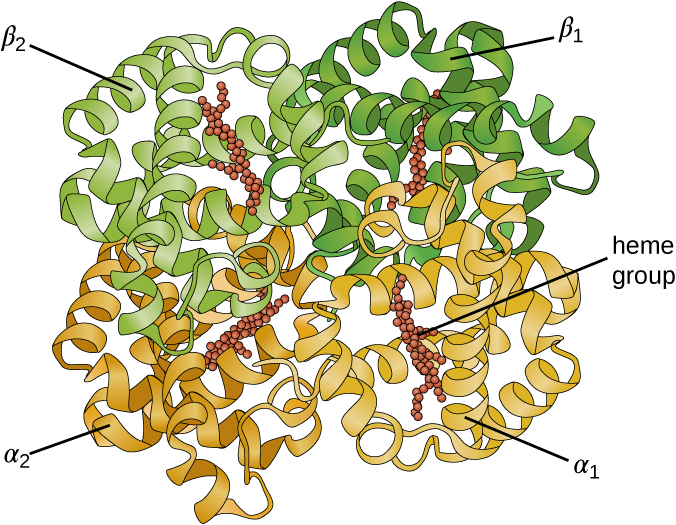
חלק מהחלבונים הם מכלולים של מספר פוליפפטידים נפרדים, הידועים גם בשם תת-יחידות חלבון. חלבונים אלה מתפקדים כראוי רק כאשר כל יחידות המשנה קיימות ומוגדרות כראוי. האינטראקציות המחזיקות את יחידות המשנה הללו יחד מהוות את המבנה הרבעוני של החלבון. המבנה הרבעוני הכולל מיוצב על ידי אינטראקציות חלשות יחסית. להמוגלובין, למשל, יש מבנה רבעוני של ארבע יחידות משנה של חלבון כדורי: שני α ושני פוליפפטידים β, שכל אחד מהם מכיל heme מבוסס ברזל (איור). \(\PageIndex{6}\)
סוג חשוב נוסף של חלבונים הוא החלבונים המצומדים שיש להם חלק שאינו חלבון. אם לחלבון המצומד יש פחמימה מחוברת, זה נקרא גליקופרוטאין. אם יש לו ליפיד מחובר, זה נקרא ליפופרוטאין. חלבונים אלה הם מרכיבים חשובים של ממברנות. איור \(\PageIndex{7}\) מסכם את ארבע הרמות של מבנה החלבון.
תרגיל \(\PageIndex{2}\)
מה יכול לקרות אם המבנה הראשוני, המשני, השלישוני או הרבעוני של חלבון משתנה?
מבנה ראשוני, חלבונים לא מתפקדים וסיסטיק פיברוזיס
חלבונים הקשורים לממברנות ביולוגיות מסווגים כחיצוניים או מהותיים. חלבונים חיצוניים, הנקראים גם חלבונים היקפיים, קשורים באופן רופף לצד אחד של הממברנה. חלבונים פנימיים, או חלבונים אינטגרליים, מוטבעים בממברנה ולעתים קרובות מתפקדים כחלק ממערכות הובלה כחלבונים טרנסממברניים. סיסטיק פיברוזיס (CF) היא הפרעה גנטית אנושית הנגרמת על ידי שינוי בחלבון הטרנסממברני. זה משפיע בעיקר על הריאות אך עשוי להשפיע גם על הלבלב, הכבד, הכליות והמעי. CF נגרמת על ידי אובדן של חומצת האמינו פנילאלנין בחלבון טרנסממברני סיסטיק פיברוזיס (CFTR). אובדן חומצת אמינו אחת משנה את המבנה הראשוני של חלבון שבדרך כלל עוזר להעביר מלח ומים פנימה והחוצה מהתאים (איור\(\PageIndex{8}\)).
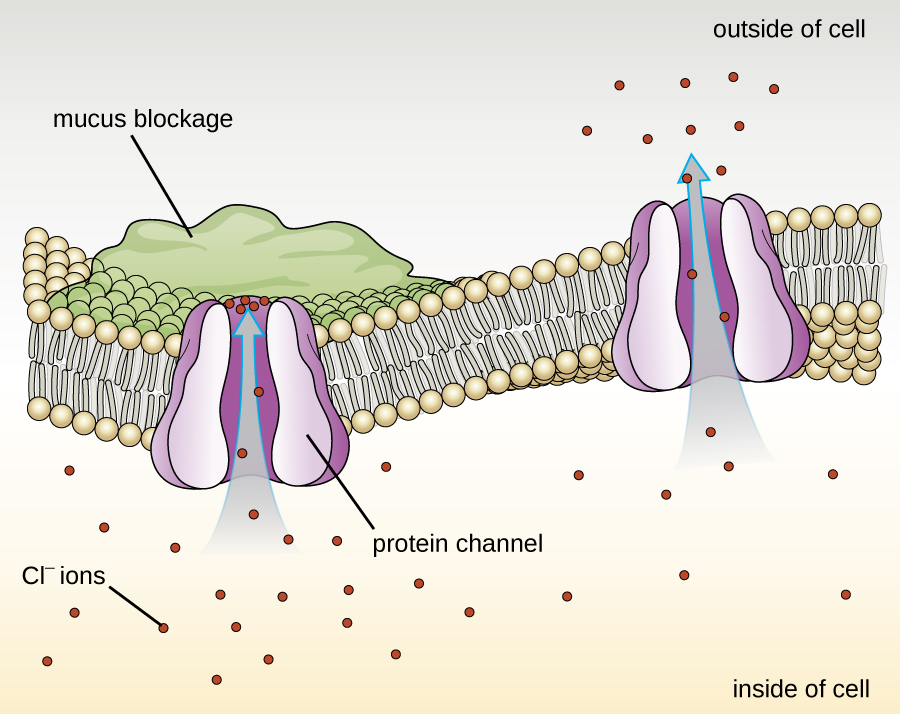
השינוי במבנה הראשוני מונע מהחלבון לתפקד כראוי, מה שגורם לגוף לייצר ריר סמיך במיוחד הסותם את הריאות ומוביל להצטברות של ריר דביק. הריר חוסם את הלבלב ומונע מאנזימים טבעיים לעזור לגוף לפרק מזון ולספוג חומרים מזינים חיוניים.
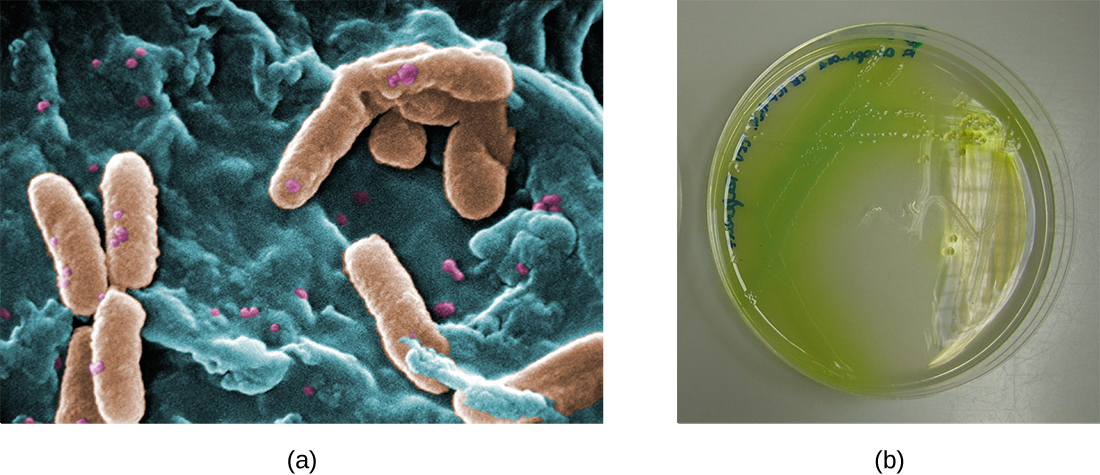
בריאותיהם של אנשים הסובלים מסיסטיק פיברוזיס, הריר המשתנה מספק סביבה בה חיידקים יכולים לשגשג. קולוניזציה זו מובילה להיווצרות ביופילמים בדרכי הנשימה הקטנות של הריאות. הפתוגנים הנפוצים ביותר שנמצאים בריאות של חולים עם סיסטיק פיברוזיס הם Pseudomonas aeruginosa (איור) ו Burkholderia cepacia. \(\PageIndex{9}\) Pseudomonas מבדיל בתוך הביופילם בריאה ויוצר מושבות גדולות, הנקראות Pseudomonas "mucoid". למושבות יש פיגמנטציה ייחודית המופיעה בבדיקות מעבדה (איור\(\PageIndex{9}\)) ומספקת לרופאים את הרמז הראשון שלמטופל יש CF (מושבות כאלה נדירות אצל אנשים בריאים).
למידע נוסף על סיסטיק פיברוזיס, בקר באתר קרן סיסטיק פיברוזיס.
מושגי מפתח וסיכום
- חומצות אמינו הן מולקולות קטנות החיוניות לכל החיים. לכל אחד מהם פחמן α שאליו קשורים אטום מימן, קבוצת קרבוקסיל וקבוצת אמין. הקבוצה המחוברת הרביעית, המיוצגת על ידי R, משתנה בהרכב הכימי, בגודל, בקוטביות ובמטען בין חומצות אמינו שונות, ומספקת שונות בתכונות.
- פפטידים הם פולימרים הנוצרים על ידי קישור של חומצות אמינו באמצעות סינתזת התייבשות. הקשרים בין חומצות האמינו המקושרות נקראים קשרי פפטיד. מספר חומצות האמינו המקושרות זו לזו עשוי להשתנות מכמה לרבים.
- חלבונים הם פולימרים הנוצרים על ידי קישור של מספר גדול מאוד של חומצות אמינו. הם מבצעים פונקציות חשובות רבות בתא, ומשמשים כחומרים מזינים ואנזימים; מולקולות אחסון לפחמן, חנקן ואנרגיה; ורכיבים מבניים.
- מבנה החלבון הוא גורם מכריע לתפקודו ומתואר על ידי סיווג מדורג: ראשוני, משני, שלישוני ורבעוני. המבנה המקורי של חלבון עלול להיות מופרע על ידי דנטורציה, וכתוצאה מכך לאובדן המבנה מסדר גבוה יותר ותפקודו הביולוגי.
- חלק מהחלבונים נוצרים על ידי מספר תת-יחידות חלבון נפרדות, האינטראקציה של יחידות משנה אלה מרכיבות את המבנה הרבעוני של קומפלקס החלבון.
- לחלבונים מצומדים יש חלק לא פוליפפטיד שיכול להיות פחמימה (היוצרת גליקופרוטאין) או חלק שומנים (יצירת ליפופרוטאין). חלבונים אלה הם מרכיבים חשובים של ממברנות.


