6.3: בידוד, תרבות וזיהוי וירוסים
- Page ID
- 209230
מטרות למידה
- דון מדוע וירוסים תוארו במקור כסוכנים הניתנים לסינון
- תאר את טיפוח הנגיפים ואיסוף וטיפול בדגימות
- השווה טכניקות in vivo ו-in vitro המשמשות לטיפוח וירוסים
בתחילת פרק זה, תיארנו כיצד מסנני חרסינה צ'מברלנד עם נקבוביות קטנות מספיק כדי לאפשר לנגיפים לעבור דרכם שימשו לגילוי TMV. כיום הוחלפו מסנני חרסינה במסנני קרום ובמכשירים אחרים המשמשים לבידוד וזיהוי וירוסים.
בידוד וירוסים
בניגוד לחיידקים, שרבים מהם ניתנים לגידול על מצע תזונתי מלאכותי, וירוסים דורשים תא מארח חי לשכפול. ניתן לגדל ולגדל תאי מארח נגועים (אוקריוטים או פרוקריוטים), ואז ניתן לקצור את מצע הגידול כמקור לנגיף. ניתן להפריד וירוסים במדיום הנוזלי מהתאים המארחים על ידי צנטריפוגה או סינון. מסננים יכולים להסיר פיזית כל דבר הקיים בתמיסה שהוא גדול יותר מהוויריונים; לאחר מכן ניתן לאסוף את הנגיפים בתסנין (איור). \(\PageIndex{1}\)
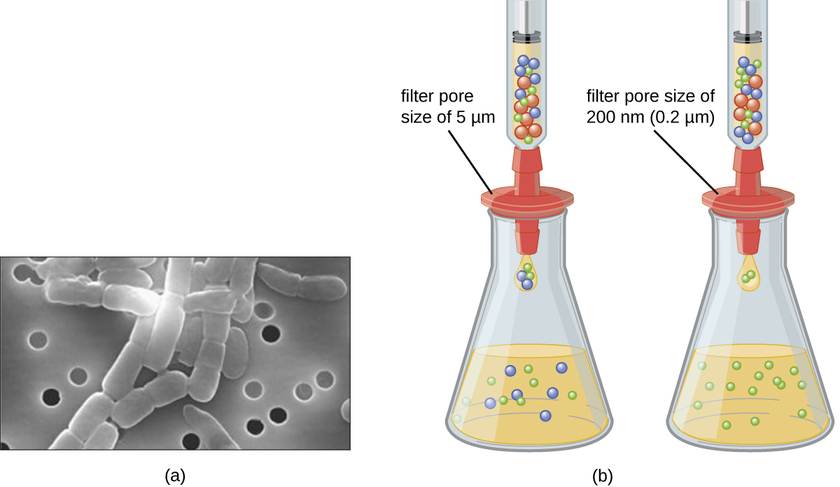
תרגיל \(\PageIndex{1}\)
איזה גודל נקבובית מסנן נדרשת כדי לאסוף וירוס?
טיפוח וירוסים
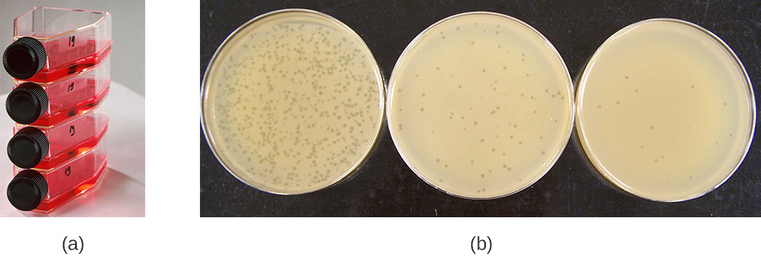
ניתן לגדל וירוסים in vivo (בתוך אורגניזם חי שלם, צמח או בעל חיים) או בַּמַבחֵנָה (מחוץ לאורגניזם חי בתאים בסביבה מלאכותית, כגון מבחנה, בקבוק תרבית תאים או צלחת אגר). ניתן לגדל בקטריופאגים בנוכחות שכבה צפופה של חיידקים (הנקראת גם מדשאה חיידקית) הגדלים באגר רך של 0.7% בצלחת פטרי או בבקבוק שטוח (אופקי) (איור). \(\PageIndex{2a}\) ריכוז האגר יורד מ -1.5% המשמשים בדרך כלל בגידול חיידקים. האגר הרך של 0.7% מאפשר לבקטריופאגים להתפזר בקלות דרך המדיום. עבור בקטריופאג'ים ליטיים, לאחר מכן ניתן להבחין בקלות בליסינג של המארחים החיידקיים כאשר מזוהה אזור ברור הנקרא רובד (איור). \(\PageIndex{1b}\) כאשר הפאג' הורג את החיידקים, נצפים פלאקים רבים בין הדשא החיידקי המעונן.
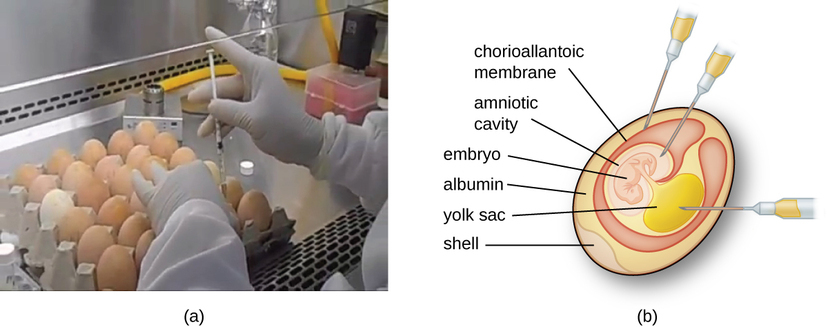
וירוסים של בעלי חיים דורשים תאים בתוך חיה מארחת או תאים בתרבית רקמות שמקורם בבעלי חיים. גידול וירוסים בבעלי חיים חשוב עבור 1) זיהוי ואבחון של וירוסים פתוגניים בדגימות קליניות, 2) ייצור חיסונים ו-3) מחקרי מחקר בסיסיים. מקורות מארח In vivo יכולים להיות עובר מתפתח בביצת ציפור עוברת (למשל, עוף, הודו) או חיה שלמה. לדוגמה, רוב החיסון נגד שפעת המיוצר עבור תוכניות חיסון שפעת שנתיות מתורבת בביצי תרנגולות.
העובר או החיה המארחת משמשים כאינקובטור לשכפול ויראלי (איור\(\PageIndex{3}\)). מיקום בתוך העובר או החיה המארחת חשוב. לנגיפים רבים יש טרופיזם של רקמות, ולכן יש להכניס אותם לאתר ספציפי לצמיחה. בתוך עובר, אתרי המטרה כוללים את חלל השפיר, הממברנה הכוריואלנטואית או שק החלמון. זיהום ויראלי עלול לפגוע בקרום הרקמה, לייצר נגעים הנקראים אבעבועות רוח; לשבש התפתחות עוברית; או לגרום למוות של העובר.
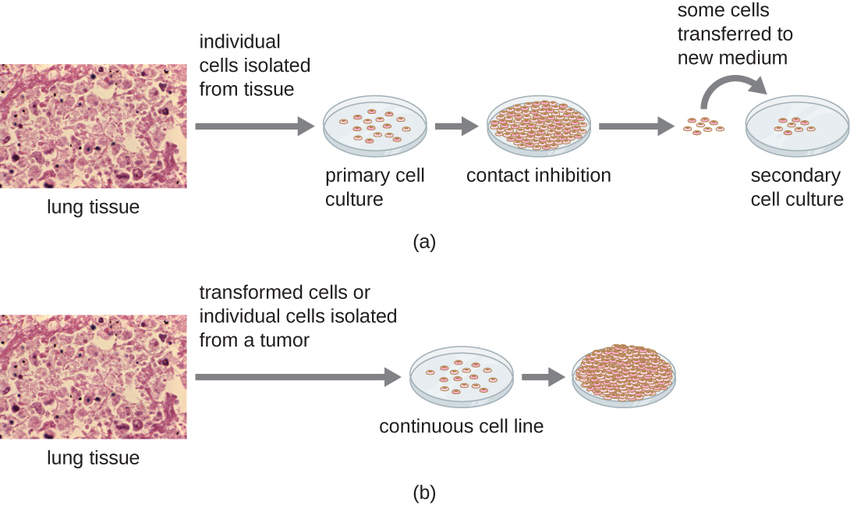
למחקרים חוץ גופיים ניתן להשתמש בסוגים שונים של תאים לתמיכה בצמיחת נגיפים. תרבית תאים ראשונית מוכנה טרי מאיברי בעלי חיים או מרקמות. תאים מופקים מרקמות על ידי גירוד מכני או טחינה לשחרור תאים או בשיטה אנזימטית באמצעות טריפסין או קולגנאז כדי לפרק רקמות ולשחרר תאים בודדים להשעיה. בגלל דרישות תלות בעיגון, תרביות תאים ראשוניות דורשות מדיום תרבית נוזלי בצלחת פטרי או בבקבוק תרבית רקמות, כך שלתאים יש משטח מוצק כגון זכוכית או פלסטיק לצורך התקשרות וצמיחה. לתרבויות ראשוניות יש בדרך כלל אורך חיים מוגבל. כאשר תאים בתרבית ראשונית עוברים מיטוזה ונוצרת צפיפות מספקת של תאים, תאים באים במגע עם תאים אחרים. כאשר מתרחש מגע זה בין תא לתא, המיטוזה מופעלת להפסיק. זה נקרא עיכוב מגע וזה מונע מצפיפות התאים להיות גבוהה מדי. כדי למנוע עיכוב מגע, יש להעביר תאים מתרבית התאים הראשית לכלי אחר עם מצע גידול טרי. זה נקרא תרבית תאים משנית. מעת לעת, יש להפחית את צפיפות התאים על ידי שפיכת חלק מהתאים והוספת מדיום טרי כדי לספק מקום וחומרים מזינים לשמירה על צמיחת התאים. בניגוד לתרביות תאים ראשוניות, שורות תאים רציפות, הנגזרות בדרך כלל מתאים או גידולים שעברו טרנספורמציה, מסוגלות לרוב להיות מתורבתות פעמים רבות או אפילו לגדל אותן ללא הגבלת זמן (ובמקרה זה הן נקראות אלמותיות). קווי תאים רציפים עשויים שלא להפגין תלות בעיגון (הם יגדלו בהשעיה) וייתכן שאיבדו את עיכוב המגע שלהם. כתוצאה מכך, שורות תאים רציפות יכולות לצמוח בערימות או בגושים הדומים לגידולי גידול קטנים (איור\(\PageIndex{4}\)).
דוגמה לקו תאים אלמותי הוא קו התאים HeLa, אשר תורבת במקור מתאי גידול שהתקבלו מהנרייטה לקס, מטופלת שמתה מסרטן צוואר הרחם בשנת 1951. תאי HeLa היו קו התאים הרציף הראשון בתרבית רקמות ושימשו לביסוס תרבית רקמות כטכנולוגיה חשובה למחקר בביולוגיה של התא, וירולוגיה ורפואה. לפני גילוי תאי HeLa, מדענים לא הצליחו להקים תרביות רקמות עם אמינות או יציבות כלשהי. יותר משישה עשורים לאחר מכן, קו תאים זה עדיין חי ומשמש למחקר רפואי. ראה קו התא האלמותי של הנרייטה לאקס כדי לקרוא עוד על קו תאים חשוב זה ועל האמצעים השנויים במחלוקת שבאמצעותם הוא הושג.
תרגיל \(\PageIndex{2}\)
איזו תכונה של תאים מחייבת דילולים תקופתיים של תרביות תאים ראשוניות?
קו התא האלמותי של הנרייטה לאקס
בינואר 1951 אובחנה הנרייטה לקס, אישה אפרו-אמריקאית בת 30 מבולטימור, כחולה בסרטן צוואר הרחם בבית החולים ג'ון הופקינס. כעת אנו יודעים שהסרטן שלה נגרם על ידי נגיף הפפילומה האנושי (HPV). השפעות ציטופתיות של הנגיף שינו את מאפייני התאים שלה בתהליך שנקרא טרנספורמציה, המעניק לתאים את היכולת להתחלק ברציפות. יכולת זו, כמובן, הביאה לגידול סרטני שבסופו של דבר הרג את גברת לאקס באוקטובר בגיל 31. לפני מותה נלקחו דגימות מהתאים הסרטניים שלה ללא ידיעתה או רשותה. הדגימות הגיעו בסופו של דבר לרשותו של ד"ר ג'ורג 'גיי, חוקר ביו-רפואי באוניברסיטת ג'ונס הופקינס. גיי הצליח לגדל חלק מהתאים מהדגימה של לאקס, ויצר את מה שמכונה כיום קו תאי HeLa האלמותי. לתאים אלה יש את היכולת לחיות ולצמוח ללא הגבלת זמן, וגם כיום הם עדיין בשימוש נרחב בתחומי מחקר רבים.
לדברי בעלה של לאקס, לא הנרייטה ולא המשפחה נתנו לבית החולים אישור לאסוף את דגימת הרקמה שלה. ואכן, המשפחה לא הייתה מודעת עד 20 שנה לאחר מותה של לאקס שהתאים שלה עדיין חיים ומשמשים באופן פעיל למטרות מסחריות ומחקריות. עם זאת, תאי HeLa היו מרכזיים בתגליות מחקר רבות הקשורות לפוליו, סרטן ואיידס, בין מחלות אחרות. התאים גם הם ממוסחרים, אם כי מעולם לא קיבלו פטנט על עצמם. למרות זאת, האחוזה של הנרייטה לקס מעולם לא נהנתה מהשימוש בתאים, אם כי בשנת 2013 קיבלה משפחת לאקס שליטה על פרסום הרצף הגנטי של תאיה.
מקרה זה מעלה מספר סוגיות ביו-אתיות סביב הסכמה מדעת של המטופלים והזכות לדעת. בזמן שנלקחו הרקמות של לאקס, לא היו חוקים או הנחיות לגבי הסכמה מדעת. האם זה אומר שהיא טופלה בהגינות באותה תקופה? בהחלט לפי הסטנדרטים של היום, התשובה תהיה לא. קצירת רקמות או איברים מחולה גוסס ללא הסכמה אינה נחשבת רק לא אתית אלא בלתי חוקית, ללא קשר לשאלה אם מעשה כזה יכול להציל את חייהם של חולים אחרים. האם זה מוסרי, אם כן, שמדענים ימשיכו להשתמש ברקמות של לאקס למחקר, למרות שהן הושגו באופן בלתי חוקי בסטנדרטים של ימינו?
אתיים או לא, התאים של לאקס נמצאים בשימוש נרחב כיום עבור כל כך הרבה יישומים שאי אפשר לרשום את כולם. האם זהו מקרה שבו המטרות מצדיקות את האמצעים? האם לאקס תשמח לדעת על תרומתה למדע ועל מיליוני האנשים שהרוויחו? האם היא תרצה שמשפחתה תקבל פיצוי על המוצרים המסחריים שפותחו באמצעות התאים שלה? או שמא היא תרגיש מופרת ומנוצלת על ידי החוקרים שלקחו חלק מגופה ללא הסכמתה? כי היא מעולם לא נשאלה, לעולם לא נדע.
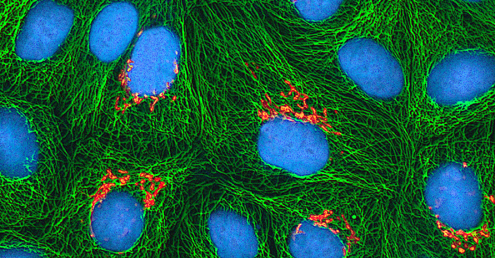
איתור וירוס
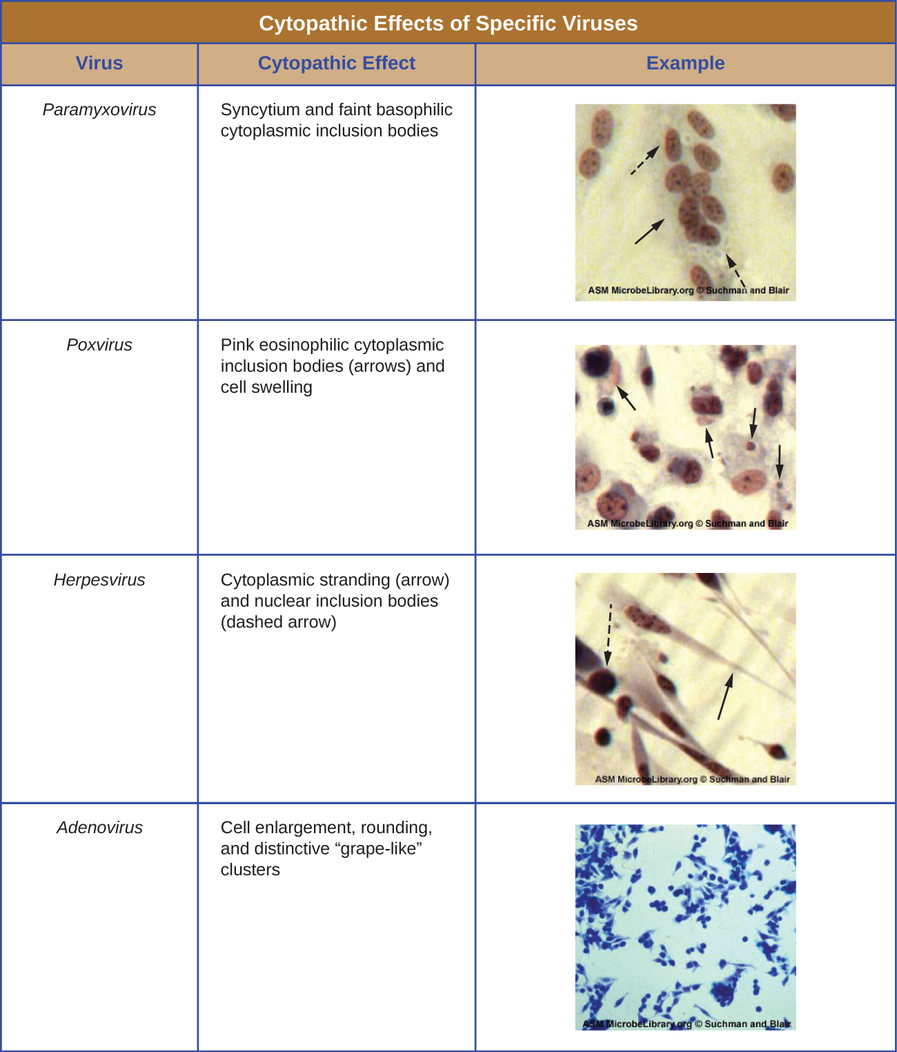
ללא קשר לשיטת הטיפוח, לאחר שהוכנס וירוס לאורגניזם מארח שלם, לעובר או לתא תרבית רקמות, ניתן להכין דגימה מהמארח, העובר או קו התא הנגוע לניתוח נוסף תחת שדה בהיר, אלקטרון, או מיקרוסקופ פלואורסצנטי. השפעות ציטופתיות (CPEs) הן הפרעות תאים נצפות מובהקות עקב זיהום ויראלי. CPEs יכולים לכלול אובדן היצמדות לפני השטח של המיכל, שינויים בצורת התא משטוח לעגול, הצטמקות הגרעין, ואקואולים בציטופלזמה, מיזוג של ממברנות ציטופלזמיות ויצירת סינציטיה מרובת גרעינים, גופי הכללה בגרעין או ציטופלזמה, ותמוגה מלאה של תאים (ראה איור). \(\PageIndex{6}\)
שינויים פתולוגיים נוספים כוללים הפרעה ויראלית של הגנום המארח ושינוי תאים נורמליים לתאים שעברו טרנספורמציה, שהם סוגי התאים הקשורים לקרצינומות וסרקומות. סוג ה- CPE או חומרתו תלויים בסוג הנגיף המעורב. איור \(\PageIndex{6}\) מפרט CPEs עבור וירוסים ספציפיים.
צפה בסרטון זה כדי ללמוד על ההשפעות של וירוסים על תאים.
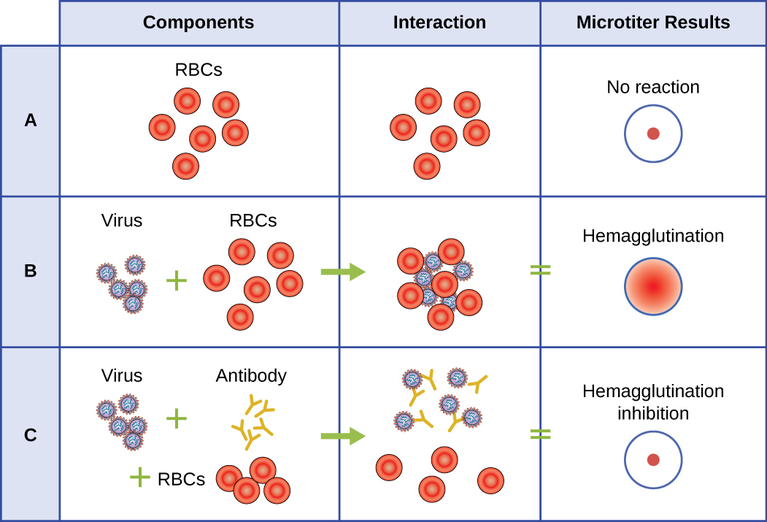
מבחן המגלוטינציה
בדיקה סרולוגית משמשת לאיתור נוכחות של סוגים מסוימים של וירוסים בסרום המטופל. סרום הוא החלק הנוזלי בצבע קש של פלזמת הדם שממנו הוסרו גורמי קרישה. ניתן להשתמש בסרום בבדיקה ישירה הנקראת בדיקת המוגלוטינציה לאיתור סוגים ספציפיים של וירוסים בדגימה של המטופל. המגלוטינציה היא התלכדות (גושים) יחד של אריתרוציטים (כדוריות דם אדומות). וירוסים רבים מייצרים חלבונים או קוצים על פני השטח הנקראים המגלוטינינים שיכולים להיקשר לקולטנים על ממברנות האריתרוציטים ולגרום לתאים להצטבר. ניתן להבחין בהמגלוטינציה ללא שימוש במיקרוסקופ, אך שיטה זו לא תמיד מבדילה בין חלקיקים נגיפיים זיהומיים ולא זיהומיים, מכיוון ששניהם יכולים לצבור אריתרוציטים.
כדי לזהות וירוס פתוגני ספציפי באמצעות hemagglutination, עלינו להשתמש בגישה עקיפה. חלבונים הנקראים נוגדנים, הנוצרים על ידי המערכת החיסונית של המטופל כדי להילחם בנגיף ספציפי, יכולים לשמש כדי להיקשר לרכיבים כגון המגלוטינינים הקשורים באופן ייחודי לסוגים ספציפיים של וירוסים. קשירת הנוגדנים עם ההמגלוטינינים הנמצאים בנגיף מונעת לאחר מכן אריתרוציטים ליצור אינטראקציה ישירה עם הנגיף. לכן כאשר אריתרוציטים מתווספים לנגיפים המצופים נוגדנים, אין הופעה של התלכדות; התלכדות נעצרה. אנו קוראים לסוגים אלה של מבחנים עקיפים למבחני עיכוב המוגלוטינציה (HAI) של נוגדנים ספציפיים לנגיף. HAI יכול לשמש כדי לזהות נוכחות של נוגדנים ספציפיים לסוגים רבים של וירוסים שעלולים לגרום או לגרום לזיהום בחולה אפילו חודשים או שנים לאחר ההדבקה (ראה איור\(\PageIndex{7}\)). בדיקה זו מתוארת בפירוט רב יותר במבחני התלכדות.
תרגיל \(\PageIndex{3}\)
מה התוצאה של בדיקת HIA חיובית?
בדיקת הגברה של חומצת גרעין
בדיקות הגברה של חומצות גרעין (NAAT) משמשות בביולוגיה מולקולרית לאיתור רצפי חומצות גרעין ייחודיים של וירוסים בדגימות מטופלים. תגובת שרשרת פולימראז (PCR) היא NAAT המשמש לאיתור נוכחות של DNA ויראלי ברקמת המטופל או בדגימת נוזל הגוף. PCR היא טכניקה המגבירה (כלומר, מסנתזת עותקים רבים) של קטע DNA ויראלי של עניין. באמצעות PCR, רצפי נוקלאוטידים קצרים הנקראים פריימרים נקשרים לרצפים ספציפיים של DNA ויראלי, ומאפשרים זיהוי של הנגיף.
טרנסקריפטאז-PCR הפוך (RT-PCR) הוא NAAT המשמש לאיתור נוכחות של נגיפי RNA. RT-PCR שונה מ- PCR בכך שהאנזים טרנסקריפטאז הפוך (RT) משמש לייצור cDNA מהכמות הקטנה של RNA ויראלי בדגימה. לאחר מכן ניתן להגביר את ה- cDNA על ידי PCR. הן PCR והן RT-PCR משמשים לאיתור ואישור נוכחות חומצת הגרעין הנגיפית בדגימות המטופל.
הפחדת HPV
מישל, סטודנטית לסיעוד בת 21, הגיעה למרפאה באוניברסיטה בדאגה שאולי נחשפה למחלה המועברת במגע מיני (STD). בן זוגה המיני פיתח לאחרונה כמה בליטות בבסיס איבר מינו. הוא דחה את הפנייה לרופא, אך מישל חושדת שמדובר ביבלות באברי המין הנגרמות על ידי HPV. היא מודאגת במיוחד מכיוון שהיא יודעת ש- HPV לא רק גורם ליבלות אלא הוא גורם בולט לסרטן צוואר הרחם. היא ובן זוגה משתמשים תמיד בקונדומים למניעת הריון, אך היא אינה בטוחה כי אמצעי זהירות זה יגן עליה מפני HPV.
הרופא של מישל לא מוצא סימנים פיזיים של יבלות באברי המין או מחלות מין אחרות, אך ממליץ למישל לבצע מריחת פאפ יחד עם בדיקת HPV. מריחת הפאפ תסנן אחר תאי צוואר הרחם הלא תקינים ואת ה- CPEs הקשורים ל- HPV; בדיקת HPV תבדוק את נוכחות הנגיף. אם שתי הבדיקות שליליות, מישל יכולה להיות בטוחה יותר שהיא ככל הנראה לא נדבקה ב- HPV. עם זאת, הרופא שלה מציע שזה יכול להיות חכם עבור מישל להתחסן נגד HPV כדי להגן על עצמה מפני חשיפה עתידית אפשרית.
תרגיל \(\PageIndex{4}\)
מדוע הרופא של מישל מזמין שתי בדיקות שונות במקום להסתמך על זה או אחר?
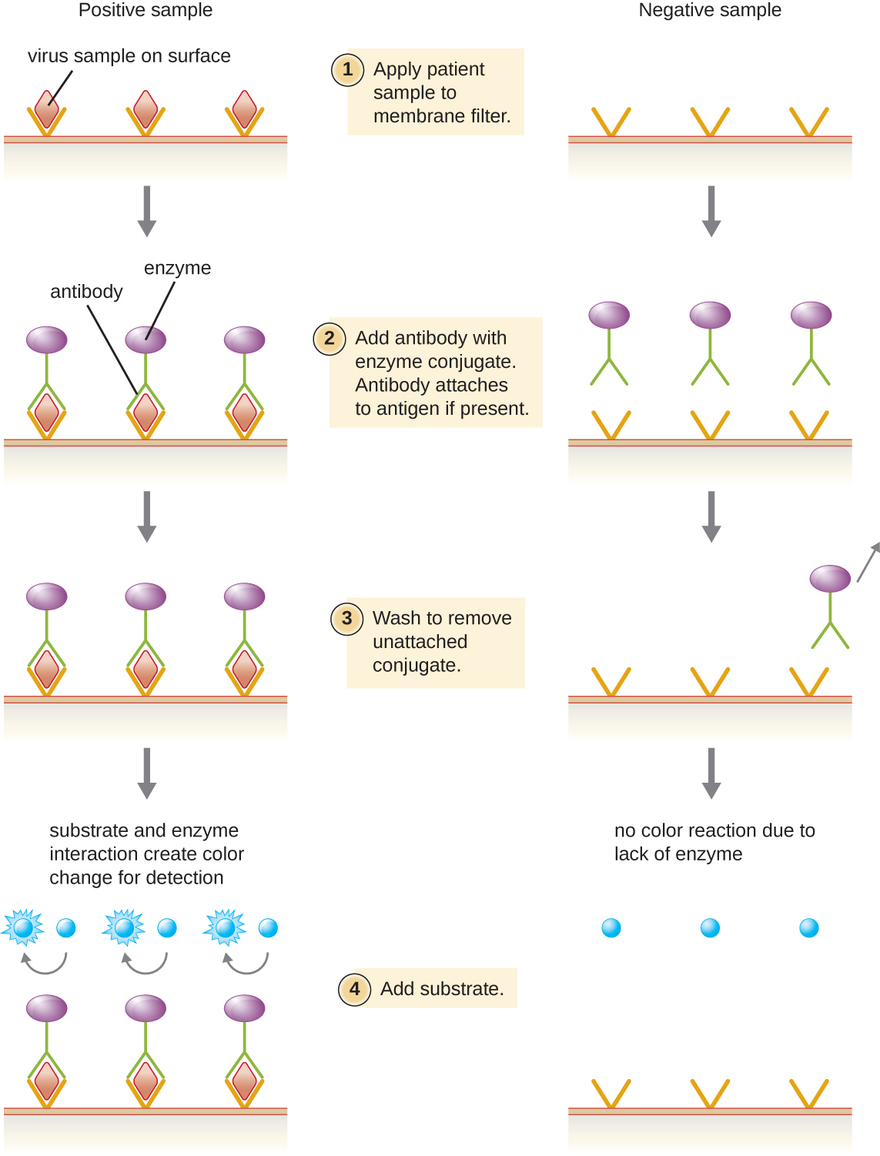
אנזים אימונואי
מבחני חיסון אנזים (EIAs) מסתמכים על יכולתם של נוגדנים לזהות ולהיצמד לביומולקולות ספציפיות הנקראות אנטיגנים. הנוגדן המזהה מתחבר לאנטיגן המטרה בדרגה גבוהה של ספציפיות במה שעשוי להיות תערובת מורכבת של ביומולקולות. כמו כן נכלל בסוג זה של assay אנזים חסר צבע המחובר לנוגדן המגלה. האנזים פועל כתג על הנוגדן המזהה ויכול לקיים אינטראקציה עם מצע חסר צבע, מה שמוביל לייצור תוצר סופי צבעוני. EIAs מסתמכים לעתים קרובות על שכבות של נוגדנים כדי ללכוד ולהגיב עם אנטיגנים, כולם מחוברים למסנן ממברנה (ראה איור\(\PageIndex{8}\)). EIAs לאנטיגנים ויראליים משמשים לעתים קרובות כבדיקות סקר מקדימות. אם התוצאות חיוביות, אישור נוסף ידרוש בדיקות עם רגישות גדולה עוד יותר, כגון כתם מערבי או NAAT. EIAs נדונים ביתר פירוט ב- EIAs ו - ELISA.
תרגיל \(\PageIndex{5}\)
מה בדרך כלל מצביע על בדיקת EIA חיובית?
מיקוד קליני: חלק 3
יחד עם ניתוח RT/PCR, הרוק של דוד נאסף גם לגידול ויראלי. באופן כללי, אין בדיקת אבחון אחת מספיקה לאבחון לפני המוות, מכיוון שהתוצאות יהיו תלויות ברגישות הבדיקה, בכמות הנגיפים הקיימים בזמן הבדיקה ובתזמון הבדיקה, שכן שחרור הווירונים ב רוק יכול להשתנות. כפי שמתברר, התוצאה הייתה שלילית לגידול ויראלי מהרוק. זה לא מפתיע את הרופא של דוד, כי תוצאה שלילית אחת אינה אינדיקציה מוחלטת של היעדר זיהום. זה יכול להיות כי מספר virions ברוק הוא נמוך בזמן הדגימה. אין זה יוצא דופן לחזור על הבדיקה במרווחים כדי לשפר את הסיכוי לזהות עומסי וירוסים גבוהים יותר.
תרגיל \(\PageIndex{6}\)
האם על הרופא של דוד לשנות את מהלך הטיפול שלו על סמך תוצאות הבדיקה הללו?
סיכום
- גידול ויראלי דורש נוכחות של צורה כלשהי של תא מארח (אורגניזם שלם, עובר או תרבית תאים).
- ניתן לבודד וירוסים מדגימות על ידי סינון.
- תסנין ויראלי הוא מקור עשיר לווירונים משוחררים.
- בקטריופאגים מזוהים על ידי נוכחות של פלאקים ברורים על הדשא החיידקי.
- וירוסים של בעלי חיים וצמחים מזוהים על ידי השפעות ציטופתיות, טכניקות מולקולריות (PCR, RT-PCR), מבחני אימונו-אנזים ומבחנים סרולוגיים (בדיקת המגלוטינציה, בדיקת עיכוב המוגלוטינציה).


