6.2: מחזור החיים הנגיפי
- Page ID
- 209238
מטרות למידה
- תאר את מחזורי החיים הליטיים והליזוגניים
- תאר את תהליך השכפול של וירוסים מן החי
- תאר מאפיינים ייחודיים של רטרו -וירוסים ווירוסים סמויים
- דון בנגיפים אנושיים ובאינטראקציות הווירוס-תא המארח שלהם
- הסבר את תהליך התמרה
- תאר את תהליך השכפול של וירוסים צמחיים
כל הווירוסים תלויים בתאים לצורך רבייה ותהליכים מטבוליים. כשלעצמם, וירוסים אינם מקודדים לכל האנזימים הדרושים לשכפול ויראלי. אבל בתוך תא מארח, וירוס יכול לפקד על מכונות סלולריות כדי לייצר יותר חלקיקים ויראליים. בקטריופאגים משתכפלים רק בציטופלזמה, מכיוון שלתאים פרוקריוטים אין גרעין או אברונים. בתאים אוקריוטים, רוב נגיפי ה- DNA יכולים להשתכפל בתוך הגרעין, למעט יוצא מן הכלל שנצפה בנגיפי ה- DNA הגדולים, כגון נגיפי הפוקס, שיכולים להשתכפל בציטופלזמה. נגיפי RNA המדביקים תאי בעלי חיים משתכפלים לעתים קרובות בציטופלזמה.
מחזור החיים של וירוסים עם מארחים פרוקריוטים
מחזור החיים של בקטריופאגים היווה מודל טוב להבנת האופן שבו נגיפים משפיעים על התאים שהם מדביקים, מכיוון שנצפו תהליכים דומים לנגיפים אוקריוטיים, העלולים לגרום למוות מיידי של התא או לבסס זיהום סמוי או כרוני. פאגים ארסיים מובילים בדרך כלל למוות של התא באמצעות תמוגה של התא. פאגים ממוזגים, לעומת זאת, יכולים להפוך לחלק מכרומוזום מארח ומשוכפלים עם גנום התא עד למועד שבו הם נגרמים ליצור וירוסים שהורכבו לאחרונה, או נגיפי צאצאים.
המחזור הליטי
במהלך המחזור הליטי של הפאג הארסי, הבקטריופאג משתלט על התא, משחזר פאגים חדשים והורס את התא. T-even phage הוא דוגמה טובה למעמד מאופיין היטב של פאגים ארסיים. ישנם חמישה שלבים במחזור הליטי של הבקטריופאג '(ראה איור). \(\PageIndex{1}\) התקשרות היא השלב הראשון בתהליך ההדבקה שבו הפאג מקיים אינטראקציה עם קולטני משטח חיידקיים ספציפיים (למשל, ליפופוליסכרידים וחלבון OmPC על משטחי המארח). לרוב הפאגים יש טווח מארח צר ועלולים להדביק מין אחד של חיידקים או זן אחד בתוך מין. ניתן לנצל הכרה ייחודית זו לטיפול ממוקד בזיהום חיידקי על ידי טיפול בפאג' או להקלדת פאגים לזיהוי תת-מינים או זנים חיידקיים ייחודיים. השלב השני של ההדבקה הוא כניסה או חדירה. זה מתרחש באמצעות התכווצות של מעטפת הזנב, הפועלת כמו מחט היפודרמית להזרקת הגנום הנגיפי דרך דופן התא והקרום. ראש הפאג ושאר הרכיבים נשארים מחוץ לחיידקים.
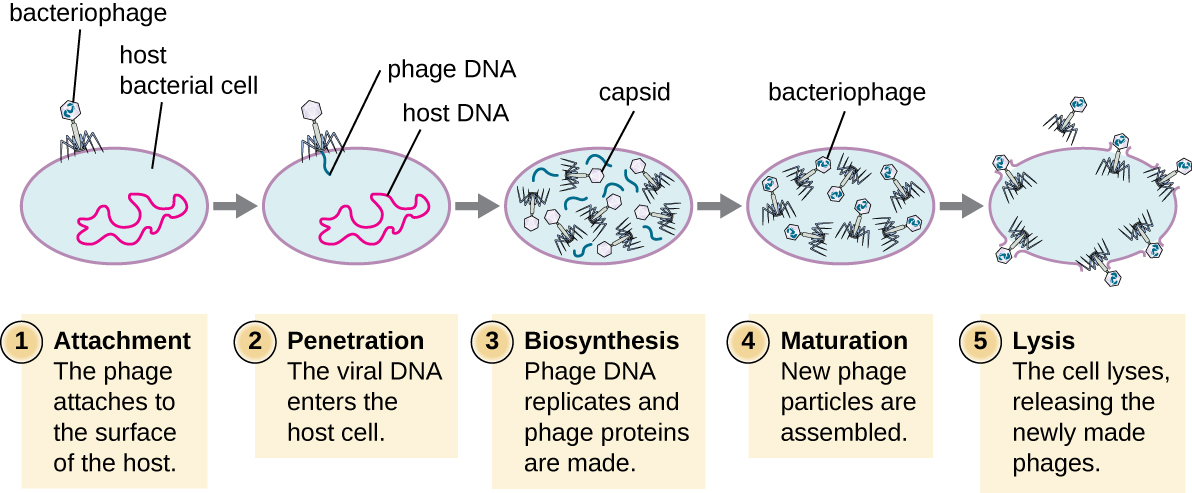
השלב השלישי של ההדבקה הוא ביוסינתזה של רכיבים ויראליים חדשים. לאחר הכניסה לתא המארח, הנגיף מסנתז אנדונוקליזות המקודדות בנגיף כדי לפרק את הכרומוזום החיידקי. לאחר מכן הוא חוטף את התא המארח כדי לשכפל, לתמלל ולתרגם את המרכיבים הנגיפיים הדרושים (קפסומרים, נדן, לוחות בסיס, סיבי זנב ואנזימים ויראליים) להרכבה של וירוסים חדשים. גנים של פולימראז מתבטאים בדרך כלל בשלב מוקדם של המחזור, בעוד שחלבוני קפסיד וזנב באים לידי ביטוי מאוחר יותר. בשלב ההתבגרות נוצרים וירונים חדשים. כדי לשחרר פאגים חופשיים, דופן התא החיידקי מופרעת על ידי חלבוני פאג כגון הולין או ליזוזים. השלב האחרון הוא שחרור. וירוסים בוגרים פורצים מהתא המארח בתהליך הנקרא תמוגה ונגיפי הצאצאים משתחררים לסביבה כדי להדביק תאים חדשים.
המחזור הליזוגני
במחזור ליזוגני, גנום הפאג נכנס גם לתא באמצעות התקשרות וחדירה. דוגמה מצוינת לפאג עם סוג זה של מחזור חיים הוא הפאג למבדה. במהלך המחזור הליזוגני, במקום להרוג את המארח, גנום הפאג משתלב בכרומוזום החיידקי והופך לחלק מהמארח. גנום הפאג המשולב נקרא נבואה. מארח חיידקי עם נבואה נקרא ליזוגן. התהליך שבו חיידק נגוע בפאג ממוזג נקרא ליזוגניה. זה אופייני לפאגים ממוזגים להיות סמויים או לא פעילים בתוך התא. כאשר החיידק משכפל את הכרומוזום שלו, הוא גם משכפל את ה- DNA של הפאג ומעביר אותו לתאי בת חדשים במהלך הרבייה. נוכחות הפאג עשויה לשנות את הפנוטיפ של החיידק, מכיוון שהוא יכול להכניס גנים נוספים (למשל, גנים רעלנים שיכולים להגביר את ארסיות החיידקים). שינוי זה בפנוטיפ המארח נקרא המרה ליזוגנית או המרת פאגים. חלק מהחיידקים, כמו Vibrio cholerae ו קלוסטרידיום בוטולינום, הם פחות ארסיים בהיעדר הנבואה. הפאגים המדביקים חיידקים אלה נושאים את גני הרעלן בגנום שלהם ומשפרים את ארסיות המארח כאשר גני הרעלן באים לידי ביטוי. במקרה של V. כולרה, רעלן מקודד בפאג יכול לגרום לשלשול חמור; ב- C. botulinum, הרעלן יכול לגרום לשיתוק. במהלך הליזוגניה, הנבואה תימשך בכרומוזום המארח עד אינדוקציה, מה שגורם לכריתת הגנום הנגיפי מהכרומוזום המארח. לאחר שהתרחשה האינדוקציה הפאג הממוזג יכול להמשיך במחזור ליטי ולאחר מכן לעבור ליזוגניה בתא שזה עתה נגוע (ראה איור). \(\PageIndex{2}\)
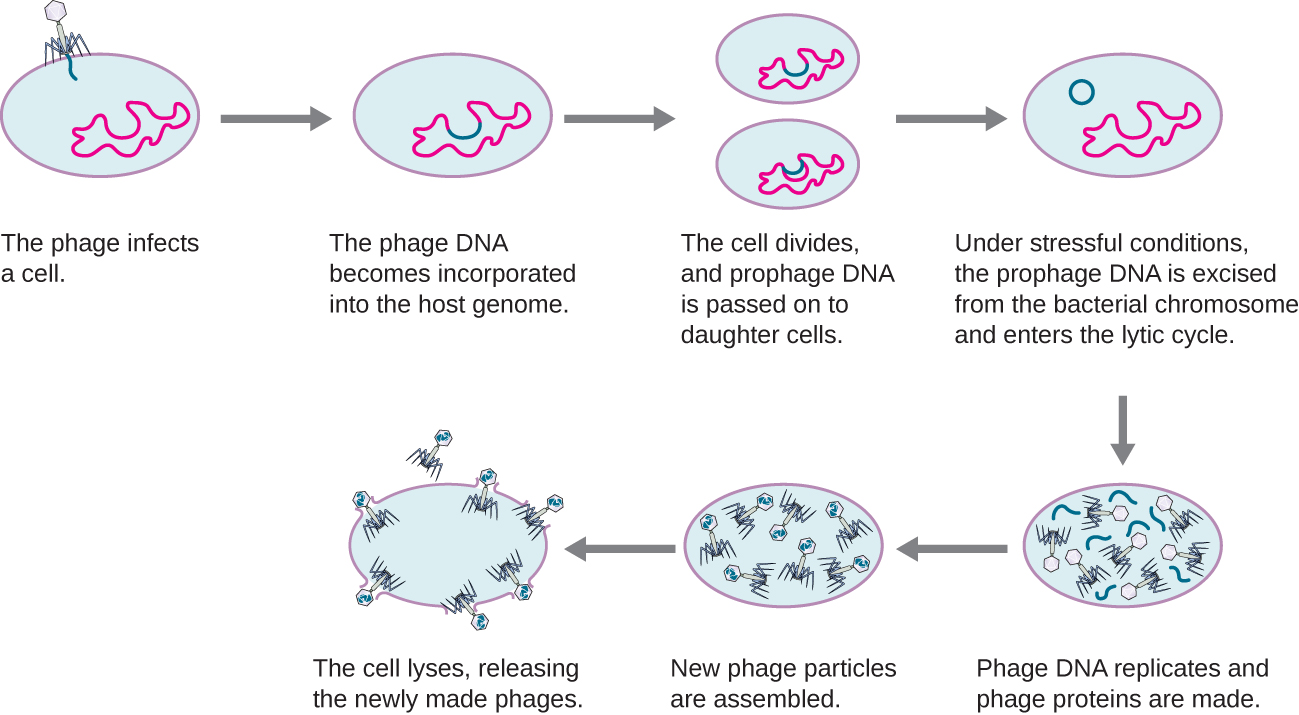
סרטון זה ממחיש את שלבי מחזור החיים הליזוגני של בקטריופאג ואת המעבר לשלב ליטי.
תרגיל \(\PageIndex{1}\)
האם פאג' סמוי אינו ניתן לזיהוי בחיידק?
התמרה
התמרה מתרחשת כאשר בקטריופאג מעביר DNA חיידקי מחיידק אחד למשנהו במהלך זיהומים עוקבים. ישנם שני סוגים של התמרה: התמרה כללית ומיוחדת. במהלך המחזור הליטי של שכפול ויראלי, הנגיף חוטף את התא המארח, מפרק את הכרומוזום המארח ויוצר יותר גנומים ויראליים. כשהוא מרכיב ואורז DNA לראש הפאג, האריזה עושה מדי פעם טעות. במקום לארוז DNA ויראלי, הוא לוקח חתיכה אקראית של DNA מארח ומכניס אותו לקפסיד. לאחר שחרורו, ויריון זה יזריק את ה- DNA של המארח לשעבר למארח שזה עתה נגוע. העברה א-מינית של מידע גנטי יכולה לאפשר להתרחש רקומבינציה של DNA, ובכך לספק למארח החדש גנים חדשים (למשל, גן עמידות לאנטיביוטיקה, או גן המטבוליזם סוכר). התמרה כללית מתרחשת כאשר חתיכה אקראית של DNA כרומוזומלי חיידקי מועברת על ידי הפאג במהלך המחזור הליטי. התמרה מיוחדת מתרחשת בסוף המחזור הליזוגני, כאשר נכרת הנבואה והבקטריופאג נכנס למחזור הליטי. מכיוון שהפאג משולב בגנום המארח, הנבואה יכולה להשתכפל כחלק מהמארח. עם זאת, תנאים מסוימים (למשל, חשיפה לאור אולטרה סגול או חשיפה כימית) מעוררים את הנבואה לעבור אינדוקציה, וגורמים לפאג' להינתק מהגנום, להיכנס למחזור הליטי ולייצר פאגים חדשים לעזוב את תאי המארח. במהלך תהליך הכריתה מהכרומוזום המארח, פאג עשוי להסיר מדי פעם מעט DNA חיידקי ליד אתר האינטגרציה הנגיפית. הפאג וה-DNA המארח מקצה אחד או משני קצוות אתר האינטגרציה ארוזים בתוך הקפסיד ומועברים למארח החדש והנגוע. מכיוון שה-DNA המועבר על ידי הפאג אינו ארוז באופן אקראי אלא הוא פיסת DNA ספציפית ליד אתר האינטגרציה, מנגנון זה של העברת גנים מכונה התמרה מיוחדת (ראה איור\(\PageIndex{3}\)). לאחר מכן ה- DNA יכול להשתלב מחדש עם כרומוזום המארח, ולתת לאחרון מאפיינים חדשים. נראה כי התמרה ממלאת תפקיד חשוב בתהליך האבולוציוני של חיידקים, ומעניקה להם מנגנון להחלפה א-מינית של מידע גנטי.
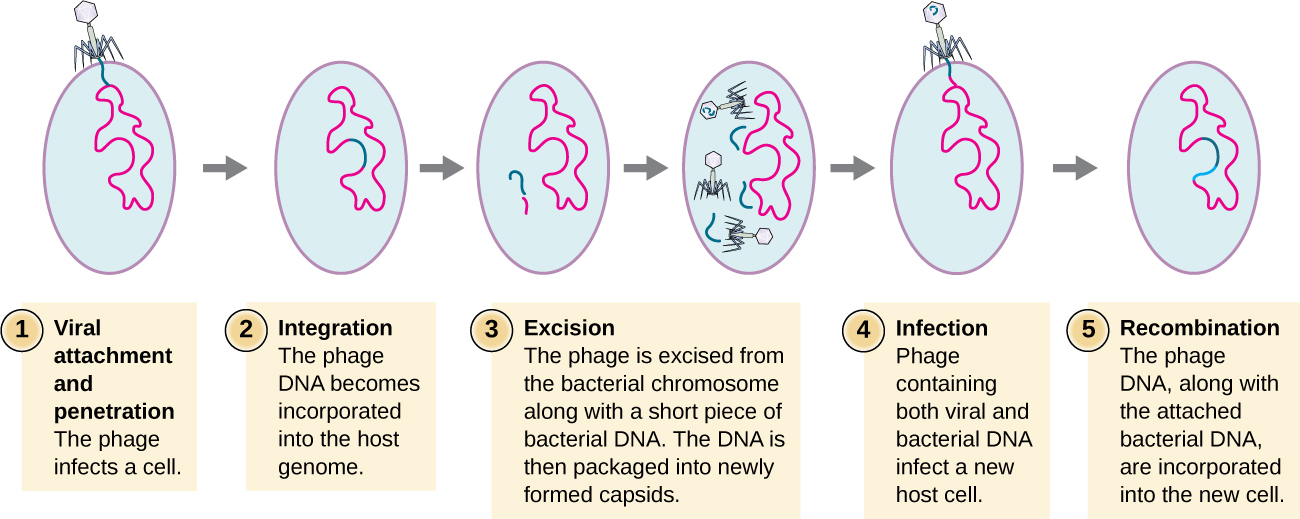
תרגיל \(\PageIndex{2}\)
איזה מחזור חיים של פאג קשור לאילו צורות של התמרה?
מחזור חיים של וירוסים עם מארחי בעלי חיים
וירוסים של בעלי חיים ליטיים עוקבים אחר שלבי זיהום דומים לבקטריופאגים: התקשרות, חדירה, ביוסינתזה, התבגרות ושחרור (ראה איור). \(\PageIndex{4}\) עם זאת, מנגנוני החדירה, הביוסינתזה של חומצת הגרעין והשחרור שונים בין וירוסים חיידקיים לבעלי חיים. לאחר הקישור לקולטני מארח, וירוסים של בעלי חיים נכנסים דרך אנדוציטוזה (בליעה על ידי התא המארח) או דרך היתוך ממברנה (מעטפת ויראלית עם קרום התא המארח). וירוסים רבים הם ספציפיים למארח, כלומר הם מדביקים רק סוג מסוים של מארח; ורוב הנגיפים מדביקים רק סוגים מסוימים של תאים בתוך רקמות. ספציפיות זו נקראת טרופיזם רקמות. דוגמאות לכך מודגמות על ידי הפוליו-וירוס, המציג טרופיזם לרקמות המוח וחוט השדרה, או נגיף השפעת, שיש לו טרופיזם ראשוני לדרכי הנשימה.
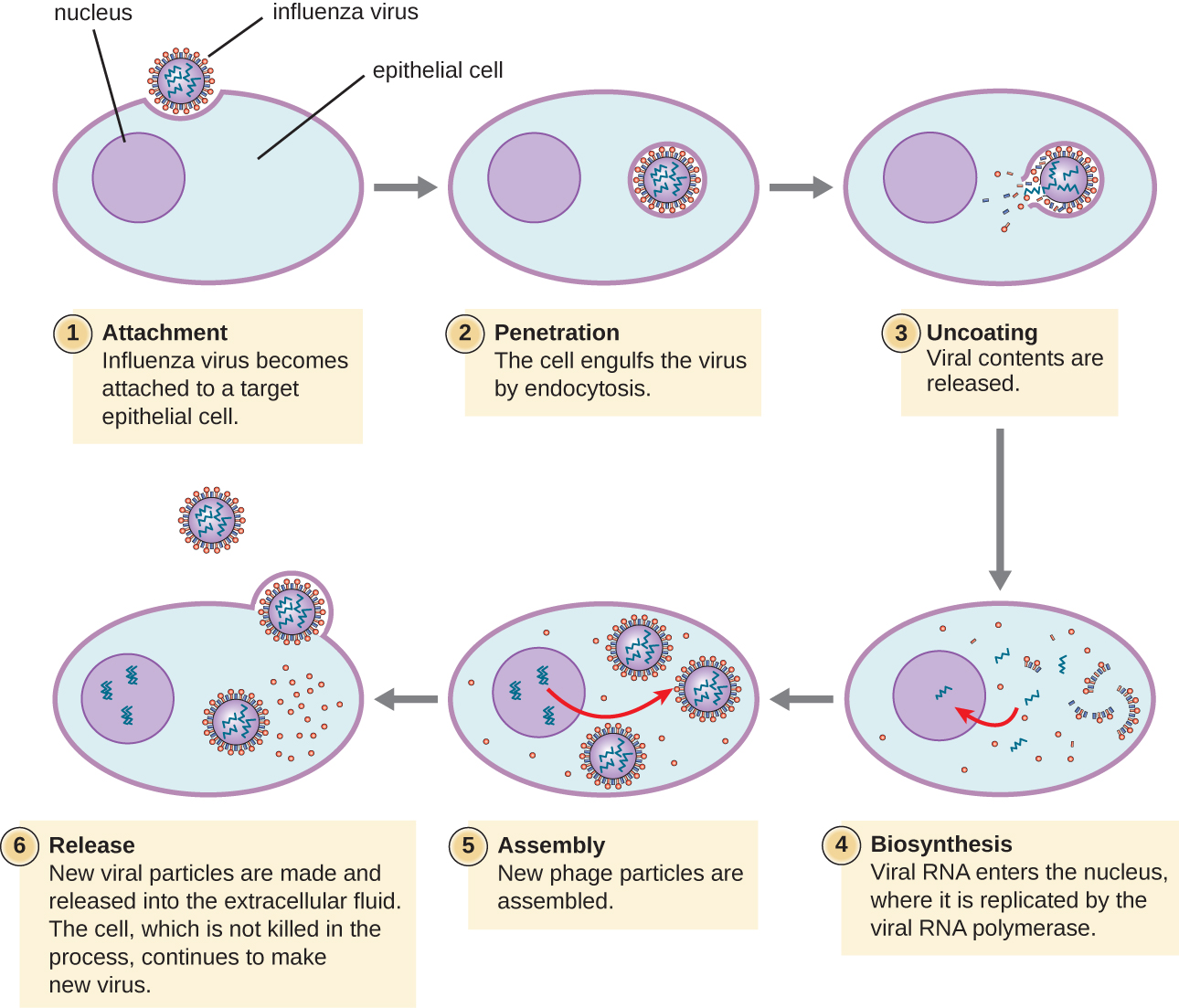
וירוסים של בעלי חיים לא תמיד מבטאים את הגנים שלהם באמצעות זרימה תקינה של מידע גנטי - מ- DNA ל- RNA לחלבון. לנגיפים מסוימים יש גנום dsDNA כמו אורגניזמים תאיים ויכולים לעקוב אחר הזרימה הרגילה. עם זאת, לאחרים עשויים להיות גנום ssDNA, dsRNA או ssRNA. אופי הגנום קובע כיצד הגנום משוכפל ומתבטא כחלבונים ויראליים. אם גנום הוא ssDNA, אנזימים מארח ישמשו לסינתזה של גדיל שני המשלים לגדיל הגנום, ובכך לייצר dsDNA. כעת ניתן לשכפל, לתמלל ולתרגם את ה- dsDNA בדומה ל- DNA המארח.
אם הגנום הנגיפי הוא RNA, יש להשתמש במנגנון אחר. ישנם שלושה סוגים של גנום RNA: dsRNA, חיובי (+) חד גדיל (+ssRNA) או שלילי (-) RNA חד-גדילי (-ssRNA). אם לנגיף יש גנום +ssRNA, ניתן לתרגם אותו ישירות לייצור חלבונים ויראליים. גנומי+ssRNA ויראלי פועל כמו mRNA תאי. עם זאת, אם וירוס מכיל גנום -ssRNA, הריבוזומים המארחים אינם יכולים לתרגם אותו עד שה-ssRNA משוכפל ל-+ssRNA על ידי פולימראז RNA תלוי RNA ויראלי (RdRp) (ראה איור). \(\PageIndex{5}\) ה- RdRP מובא על ידי הנגיף וניתן להשתמש בו לייצור +ssRNA מהגנום המקורי -ssRNA. ה-RdRP הוא גם אנזים חשוב לשכפול של נגיפי dsRNA, מכיוון שהוא משתמש בגדיל השלילי של הגנום הדו-גדילי כתבנית ליצירת +ssRNA. לאחר מכן ניתן לתרגם את עותקי +ssRNA שסונתזו לאחרונה על ידי ריבוזומים סלולריים.
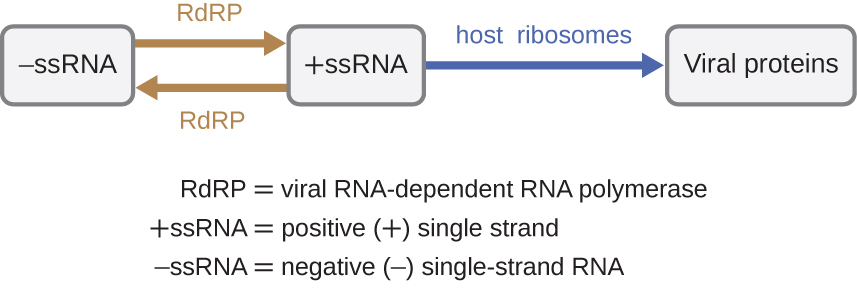
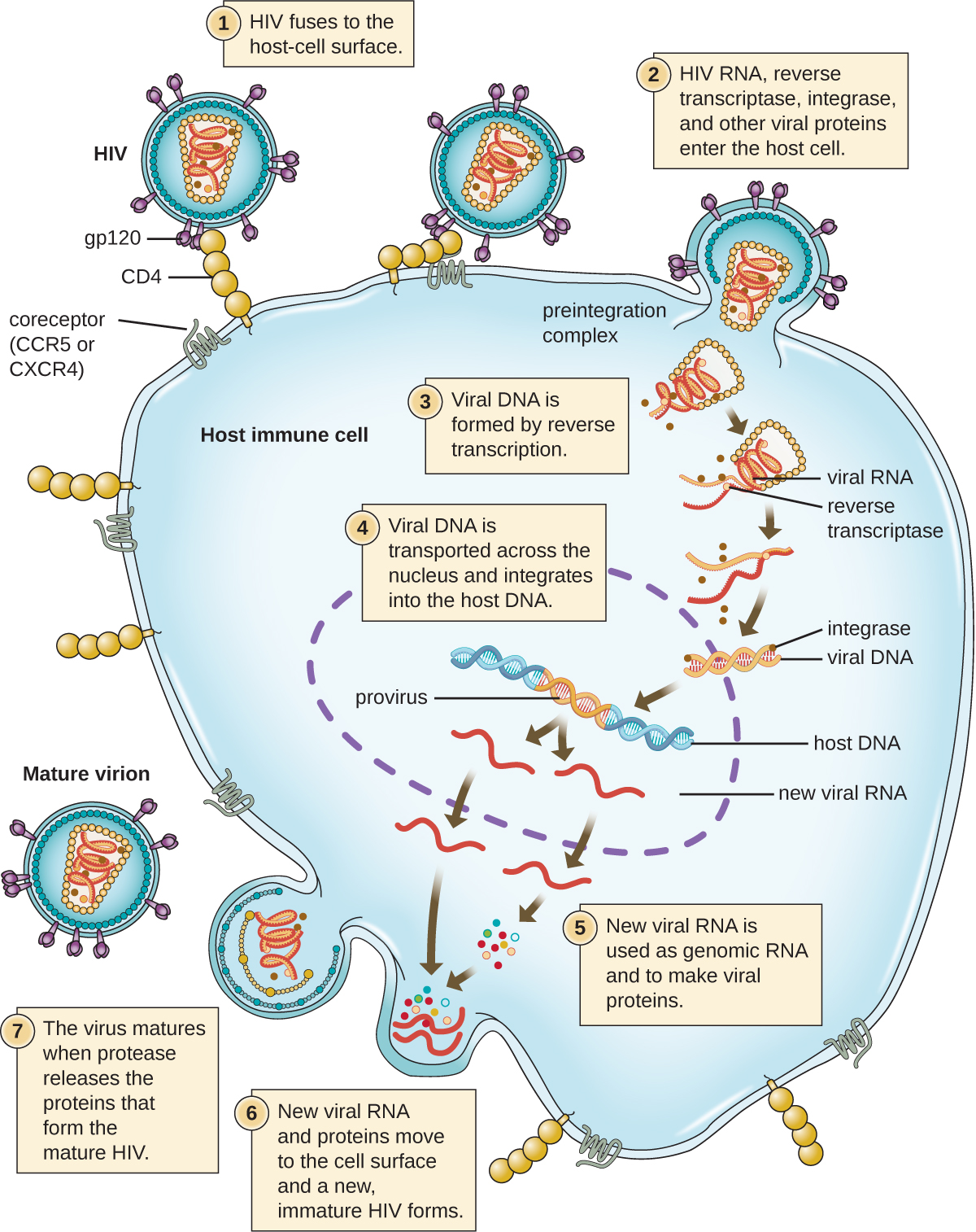
מנגנון חלופי לסינתזת חומצת גרעין ויראלית נצפה ברטרו-וירוס es, שהם נגיפי +ssRNA (ראה איור). \(\PageIndex{6}\) נגיפי RNA חד-גדילים כגון HIV נושאים אנזים מיוחד הנקרא טרנסקריפטאז הפוך בתוך הקפסיד המסנתז עותק ssDNA משלים (cDNA) באמצעות הגנום +ssRNA כתבנית. לאחר מכן ה- ssDNA הופך ל- dsDNA, שיכול להשתלב בכרומוזום המארח ולהפוך לחלק קבוע מהמארח. הגנום הנגיפי המשולב נקרא פרובירוס. הנגיף יכול כעת להישאר במארח זמן רב כדי לבסס זיהום כרוני. שלב הפרובירוס דומה לשלב הנבואה בזיהום חיידקי במהלך המחזור הליזוגני. עם זאת, בניגוד לנבואה, הפרובירוס אינו עובר כריתה לאחר שחבור לגנום.
תרגיל \(\PageIndex{3}\)
האם RNA פולימראז תלוי RNA עשוי מגן ויראלי או מגן מארח?
זיהומים מתמשכים
זיהום מתמשך מתרחש כאשר נגיף אינו מנוקה לחלוטין ממערכת המארח אלא נשאר ברקמות או באיברים מסוימים של האדם הנגוע. הנגיף עלול לשתוק או לעבור זיהום פרודוקטיבי מבלי לפגוע או להרוג את המארח ברצינות. מנגנונים של זיהום מתמשך עשויים לכלול ויסות של ביטויי הגן הנגיפי או המארח או שינוי התגובה החיסונית המארחת. שתי הקטגוריות העיקריות של זיהומים מתמשכים הן זיהום סמוי וזיהום כרוני. דוגמאות לנגיפים הגורמים לזיהומים סמויים כוללים נגיף הרפס סימפלקס (הרפס אוראלי ואיברי המין), נגיף דליות (אבעבועות רוח ורעפים) ונגיף אפשטיין-בר (מונונוקלאוזיס). נגיף הפטיטיס C ו- HIV הן שתי דוגמאות לנגיפים הגורמים לזיהומים כרוניים ארוכי טווח.
זיהום סמוי
לא כל נגיפי בעלי החיים עוברים שכפול על ידי המחזור הליטי. ישנם וירוסים המסוגלים להישאר מוסתרים או רדומים בתוך התא בתהליך שנקרא חביון. סוגים אלה של וירוסים ידועים בשם וירוסים סמויים ועלולים לגרום לזיהומים סמויים. וירוסים המסוגלים להשהות עלולים לגרום בתחילה לזיהום חריף לפני שהם הופכים לרדומים.
לדוגמא, נגיף הווריצלה-זוסטר מדביק תאים רבים בגוף וגורם לאבעבועות רוח, המאופיינות בפריחה של שלפוחיות המכסות את העור. כ-10 עד 12 ימים לאחר ההדבקה, המחלה נפתרת והנגיף הולך ונרדם, חי בתוך גרעיני תאי עצב במשך שנים. במהלך תקופה זו, הנגיף אינו הורג את תאי העצב או ממשיך לשכפל. לא ברור מדוע הנגיף מפסיק להשתכפל בתוך תאי העצב ומבטא מעט חלבונים ויראליים, אך במקרים מסוימים, בדרך כלל לאחר שנים רבות של תרדמה, הנגיף מופעל מחדש וגורם למחלה חדשה הנקראת שלבקת חוגרת (איור\(\PageIndex{7}\)). בעוד שאבעבועות רוח משפיעות על אזורים רבים בגוף, שלבקת חוגרת היא מחלה ספציפית לתאי עצב המגיחה מהגרעינים שבהם הנגיף היה רדומה.
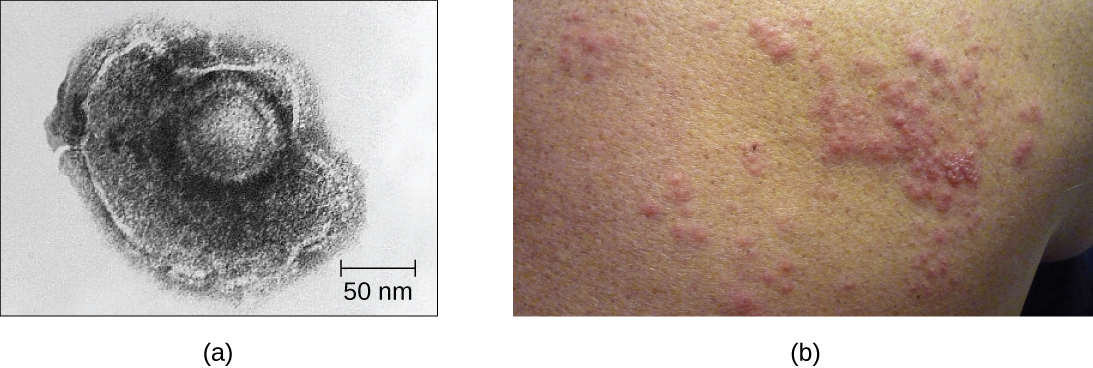
וירוסים סמויים עשויים להישאר רדומים על ידי קיומם כמולקולות גנום ויראליות מעגליות מחוץ לכרומוזום המארח. אחרים הופכים לפרובירוסים על ידי השתלבות בגנום המארח. במהלך הרדמה, וירוסים אינם גורמים לתסמינים של מחלה ועלולים להיות קשים לאיתור. מטופל עשוי להיות לא מודע לכך שהוא או היא נושאים את הנגיף אלא אם כן בוצעה בדיקת אבחון ויראלית.
זיהום כרוני
זיהום כרוני הוא מחלה עם תסמינים חוזרים או מתמשכים לאורך זמן. זיהומים ויראליים מסוימים יכולים להיות כרוניים אם הגוף אינו מסוגל לחסל את הנגיף. HIV הוא דוגמה לנגיף המייצר זיהום כרוני, לרוב לאחר תקופה ארוכה של חביון. ברגע שאדם נדבק ב- HIV, ניתן לאתר את הנגיף ברקמות ברציפות לאחר מכן, אך לעתים קרובות חולים שאינם מטופלים אינם חווים תסמינים במשך שנים. עם זאת, הנגיף שומר על התמדה כרונית באמצעות מספר מנגנונים המפריעים לתפקוד החיסוני, כולל מניעת ביטוי של אנטיגנים ויראליים על פני השטח של תאים נגועים, שינוי תאי החיסון עצמם, הגבלת ביטוי של גנים ויראליים ושינוי מהיר של אנטיגנים ויראליים באמצעות מוטציה. בסופו של דבר, הפגיעה במערכת החיסון גורמת להתקדמות המחלה המובילה לתסמונת הכשל החיסוני הנרכש (איידס). המנגנונים השונים בהם משתמש HIV כדי להימנע מפינוי על ידי מערכת החיסון משמשים גם וירוסים אחרים המדביקים כרונית, כולל נגיף הפטיטיס C.
תרגיל \(\PageIndex{4}\)
באילו שתי דרכים יכול וירוס להצליח לשמור על זיהום מתמשך?
מחזור חיים של וירוסים עם מארחי צמחים
וירוסים צמחיים דומים יותר לנגיפים של בעלי חיים מאשר לבקטריופאגים. וירוסים צמחיים עשויים להיות עטופים או לא עטופים. כמו וירוסים רבים של בעלי חיים, לנגיפים צמחיים יכול להיות גנום DNA או RNA ולהיות חד גדילי או כפול. עם זאת, לרוב הנגיפים הצמחיים אין גנום DNA; לרובם יש גנום +ssRNA, הפועל כמו RNA שליח (mRNA). רק למיעוט של וירוסים צמחיים יש סוגים אחרים של גנומים.
לנגיפי צמחים עשוי להיות טווח מארח צר או רחב. לדוגמה, נגיף ההדרים טריסטזה מדביק רק כמה צמחים מהסוג הדרים, בעוד שנגיף פסיפס המלפפון מדביק אלפי צמחים ממשפחות צמחים שונות. רוב נגיפי הצמחים מועברים במגע בין צמחים, או על ידי פטריות, נמטודות, חרקים או פרוקי רגליים אחרים הפועלים כווקטורים מכניים. עם זאת, וירוסים מסוימים יכולים להיות מועברים רק על ידי סוג מסוים של וקטור חרקים; לדוגמה, וירוס מסוים עשוי להיות מועבר על ידי כנימות אך לא זבובים לבנים. במקרים מסוימים, וירוסים עלולים להיכנס גם לצמחים בריאים דרך פצעים, כפי שעלול להתרחש עקב גיזום או נזקי מזג אוויר.
נגיפים המדביקים צמחים נחשבים לטפילים ביוטרופיים, מה שאומר שהם יכולים ליצור זיהום מבלי להרוג את המארח, בדומה למה שנצפה במחזורי החיים הליזוגניים של בקטריופאגים. זיהום ויראלי יכול להיות אסימפטומטי (סמוי) או יכול להוביל למוות של תאים (זיהום ליטי). מחזור החיים מתחיל עם החדירה של הנגיף לתא המארח. לאחר מכן, הנגיף אינו מצופה בתוך הציטופלזמה של התא כאשר הקפסיד מוסר. בהתאם לסוג חומצת הגרעין, רכיבים תאיים משמשים לשכפול הגנום הנגיפי וסינתזה של חלבונים ויראליים להרכבה של וירונים חדשים. כדי ליצור זיהום מערכתי, הנגיף חייב להיכנס לחלק של מערכת כלי הדם של הצמח, כגון פלואם. הזמן הנדרש לזיהום מערכתי עשוי להשתנות בין מספר ימים למספר שבועות בהתאם לנגיף, מיני הצמחים ותנאי הסביבה. מחזור החיים של הנגיף הושלם כאשר הוא מועבר מצמח נגוע לצמח בריא.
תרגיל \(\PageIndex{5}\)
מהו המבנה והגנום של וירוס צמחי טיפוסי?
עקומת צמיחה ויראלית
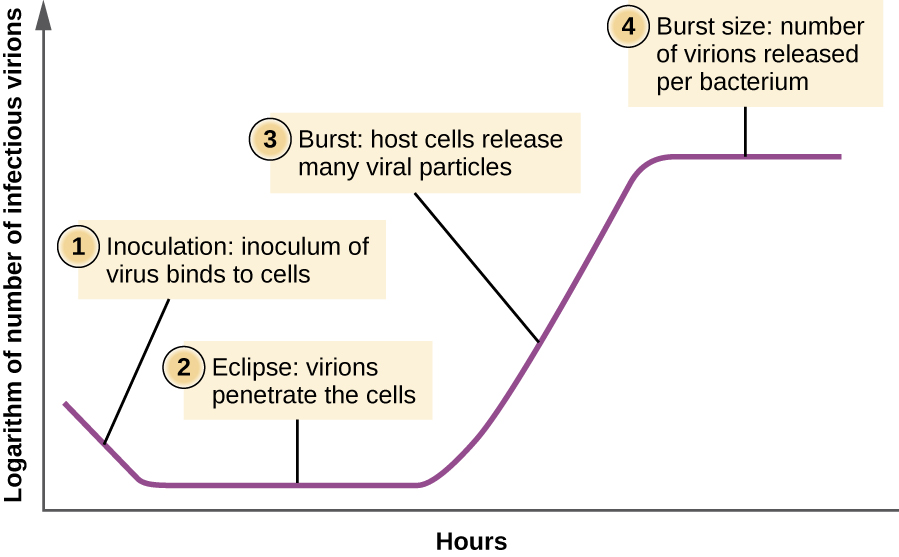
בניגוד לעקומת הגידול של אוכלוסיית חיידקים, עקומת הגידול של אוכלוסיית וירוסים לאורך מחזור חייה אינה עוקבת אחר עקומה סיגמואידית. במהלך השלב הראשוני, חיסון של וירוס גורם לזיהום. בשלב הליקוי, וירוסים נקשרים וחודרים לתאים ללא וירוסים שזוהו במדיום. ההבדל העיקרי שמופיע לאחר מכן בעקומת הצמיחה הנגיפית בהשוואה לעקומת גדילה של חיידקים מתרחש כאשר וירונים משתחררים מהתא המארח המנומר בו זמנית. התרחשות כזו נקראת פרץ, ומספר הנגיפים לכל חיידק המשתחרר מתואר כגודל ההתפרצות. בעקומת כפל של שלב אחד עבור בקטריופאג ', התאים המארחים משתחררים, ומשחררים חלקיקים ויראליים רבים למדיום, מה שמוביל לעלייה תלולה מאוד בטיטר הנגיפי (מספר הנגיפים ליחידת נפח). אם לא נותרו תאי מארח ברי קיימא, החלקיקים הנגיפיים מתחילים להתפרק במהלך הירידה של התרבות (ראה איור\(\PageIndex{8}\)).
תרגיל \(\PageIndex{6}\)
איזה היבט של מחזור החיים של וירוס מוביל לעלייה פתאומית בעקומת הצמיחה?
טיפולים לא רשומים
אבולה חשוכת מרפא וקטלנית. ההתפרצות במערב אפריקה בשנת 2014 הייתה חסרת תקדים, וגמדה מגפות אבולה אנושיות אחרות ברמת התמותה. מתוך 24,666 מקרים חשודים או מאושרים שדווחו, 10,179 בני אדם מתו. 1
אין טיפולים מאושרים או חיסונים לאבולה זמינים. בעוד שחלק מהתרופות הראו פוטנציאל במחקרי מעבדה ובמודלים של בעלי חיים, הן לא נבדקו בבני אדם לבטיחות ויעילות. לא רק שתרופות אלו אינן נבדקות או לא רשומות, אלא שהן גם במחסור.
בהתחשב בסבל הרב ובשיעורי התמותה הגבוהים, הוגן לשאול האם תרופות לא רשומות ולא נבדקות עדיפות על אף אחת בכלל. האם יש לוותר על תרופות כאלה, ואם כן, מי צריך לקבל אותן, לאור האספקה המוגבלת ביותר שלהן? האם זה מוסרי לטפל בתרופות שלא נבדקו בחולים עם אבולה? מצד שני, האם זה מוסרי למנוע תרופות שעלולות להציל חיים מחולים גוססים? או שאולי התרופות צריכות להיות שמורות לספקי שירותי בריאות הפועלים להכיל את המחלה?
באוגוסט 2014 טופלו שני עובדי סיוע אמריקאים נגועים וכומר ספרדי ב- ZMapp, תרופה לא רשומה שנבדקה בקופים אך לא בבני אדם. שני עובדי הסיוע האמריקאים התאוששו, אך הכומר מת. מאוחר יותר באותו חודש, ארגון הבריאות העולמי פרסם דו"ח על האתיקה של טיפול בחולים עם התרופה. מכיוון שאבולה היא לעתים קרובות קטלנית, הפאנל נימק כי זה מוסרי לתת את התרופות הלא רשומות ולא מוסרי לעכב אותן בגלל חששות בטיחותיים. מצב זה הוא דוגמה ל"שימוש רחום "מחוץ למערכת הוויסות והממשל המבוססת של טיפולים.
אבולה בארצות הברית
ב- 24 בספטמבר 2014 הגיע תומאס אריק דאנקן לבית החולים הפרסביטריאני לבריאות טקסס בדאלאס כשהוא מתלונן על חום, כאבי ראש, הקאות ושלשולים - תסמינים הנצפים בדרך כלל בחולים עם הצטננות או שפעת. לאחר בדיקה, רופא מחלקת חירום איבחן אותו עם סינוסיטיס, רשם כמה אנטיביוטיקה, ושלח אותו הביתה. יומיים לאחר מכן חזר דאנקן לבית החולים באמבולנס. מצבו הידרדר ובדיקות דם נוספות אישרו שהוא נדבק בנגיף האבולה.
מחקירות נוספות עולה כי דאנקן חזר זה עתה מליבריה, אחת המדינות בעיצומה של מגיפת אבולה קשה. ב -15 בספטמבר, תשעה ימים לפני שהופיע בבית החולים בדאלאס, סייע דאנקן להעביר שכן מוכה אבולה לבית חולים בליבריה. בית החולים המשיך לטפל בדאנקן, אך הוא מת מספר ימים לאחר שאושפז.
ציר הזמן של מקרה דאנקן מעיד על מחזור החיים של נגיף האבולה. זמן הדגירה של אבולה נע בין 2 ימים ל 21 ימים. תשעה ימים חלפו בין חשיפתו של דאנקן לזיהום הנגיף לבין הופעת הסימפטומים שלו. זה תואם, בין השאר, את תקופת הליקוי בגידול אוכלוסיית הנגיף. בשלב הליקוי, דאנקן לא היה מסוגל להעביר את המחלה לאחרים. עם זאת, ברגע שאדם נגוע מתחיל להפגין תסמינים, המחלה הופכת מדבקת מאוד. נגיף האבולה מועבר באמצעות מגע ישיר עם טיפות נוזלי גוף כמו רוק, דם והקאות. דאנקן יכול היה להעביר את המחלה לאחרים בכל עת לאחר שהחל לסבול מתסמינים, ככל הנראה זמן מה לפני הגעתו לבית החולים בדאלאס. ברגע שבית חולים מבין שחולה כמו דאנקן נגוע בנגיף האבולה, המטופל נמצא בהסגר מיידי, ופקידי בריאות הציבור יוזמים עקבות גב כדי לזהות את כל מי שחולה כמו דאנקן עשוי לקיים אינטראקציה במהלך התקופה בה הוא הראה סימפטומים.
פקידי בריאות הציבור הצליחו לאתר 10 אנשים בסיכון גבוה (בני משפחה של דאנקן) ו -50 אנשים בסיכון נמוך כדי לעקוב אחר סימני זיהום. אף אחד מהם לא נדבק במחלה. עם זאת, אחת האחיות שהואשמו בטיפולו של דאנקן אכן נדבקה. זה, יחד עם האבחון השגוי הראשוני של דאנקן, הבהיר כי בתי החולים בארה"ב צריכים לספק הכשרה נוספת לצוותים רפואיים כדי למנוע התפרצות אבולה אפשרית בארה"ב.
תרגיל \(\PageIndex{7}\)
- אילו סוגים של הכשרה יכולים להכין אנשי מקצוע בתחום הבריאות להכיל מגיפות מתעוררות כמו התפרצות האבולה של 2014?
- מה ההבדל בין פתוגן מדבק לבין פתוגן מדבק?

למידע נוסף על אבולה, אנא בקר באתר CDC.
סיכום
- וירוסים רבים מכוונים למארחים או לרקמות ספציפיות. לחלקם יש יותר ממארח אחד.
- וירוסים רבים עוקבים אחר מספר שלבים כדי להדביק תאי מארח. שלבים אלה כוללים התקשרות, חדירה, ביטול ציפוי, ביוסינתזה, התבגרות ושחרור.
- לבקטריופאגים יש מחזור ליטי או ליזוגני. המחזור הליטי מוביל למותו של המארח, ואילו המחזור הליזוגני מוביל לשילוב של הפאג בגנום המארח.
- בקטריופאגים מזריקים DNA לתא המארח, ואילו וירוסים של בעלי חיים נכנסים על ידי אנדוציטוזה או היתוך ממברנה.
- וירוסים של בעלי חיים יכולים לעבור חביון, בדומה לליזוגניה עבור בקטריופאג.
- רוב הנגיפים הצמחיים הם ssRNA בעל גדילים חיוביים ויכולים לעבור חביון, זיהום כרוני או ליטי, כפי שנצפה עבור וירוסים של בעלי חיים.
- עקומת הגידול של אוכלוסיות בקטריופאגים היא עקומת כפל חד-שלבית ולא עקומה סיגמואידית, בהשוואה לעקומת הצמיחה של החיידקים.
- בקטריופאגים מעבירים מידע גנטי בין מארחים באמצעות התמרה כללית או מיוחדת.
הערות שוליים
- 1 ארגון הבריאות העולמי. "נתונים וסטטיסטיקה של אבולה של WHO." 18 במרץ 2005. http://apps.who.int/gho/data/view.eb...150318? לאנג=en


