11.3E: פגוציטוזיס
- Page ID
- 209032
תאר בקצרה את תפקידם של הדברים הבאים בהתייחסות לפגוציטוזיס: - דלקת
- בלוטות לימפה
- בלוטות לימפה
- טחול
תאר את השלבים הבאים בפגוציטוזיס: - הפעלה
- כימוטקסיס
- קובץ מצורף (גם לא משופר וגם משופר)
- להכניס לקיבה
- הרס
ציין מה קורה כאשר כל אחד מהפגוציטים מוצפים בחיידקים או שהם נצמדים לתאים גדולים כדי לעבור פגוציטוזה. תאר מה גורם לרוב הרס הרקמות שנראה במהלך זיהומים מיקרוביאליים. השווה את מערכות ההרג התלויות בחמצן ובלתי תלויות בחמצן של נויטרופילים ומקרופאגים. תאר בקצרה את תפקידה של אוטופגיה בהסרת חיידקים תוך תאיים.
- הפעלה
- כימוטקסיס
- קובץ מצורף (גם לא משופר וגם משופר)
- להכניס לקיבה
- הרס

בנוסף, תאי לנגרהנס (תאים דנדריטים לא בשלים) ממוקמים בכל אפיתל העור, דרכי הנשימה ודרכי העיכול, שם בצורתם הלא בשלה הם מחוברים בתהליכים ציטופלסמיים ארוכים. עם לכידת אנטיגנים באמצעות פינוציטוזיס ופגוציטוזיס והופעל על ידי ציטוקינים פרו-דלקתיים, התאים הדנדריטים מתנתקים מהאפיתל, נכנסים לכלי לימפה ונישאים לבלוטות לימפה אזוריות. עד שהם נכנסים לבלוטות הלימפה, הם התבגרו וכעת הם מסוגלים להציג אנטיגן לאוכלוסיות המשתנות ללא הרף של לימפוציטים T תמימים הממוקמים בקליפת המוח של בלוטות הלימפה.
הטחול מכיל סיבים רשתיים רבים התומכים במקרופאגים קבועים ובתאים דנדריטים, כמו גם אוכלוסיות המשתנות ללא הרף של לימפוציטים B ולימפוציטים מסוג T במחזור. הדם נושא מיקרואורגניזמים לטחול שם הם מסוננים החוצה ופגוציטוזים על ידי המקרופאגים והתאים הדנדריטים הקבועים ומוצגים בפני לימפוציטים B ולימפוציטים T במחזור כדי ליזום תגובות חיסוניות אדפטיביות. ישנם גם מקרופאגים ותאים דנדריטים מיוחדים הממוקמים במוח (מיקרוגליה), ריאות (מקרופאגים מכתשית), כבד (תאי קופפר), כליות (תאים מזנגיאליים), עצמות (אוסטאוקלסטים) ודרכי העיכול (מקרופאגים פריטוניאליים).
השלבים המעורבים בפגוציטוזיס
ישנם מספר שלבים ברורים המעורבים בפגוציטוזיס:
שלב 1: הפעלת הפגוציט
פגוציטים במנוחה מופעלים על ידי מתווכים דלקתיים כגון מוצרים חיידקיים (חלבונים חיידקיים, כמוסות, LPS, פפטידוגליקן, חומצות טיכואיות וכו '), חלבונים משלימים, ציטוקינים דלקתיים ופרוסטגלנדינים. כתוצאה מכך, הפגוציטים המסתובבים מייצרים קולטני גליקופרוטאין על פני השטח המגבירים את יכולתם להיצמד למשטח הפנימי של דפנות הנימים, ומאפשרים להם להידחק מהנימים ולהימשך לאתר ההדבקה.
בנוסף, הם מייצרים קולטנים לזיהוי דפוסים אנדוציטיים המזהים ונקשרים לדפוסים מולקולריים הקשורים לפתוגן או PAMPs - מרכיבים של מולקולות מיקרוביאליות נפוצות כגון פפטידוגליקן, חומצות טייכואיות, ליפופוליסכריד וגליקנים עשירים במאנוז שאינם נמצאים בתאים אנושיים - לחבר את החיידק לפגוציט למה שנקרא התקשרות לא משופרת (נדון להלן). הם גם מפגינים פעילות מטבולית ומיקרוביצידית מוגברת על ידי הגדלת הייצור שלהם של ATPs, אנזימים ליזוזומליים, מחמצנים קטלניים וכו'.
שלב 2: כימוטקסיס של פגוציטים (למקרופאגים נודדים, נויטרופילים ואאוזינופילים)
כימוטקסיס היא תנועה של פגוציטים לעבר ריכוז הולך וגובר של חומר משיכה כלשהו כגון גורמים חיידקיים (חלבונים חיידקיים, כמוסות, LPS, פפטידוגליקן, חומצות טייכואיות וכו '), חלבונים משלימים (C5a), כימוקינים (ציטוקינים כימוטקטיים כגון אינטרלוקין -8 המופרשים על ידי תאים שונים), מוצרים מפוצלים של פיברין, קינינים ופוספוליפידים המשתחררים על ידי תאי מארח פצועים.
| סרט המציג כימוטקסיס על ידי נויטרופילים. Chemotaxis של נויטרופילים. © מ זרים אינטימיים: חיים בלתי נראים על כדור הארץ. נוצר על ידי מונדו מדיה. פיטר בייקר, מפיק בכיר. מורשה לשימוש, מיקרובליברי ASM. |
| אנימציית You Tube המסכמת פגוציטוזיס על ידי מקרופאג. |
| סרט You Tube הממחיש כימוטקסיס. |
כמה חיידקים, כגון נגיפי שפעת A, שחפת Mycobacterium, זנים פולשניים בדם של Neisseria gonorrhoeae ו שעלת בורדלה הוכחו כחוסמים כימוטקסיס.
שלב 3: התקשרות של הפגוציט לחיידק או לתא
צירוף של מיקרואורגניזמים הוא הכרחי עבור בליעה. הקובץ המצורף עשוי להיות לא משופר או משופר.

ג. לכידה חוץ-תאית עם NETs: בתגובה לדפוסים מולקולריים מסוימים הקשורים לפתוגן כגון LPS, וציטוקינים מסוימים כגון IL-8, נויטרופילים משחררים DNA וחלבונים גרגירים אנטי-מיקרוביאליים. מלכודות חוץ-תאיות נויטרופילים אלה (NETs) נקשרות לחיידקים, מונעות מהן להתפשט והורגות אותן עם חלבונים אנטי-מיקרוביאליים (ראה איור \(\PageIndex{15}\) ואיור \(\PageIndex{16}\)).
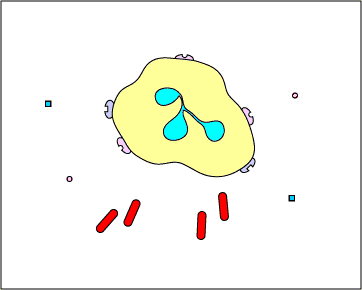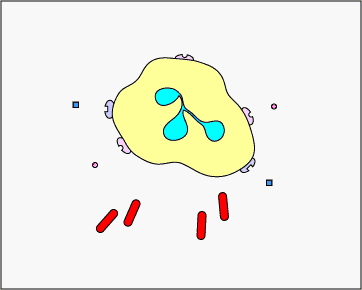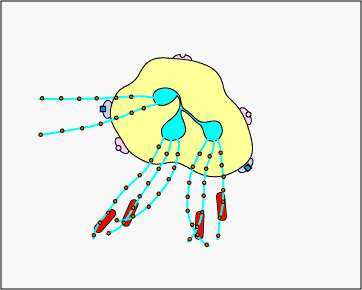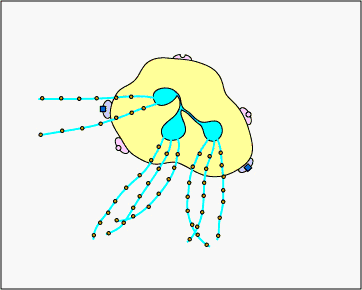
נויטרופילים NETS לוכדים והורגים חיידקים. בתגובה לדפוסים מולקולריים מסוימים הקשורים לפתוגן כגון LPS, וציטוקינים מסוימים כגון IL-8, נויטרופילים משחררים DNA וחלבונים גרגירים אנטי-מיקרוביאליים. מלכודות חוץ-תאיות נויטרופילים אלה (NETs) נקשרות לחיידקים, מונעות מהן להתפשט והורגות אותן עם חלבונים אנטי-מיקרוביאליים כגון היסטונים ואלסטינים. השערה אחת, המוצגת באנימציה זו, מציעה שה-NETs מיוצרים על ידי נויטרופילים חיים בתגובה לחיידקים. לחלופין, NETs עשויים להשתחרר כתוצאה ממוות תאי נמק של נויטרופילים.
חלק מהמיקרואורגניזמים עמידים יותר בפני התקשרות פגוציטית.
כמוסות יכולות לעמוד בפני התקשרות לא משופרת על ידי מניעת קולטני זיהוי התבניות האנדוציטיות על פגוציטים לזהות את רכיבי דופן התא החיידקי ופחמימות המכילות מנוז (ראה איור). \(\PageIndex{14}\) סטרפטוקוקוס. דלקת ריאות מפעילה את מסלול המשלים הקלאסי, אך מתנגדת לאופסוניזציה של C3b, והשלמה גורמת לדלקת נוספת בריאות.
סרט של חיידק מכוסה המתנגד לבליעה על ידי נויטרופיל. פגוציטוזיס © ג'יימס סאליבן, מחבר. מורשה לשימוש, מיקרובליברי ASM.
ב. חלק מהכמוסות מונעות היווצרות של C3 convertase, אנזים מוקדם במסלולי המשלים. ללא אנזים זה, האופסונינים C3b ו- C4b, כמו גם החלבונים המועילים האחרים אינם מיוצרים.
ג. כמוסות אחרות, עשירות בחומצה סיאלית, מרכיב נפוץ בגליקופרוטאין של התא המארח, יש זיקה לחלבון H בסרום, חלבון רגולטורי משלים המוביל לפירוק האופסונין C3b על ידי גורם I ויצירת C3 convertase. (חלבון H בסרום הוא מה שמוביל בדרך כלל לפירוק של כל C3b הנקשר לגליקופרוטאינים מארחים כך שלא נדביק את הפגוציטים שלנו לתאים שלנו עם C3b.)
ד חלק מהכמוסות פשוט מכסות את ה-C3b שאכן נקשר למשטח החיידק ומונע מהקולטן C3b על פגוציטים ליצור קשר עם ה-C3b (ראה איור). \(\PageIndex{3}\) זה נראה עם הקפסולה של סטרפטוקוקוס דלקת ריאות.
ה. ל- Neisseria meningitidis יש כמוסה המורכבת מחומצה סיאלית ואילו סטרפטוקוקוס פיוגנים (סטרפטוקוקים בטא מקבוצה A) יש כמוסה העשויה מחומצה היאלורונית. שני הפוליסכרידים הללו דומים מאוד לפחמימות הנמצאות בפוליסכרידים של רקמות אנושיות ומכיוון שהם אינם מוכרים כזרים על ידי הלימפוציטים המבצעים את התגובות החיסוניות, נוגדנים אינם נוצרים כנגד כמוסות אלו. באופן דומה, חיידקים מסוימים מסוגלים לצפות את עצמם בחלבונים מארחים כמו פיברונקטין, לקטופרין או טרנספרין ובדרך זו נמנעים מנוגדנים.
ו. מולקולת ממברנה חיצונית של Neisseria gonorrhoeae הנקראת חלבון II וחלבון M של סטרפטוקוקוס פיוגנים מאפשרים לחיידקים אלה להיות עמידים יותר בפני בליעה פגוציטית. חלבון M של S. pyogenes, למשל, קושר את גורם H של מסלול המשלים וזה גורם לפירוק של האופסונין C3b לפי גורם I ויצירת C3 convertase. S. pyogenes מייצר גם פרוטאז שמבקע את החלבון המשלים C5a.
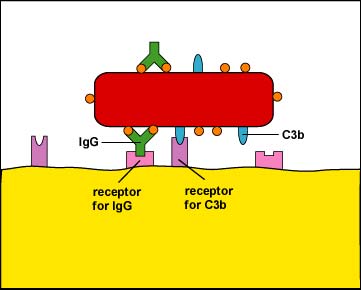
ז. Staphylococcus aureus מייצר חלבון A בעוד סטרפטוקוקוס פיוגנס מייצר חלבון G. שני החלבונים הללו נקשרים לחלק ה- Fc של הנוגדנים (ראה איור\(\PageIndex{4}\)) ובדרך זו החיידקים מצופים בנוגדנים באופן שאינו גורם לאופסוניזציה (ראה איור). \(\PageIndex{5}\)
שלב 4: בליעת החיידק או התא על ידי הפגוציט
לאחר ההתקשרות, פילמור ולאחר מכן דה-פולימריזציה של חוטי אקטין שולחים פסאודופודים החוצה כדי לבלוע את החיידק (ראה איור\(\PageIndex{6}\)) ולמקם אותו בשלפוחית אנדוציטית הנקראת פגוזום (ראה איור). \(\PageIndex{7}\)
במהלך תהליך זה, משאבת אלקטרונים מביאה פרוטונים (H +) לתוך הפאגוזום. זה מוריד את ה-pH בתוך הפגוזום ל-3.5 - 4.0 כך שכאשר ליזוזום מתמזג עם הפגוזום, ה-pH נכון להידרולאזים החומציים כדי לפרק ביעילות חלבונים תאיים. ההחמצה משחררת גם דפנסינים, קתליצידין וחלבון המעורר חדירות חיידקים (BPI), פפטידים ואנזימים שיכולים להרוג חיידקים, ממטריצה ולאפשר את הפעלתם.
סריקת מיקרוגרפים אלקטרונים של מקרופאג עם פסאודופודים ופגוציטוזינג מקרופאג E. coli על כלי דם; באדיבות המיקרוסקופיה של דניס קונקל.
חיידקים תוך תאיים, כגון וירוסים וחיידקים הפולשים לתאי מארח, יכולים להיבלע גם ברגע שהם נכנסים לציטוזול של התא בתהליך הנקרא אוטופגיה. תא קשור לממברנה הנקרא אוטופגוזום גדל סביב החיידק והציטוזול שמסביב ולאחר מכן מעביר אותו לליזוזומים להשמדה (ראה איור). \(\PageIndex{17}\) (תהליך זה משמש גם תאים אוקריוטיים כדי לבלוע ולפרק רכיבים תאיים מיותרים או לא מתפקדים כגון אברונים פגומים.)
חלק מהמיקרואורגניזמים עמידים יותר בפני בליעה פגוציטית
א. ירסיניה פתוגנית, כמו זו הגורמת למגיפה, פגוציטים במגע ובאמצעות מערכת הפרשה מסוג III, מספקת חלבונים אשר דה-פולימריזים את מיקרופילמנטים האקטין הדרושים לבליעה פגוציטית לתוך הפגוציטים (ראה איור). \(\PageIndex{8}\) חלבון ירסיניה נוסף מפרק את C3b ו- C5a.
ב. חיידקים מסוימים, כמו שחפת Mycobacterium, סלמונלה וליסטריה מונוציטוגנים יכולים לחסום אוטופגיה.
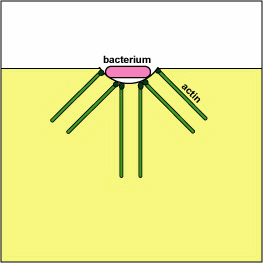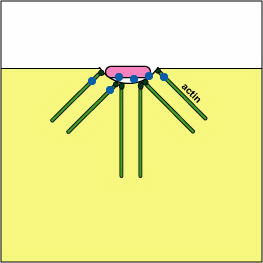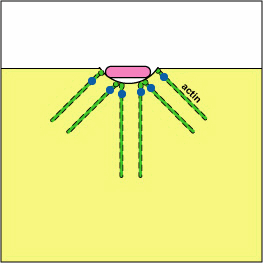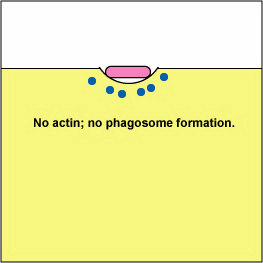
חסימת היווצרות פגוזומים על ידי דה-פולימריזציה של אקטין. מולקולות של חיידקים מסוימים, באמצעות מערכת הפרשה מסוג III, מספקות חלבונים אשר מפטרים את מיקרופילמנטים האקטין של הפגוציטים המשמשים לבליעה פגוציטית.
שלב 5: הרס החיידק או התאפגוציטים מכילים שקיות קרומיות הנקראות ליזוזומים המיוצרים על ידי מנגנון גולגי המכילים אנזימי עיכול שונים, כימיקלים מיקרוביצידיים ורדיקלי חמצן רעילים. הליזוזומים נעים לאורך המיקרוטובולים בתוך הפגוציט ומתמזגים עם הפגוזומים המכילים את החיידקים הנבלעים והחיידקים נהרסים (ראה איור). \(\PageIndex{9}\)
לצפייה במיקרוגרף אלקטרונים של פגוליסוזום, עיין בדף האינטרנט של המכללה לרפואה של אוניברסיטת אילינוי.
| אנימציית You Tube המסכמת פגוציטוזיס על ידי מקרופאג. |
חלק מהחיידקים עמידים יותר להרס פגוציטי לאחר שנבלעו.
א. חלק מהחיידקים, כגון Legionella pneumophilia ו Mycobacterium מינים, גורמים לתא הפגוציטי למקם אותם לתוך ואקום אנדוציטי באמצעות מסלול המפחית את חשיפתם לתרכובות חמצן רעילות.
ב. חלק מהחיידקים, כגון סלמונלה, עמידים יותר לצורות חמצן רעילות ולדיפנסינים (פפטידים רעילים ההורגים חיידקים).
ד. Neisseria gonorrhoeae מייצר חלבון Por (חלבון I) המונע מפגוזומים להתמזג עם ליזוזומים המאפשר לחיידקים לשרוד בתוך פגוציטים.
חיידקים מסוימים, כגון מינים של סלמונלה, מיקובקטריום, לגיונלה וכלמידיה, חוסמים את מכונות ההובלה השלפוחית המאפשרות לפגוזום להתמזג עם הליזוזום.
ו. חיידקים מסוימים, כגון Mycobacterium פתוגני ו- Legionella pneumophilia, מונעים את החמצת הפגוזום הדרושה להרג יעיל של חיידקים על ידי אנזימים ליזוזומליים. (בדרך כלל לאחר היווצרות הפגוזום, התוכן הופך לחומץ מכיוון שהאנזימים הליזוזומליים המשמשים להרג מתפקדים בצורה יעילה הרבה יותר ב- pH חומצי.)
הפיגמנטים הקרוטנואידים המעניקים ל- Staphylococcus aureus את צבעו הזהוב ואת סטרפטוקוקים מקבוצה B (GBS) את הגוון הכתום שלו מגנים על החיידקים מפני החמצון הרעיל שהנויטרופילים משתמשים בהם כדי להרוג חיידקים.
ח. שומנים בדופן התא של שחפת Mycobacterium, כגון lipoarabinomannan, עוצרים את התבגרות הפגוזומים המונעים את העברת החיידקים לליזוזומים.
כלומר חיידקים מסוימים מסוגלים להרוג פגוציטים. חיידקים כגון Staphylococcus aureus ו סטרפטוקוקוס פיוגנים מייצרים את האקסוטוקסין לוקוצידין הפוגע בקרום הציטופלזמי של הפגוציט. מצד שני, חיידקים, כמו שיגלה וסלמונלה, גורמים לאפופטוזיס מקרופאגים, מוות תאי מתוכנת.
אם אתר ההדבקה מכיל מספר גדול מאוד של מיקרואורגניזמים ורמות גבוהות של ציטוקינים דלקתיים וכימוקינים מיוצרים בתגובה ל-PAMPs, הפגוציט ירוקן את תכולת הליזוזומים שלו בתהליך הנקרא דגרנולציה על מנת להרוג את המיקרואורגניזמים או התא מחוץ לתאים.
עם זאת, תכנים ליזוזומליים משוחררים אלה הורגים גם תאים ורקמות מארח שמסביב. רוב הרס הרקמות הקשור לזיהומים הוא תוצאה של תהליך זה (ראה איור\(\PageIndex{11}\)).
[1]הפגוציט גם ירוקן את תכולת הליזוזומים שלו להרג חוץ תאי אם התא שאליו נצמד הפגוציט גדול מכדי להיבלע (ראה איור ואיור). \(\PageIndex{12}\) \(\PageIndex{13}\)
ישנן 2 מערכות הרג בנויטרופילים ובמקרופאגים: המערכת התלויה בחמצן והמערכת הבלתי תלויה בחמצן.
1. המערכת התלויה בחמצן: ייצור מיני חמצן תגובתיים (ROS)
הממברנה הציטופלסמית של פגוציטים מכילה את האנזים אוקסידאז הממיר חמצן לאניון סופראוקסיד (O 2-). זה יכול לשלב עם מים באמצעות האנזים דיסמוטאז ליצירת מי חמצן (H 2 O 2) ורדיקלים הידרוקסיל (OH).
במקרה של נויטרופילים, אך לא מקרופאגים, מי החמצן יכול להשתלב עם יוני כלוריד (Cl 2-) על ידי פעולת האנזים מיאלופרוקסידאז (MPO) ליצירת חומצה היפוכלורית (HOCL) וחמצן יחיד.
במקרופאגים, תחמוצת החנקן (NO) יכולה להשתלב עם מי חמצן ליצירת רדיקלים פרוקסיניטריטים. (בנוסף ל-ROS ו-NO, מקרופאגים מפרישים ציטוקינים דלקתיים כגון TNF-alpha, IL-1, IL-8 ו-IL-12 כדי לקדם תגובה דלקתית.)
תרכובות אלו הן מאוד חיידקיות מכיוון שהן חומרי חמצון רבי עוצמה המחמצנים את רוב הקבוצות הכימיות המצויות בחלבונים, אנזימים, פחמימות, DNA ושומנים. חמצון שומנים יכול לפרק ממברנות ציטופלזמיות. ביחד, רדיקלים חופשיים מחמצנים אלה נקראים מיני חמצן תגובתיים (ROS).
אוקסידאז פועל גם כמשאבת אלקטרונים המביאה פרוטונים (H +) לפגוזום. זה מוריד את ה-pH בתוך הפגוזום כך שכאשר ליזוזומים מתמזגים עם הפגוזום, ה-pH נכון להידרולאזים החומציים, כמו אלסטאז, כדי לפרק ביעילות חלבונים תאיים.
בנוסף לפגוציטים המשתמשים במערכת תלוית חמצן זו כדי להרוג חיידקים תוך תאיים, נויטרופילים גם משחררים באופן שגרתי את חומרי החמצון הללו, כמו גם הידרולאזים חומציים, לצורך הריגת חיידקים מחוץ לתאים. סוכנים אלה, לעומת זאת, בסופו של דבר הורגים את הנויטרופילים עצמם, כמו גם כמה תאי גוף ורקמות שמסביב כפי שהוזכר לעיל.
2. המערכת הבלתי תלויה בחמצן
חלק מהליזוזומים מכילים דפנסינים), פפטידים קטיוניים המשנים ממברנות ציטופלזמיות; ליזוזים, אנזים המפרק פפטידוגליקן, לקטופרין, חלבון המונע מחיידקים ברזל נחוץ; קתפסין G, פרוטאז הגורם נזק לממברנות המיקרוביאליות; אלסטאז, פרוטאז ההורג סוגים רבים של חיידקים; קתליצידינים, חלבונים שעם המחשוף רעילים ישירות למגוון של מיקרואורגניזמים; חלבון המשרה חדירות חיידקים (BPI), חלבונים המשמשים נויטרופילים להרוג חיידקים מסוימים על ידי פגיעה בקרום שלהם; קולגנאז; ואנזימי עיכול שונים אחרים המציגים פעילות אנטי-מיקרוביאלית על ידי פירוק חלבונים, RNA, תרכובות פוספט, שומנים ופחמימות.
לסטרפטוקוקוס פיוגנס יש כמוסה העשויה מחומצה היאלורונית, פוליסכריד שנמצא גם על תאים אנושיים.
תאר איזו משמעות יש לזה בחיידק המתנגד לפגוציטוזיס ומדוע.
- סטרפטוקוקוס פיוגנס מייצר חלבון הנקרא חלבון G הנקשר לחלק ה- Fc של IgG אנושי.
תאר איזו משמעות יש לזה בחיידק המתנגד לפגוציטוזיס ומדוע.
- חיידקים רבים מייצרים כמוסות המכסות את דופן התא שלהם.
תאר איזו משמעות יש לזה בחיידק המתנגד לפגוציטוזיס ומדוע.
- לאנשים שנולדו עם מחלה גרנולומטית כרונית יש נויטרופילים חסרי האנזים אוקסידאז בקרום הציטופלזמי שלהם.
תאר איזו משמעות יש לזה בחיידק המתנגד לפגוציטוזיס ומדוע.
סיכום
פגוציטוזיס היא השיטה העיקרית בה משתמש הגוף להסרת מיקרואורגניזמים חופשיים בדם ובנוזלי הרקמות. תגובה דלקתית לפציעה ו/או זיהום מאפשרת לפגוציטים לעזוב את זרם הדם, להיכנס לרקמה וללכת לאתר של זיהום או פציעה. מיקרואורגניזמים הנכנסים לגושים לימפה הנמצאים בדרכי הנשימה, במערכת העיכול ובדרכי המין יכולים לעבור פגוציטוזה על ידי מקרופאגים קבועים ותאים דנדריטים ולהציג בפני לימפוציטים B ולימפוציטים T כדי ליזום תגובות חיסוניות אדפטיביות. נוזל רקמות קולט חיידקים ברקמה, נכנס לכלי הלימפה כלימפה, ונושא את החיידקים לבלוטות לימפה אזוריות שם הם מסוננים החוצה ופגוציטים על ידי מקרופאגים ותאים דנדריטים קבועים ומוצגים בפני לימפוציטים B במחזור ולימפוציטים T ליזום מערכת חיסונית אדפטיבית תגובות.
תאים דנדריטים הממוקמים בכל אפיתל העור, דרכי הנשימה ודרכי העיכול פגוציטים חיידקים, נכנסים לכלי לימפה ונושאים את החיידקים לבלוטות לימפה אזוריות, שם התאים הדנדריטים מציגים אנטיגנים הקשורים לחיידקים לאוכלוסיות המשתנות ללא הרף של לימפוציטים T תמימים. הדם נושא מיקרואורגניזמים לטחול שם הם מסוננים החוצה ופגוציטים על ידי מקרופאגים קבועים ותאים דנדריטים ומוצגים בפני לימפוציטים B במחזור ולימפוציטים T ליזום תגובות חיסוניות אדפטיביות. ישנם גם מקרופאגים ותאים דנדריטים מיוחדים הממוקמים במוח (מיקרוגליה), ריאות (מקרופאגים מכתשית), כבד (תאי קופפר), כליות (תאים מזנגיאליים), עצמות (אוסטאוקלסטים) ודרכי העיכול (מקרופאגים פריטוניאליים.
- פגוציטים במנוחה מופעלים על ידי מתווכים דלקתיים ומייצרים קולטנים על פני השטח המגבירים את יכולתם להיצמד למשטח הפנימי של דפנות הנימים ומאפשרים להם להידחק מהנימים ולהיכנס לרקמה, תהליך הנקרא דיאפדיזה.
- ההפעלה מאפשרת גם לפגוציטים לייצר קולטנים לזיהוי דפוסים אנדוציטיים המזהים ונקשרים ל-PAMPs מיקרוביאליים על מנת לחבר את החיידק לפגוציט, כמו גם להפגין פעילות מטבולית ומיקרובידילית מוגברת.
- לאחר מכן, פגוציטים משתמשים בכימוטקסיס כדי לנוע לעבר ריכוז הולך וגובר של חומר משיכה כלשהו כגון גורמים חיידקיים או מולקולות הגנה.
- התקשרות של פגוציטים לחיידקים או לתאים יכולה להיות באמצעות התקשרות לא משופרת או התקשרות משופרת.
- התקשרות לא משופרת היא זיהוי של דפוסים מולקולריים הקשורים לפתוגן או PAMPs על ידי קולטנים לזיהוי דפוסים אנדוציטיים על פני הפגוציטים.
- התקשרות משופרת, או אופסוניזציה, היא התקשרות של חיידקים לפגוציטים באמצעות מולקולת נוגדנים הנקראת IgG, חלבוני המשלים C3b ו- C4b, וחלבוני פאזה חריפה כגון לקטין מחייב מנוז (MBL) וחלבון C-reactive (CRP).
- לאחר ההתקשרות, פילמור ולאחר מכן דה-פולימריזציה של חוטי אקטין שולחים פסאודופודים החוצה כדי לבלוע את החיידק ולמקם אותו בשלפוחית אנדוציטית הנקראת פגוזום.
- במהלך תהליך זה, משאבת אלקטרונים מביאה פרוטונים (H+) לתוך הפאגוזום כדי להוריד את ה-pH בתוך הפגוזום ל-pH המתאים להידרולאזים החומציים כדי לפרק ביעילות חלבונים תאיים.
- פגוציטים מכילים שקיות קרומיות הנקראות ליזוזומים המכילים אנזימי עיכול שונים, כימיקלים מיקרובידיים ורדיקלי חמצן רעילים. הליזוזומים מתמזגים עם הפגוזומים המכילים את החיידקים הנבלעים והמיקרובים נהרסים.
- אם אתר ההדבקה מכיל מספר גדול מאוד של מיקרואורגניזמים ורמות גבוהות של ציטוקינים דלקתיים וכימוקינים מיוצרים בתגובה ל-PAMPs, הפגוציט ירוקן את תכולת הליזוזומים שלו על מנת להרוג את המיקרואורגניזמים או התא מחוץ לתאים.
- תוכן ליזוזומלי המשתחרר במהלך הרג חוץ תאי הורג גם תאים ורקמות מארח שמסביב. רוב הרס הרקמות הקשור לזיהומים הוא תוצאה של הרג חוץ תאי על ידי פגוציטים.


