10.3: גנומיקה ופרוטאומיקה
- Page ID
- 208627
חקר חומצות הגרעין החל בגילוי ה- DNA, התקדם לחקר גנים ושברים קטנים, וכעת התפוצץ לתחום הגנומיקה. גנומיקה היא חקר הגנום כולו, כולל מערך הגנים השלם, רצף הנוקלאוטידים והארגון שלהם, והאינטראקציות שלהם בתוך מין ועם מינים אחרים. ההתקדמות בגנומיקה התאפשרה על ידי טכנולוגיית רצף DNA. כשם שטכנולוגיית המידע הובילה למפות גוגל המאפשרות לנו לקבל מידע מפורט על מיקומים ברחבי העולם, מידע גנומי משמש ליצירת מפות דומות של ה- DNA של אורגניזמים שונים.
מיפוי גנומים
מיפוי הגנום הוא תהליך מציאת מיקום הגנים בכל כרומוזום. המפות שנוצרות דומות למפות בהן אנו משתמשים כדי לנווט ברחובות. מפה גנטית היא המחשה המפרטת גנים ומיקומם בכרומוזום. מפות גנטיות מספקות את התמונה הגדולה (בדומה למפה של כבישים מהירים בין -מדינתיים) ומשתמשות בסמנים גנטיים (בדומה לציוני דרך). סמן גנטי הוא גן או רצף בכרומוזום המראה קשר גנטי עם תכונה של עניין. הסמן הגנטי נוטה לעבור בתורשה עם הגן המעניין, ומדד אחד למרחק ביניהם הוא תדירות הרקומבינציה במהלך המיוזה. גנטיקאים מוקדמים כינו את ניתוח ההצמדה הזה.
מפות פיזיות נכנסות לפרטים האינטימיים של אזורים קטנים יותר של הכרומוזומים (בדומה למפת דרכים מפורטת) (איור\(\PageIndex{1}\)). מפה פיזית היא ייצוג של המרחק הפיזי, בנוקלאוטידים, בין גנים או סמנים גנטיים. הן מפות קישור גנטיות והן מפות פיזיות נדרשות לבניית תמונה מלאה של הגנום. מפה מלאה של הגנום מקלה על החוקרים לחקור גנים בודדים. מפות הגנום האנושי מסייעות לחוקרים במאמציהם לזהות גנים הגורמים למחלות אנושיות הקשורות למחלות כגון סרטן, מחלות לב וסיסטיק פיברוזיס, אם להזכיר כמה. בנוסף, ניתן להשתמש במיפוי גנום כדי לסייע בזיהוי אורגניזמים בעלי תכונות מועילות, כגון חיידקים בעלי יכולת לנקות מזהמים או אפילו למנוע זיהום. מחקר הכולל מיפוי גנום צמחי עשוי להוביל לשיטות המייצרות יבול גבוה יותר או להתפתחות צמחים שמסתגלים טוב יותר לשינויי האקלים.
![תרשים המציג כרומוזום אנושי עם רצועות שנחשפו עם כתם Giemsa. הלהקות מסומנות עם Xp ומספר על הזרוע הקצרה ו- Xq ומספר על הזרוע הארוכה. גנים מסוימים נמצאים בתוך חלק מהלהקות. גנים אלה מסומנים מימין: אנמיה פנקוני B, תסמונת ויסקוט-אולדריץ ', מחלת פליזאוס-מרצבאכר, תסמונת X שביר ומחסור ב- G6PD [0].](https://bio.libretexts.org/@api/deki/files/9384/Figure_10_03_01.jpg)
מפות גנטיות מספקות את המתאר, ומפות פיזיות מספקות את הפרטים. קל להבין מדוע שני סוגי טכניקות מיפוי הגנום חשובים כדי להראות את התמונה הגדולה. מידע המתקבל מכל טכניקה משמש בשילוב לחקר הגנום. מיפוי גנומי משמש עם אורגניזמים מודלים שונים המשמשים למחקר. מיפוי הגנום הוא עדיין תהליך מתמשך, וככל שמתפתחות טכניקות מתקדמות יותר, צפויות התקדמות רבה יותר. מיפוי הגנום דומה להשלמת פאזל מסובך באמצעות כל פיסת נתונים זמינה. מידע מיפוי שנוצר במעבדות בכל רחבי העולם מוכנס למאגרי מידע מרכזיים, כגון המרכז הלאומי למידע ביוטכנולוגי (NCBI). נעשים מאמצים להפוך את המידע לנגיש יותר לחוקרים ולציבור הרחב. בדיוק כפי שאנו משתמשים במערכות מיקום גלובליות במקום במפות נייר כדי לנווט בכבישים, NCBI מאפשר לנו להשתמש בכלי מציג גנום כדי לפשט את תהליך כריית הנתונים.
מושג בפעולה

ירושה מנדלית מקוונת באדם (OMIM) היא קטלוג מקוון לחיפוש של גנים אנושיים והפרעות גנטיות. אתר זה מציג מיפוי גנום, וכן מפרט את ההיסטוריה והמחקר של כל תכונה והפרעה. לחץ על הקישור כדי לחפש תכונות (כגון ידניות) והפרעות גנטיות (כגון סוכרת).
רצף גנום שלם
למרות שחלו התקדמות משמעותית במדעי הרפואה בשנים האחרונות, הרופאים עדיין מבולבלים ממחלות רבות וחוקרים משתמשים ברצף גנום שלם כדי לרדת לעומק הבעיה. רצף גנום שלם הוא תהליך הקובע את רצף ה- DNA של גנום שלם. רצף גנום שלם הוא גישה בכוח אכזרי לפתרון בעיות כאשר יש בסיס גנטי בליבה של מחלה. מספר מעבדות מספקות כעת שירותים לרצף, ניתוח ופרשנות של גנומים שלמים.
בשנת 2010 נעשה שימוש ברצף גנום שלם כדי להציל ילד צעיר שבמעיים שלו היו מורסות מסתוריות מרובות. לילד היו מספר ניתוחים במעי הגס ללא הקלה. לבסוף, רצף גנום שלם גילה פגם במסלול השולט באפופטוזיס (מוות תאי מתוכנת). השתלת מח עצם שימשה להתגברות על הפרעה גנטית זו, מה שהוביל לריפוי לילד. הוא היה האדם הראשון שאובחן בהצלחה באמצעות רצף גנום שלם.
הגנום הראשון שרצף, כמו אלה השייכים לנגיפים, חיידקים ושמרים, היה קטן יותר מבחינת מספר הנוקלאוטידים מאשר הגנום של אורגניזמים רב-תאיים. הגנום של אורגניזמים מודלים אחרים, כגון העכבר (Mus musculus), זבוב הפירות (תסיסנית מלנוגסטר) והנמטודה (Caenorhabditis elegans) ידועים כיום. מחקר בסיסי רב מתבצע באורגניזמים מודליםמכיוון שניתן ליישם את המידע על אורגניזמים אחרים. אורגניזם מודל הוא מין הנחקר כמודל להבנת התהליכים הביולוגיים במינים אחרים שיכולים להיות מיוצגים על ידי אורגניזם המודל. לדוגמה, זבובי פירות מסוגלים לחילוף חומרים של אלכוהול כמו בני אדם, ולכן הגנים המשפיעים על הרגישות לאלכוהול נחקרו בזבובי פירות במאמץ להבין את השונות ברגישות לאלכוהול בבני אדם. רצף גנומים שלמים עוזר במאמצי המחקר באורגניזמים מודליים אלה (איור\(\PageIndex{2}\)).

רצף הגנום האנושי הראשון פורסם בשנת 2003. מספר הגנומים השלמים שעברו רצף גדל בהתמדה וכולל כעת מאות מינים ואלפי גנומים אנושיים בודדים.
יישום גנומיקה
הכנסת פרויקטים של רצף DNA ורצף גנום שלם, במיוחד פרויקט הגנום האנושי, הרחיבה את תחולת המידע על רצף ה- DNA. כיום נעשה שימוש בגנומיקה במגוון רחב של תחומים, כגון מטאנומיקה, פרמקוגנומיקה וגנומיקה מיטוכונדריאלית. היישום הנפוץ ביותר של גנומיקה הוא להבין ולמצוא תרופות למחלות.
חיזוי סיכון למחלות ברמה האישית
חיזוי הסיכון למחלות כרוך בהקרנה וזיהוי של אנשים בריאים כיום על ידי ניתוח גנום ברמה האישית. התערבות עם שינויים באורח החיים ותרופות יכול להיות מומלץ לפני תחילת המחלה. עם זאת, גישה זו ישימה ביותר כאשר הבעיה נובעת ממוטציה של גן יחיד. ליקויים כאלה מהווים רק כ -5 אחוזים מהמחלות שנמצאות במדינות מפותחות. מרבית המחלות השכיחות, כמו מחלות לב, הן רב-פקטוראליות או פוליגניות, המתייחסות למאפיין פנוטיפי שנקבע על ידי שני גנים או יותר, וגם גורמים סביבתיים כמו תזונה. באפריל 2010 פרסמו מדענים מאוניברסיטת סטנפורד את ניתוח הגנום של אדם בריא (סטיבן קווייק, מדען מאוניברסיטת סטנפורד, שרצף את הגנום שלו); הניתוח ניבא את נטייתו לרכוש מחלות שונות. הערכת סיכונים נעשתה כדי לנתח את אחוז הסיכון של Quake עבור 55 מצבים רפואיים שונים. נמצאה מוטציה גנטית נדירה שהראתה שהוא נמצא בסיכון להתקף לב פתאומי. הוא גם צפוי להיות בעל סיכון של 23 אחוזים לפתח סרטן הערמונית וסיכון של 1.4 אחוזים לפתח מחלת אלצהיימר. המדענים השתמשו במאגרי מידע ובמספר פרסומים כדי לנתח את הנתונים הגנומיים. למרות שרצף גנומי הופך לזול יותר וכלים אנליטיים הופכים לאמינים יותר, נותרו לטפל בסוגיות אתיות סביב ניתוח גנומי ברמת אוכלוסייה. לדוגמה, האם ניתן להשתמש בנתונים כאלה באופן לגיטימי כדי לגבות פחות או יותר עבור ביטוח או להשפיע על דירוג האשראי?
לימודי אגודה רחבי גנום
מאז 2005 ניתן היה לערוך סוג של מחקר הנקרא מחקר אסוציאציה רחב גנום, או GWAS. GWAS היא שיטה המזהה הבדלים בין פרטים בפולימורפיזם נוקלאוטיד בודד (SNPs) שעשויים להיות מעורבים בגרימת מחלות. השיטה מתאימה במיוחד למחלות שעלולות להיות מושפעות משינוי גנטי אחד או רבים ברחבי הגנום. קשה מאוד לזהות את הגנים המעורבים במחלה כזו באמצעות מידע על ההיסטוריה המשפחתית. שיטת GWAS מסתמכת על מסד נתונים גנטי שנמצא בפיתוח מאז 2002 שנקרא פרויקט HapMap הבינלאומי. פרויקט HapMap רצף את הגנום של כמה מאות אנשים מרחבי העולם וזיהה קבוצות של SNPs. הקבוצות כוללות SNPs הממוקמים קרוב זה לזה בכרומוזומים ולכן הם נוטים להישאר יחד באמצעות רקומבינציה. העובדה שהקבוצה נשארת יחד פירושה שזיהוי SNP סמן אחד הוא כל מה שצריך כדי לזהות את כל ה-SNPs בקבוצה. ישנם כמה מיליוני SNPs שזוהו, אך זיהוים אצל אנשים אחרים שלא רצפו את הגנום המלא שלהם הוא הרבה יותר קל מכיוון שצריך לזהות רק את SNPs הסמן.
בתכנון משותף ל- GWAS, נבחרות שתי קבוצות של אנשים; לקבוצה אחת יש את המחלה, ולקבוצה השנייה אין. הפרטים בכל קבוצה מותאמים במאפיינים אחרים כדי להפחית את ההשפעה של משתנים מבלבלים הגורמים להבדלים בין שתי הקבוצות. לדוגמה, הגנוטיפים עשויים להיות שונים מכיוון ששתי הקבוצות נלקחות בעיקר ממקומות שונים בעולם. לאחר בחירת הפרטים, ובדרך כלל מספרם הוא אלף או יותר כדי שהמחקר יעבוד, מתקבלות דגימות של ה- DNA שלהם. ה-DNA מנותח באמצעות מערכות אוטומטיות כדי לזהות הבדלים גדולים באחוז ה-SNPs המסוימים בין שתי הקבוצות. לעתים קרובות המחקר בוחן מיליון SNPs או יותר ב- DNA. ניתן להשתמש בתוצאות GWAS בשתי דרכים: ההבדלים הגנטיים עשויים לשמש כסמנים לרגישות למחלה אצל אנשים לא מאובחנים, והגנים המסוימים שזוהו יכולים להיות מטרות למחקר על המסלול המולקולרי של המחלה וטיפולים פוטנציאליים. שלוחה של גילוי קשרי גנים למחלות הייתה היווצרותן של חברות המספקות מה שמכונה "גנומיקה אישית" שיזהו רמות סיכון למחלות שונות על סמך תוסף SNP של הפרט. המדע שמאחורי השירותים הללו שנוי במחלוקת.
מכיוון ש- GWAS מחפש קשרים בין גנים למחלות, מחקרים אלה מספקים נתונים למחקרים אחרים על סיבות, במקום לענות על שאלות ספציפיות בעצמם. קשר בין הבדל גנטי למחלה לא אומר בהכרח שיש קשר סיבה ותוצאה. עם זאת, כמה מחקרים סיפקו מידע שימושי על הגורמים הגנטיים למחלות. לדוגמה, שלושה מחקרים שונים בשנת 2005 זיהו גן לחלבון המעורב בוויסות הדלקת בגוף הקשור לעיוורון הגורם למחלות הנקרא ניוון מקולרי הקשור לגיל. זה פתח אפשרויות חדשות לחקר הגורם למחלה זו. מספר רב של גנים זוהו כקשורים למחלת קרוהן באמצעות GWAS, וחלקם הציעו מנגנונים היפותטיים חדשים לסיבת המחלה.
פרמקוגנומיקה
פרמקוגנומיקה כוללת הערכת היעילות והבטיחות של תרופות על בסיס מידע מהרצף הגנומי של הפרט. ניתן להשתמש במידע על רצף הגנום האישי כדי לרשום תרופות שיהיו היעילות ביותר והפחות רעילות על בסיס הגנוטיפ של המטופל הבודד. לימוד שינויים בביטוי הגנים יכול לספק מידע על פרופיל שעתוק הגנים בנוכחות התרופה, אשר יכול לשמש אינדיקטור מוקדם לפוטנציאל להשפעות רעילות. לדוגמה, גנים המעורבים בצמיחה תאית ומוות תאים מבוקר, כאשר הם מופרעים, עלולים להוביל לצמיחה של תאים סרטניים. מחקרים רחבי הגנום יכולים גם לעזור למצוא גנים חדשים המעורבים ברעילות התרופה. חתימות הגנים אולי אינן מדויקות לחלוטין, אך ניתן לבדוק אותן עוד לפני שמתעוררים תסמינים פתולוגיים.
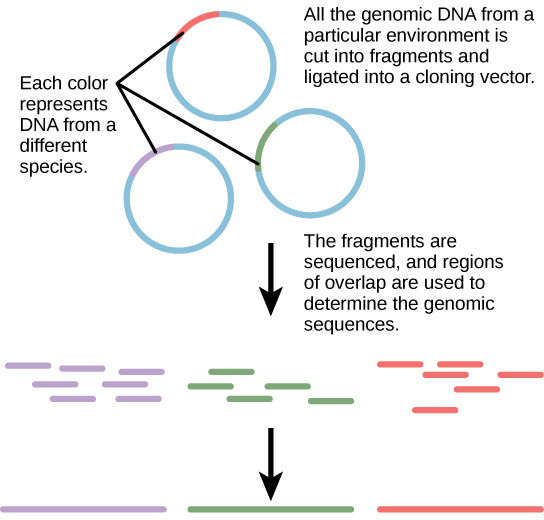
מטגנומיקה
באופן מסורתי, מיקרוביולוגיה נלמדה מתוך תפיסה שמיקרואורגניזמים נלמדים בצורה הטובה ביותר בתנאי תרבית טהורים, הכוללים בידוד סוג יחיד של תא וטיפוחו במעבדה. מכיוון שמיקרואורגניזמים יכולים לעבור מספר דורות תוך שעות ספורות, פרופילי ביטוי הגנים שלהם מסתגלים לסביבת המעבדה החדשה במהירות רבה. מצד שני, מינים רבים מתנגדים לתרבות בבידוד. רוב המיקרואורגניזמים אינם חיים כישויות מבודדות, אלא בקהילות מיקרוביאליות המכונות ביופילמים. מכל הסיבות הללו, תרבות טהורה היא לא תמיד הדרך הטובה ביותר ללמוד מיקרואורגניזמים. Metagenomics הוא חקר הגנום הקולקטיבי של מינים מרובים הגדלים ומקיימים אינטראקציה בנישה סביבתית. Metagenomics יכול לשמש כדי לזהות מינים חדשים מהר יותר ולנתח את ההשפעה של מזהמים על הסביבה (איור). \(\PageIndex{3}\) כעת ניתן ליישם טכניקות Metagenomics גם על קהילות של אוקריוטים גבוהים יותר, כגון דגים.
יצירת דלק ביולוגי חדש
הידע על הגנומיקה של מיקרואורגניזמים נמצא בשימוש כדי למצוא דרכים טובות יותר לרתום דלק ביולוגי מאצות וציאנובקטריה. מקורות הדלק העיקריים כיום הם פחם, נפט, עץ ומוצרים צמחיים אחרים כגון אתנול. למרות שצמחים הם משאבים מתחדשים, עדיין יש צורך למצוא מקורות אנרגיה מתחדשים חלופיים יותר כדי לענות על דרישות האנרגיה של האוכלוסייה שלנו. עולם החיידקים הוא אחד המשאבים הגדולים ביותר לגנים המקודדים לאנזימים חדשים ומייצרים תרכובות אורגניות חדשות, והוא נותר ברובו בלתי מנוצל. משאב גנטי עצום זה טומן בחובו פוטנציאל לספק מקורות חדשים לדלקים ביולוגיים (איור\(\PageIndex{4}\)).

גנומיקה מיטוכונדריאלית
מיטוכונדריה הם אברונים תוך תאיים המכילים DNA משלהם. ה- DNA המיטוכונדריאלי משתנה בקצב מהיר ומשמש לעתים קרובות לחקר מערכות יחסים אבולוציוניות. תכונה נוספת שהופכת את לימוד הגנום המיטוכונדריאלי למעניין היא שברוב האורגניזמים הרב-תאיים, ה- DNA המיטוכונדריאלי מועבר מהאם במהלך תהליך ההפריה. מסיבה זו, גנומיקה מיטוכונדריאלית משמשת לעתים קרובות להתחקות אחר גנאלוגיה.
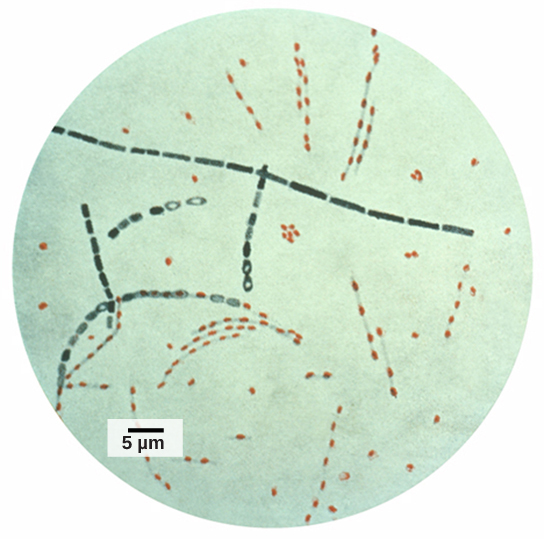
גנומיקה בניתוח משפטי
מידע ורמזים שהתקבלו מדגימות DNA שנמצאו בזירות פשע שימשו כראיה בתיקי משפט, וסמנים גנטיים שימשו בניתוח משפטי. ניתוח גנומי הפך שימושי גם בתחום זה. בשנת 2001 פורסם השימוש הראשון בגנומיקה בזיהוי פלילי. זה היה מאמץ משותף בין מוסדות מחקר אקדמיים לבין ה- FBI לפתור את המקרים המסתוריים של אנתרקס (איור\(\PageIndex{5}\)) שהועבר על ידי שירות הדואר האמריקאי. חיידקי האנתרקס הפכו לאבקה זיהומית ונשלחו בדואר לתקשורת החדשות ולשני סנאטורים אמריקאים. האבקה הדביקה את הצוות המינהלי ועובדי הדואר שפתחו או טיפלו במכתבים. חמישה אנשים מתו, ו -17 חלו מהחיידקים. באמצעות גנומיקה מיקרוביאלית, החוקרים קבעו כי נעשה שימוש בזן ספציפי של אנתרקס בכל הדיוור; בסופו של דבר, המקור הועבר למדען במעבדה לאומית להגנה ביולוגית במרילנד.
גנומיקה בחקלאות
גנומיקה יכולה להפחית במידה מסוימת את הניסויים והכישלונות הכרוכים במחקר מדעי, מה שיכול לשפר את איכות וכמות יבול היבול בחקלאות (איור\(\PageIndex{6}\)). קישור תכונות לגנים או חתימות גנים עוזר לשפר את גידול היבול ליצירת כלאיים בעלי התכונות הרצויות ביותר. מדענים משתמשים בנתונים גנומיים כדי לזהות תכונות רצויות, ולאחר מכן מעבירים את התכונות הללו לאורגניזם אחר כדי ליצור אורגניזם חדש מהונדס גנטית, כמתואר במודול הקודם. מדענים מגלים כיצד גנומיקה יכולה לשפר את איכות וכמות הייצור החקלאי. לדוגמה, מדענים יכולים להשתמש בתכונות רצויות כדי ליצור מוצר שימושי או לשפר מוצר קיים, כגון הפיכת יבול רגיש לבצורת לסובלני יותר לעונה היבשה.

פרוטאומיקה
חלבונים הם התוצרים הסופיים של גנים המבצעים את הפונקציה המקודדת על ידי הגן. חלבונים מורכבים מחומצות אמינו וממלאים תפקידים חשובים בתא. כל האנזימים (למעט ריבוזימים) הם חלבונים ופועלים כזרזים המשפיעים על קצב התגובות. חלבונים הם גם מולקולות רגולטוריות, וחלקם הורמונים. חלבוני הובלה, כמו המוגלובין, מסייעים בהעברת חמצן לאיברים שונים. נוגדנים המגינים מפני חלקיקים זרים הם גם חלבונים. במצב החולה, תפקוד החלבון יכול להיפגע בגלל שינויים ברמה הגנטית או בגלל השפעה ישירה על חלבון מסוים.
פרוטאום הוא כל מערך החלבונים המיוצר על ידי סוג תא. ניתן ללמוד פרוטאומים באמצעות הידע של גנומים מכיוון שגנים מקודדים ל-mRNA, וה-mRNA מקודדים לחלבונים. חקר תפקודם של פרוטאומים נקרא פרוטאומיקה. פרוטאומיקה משלימה את הגנומיקה והיא שימושית כאשר מדענים רוצים לבדוק את ההשערות שלהם שהתבססו על גנים. למרות שלכל התאים באורגניזם רב תאי יש אותה קבוצה של גנים, קבוצת החלבונים המיוצרים ברקמות שונות שונה ותלויה בביטוי גנים. לפיכך, הגנום קבוע, אך הפרוטום משתנה והוא דינמי בתוך אורגניזם. בנוסף, ניתן לחבר RNA לחלופין (לחתוך ולהדביק ליצירת שילובים חדשים וחלבונים חדשים), וחלבונים רבים משתנים לאחר התרגום. למרות שהגנום מספק שרטוט, הארכיטקטורה הסופית תלויה במספר גורמים שיכולים לשנות את התקדמות האירועים היוצרים את הפרוטום.
גנומים ופרוטאומים של חולים הסובלים ממחלות ספציפיות נחקרים כדי להבין את הבסיס הגנטי של המחלה. המחלה הבולטת ביותר הנחקרת בגישות פרוטאומיות היא סרטן (איור\(\PageIndex{7}\)). גישות פרוטאומיות משמשות לשיפור ההקרנה והגילוי המוקדם של סרטן; זה מושג על ידי זיהוי חלבונים שהביטוי שלהם מושפע מתהליך המחלה. חלבון בודד נקרא סמן ביולוגי, ואילו קבוצה של חלבונים עם רמות ביטוי משתנות נקראת חתימת חלבון. כדי שסמן ביולוגי או חתימת חלבון יהיו שימושיים כמועמד להקרנה מוקדמת וגילוי של סרטן, יש להפריש אותו בנוזלי גוף כגון זיעה, דם או שתן, כך שניתן יהיה לבצע הקרנות בקנה מידה גדול בצורה לא פולשנית. הבעיה הנוכחית בשימוש בסמנים ביולוגיים לגילוי מוקדם של סרטן היא השיעור הגבוה של תוצאות שליליות כוזבות. תוצאה שלילית כוזבת היא תוצאת בדיקה שלילית שהייתה צריכה להיות חיובית. במילים אחרות, מקרים רבים של סרטן אינם מזוהים, מה שהופך את הסמנים הביולוגיים לבלתי אמינים. כמה דוגמאות לסמנים ביולוגיים של חלבונים המשמשים לגילוי סרטן הם CA-125 לסרטן השחלות ו- PSA לסרטן הערמונית. חתימות חלבון עשויות להיות אמינות יותר מסמנים ביולוגיים לאיתור תאים סרטניים. פרוטאומיקה משמשת גם לפיתוח תוכניות טיפול אינדיבידואליות, הכוללות חיזוי האם אדם יגיב לתרופות ספציפיות או לא ותופעות הלוואי שעלולות להיות לאדם. פרוטאומיקה משמשת גם לחיזוי האפשרות להישנות המחלה.

המכון הלאומי לסרטן פיתח תוכניות לשיפור איתור וטיפול בסרטן. הטכנולוגיות הפרוטאומיות הקליניות לסרטן ורשת המחקר לגילוי מוקדם הן מאמצים לזהות חתימות חלבון ספציפיות לסוגים שונים של סרטן. תוכנית הפרוטומיקה הביו-רפואית נועדה לזהות חתימות חלבון ולעצב טיפולים יעילים לחולי סרטן.
סיכום
מיפוי הגנום דומה לפתרון חידה גדולה ומסובכת עם פיסות מידע המגיעות ממעבדות בכל רחבי העולם. מפות גנטיות מספקות מתווה למיקום הגנים בתוך הגנום, והן מעריכות את המרחק בין גנים לסמנים גנטיים על בסיס תדירות הרקומבינציה במהלך המיוזה. מפות פיזיות מספקות מידע מפורט על המרחק הפיזי בין הגנים. המידע המפורט ביותר זמין באמצעות מיפוי רצפים. מידע מכל מקורות המיפוי והרצף משולב לחקר גנום שלם.
רצף גנום שלם הוא המשאב העדכני ביותר הזמין לטיפול במחלות גנטיות. חלק מהרופאים משתמשים ברצף גנום שלם כדי להציל חיים. לגנומיקה יש יישומים תעשייתיים רבים, כולל פיתוח דלק ביולוגי, חקלאות, תרופות ובקרת זיהום.
הדמיון הוא המחסום היחיד ליישום הגנומיקה. הגנומיקה מיושמת ברוב תחומי הביולוגיה; ניתן להשתמש בה לרפואה מותאמת אישית, חיזוי סיכוני מחלה ברמה אינדיבידואלית, חקר אינטראקציות תרופתיות לפני ביצוע ניסויים קליניים וחקר מיקרואורגניזמים בסביבה בניגוד למעבדה. זה מיושם גם על יצירת דלקים ביולוגיים חדשים, הערכה גנאלוגית באמצעות מיטוכונדריה, התקדמות במדע הפלילי ושיפורים בחקלאות.
פרוטאומיקה היא חקר כל מערך החלבונים המתבטא על ידי סוג תא נתון בתנאים סביבתיים מסוימים. באורגניזם רב תאי, לסוגי תאים שונים יהיו פרוטאומים שונים, ואלה ישתנו עם שינויים בסביבה. בניגוד לגנום, פרוטאום הוא דינמי ותחת שטף קבוע, מה שהופך אותו למסובך ושימושי יותר מהידע על גנומים בלבד.
רשימת מילים
- סמן ביולוגי
- חלבון בודד המיוצר באופן ייחודי במצב חולה
- מפה גנטית
- מתווה של גנים ומיקומם על כרומוזום המבוסס על תדרי רקומבינציה בין סמנים
- גנומיקה
- המחקר של גנומים שלמים, כולל מערך הגנים השלם, רצף הנוקלאוטידים והארגון שלהם, והאינטראקציות שלהם בתוך מין ועם מינים אחרים
- מטגנומיקה
- חקר הגנום הקולקטיבי של מינים מרובים הגדלים ומקיימים אינטראקציה בנישה סביבתית
- אורגניזם מודל
- מין הנחקר ומשמש כמודל להבנת התהליכים הביולוגיים במינים אחרים המיוצגים על ידי אורגניזם המודל
- פרמקוגנומיקה
- חקר אינטראקציות תרופתיות עם הגנום או הפרוטום; נקרא גם טוקסיקוגנומיקה
- מפה פיזית
- ייצוג של המרחק הפיזי בין גנים או סמנים גנטיים
- חתימת חלבון
- קבוצה של חלבונים מבוטאים יתר או פחות האופייניים לתאים ברקמה חולה מסוימת
- פרוטאומיקה
- מחקר על תפקודם של פרוטאומים
- רצף גנום שלם
- תהליך הקובע את רצף הנוקלאוטידים של גנום שלם


