17.1: איזוטופים רדיואקטיביים
- Page ID
- 209280
נזכיר כי אטום הוא המרכיב הקטן ביותר של יסוד השומר על כל התכונות הכימיות של אותו יסוד (ראה חומר). כפי שנדון בעבר, אטומים מכילים נויטרונים לא טעונים ופרוטונים טעונים חיוביים בגרעין. אלקטרונים טעונים שלילית מקיפים את הגרעין. המסה האטומית של אטום נקבעת על פי מספר הפרוטונים והנייטרונים מכיוון שמסת האלקטרונים זניחה. כל פרוטון או נויטרון שוקלים יחידת מסה אטומית אחת (AMU). ערכי המסה האטומית המוצגים בטבלה המחזורית של היסודות אינם מספרים שלמים מכיוון שהם מייצגים את המסה האטומית הממוצעת לאטומים של אותו יסוד (איור\(\PageIndex{a}\)). לאטומים של אותו יסוד אין בהכרח אותה מסה מכיוון שהם יכולים להיות שונים במספר הנויטרונים.
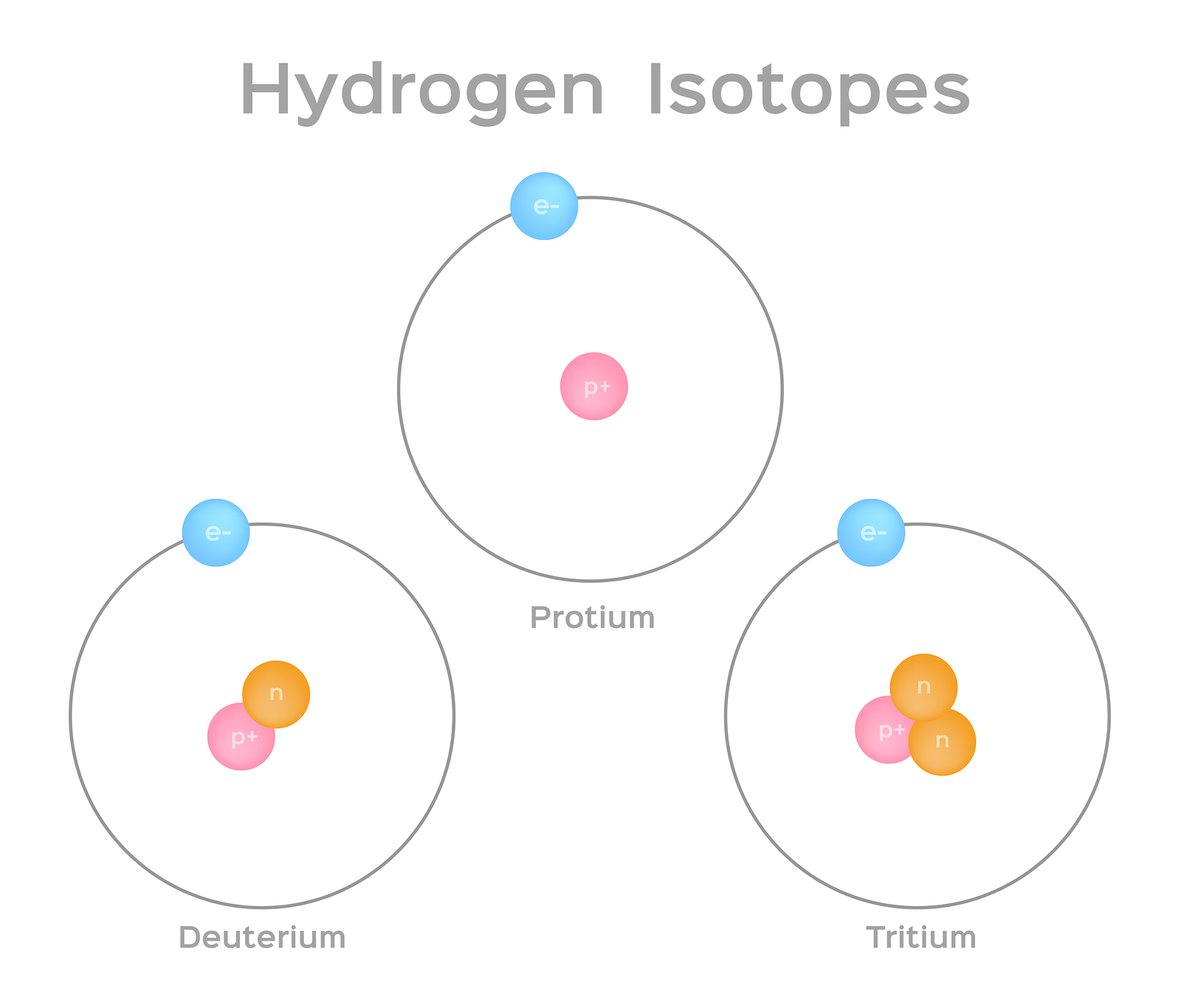
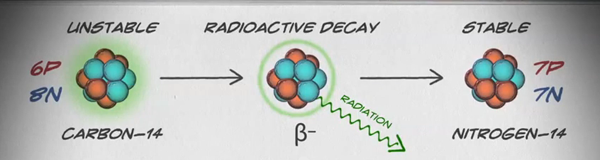
איזוטופים הם צורות שונות של אותו יסוד שיש להם אותו מספר פרוטונים, אך מספר שונה של נויטרונים. לחלק מהיסודות, כמו פחמן, אשלגן ואורניום, יש איזוטופים טבעיים. פחמן-12, האיזוטופ הנפוץ ביותר של פחמן, מכיל שישה פרוטונים ושישה נויטרונים. לכן יש לו מספר מסה של 12 (שישה פרוטונים ושישה נויטרונים) ומספר אטומי של 6 (מה שהופך אותו לפחמן). פחמן-14 מכיל שישה פרוטונים ושמונה נויטרונים. לכן יש לו מספר מסה של 14 (שישה פרוטונים ושמונה נויטרונים) ומספר אטומי של 6, כלומר הוא עדיין היסוד פחמן. שתי צורות חלופיות אלה של פחמן הן איזוטופים. איזוטופים מסוימים אינם יציבים ופולטים קרינה בצורה של חלקיקים ואנרגיה ליצירת יסודות יציבים יותר. צורות מסוימות של קרינה מסוכנות. אלה נקראים איזוטופים רדיואקטיביים או רדיואיזוטופים (איור). \(\PageIndex{b}\) במהלך ריקבון רדיואקטיבי, סוג אחד של אטום יכול להשתנות לסוג אחר של אטום בדרך זו (איור\(\PageIndex{c}\)).
מחצית חיים
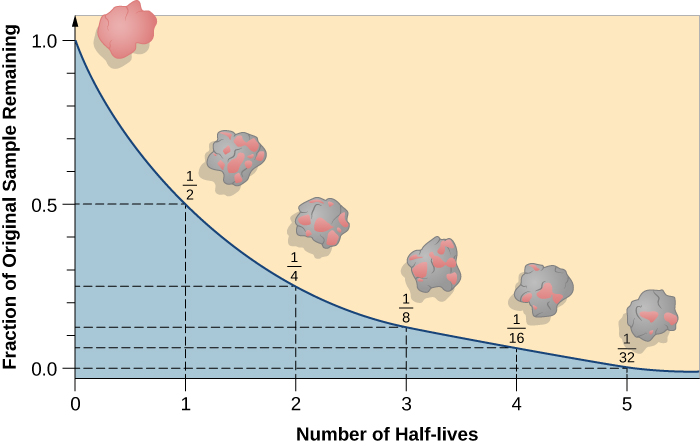
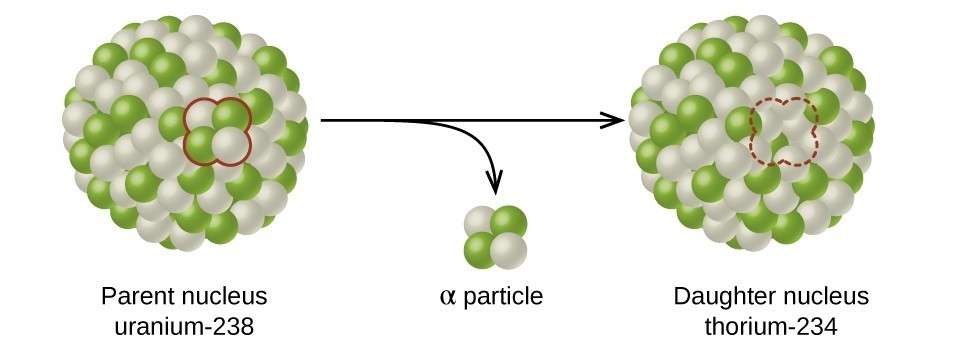
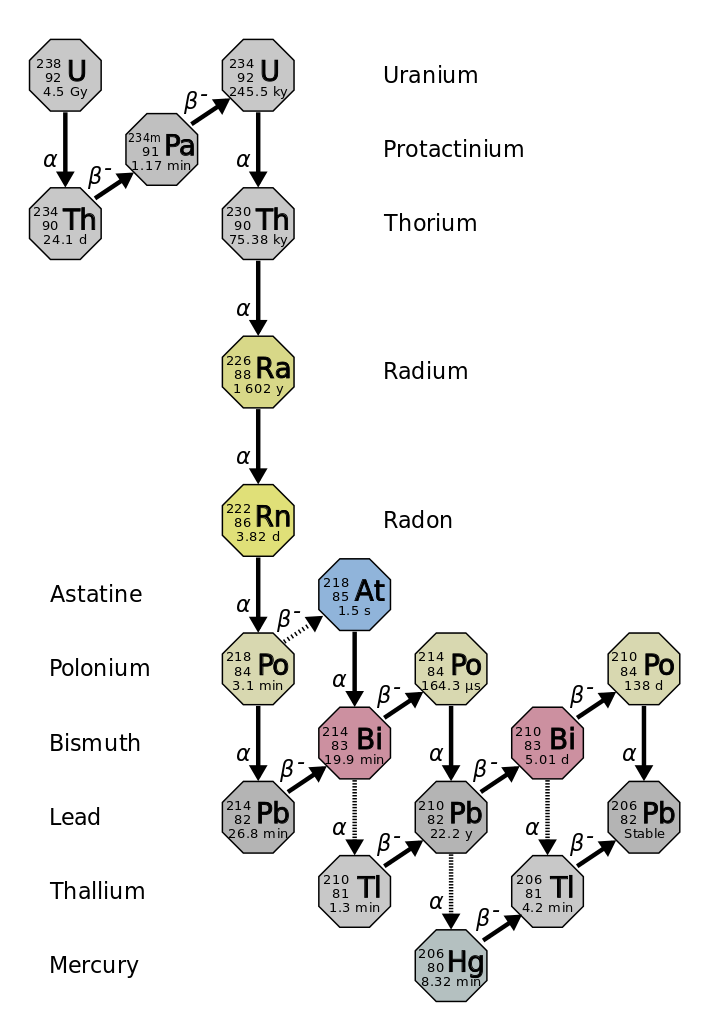
מחצית החיים היא משך הזמן שלוקח למחצית מהאיזוטופ הרדיואקטיבי המקורי להתפרק (איור\(\PageIndex{d}\)). לדוגמה, זמן מחצית החיים של אורניום -238 הוא כ -4.5 מיליארד שנים. לאחר 4.5 מיליארד שנים, רק מחצית (50%) מהכמות המקורית של אורניום -238 תישאר. השאר יתפרקו לתוריום -234 (שהוא גם רדיואקטיבי ומתפורר במהירות לסדרה של איזוטופים רדיואקטיביים, עד שבסופו של דבר הוא הופך לעופרת 206, שהיא יציבה; איור). \(\PageIndex{e-f}\) לאחר שני מחצית חיים (9 מיליארד שנים), רק מחצית מ -50% יישארו (25% מהמקור). לאחר שלוש מחצית חיים, רק 12.5% מהאורניום המקורי -238 יישארו.
אבולוציה בפעולה: תיארוך פחמן
פחמן-14 (14 C) הוא רדיואיזוטופ טבעי שנוצר באטמוספירה על ידי קרניים קוסמיות. זהו תהליך מתמשך, כך שתמיד נוצרים יותר 14 C. ככל שמתפתח אורגניזם חי, הרמה היחסית של 14 C בגופו שווה לריכוז 14C באטמוספירה. כאשר אורגניזם מת, הוא כבר לא בולע 14 צלזיוס, כך שהיחס יירד. 14 C מתפרק ל- 14 N בתהליך הנקרא ריקבון בטא; זה פולט אנרגיה בתהליך איטי זה (איור\(\PageIndex{c}\)). לאחר כ-5,730 שנים, רק מחצית מהריכוז ההתחלתי של 14 C יומר ל-14 נ' הזמן שלוקח למחצית מהריכוז המקורי של איזוטופ להתפורר לצורתו היציבה יותר נקרא מחצית החיים שלו.
מכיוון שזמן מחצית החיים של 14 C ארוך, הוא משמש ליישון חפצים חיים בעבר, כגון מאובנים. באמצעות היחס בין ריכוז 14 C שנמצא באובייקט לכמות 14 C שזוהתה באטמוספירה, ניתן לקבוע את כמות האיזוטופ שטרם התפרק. על סמך כמות זו ניתן לחשב את גיל המאובן לכ- 50,000 שנה (איור \(\PageIndex{g}\) למטה). איזוטופים עם מחצית חיים ארוכה יותר, כגון אשלגן -40, משמשים לחישוב הגילאים של מאובנים ישנים יותר. באמצעות שימוש בתארוך פחמן, מדענים יכולים לשחזר את האקולוגיה והביוגיאוגרפיה של אורגניזמים החיים במהלך 50,000 השנים האחרונות.
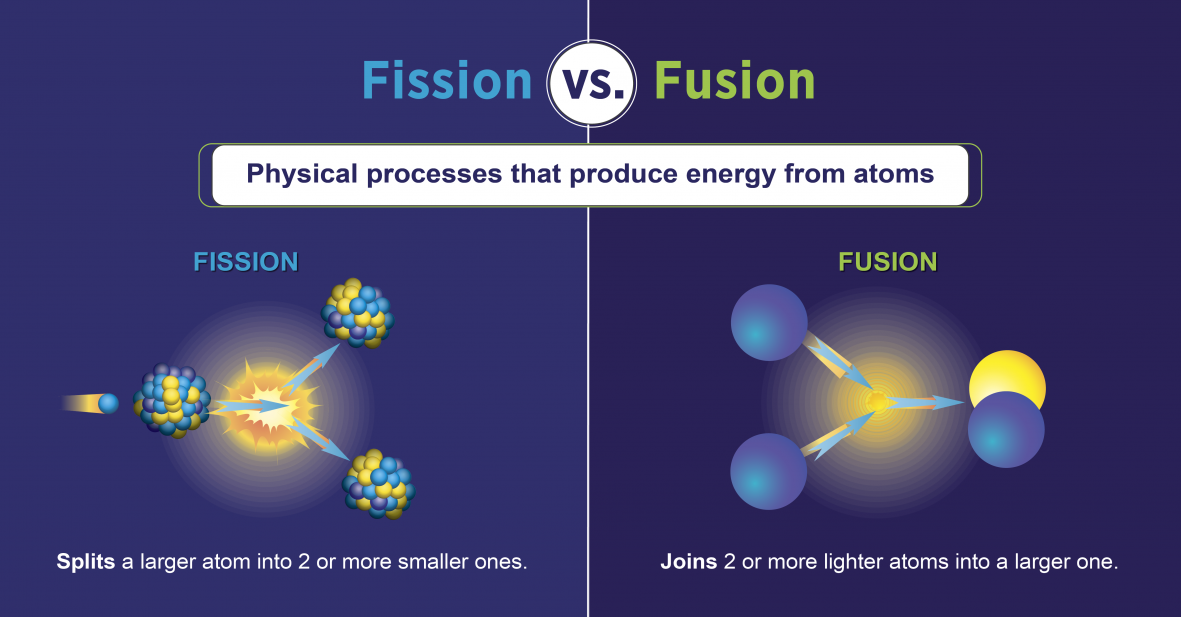
תגובות ביקוע גרעיני
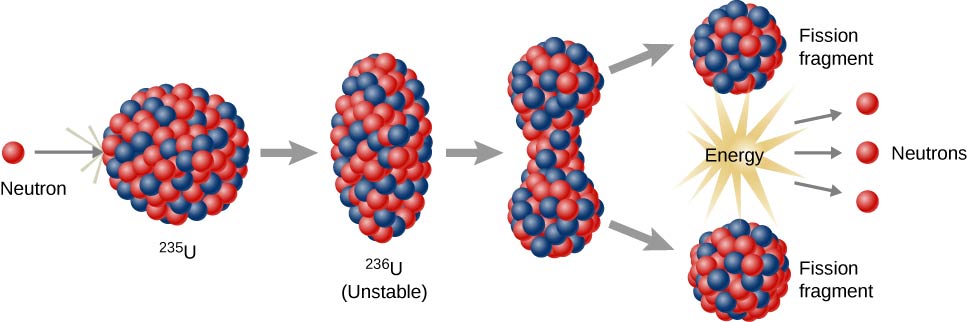
תגובות ביקוע גרעיניות הן אלו הכרוכות בפיצול גרעין האטום (איור\(\PageIndex{h}\)). הם יכולים להיגרם על ידי פיצוץ אלמנטים רדיואקטיביים עם נויטרונים. כמו בהתפרקות רדיואקטיבית טבעית, תגובות ביקוע גרעיניות המושרות משחררות אנרגיה. אנרגיית החום המשתחררת בעת ביקוע גרעיני יכולה לשמש לייצור חשמל. זהו הבסיס של כוח גרעיני. נכון לעכשיו, אורניום -235 (235 U; איזוטופ של אורניום עם מסה אטומית של 235) משמש כיום כדלק לתגובות ביקוע גרעיני (איור). \(\PageIndex{h}\)