15.2: אפידמיולוגיה
- Page ID
- 209283
תחום האפידמיולוגיה נוגע להתפלגות הגיאוגרפית ולתזמון של התרחשויות מחלות זיהומיות וכיצד הן מועברות ומתוחזקות בטבע, במטרה לזהות ולשלוט בהתפרצויות. מדע האפידמיולוגיה כולל אטיולוגיה (חקר הגורמים למחלות) וחקירת העברת מחלות (מנגנונים שבאמצעותם מתפשטת מחלה). אפידמיולוגים הם אפוא מדענים החוקרים את הגורמים והדפוסים למחלות אנושיות, הכוללים בחינת נתונים סטטיסטיים לזיהוי איומי בריאות והמלצה על אסטרטגיות להפחתת איומים אלה.
עבודתה של האפידמיולוגית אליס וואנג מודגשת בסרטון שלהלן. בעוד שרבות מהדוגמאות בדף זה מתמקדות במחלות זיהומיות (הנובעות ממפגעים ביולוגיים), אפידמיולוגים יכולים לחקור גם מחלות לא מדבקות (כגון הרעלה או השמנת יתר). הטקסט בסוף הסרטון אומר, "האם אתה CDC? למידע נוסף על הזדמנויות תעסוקה עם CDC, בקר בכתובת: jobs.cdc.gov".
היסטוריה של אפידמיולוגיה
מחקריהם של רופאים וחוקרים מהמאה ה -19 כמו ג'ון סנואו, פלורנס נייטינגייל, איגנז שמאלוויס, ג'וזף ליסטר, רוברט קוך, לואי פסטר ואחרים זרעו את זרעי האפידמיולוגיה המודרנית.
ג'ון סנואו (איור\(\PageIndex{a}\)) היה רופא בריטי המכונה אבי האפידמיולוגיה לקביעת מקור מגיפת הכולרה ברוד סטריט בשנת 1854 בלונדון. בהתבסס על תצפיות שערך במהלך התפרצות כולרה מוקדמת יותר (1848—1849), הציע סנואו כי כולרה תתפשט בדרך העברה צואה-פומית וכי חיידק הוא הגורם המדבק. הוא חקר את מגיפת הכולרה בשנת 1854 בשתי דרכים. ראשית, בחשד כי מים מזוהמים הם מקור המגיפה, שלג זיהה את מקור המים עבור אלה נגועים. הוא מצא תדירות גבוהה של מקרי כולרה בקרב אנשים שהשיגו את מימיהם מנהר התמזה במורד הזרם מלונדון. מים אלה הכילו את האשפה והביוב מלונדון וההתנחלויות במעלה הזרם. הוא גם ציין כי עובדי מבשלות הבירה לא חלו בכולרה ובחקירה מצאו שהבעלים סיפקו לעובדים בירה לשתות והצהירו כי סביר להניח שהם לא שתו מים. שנית, הוא גם מיפה בקפידה את שכיחות הכולרה ומצא תדירות גבוהה בקרב אותם אנשים המשתמשים במשאבת מים מסוימת הממוקמת ברחוב ברוד. בתגובה לעצתו של סנואו, גורמים מקומיים הסירו את ידית המשאבה, וכתוצאה מכך הבלימה של מגיפת הכולרה ברחוב ברוד. לחשבונו של ג'ון סנואו עצמו על עבודתו יש קישורים ומידע נוספים.
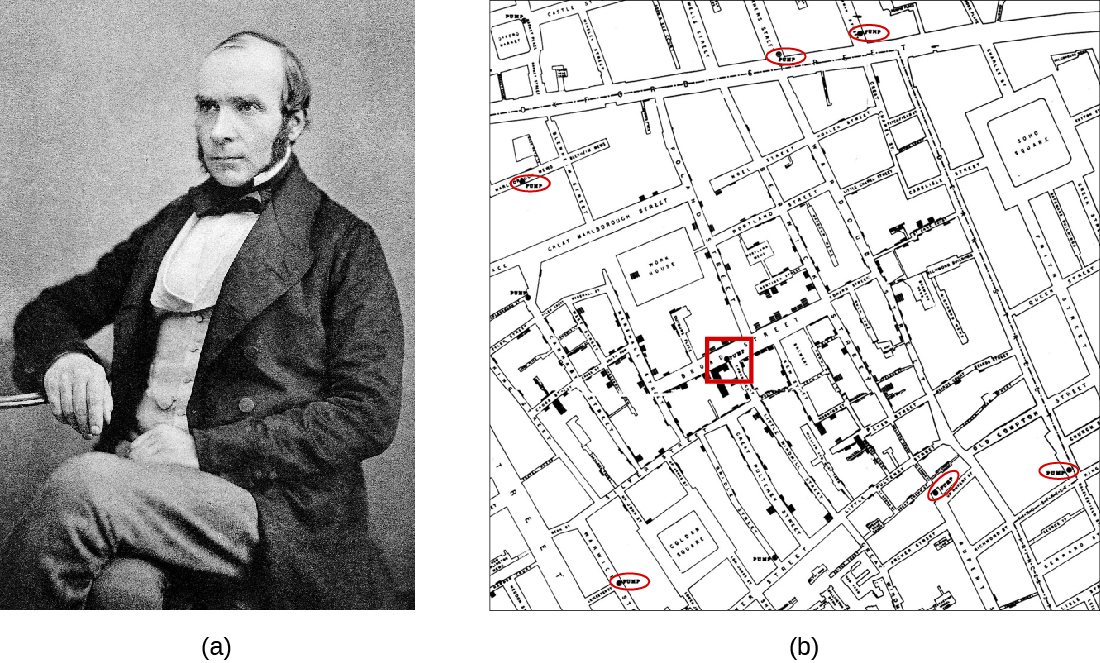
עבודתו של שלג מייצגת מחקר אפידמיולוגי מוקדם והיא הביאה לתגובה הראשונה הידועה לבריאות הציבור למגיפה. שיטות המעקב הקפדניות של שלג הן כיום מנהג נפוץ בחקר התפרצויות מחלות ובקשירת מחלות חדשות לסיבותיהן. עבודתו שופכת אור נוסף על שיטות ביוב לא סניטריות ועל ההשפעות של השלכת פסולת בתמזה. בנוסף, עבודתו תמכה בתיאוריית הנבטים של מחלות, שטענה כי מחלות יכולות להיות מועברות באמצעות פריטים מזוהמים, כולל מים מזוהמים בחומר צואה.
עבודתה של פלורנס נייטינגייל היא דוגמה נוספת למחקר אפידמיולוגי מוקדם. בשנת 1854, נייטינגייל היה חלק מקבוצת אחיות שנשלחו על ידי הצבא הבריטי לטיפול בחיילים פצועים במהלך מלחמת קרים. נייטינגייל ניהל רישומים מדוקדקים בנוגע לסיבות המחלה והמוות במהלך המלחמה. רישום התיעוד שלה היה משימה בסיסית של מה שיהפוך לימים למדע האפידמיולוגיה. הניתוח שלה לנתונים שאספה פורסם בשנת 1858. בספר זה, היא הציגה נתוני תדירות חודשיים על סיבות למוות בהיסטוגרמה של תרשים טריז (איור\(\PageIndex{b}\)). הצגה גרפית זו של נתונים, יוצאת דופן באותה תקופה, המחישה בעוצמה כי הרוב המכריע של הנפגעים במהלך המלחמה התרחשו לא בגלל פצעים שנגרמו בפעולה אלא ממה שנייטינגייל ראה במחלות זיהומיות הניתנות למניעה. לעתים קרובות מחלות אלה התרחשו בגלל תברואה לקויה וחוסר גישה למתקני בית החולים. ממצאי נייטינגייל הובילו לרפורמות רבות במערכת הטיפול הרפואי של הצבא הבריטי. למידע נוסף על תרשים הטריז של נייטינגייל כאן.

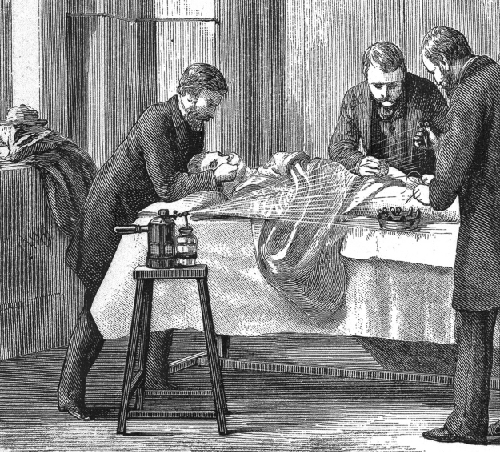
ג'וזף ליסטר סיפק ראיות אפידמיולוגיות מוקדמות שהובילו לשיטות בריאות ציבוריות טובות במרפאות ובבתי חולים. רוב הרופאים לא שטפו את ידיהם בין ביקורי המטופלים או ניקו ועיקרו את כלי הניתוח שלהם. ליסטר, לעומת זאת, גילה את תכונות החיטוי של חומצה קרבולית, המכונה גם פנול. הוא הציג מספר פרוטוקולי חיטוי שהורידו באופן דרמטי את שיעורי ההדבקה לאחר הניתוח. הוא דרש ממנתחים שעבדו אצלו להשתמש בתמיסת חומצה קרבולית של 5% לניקוי הכלים הכירורגיים שלהם בין מטופלים, ואף הרחיק לכת עד כדי ריסוס התמיסה על תחבושות ועל אתר הניתוח במהלך הניתוחים (איור\(\PageIndex{c}\)). הוא גם נקט באמצעי זהירות שלא להכניס מקורות זיהום מעורו או מבגדיו על ידי הסרת מעילו, הפשטת שרווליו ושטיפת ידיו בתמיסה מדוללת של חומצה קרבולית לפני הניתוח ובמהלכו.
ניתוח מחלות באוכלוסייה
ניתוחים אפידמיולוגיים מתבצעים תמיד בהתייחס לאוכלוסייה, שהיא קבוצת האנשים הנמצאים בסיכון למחלה או למצב. ניתן להגדיר את האוכלוסייה גיאוגרפית, אך אם רק חלק מהאנשים באזור זה רגישים, ייתכן שיידרשו קריטריונים נוספים. אנשים רגישים עשויים להיות מוגדרים על ידי התנהגויות מסוימות, כגון שימוש בסמים תוך ורידי, בעלות על חיות מחמד מסוימות או חברות במוסד, כגון מכללה. היכולת להגדיר את האוכלוסייה חשובה מכיוון שרוב מדדי העניין באפידמיולוגיה נעשים בהתייחס לגודל האוכלוסייה.
מצב החולה נקרא תחלואה. תחלואה באוכלוסייה יכולה לבוא לידי ביטוי בכמה דרכים שונות. תחלואה, או תחלואה מוחלטת, מתבטאת במספר אנשים ללא התייחסות לגודל האוכלוסייה. שיעור התחלואה יכול לבוא לידי ביטוי כמספר הפרטים החולים מתוך מספר סטנדרטי של פרטים באוכלוסייה, כגון 100,000, או כאחוז מהאוכלוסייה.
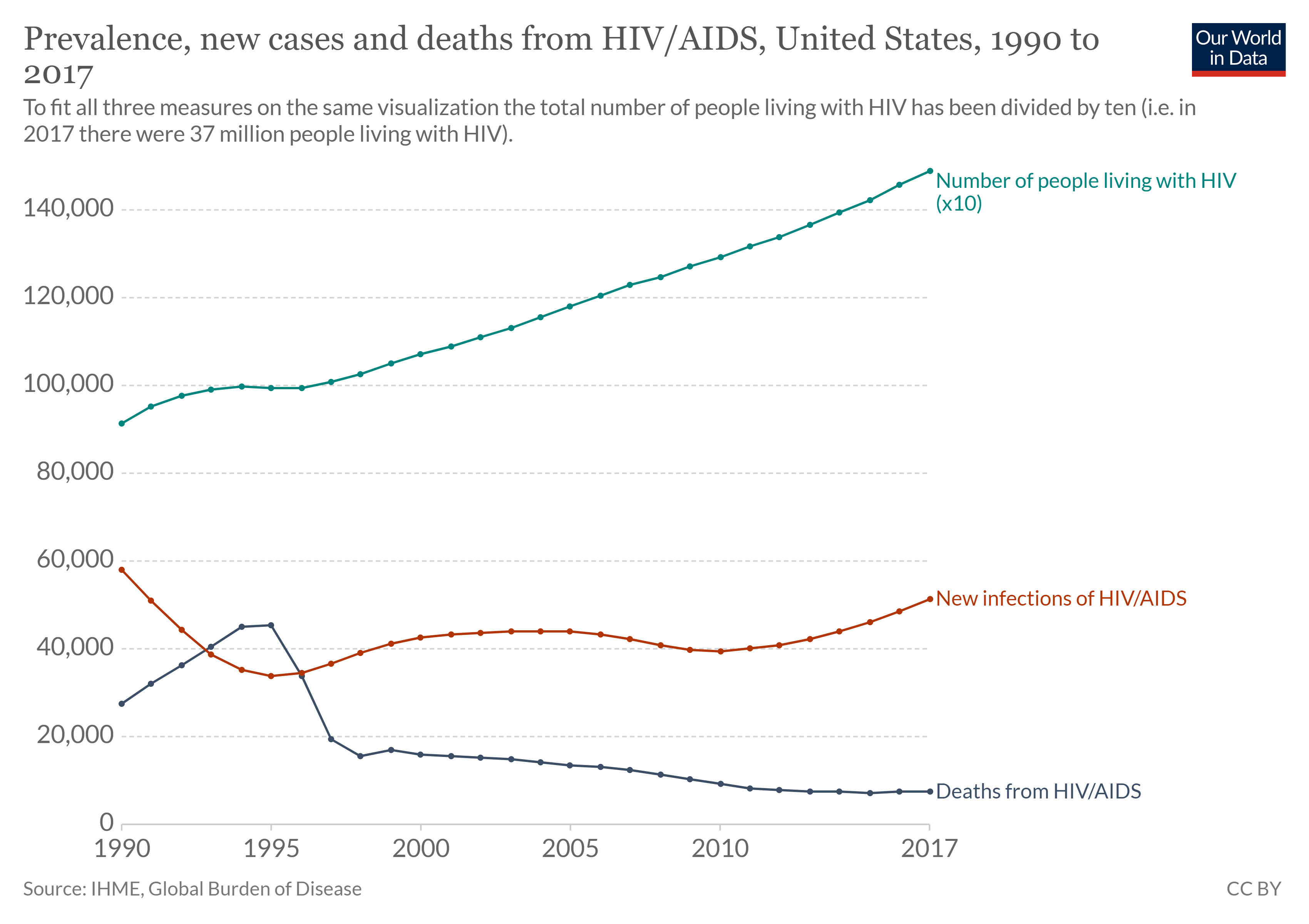
ישנם שני היבטים של תחלואה הרלוונטיים לאפידמיולוג: שכיחות המחלה ושכיחותה. שכיחות היא המספר, או השיעור, של אנשים עם מחלה מסוימת באוכלוסייה נתונה בנקודת זמן. לדוגמה, המרכזים לבקרת מחלות ומניעתן (CDC) העריכו כי כ -1.2 מיליון בני אדם בארצות הברית חיו עם זיהום פעיל בנגיף חיסוני אנושי (HIV) בשנת 2018. מבוטא בפרופורציה, או בשיעור, מדובר בשכיחות של 367 אנשים נגועים לכל 100,000 באוכלוסייה. מצד שני, שכיחות היא מספר או חלקם של המקרים החדשים בפרק זמן. באותה שנה, ה- CDC מעריך כי היו 36,400 מקרים שאובחנו לאחרונה של הידבקות ב- HIV, שהם שכיחות של 11.1 מקרים חדשים לכל 100,000 באוכלוסייה. ניתן לראות את הקשר בין שכיחות לשכיחות באיור\(\PageIndex{d}\). עבור מחלה כרונית כמו הידבקות ב- HIV, השכיחות תהיה בדרך כלל גבוהה מהשכיחות מכיוון שהיא מייצגת את המספר המצטבר של מקרים חדשים לאורך שנים רבות פחות מספר המקרים שאינם פעילים עוד (מכיוון שהמטופל נפטר או נרפא).
בנוסף לשיעורי התחלואה, ניתן לדווח גם על שכיחות ושכיחות התמותה (מוות). שיעור תמותה יכול לבוא לידי ביטוי כאחוז האוכלוסייה שמתה ממחלה או כמספר מקרי המוות לכל 100,000 איש (או מספר סטנדרטי מתאים אחר).
דפוסי שכיחות
מחלות הנראות רק מדי פעם, ובדרך כלל ללא ריכוז גיאוגרפי, נקראות מחלות ספורדיות. דוגמאות למחלות ספורדיות כוללות טטנוס, כלבת ומגיפה. בארצות הברית, Clostridium tetani, החיידק הגורם לטטנוס, נמצא בכל מקום בסביבת הקרקע, אך מקרים של זיהום מתרחשים רק לעתים רחוקות ובמקומות מפוזרים מכיוון שרוב האנשים מחוסנים, מנקים פצעים כראוי, או נמצאים רק לעתים רחוקות במצב שיגרום לזיהום. כמו כן בארצות הברית ישנם כמה מקרים מפוזרים של מגיפה מדי שנה, בדרך כלל נדבקים ממכרסמים באזורים כפריים במדינות המערב.
מחלות שנמצאות כל הזמן (לרוב ברמה נמוכה) באוכלוסייה באזור גיאוגרפי מסוים נקראות מחלות אנדמיות. לדוגמה, מלריה אנדמית באזורים מסוימים בברזיל, אך אינה אנדמית לארצות הברית.
מחלות אשר מספר גדול מהצפוי של מקרים מתרחשת בתוך זמן קצר בתוך אזור גיאוגרפי נקראים מחלות מגיפה. שפעת היא דוגמה טובה למחלה מגיפה נפוצה. דפוסי שכיחות של שפעת נוטים לעלות בכל חורף בחצי הכדור הצפוני. עליות עונתיות אלה צפויות, כך שלא יהיה מדויק לומר כי שפעת היא מגיפה בכל חורף; עם זאת, בחלק מהחורפים יש בדרך כלל מספר גדול של מקרי שפעת עונתיים באזורים מסוימים, ומצבים כאלה היו נחשבים למגיפות (נתונים\(\PageIndex{e-f}\)).
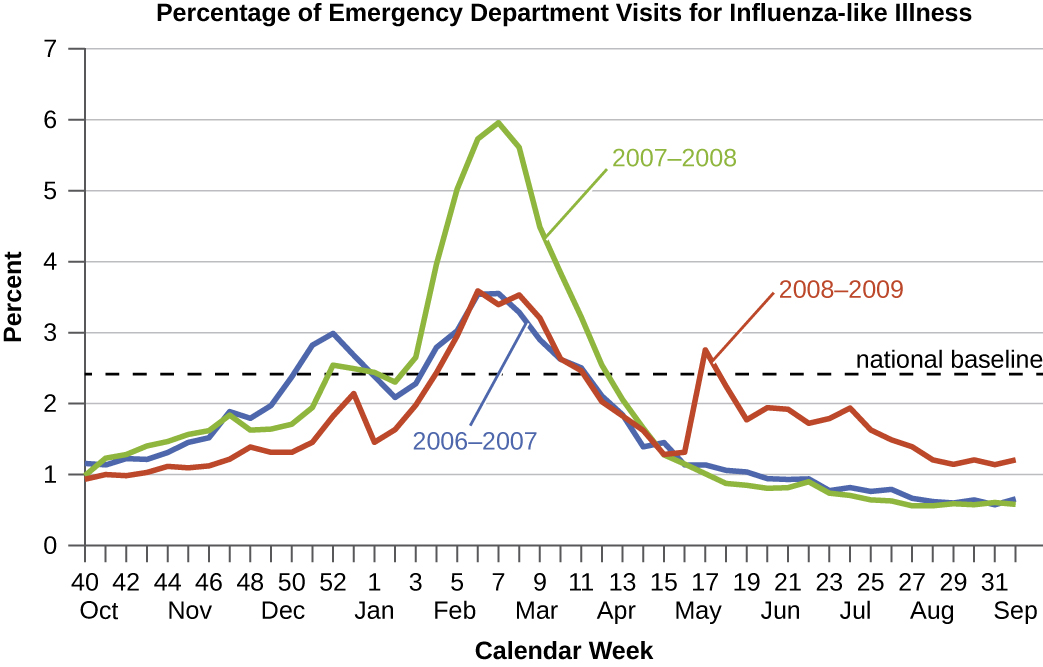
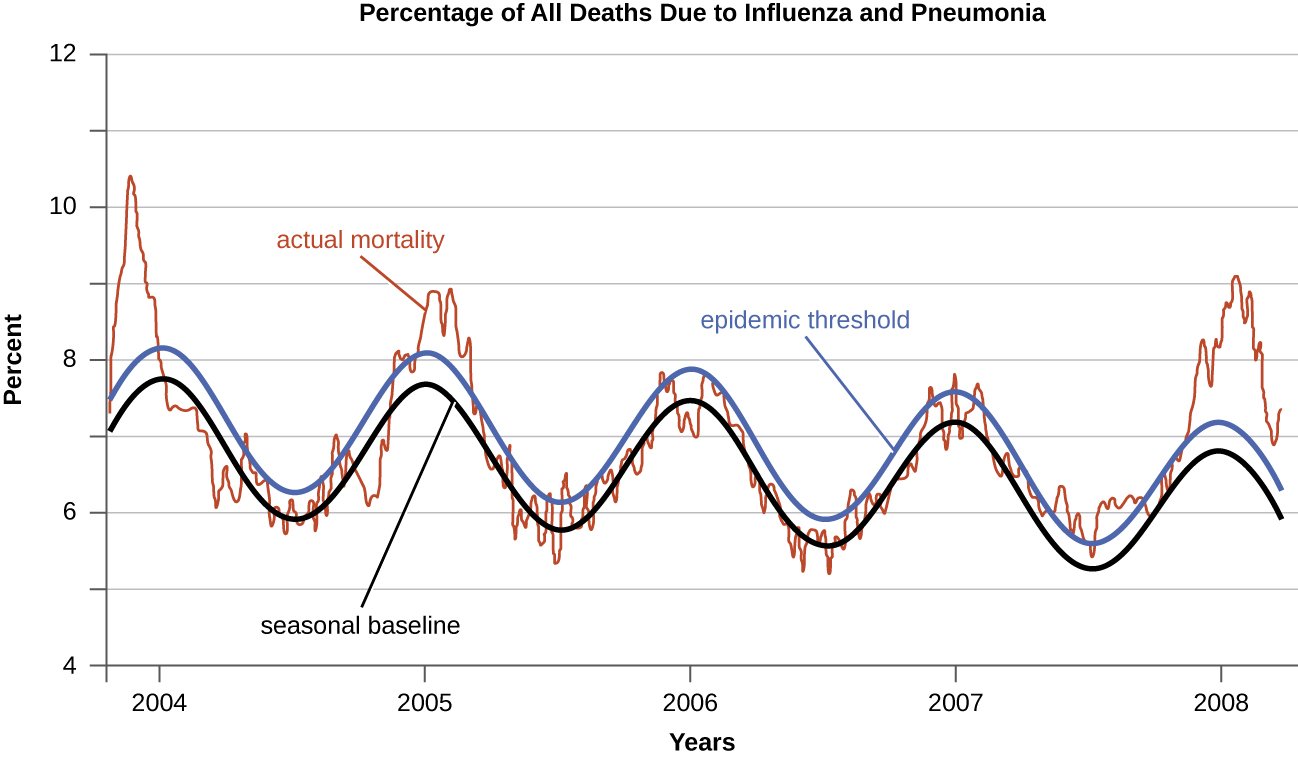
מגיפה המתרחשת בקנה מידה עולמי נקראת מחלה מגיפה. לדוגמה, HIV/איידס (תסמונת כשל חיסוני נרכש) ומחלת נגיף הקורונה 19 (COVID-19) הן מחלות מגיפה, וזני נגיף שפעת חדשים הופכים לעתים קרובות למגיפה.
אטיולוגיה
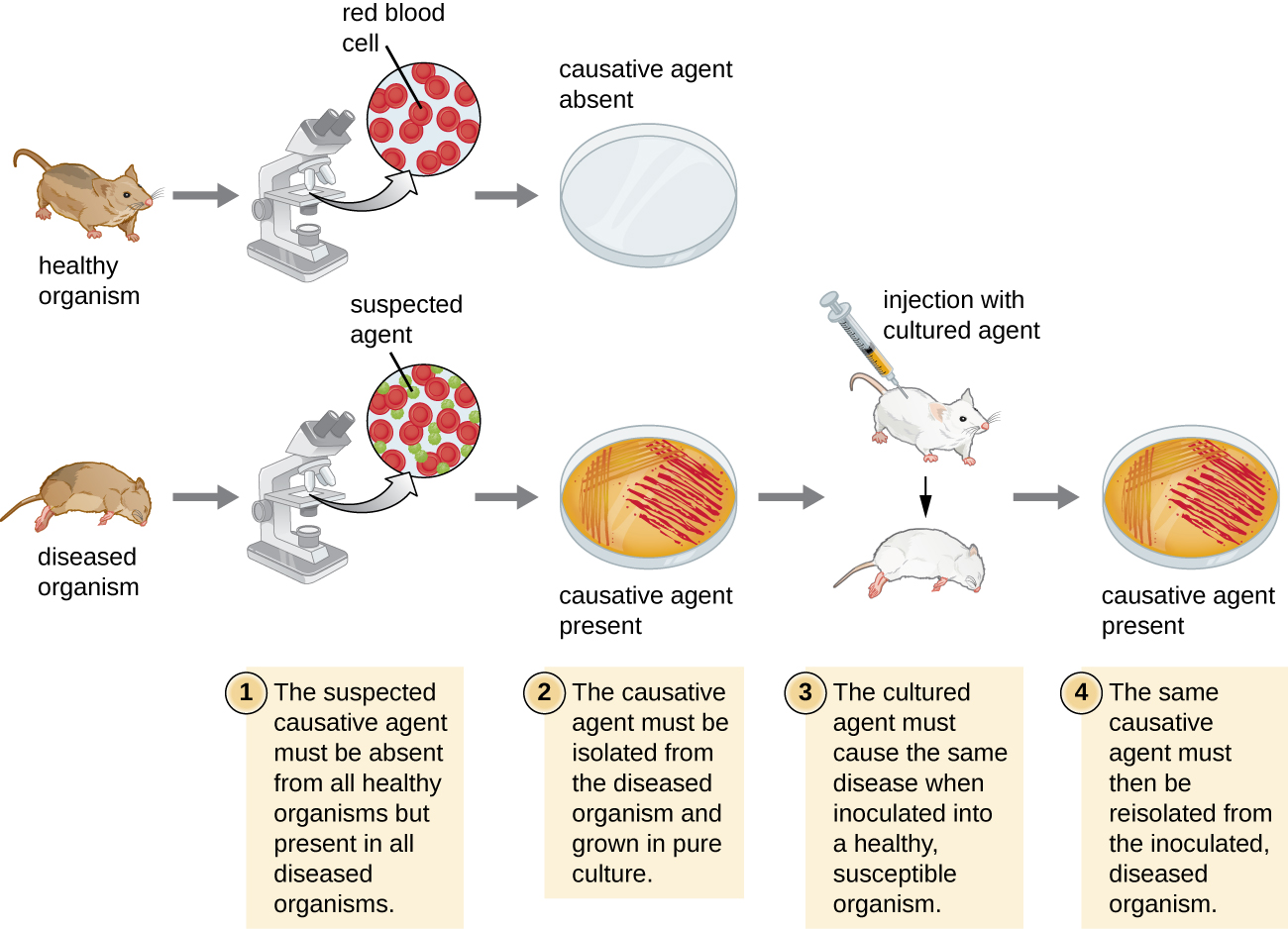
כאשר בוחנים מגיפה, המשימה הראשונה של אפידמיולוג היא לקבוע את הגורם למחלה, המכונה הסוכן האטיולוגי או הגורם הסיבתי. חיבור מחלה לפתוגן ספציפי יכול להיות מאתגר בגלל המאמץ הנוסף הנדרש בדרך כלל להפגנת סיבתיות ישירה בניגוד לקשר פשוט. זה לא מספיק כדי לראות קשר בין מחלה לבין פתוגן חשוד, ניסויים מבוקרים נדרשים כדי למנוע סיבות אפשריות אחרות. בנוסף, בדרך כלל קשה לזהות פתוגנים כאשר אין מושג מיידי מה גורם להתפרצות. סימנים ותסמינים של מחלה הם גם בדרך כלל לא ספציפיים, כלומר גורמים רבים ושונים יכולים להוליד את אותה קבוצה של סימנים ותסמינים. זה מסבך את האבחנה גם כאשר גורם סיבתי מוכר למדענים.
רוברט קוך היה המדען הראשון שהדגים באופן ספציפי את הגורם הסיבתי למחלה (אנתרקס) בסוף המאה ה -19. קוך פיתח ארבעה קריטריונים, הידועים כיום בשם ההנחות של קוך, אשר היה צריך לעמוד בהם על מנת לקשר באופן חיובי מחלה עם חיידק פתוגני (איור). \(\PageIndex{g}\) בין השנים 1876 - 1905, מחלות נפוצות רבות נקשרו לסוכנים האטיולוגיים שלהן, כולל כולרה, דיפטריה, זיבה, דלקת קרום המוח, מגיפה, עגבת, טטנוס ושחפת. כיום אנו משתמשים בהנחות המולקולריות של קוך, וריאציה של ההנחות המקוריות של קוך. (תוכלו לקרוא עוד על שניהם כאן. )
כיצד מחלות מתפשטות
ההבנה כיצד פתוגנים זיהומיים מתפשטים היא קריטית למניעת מחלות זיהומיות. כדי שפתוגנים יימשכו לאורך פרקי זמן ארוכים הם זקוקים למאגרים במקום בו הם מתגוררים בדרך כלל. מאגרים יכולים להיות אורגניזמים חיים (חולדות, עטלפים, דביבונים, בעלי חיים וכו ') או אתרים שאינם חיים. מאגרים שאינם חיים יכולים לכלול אדמה ומים בסביבה. אלה עשויים להכיל את האורגניזם באופן טבעי מכיוון שהוא עשוי לגדול בסביבה זו. סביבות אלה עלולות להיות מזוהמות גם בפתוגנים בצואה אנושית, פתוגנים שנשפכים על ידי מארחים ביניים, או פתוגנים הכלולים בשרידי מארחי ביניים.
אדם המסוגל להעביר פתוגן מבלי להציג סימפטומים מכונה נשא. נשא פסיבי מזוהם בפתוגן ויכול להעביר אותו מכנית למארח אחר; עם זאת, נשא פסיבי אינו נגוע. לעומת זאת, נשא פעיל הוא אדם נגוע שיכול להעביר את המחלה לאחרים. נשא פעיל עשוי להציג סימנים או תסמינים של זיהום או לא.
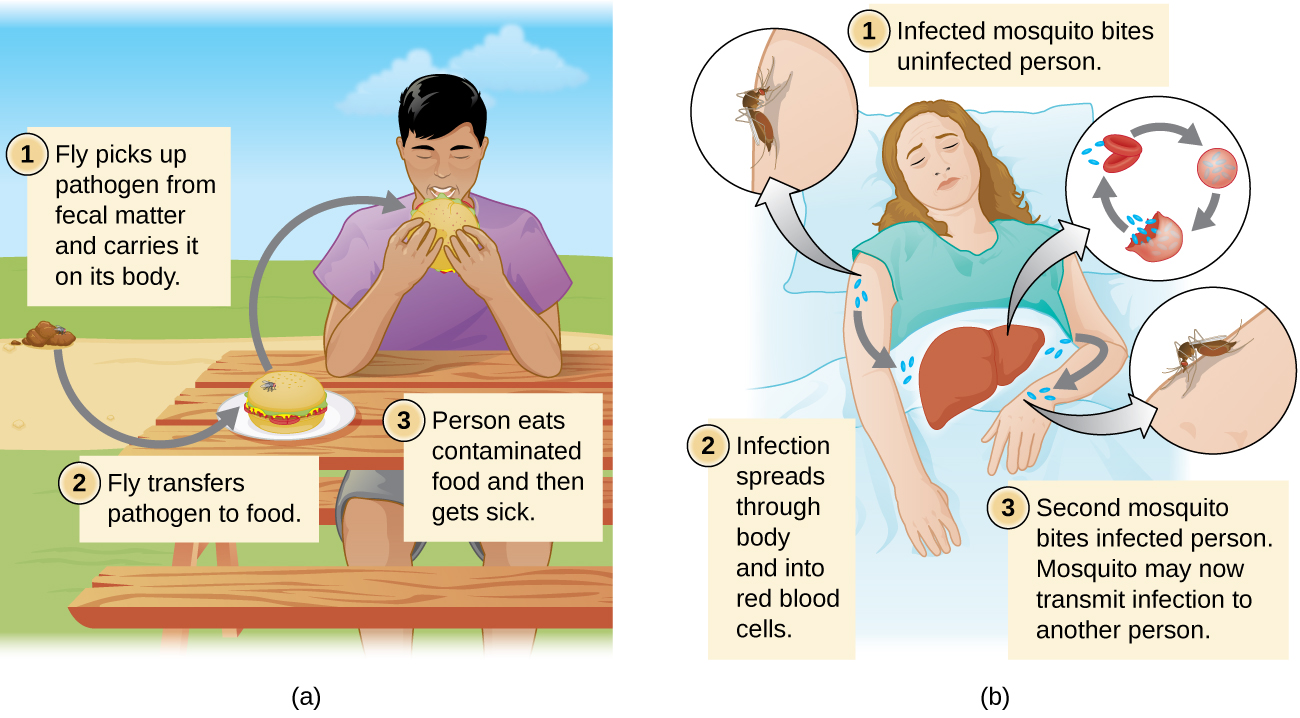
ללא קשר למאגר, ההעברה חייבת להתרחש כדי שהזיהום יתפשט. העברת קשר כוללת מגע ישיר או מגע עקיף. העברה מאדם לאדם היא סוג של העברת מגע ישיר. כאן הסוכן מועבר במגע פיזי בין שני אנשים (איור\(\PageIndex{h}\)) באמצעות פעולות כמו נגיעה, נשיקה, קיום יחסי מין או תרסיסי טיפות. העברת מגע עקיפה כוללת חפצים דוממים הנקראים פומיטים אשר מזוהמים על ידי פתוגנים מאדם או מאגר נגוע (איור). \(\PageIndex{i}\) לדוגמה, אדם הסובל מהצטננות עלול להתעטש ולגרום לטיפות לנחות על פומיט כגון מפת שולחן או שטיח, או שהאדם עשוי לנגב את אפה ואז להעביר ריר לפומיט כגון ידית דלת או מגבת.


העברת רכב מתייחסת להעברת פתוגנים דרך כלי רכב כגון מים, מזון ואוויר. זיהום מים בשיטות תברואה לקויות מוביל להעברת מחלות במים. מחלה הנישאת במים נותרה בעיה רצינית באזורים רבים ברחבי העולם. ארגון הבריאות העולמי (WHO) מעריך כי מי שתייה מזוהמים אחראים ליותר מ -500,000 מקרי מוות מדי שנה. באופן דומה, מזון המזוהם באמצעות טיפול או אחסון לקויים עלול להוביל להעברת מחלות במזון. אבק וחלקיקים עדינים המכונים אירוסולים, שיכולים לצוף באוויר, יכולים לשאת פתוגנים ולהקל על העברת מחלות באוויר.
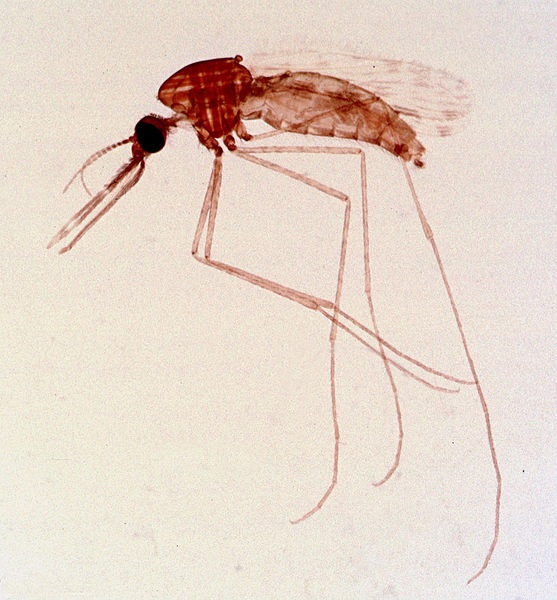
מחלות יכולות להיות מועברות גם על ידי וקטור מכני או ביולוגי, בעל חיים (בדרך כלל פרוקי רגליים) הנושא את המחלה ממארח אחד למשנהו. קרציות, פרעושים ויתושים הם דוגמאות לווקטורים (איור\(\PageIndex{j}\)). העברה מכנית מקלה על ידי וקטור מכני, בעל חיים הנושא פתוגן ממארח אחד למשנהו מבלי להידבק בעצמו. העברה ביולוגית מתרחשת כאשר הפתוגן מתרבה בתוך וקטור ביולוגי המעביר את הפתוגן ממארח אחד למשנהו (איור\(\PageIndex{k}\)).
השפלה של המערכת האקולוגית יכולה להגביר את התפשטות המחלה באמצעות מספר מנגנונים. ראשית, הוא יכול לקדם אוכלוסיות וקטוריות. לדוגמה, כריתת יערות, סכרים ועיור מגדילים את כמות המים העומדים, ומגדילים את בית הגידול לווקטורים, כגון יתושים. בנוסף, שינויי אקלים עשויים להרחיב את מגוון וקטורי המחלות המוגבלים לאזורים טרופיים או סובטרופיים. שנית, שיבושים במחזור המים יכולים ליצור תנאים המעדיפים פתוגנים. לדוגמה, נגר דשנים מחקלאות מעלה את רמות התזונה, מה שהופך את גופי המים למתאימים יותר לחיידק הגורם לכולרה. שיטפונות מוגברים כתוצאה משינויים בשימוש בקרקע ושינויי אקלים מקלים גם על התפשטות מחלות הנישאות במים.
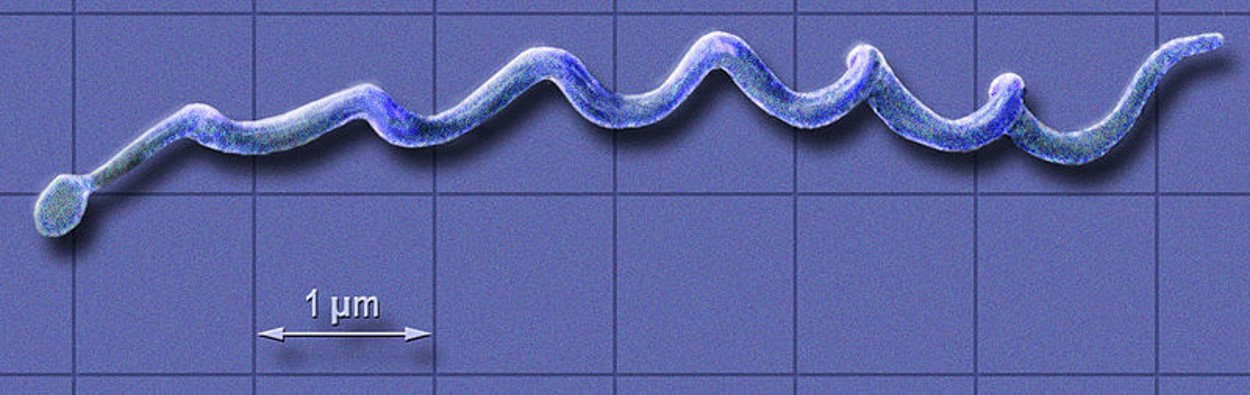
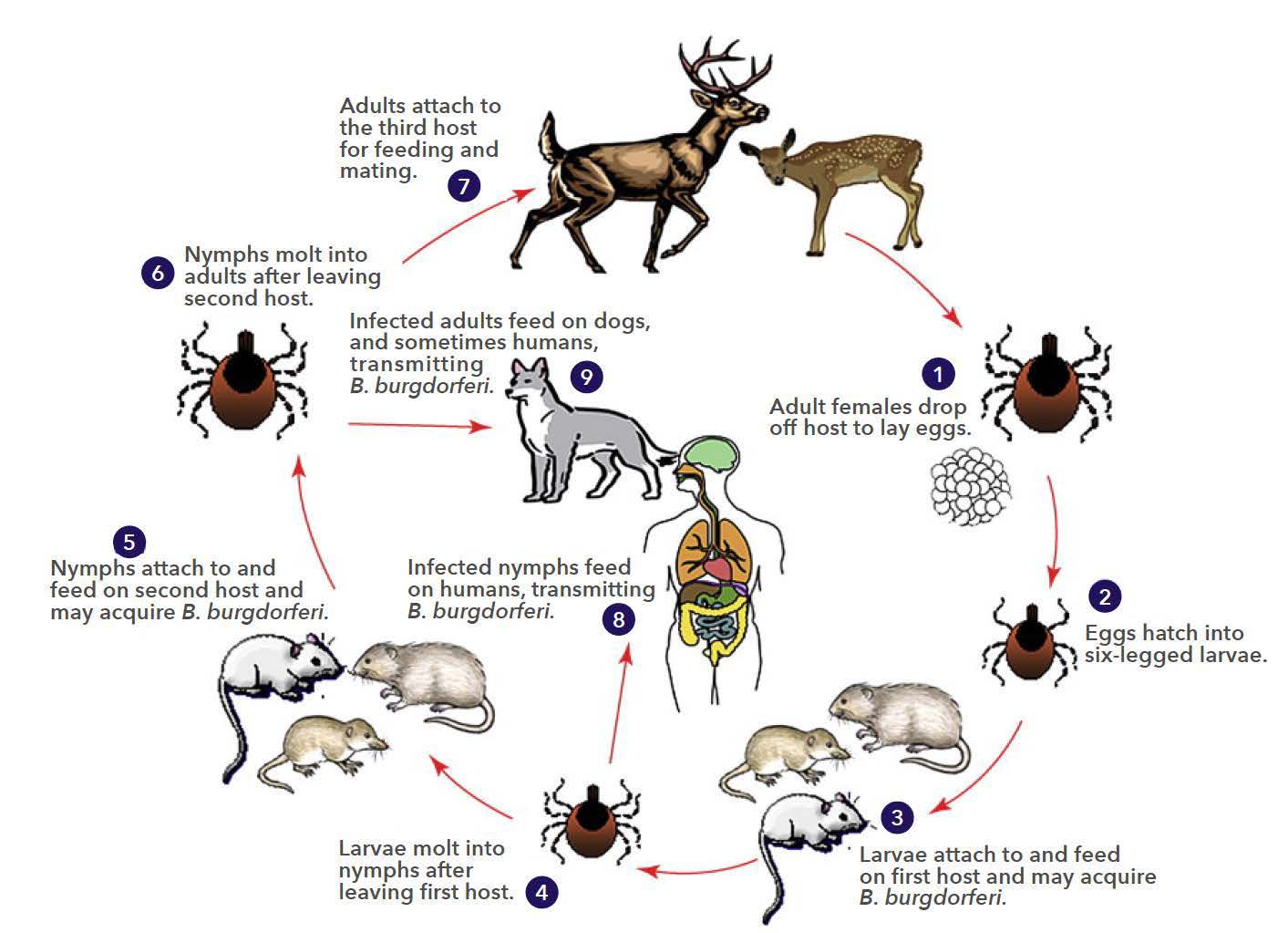
דרך שלישית שבה השפלה של המערכת האקולוגית יכולה להגביר את התפשטות המחלות היא באמצעות הפחתת המגוון הביולוגי. לדוגמא, מחלת ליים נגרמת על ידי החיידק בורליה ומועברת לבני אדם מיונקים קטנים (המאגרים) על ידי קרציות (דמויות). \(\PageIndex{l-m}\) חלק מהמאגרים (סנאים ואופוסומים) מסירים קרציות, מפחיתים זיהום, אך עכברי שדה לא. פיצול בתי הגידול הגדיל את עכברי השדה ביחס לסנאים ואופוסומים ובכך הגדיל את המאגר למחלת ליים.
אנשים שנחשדים או ידועים שנחשפו לפתוגנים מדבקים מסוימים עשויים להיות בהסגר או לבודד כדי למנוע העברת המחלה לאחרים. בתי חולים ומתקני בריאות אחרים מקימים בדרך כלל מחלקות מיוחדות לבידוד חולים עם מחלות מסוכנות במיוחד כגון שחפת או COVID-19 (איור\(\PageIndex{n}\)). בהתאם להגדרה, מחלקות אלה עשויות להיות מצוידות בשיטות טיפול מיוחדות באוויר, ואנשי צוות רשאים ליישם פרוטוקולים מיוחדים להגבלת הסיכון להעברה, כגון ציוד מגן אישי או שימוש בתרסיסי חיטוי כימיים עם כניסה ויציאה של אנשי רפואה.

ייחוס
שונה על ידי מליסה הא ממחלות ואפידמיולוגיה ממיקרוביולוגיה על ידי OpenStax (מורשה תחת CC-BY). גישה בחינם באתר openstax.org.


