8.3: אלקטרופורזה
- Page ID
- 207753
אלקטרופורזה משתמשת בשדה חשמלי המופעל על פני מטריצת ג'ל כדי להפריד מולקולות גדולות כגון DNA, RNA וחלבונים לפי מטען וגודל. דגימות נטענות לבארות של מטריצת ג'ל שיכולה להפריד מולקולות לפי גודל ושדה חשמלי מוחל על פני הג'ל. שדה זה גורם למולקולות טעונות שלילי לנוע לעבר האלקטרודה החיובית. מטריצת הג'ל, עצמה, פועלת כמסננת, שדרכה עוברות המולקולות הקטנות ביותר במהירות, בעוד מולקולות ארוכות יותר נעות לאט יותר.
עבור DNA ו- RNA, מיון מולקולות לפי גודל בדרך זו הוא טריוויאלי, בגלל המטען השלילי האחיד על עמוד השדרה של הפוספט. עבור חלבונים, המשתנים במטענים שלהם, יש להשתמש בטריק חכם כדי לגרום להם לחקות חומצות גרעין - ראה אלקטרופורזה של ג'ל פוליאקרילאמיד (PAGE) להלן. לסוגים שונים של ג'לים יש גדלי נקבוביות שונים. כמו מסננות עם רשתות עדינות או גסות יותר, ג'לים מסוימים עושים עבודה טובה יותר בהפרדת מולקולות קטנות יותר בעוד שאחרים עובדים טוב יותר עבור גדולות יותר. ג'ל אלקטרופורזה עשוי לשמש טכניקה הכנה (כלומר, כאשר טיהור חלבונים או חומצות גרעין), אבל לרוב זה משמש ככלי אנליטי.
אלקטרופורזה של ג'ל אגרוז
אלקטרופורזה של ג'ל אגרוז היא טכניקה המשמשת להפרדת חומצות גרעין בעיקר לפי גודל. אגרוז הוא פוליסכריד המתקבל מאצות ים (איור 8.11). ניתן להמיס אותו במאגר רותח ולשפוך אותו למגש, שם הוא מתייצב כשהוא מתקרר (איור 8.12) ליצירת לוח. ג'לי אגרוז מוזגים עם מסרק במקום כדי ליצור בארות שאליהן מונחות דגימות DNA או RNA לאחר שהג'ל התמצק. הג'ל טובל במאגר ומורח זרם על פני הלוח. ל-DNA דו-גדילי יש מטען שלילי אחיד שאינו תלוי בהרכב הרצף של המולקולה. לכן, אם שברי DNA ממוקמים בשדה חשמלי הם ינודדו מהקתודה (-) לכיוון האנודה (+). קצב הנדידה תלוי ישירות ביכולתה של כל מולקולת DNA לתולעת או להתנועע דרך ג'ל המסננת. מטריצת האגרוז מספקת פתחים למקרומולקולות לעבור דרכם. למקרומולקולות הגדולות ביותר יש את הזמן הקשה ביותר לנווט דרך הג'ל, ואילו המקרומולקולות הקטנות ביותר מחליקות דרכו הכי מהר.
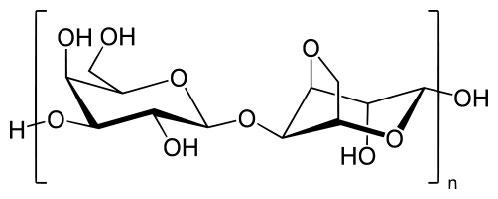
איור 8.11 - מבנה פוליסכריד אגרוז. ויקיפדיה
מכיוון שאלקטרופורזה משתמשת בזרם חשמלי ככוח להנעת המולקולות דרך המטריצה, יש לטעון את המולקולות המופרדות. מכיוון שיחס הגודל למטען של DNA ו- RNA קבוע לכל הגדלים של חומצות הגרעין הללו, המולקולות פשוט ממיינות על בסיס גודלן - הקטן ביותר נע הכי מהר והגדול ביותר נע הכי לאט.
כל השברים בגודל נתון יעברו באותו מרחק על הג'ל ויוצרים את מה שמכונה "להקות" על הג'ל. ויזואליזציה של שברי ה-DNA בג'ל מתאפשרת על ידי הוספת צבע, כגון אתידיום ברומיד, שמתערבב בין הבסיסים והפלורסציות במבט תחת אור אולטרה סגול (איור 8.13) על ידי הפעלת DNA ייחוס בגדלים ידועים לצד הדגימות, ניתן לקבוע את הגדלים של שברי ה-DNA בדגימה. כדאי לציין שלפי המוסכמה, שברי DNA אינם מתוארים לפי המשקל המולקולרי שלהם (בניגוד לחלבונים), אלא לפי אורכם בזוגות בסיסים (bp) או בקילו-בסיסים (kb).

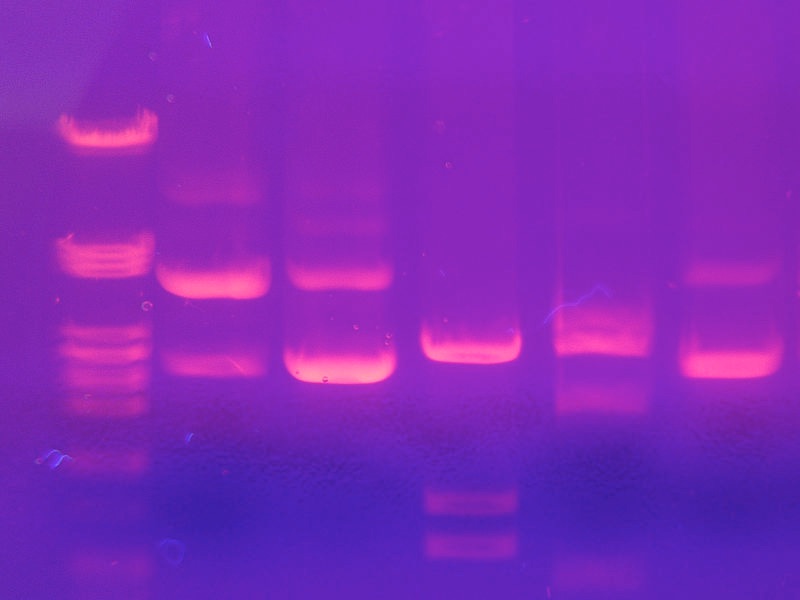
איור 8.13 - להקות DNA דמיינו עם צביעת אתידיום ברומיד. ויקיפדיה
אלקטרופורזה של ג'ל פוליאקרילאמיד (PAGE)
בדומה ל- DNA ו- RNA, חלבונים הם מקרומולקולות גדולות, אך בניגוד לחומצות גרעין, חלבונים אינם בהכרח טעונים שלילית. המטען על כל חלבון תלוי ברצף חומצות האמינו הייחודי שלו. לפיכך, החלבונים בתערובת לא בהכרח ינועו כולם לעבר האנודה.
בנוסף, בעוד ש- DNA דו-גדילי הוא בצורת מוט, רוב החלבונים הם כדוריים (מקופלים). יתר על כן, חלבונים קטנים במידה ניכרת מחומצות גרעין, כך שפתחי המטריצה של ג'ל האגרוז פשוט גדולים מכדי לספק הפרדה ביעילות. כתוצאה מכך, חלבונים ללא שינוי (מקומיים) אינם סיכויים טובים במיוחד לאלקטרופורזה על ג'לי אגרוז. כדי להפריד חלבונים על ידי מסה באמצעות אלקטרופורזה, יש לבצע מספר שינויים.
מטריצת ג'ל
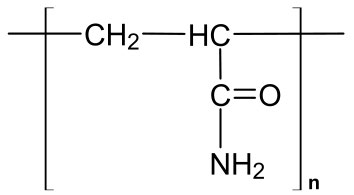
ראשית, נעשה שימוש במטריצה המיוצרת על ידי פילמור וקישור צולב של יחידות אקרילאמיד. אקרילאמיד מונומרי (איור 8.14) מפולמר והפולימרים מקושרים באמצעות N, N'-methylene-bisacrylamide (איור 8.15) ליצירת מבנה דמוי רשת. אפשר להתאים את גודל הפתחים של המטריצה/רשת בקלות על ידי שינוי אחוז האקרילאמיד בתגובה. אחוזים גבוהים יותר של אקרילאמיד נותנים פתחים קטנים יותר ויעילים יותר להפרדת מולקולות קטנות יותר, בעוד שאחוזים נמוכים יותר של אקרילאמיד משמשים בעת פתרון תערובות של מולקולות גדולות יותר. (הערה: ג'לים פוליאקרילאמיד משמשים גם להפרדת שברי חומצות גרעין קטנים, כאשר כמה ג'לים אקרילאמיד מסוגלים להפריד פיסות DNA הנבדלות באורכן על ידי נוקלאוטיד אחד בלבד.)
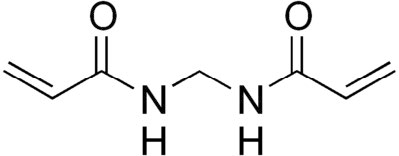
איור 8.15 - N, N'-מתילנביסקרילאמיד - מגיב צולב אקרילאמיד. ויקיפדיה
שינוי טעינה על ידי SDS
שיקול שני הוא שיש לשנות חלבונים פיזית כדי "להציג" את עצמם למטריצה כמו מוטות ה-DNA הטעונים שלילי. זה מושג על ידי טיפול בחלבונים עם חומר הניקוי האניוני, SDS (נתרן דודציל סולפט). SDS מבטל את החלבונים כך שהם מקבלים צורה דמוית מוט ומולקולות ה-SDS מצפות את החלבונים כך שהמשטח החיצוני עמוס במטענים שליליים, מסווים את המטענים המקוריים על החלבונים והופכים את המטען על החלבונים לפרופורציונלי יותר למסה שלהם, כמו עמוד השדרה של ה-DNA.
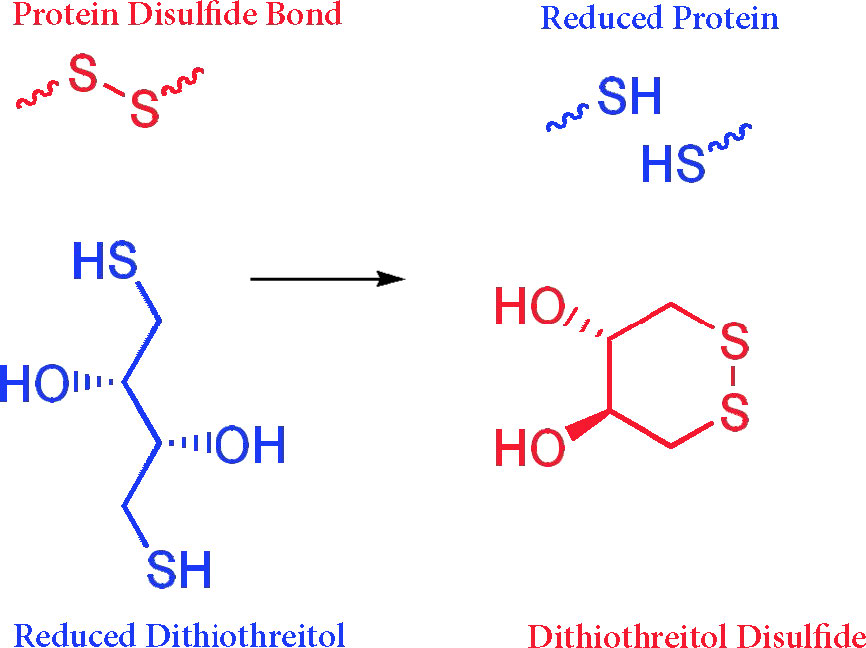
מכיוון שלחלבונים יש בדרך כלל קשרי דיסולפיד המונעים מהם להתפתח לחלוטין בחומר ניקוי, דגימות מבושלות עם מרקפטואתנול כדי לשבור את קשרי הדיסולפיד ולהבטיח שהחלבונים דמויי מוט ככל האפשר ב- SDS. ריאגנטים כמו מרקפטואתנול (וגם דיתיותריטול) הם ריאגנטים המכילים סולפהידריל המתחמצנים כשהם מפחיתים קשרי דיסולפיד במולקולות אחרות (ראה איור 8.16)
ג'ל הערמה
שיקול שלישי הוא שניתן להשתמש ב"ג'ל ערימה "בחלק העליון של ג'ל פוליאקרילאמיד כדי לספק דרך לדחוס את הדגימות לרצועה הדוקה לפני שהן נכנסות לג'ל הפוליאקרילאמיד הראשי (הנקרא ג'ל הפתרון). בדיוק כמו שברי DNA באלקטרופורזה של ג'ל אגרוז ממוינים על בסיס גודל (המהלך הגדול ביותר האיטי והקטן ביותר נע הכי מהר), החלבונים נודדים דרך מטריצת הג'ל במהירויות הקשורות הפוך לגודלם. עם השלמת האלקטרופורזה, ניתן לדמיין חלבונים על ידי צביעה בתרכובות הנקשרות לחלבונים, כמו Coomassie Brilliant Blue (איור 8.17) או חנקתי כסף.
איור 8.17 - שני ג'לים SDS-PAGE - חלבונים הם הרצועות הכחולות (מוכתמות בכחול קומאסי). ויקיפדיה
אלקטרופורזה של ג'ל ללא דנטורציה
טכניקת SDS_PAGE שתוארה לעיל היא השיטה הנפוצה ביותר המשמשת להפרדה אלקטרופורטית של חלבונים. עם זאת, במצבים מסוימים, חלבונים עשויים להיפתר על מה שמכונה ג'לים "ילידים", בהיעדר SDS. בתנאים אלה, תנועת החלבונים דרך הג'ל תושפע לא רק מהמסה שלהם, אלא גם מהמטען שלהם ב- pH של הג'ל. חלבונים המורכבים עם מולקולות אחרות עשויים לנוע כישות אחת, מה שמאפשר בידוד של השותפים המחייבים של חלבונים בעלי עניין.
מיקוד איזואלקטרי
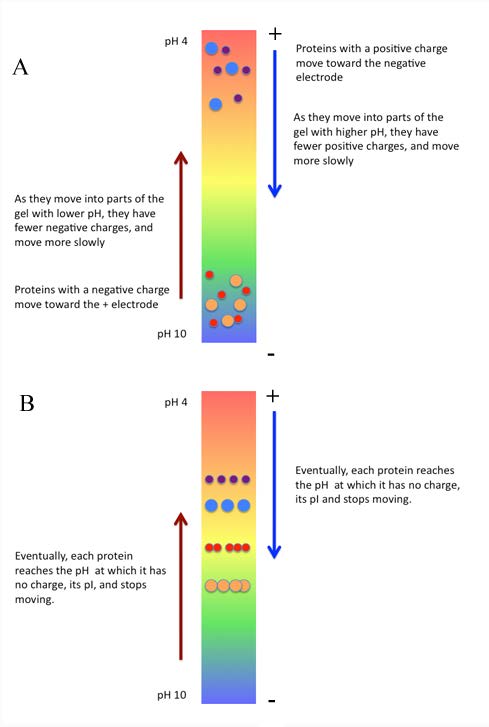
חלבונים משתנים במידה ניכרת במטענים שלהם, וכתוצאה מכך בערכי ה-pI שלהם (pH שבו המטען שלהם הוא אפס). ניתן לנצל זאת להפרדת חלבונים בתערובת. הפרדת חלבונים על ידי מיקוד איזואלקטרי דורשת הקמת שיפוע pH בצינור המכיל מטריצת ג'ל אקרילאמיד. גודל הנקבוביות של הג'ל מותאם להיות גדול, כדי להפחית את ההשפעה של סינון על פי גודל. מולקולות להפרדה מוחלות על הג'ל המכיל את שיפוע ה-pH ומוחל שדה חשמלי. בתנאים אלה, חלבונים ינועו בהתאם למטען שלהם.
מולקולות טעונות חיוביות, למשל, נעות לעבר האלקטרודה השלילית, אך מכיוון שהן עוברות דרך שיפוע pH, כשהן עוברות דרכה, הן מגיעות לאזור בו המטען שלהן אפס, ובשלב זה הן מפסיקות לנוע. בשלב זה הם נמשכים לא לאלקטרודה החיובית ולא השלילית ולכן הם "ממוקדים" ב- pI שלהם (איור 8.18). באמצעות מיקוד איזואלקטרי, ניתן להפריד חלבונים שערכי ה-pI שלהם שונים ב-0.01 יחידות בלבד.
אלקטרופורזה ג'ל דו מימדית
הן SDS-PAGE והן מיקוד איזואלקטרי הן טכניקות רבות עוצמה, אך שילוב חכם של השניים הוא כלי רב עוצמה של פרוטאומיקה - המדע של לימוד כל החלבונים של תא/רקמה בו זמנית. באלקטרופורזה של ג'ל דו-ממדי, ליזאט מוכן לראשונה מתאי העניין. החלבונים בליזאט מופרדים תחילה על ידי ה- pI שלהם, באמצעות מיקוד איזואלקטרי ולאחר מכן לפי גודל על ידי SDS-PAGE.

תערובת החלבונים מוחלת תחילה על צינור או רצועה (איור 8.19, שלב 1) שבו מתבצע מיקוד איזואלקטרי כדי להפריד את החלבונים לפי ערכי ה-pI שלהם (שלב 2). לאחר מכן, כפי שמוצג באיור, הג'ל המכיל את החלבונים המופרדים על ידי ה- PIs שלהם מופנה על צדו ומוחל לאורך החלק העליון של לוח פוליאקרילאמיד עבור SDS-PAGE להפרדה על בסיס גודל (שלב 3). החלבונים במטריצת המיקוד האיזואלקטרית עוברים אלקטרופורזה לג'ל הפוליאקרילאמיד ומופרדים על בסיס גודל. התוצר של ניתוח זה הוא ג'ל דו-ממדי כפי שמוצג באיור 8.20. העוצמה של אלקטרופורזה ג'ל דו-ממדית היא שכמעט כל חלבון בתא יכול להיות מופרד ולהופיע על הג'ל כנקודה המוגדרת על ידי גודלו הייחודי ו- pI. באיור, כתמים בפינה השמאלית העליונה תואמים לחלבונים גדולים בעלי מטען חיובי, ואילו אלה בפינה הימנית התחתונה הם קטנים בעלי מטען שלילי. ניתן לחמוק ולזהות כל נקודה בג'ל דו-ממדי באמצעות ספקטרומטריית מסה בתפוקה גבוהה. זה חזק במיוחד כאשר משווים פרופילי חלבון בין רקמות שונות או בין בקרה לדגימות מטופלות של אותה רקמה.

איור 8.20 - תוצאה של הפרדת אלקטרופורזה דו-ממדית של ג'ל. ויקיפדיה
השוואת פרופילי חלבון
השוואה בין ג'לים דו-ממדיים של חלבונים מרקמות לא סרטניות וחלבונים מרקמה סרטנית מאותו סוג מספקת זיהוי מהיר של חלבונים שרמת הביטוי שלהם שונה בין השניים. מידע כזה יכול להיות שימושי בעיצוב טיפולים או בהבנת המנגנונים שבאמצעותם הסרטן מתפתח.


