8.11: מחשוף חלבון
- Page ID
- 207788
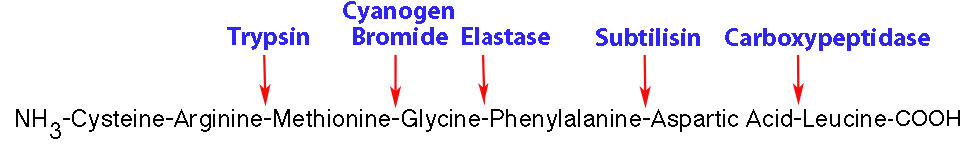
בגלל גודלם הגדול, חלבונים שלמים יכולים להיות קשים ללימוד באמצעות טכניקות אנליטיות, כגון ספקטרומטריית מסה. כתוצאה מכך, לעתים קרובות רצוי לשבור פוליפפטיד גדול לחתיכות קטנות יותר. פרוטאזות הן אנזימים שבדרך כלל שוברים קשרים פפטידים על ידי קישור לרצפי חומצות אמינו ספציפיים בחלבון ומזרזים את ההידרוליזה שלהם.
ריאגנטים כימיים, כגון ציאנוגן ברומיד, המבקע קשרי פפטיד בצד מסוף C של שארית מתיונין יכולים לשמש גם כדי לחתוך חלבונים גדולים יותר לפפטידים קטנים יותר. חלבונים נפוצים המבצעים פעילות זו נמצאים במערכת העיכול ומוצגים להלן.
- Subtilisin - צד מסוף C של שרשראות צד גדולות לא טעונות
- כימוטריפסין - צד מסוף C של ארומטים (Phe, Tyr, Trp)
- טריפסין - צד מסוף C של ליסין וארגינינים (לא ליד פרולין)
- קרבוקסיפפטידאז - צד N-טרמינלי של חומצת אמינו מסוף C
- אלסטאז - הידרוליזה של צד C של AAs קטנים (Gly, Ala)
- ציאנוגן ברומיד (כימי) - הידרוליזה של צד C של Met
קביעת מסה ורצף חלבון
ספקטרומטריית מסה, כשמה כן הוא, היא שיטה שניתן להשתמש בה לקביעת המוני המולקולות. לאחר שהוגבל לניתוח מולקולות קטנות, הוא הותאם ושופר מאז כדי לאפשר ניתוח של מולקולות חשובות מבחינה ביולוגית כמו חלבונים וחומצות גרעין. ספקטרומטרי מסה משתמשים בשדה חשמלי כדי להאיץ מולקולה מיוננת לעבר גלאי. הזמן שלוקח מולקולה מיוננת לעבור מנקודת היינון שלה לגלאי יהיה תלוי הן במסה שלה והן במטען שלה ונקרא זמן הטיסה שלה (TOF).
מלדי-TOF

MALDI-TOF (יינון לייזר בסיוע מטריקס - זמן טיסה) היא טכניקה אנליטית המאפשרת לקבוע את המסות המולקולריות של מולקולות רלוונטיות ביולוגית בדיוק רב. הוא משמש בדרך כלל בפרוטאומיקה וקביעת מסות של ביומולקולות גדולות, כולל חומצות גרעין. הפיתוח של MALDI, המאפשר ייצור של צורות יוניות של מולקולות גדולות יחסית, היה חיוני לשימוש מוצלח בספקטרומטריית מסה של ביומולקולות. איור 8.46 מציג מערכת MALDI-TOF קומפקטית.
תהליך MALDI-TOF כולל שלושה שלבים בסיסיים. ראשית, החומר שיש לנתח מוטבע בחומר תמיכה מוצק (מטריצה) שניתן לנדוד בתא ואקום על ידי קרן לייזר. בחלק השני של התהליך, לייזר המתמקד במטריצה מנדף את הדגימה, גורם למולקולות שבתוכה להתאדות ובתוך כך ליצור יונים על ידי השגת או איבוד פרוטונים. שלישית, היונים שנוצרו כך במדגם מואצים על ידי שדה חשמלי לעבר גלאי. קצב התנועה שלהם לעבר הגלאי הוא פונקציה של היחס בין המסה שלהם לטעינה (m/z). יון עם מסה של 100 ומטען של +1 ינוע במהירות כפולה כמו יון עם מסה של 200 ומטען של +1 ובאותו קצב כמו יון עם מסה של 200 ומטען של +2. לפיכך, על ידי קביעה מדויקת של הזמן שלוקח ליון לעבור מיינון (זמן אפס של טיפול הלייזר) לגילוי, ניתן לקבוע בקלות את יחס המסה למטען עבור כל המולקולות בדגימה.
יינון עלול לגרום לערעור יציבות של מולקולות גדולות יותר, המתפרקות לקטנות יותר בתא הזיהוי MALDI-TOF. גודלו של כל אחד משברי המשנה של מולקולה גדולה יותר מאפשר לקבוע את זהותה אם זה לא ידוע קודם לכן. ניתן לשפר את הפיצול הזה בכוונה על ידי כך שהיונים המואצים מתנגשים בגז אינרטי, כמו ארגון.
פיצול של מולקולה עשוי להתבצע גם לפני הניתוח, כמו למשל, על ידי ביקוע חלבון לפפטידים קטנים יותר על ידי שימוש באנזימים או חומרים כימיים. רצף חומצות האמינו של חלבון עשוי להיקבע על ידי שימוש ב- MALDI-TOF על ידי ניתוח המסות המולקולריות המדויקות של שברי הפפטיד הקצרים הרבים המתקבלים מחלבון. כאשר חומצת אמינו אחת, למשל, מתפרקת מפפטיד גדול יותר, ניתן לזהות זאת כהבדל במסה בין השבר עם ובלי חומצת האמינו, מכיוון שלכל חומצת אמינו תהיה מסה מולקולרית אופיינית. על ידי טביעת אצבע המונית של פפטיד וניתוח של שברים קטנים יותר של פפטידים בודדים, ניתן לקבוע את כל הרצף של פוליפפטיד.


