8.2: טכניקות חלוקה וכרומטוגרפיה
- Page ID
- 207750
חלוקה של דגימות, כפי שהשם מרמז, היא תהליך של הפרדת הרכיבים או השברים של הליזאט. חלוקה מתחילה בדרך כלל בצנטריפוגה של הליזאט. באמצעות צנטריפוגה במהירות נמוכה, אפשר להסיר פסולת תאים, משאיר supernatant המכיל את התוכן של התא. על ידי שימוש במהירויות צנטריפוגה גבוהות יותר ברציפות (וכתוצאה מכך כוחות g) ניתן להפריד מרכיבים תאיים שונים, כמו גרעינים, מיטוכונדריה וכו ', מהציטופלזמה. לאחר מכן ניתן לסנן אותם בנפרד כדי לשחרר מולקולות הספציפיות לתא הסלולרי המסוים. אם כן, ניתן להפריד עוד יותר את החלק המסיס של כל ליזאט למרכיביו בשיטות שונות.

כרומטוגרפיה של עמודות
שיטה אחת חזקה המשמשת למטרה זו היא כרומטוגרפיה. נשקול מספר גישות כרומטוגרפיות. כרומטוגרפיה משמשת להפרדת מרכיבי התערובת על סמך הבדלים בגודלם, במטען או במאפיינים אחרים. במהלך הכרומטוגרפיה, השלב הנייד (חיץ או ממס אחר) עובר דרך השלב הנייח (בדרך כלל מטריצה מוצקה) הנושא את מרכיבי התערובת. הפרדת הרכיבים מושגת, מכיוון שהרכיבים השונים נעים בקצב שונה, מסיבות המשתנות, תלוי בסוג הכרומטוגרפיה בה נעשה שימוש. נשקול מספר סוגים שונים של כרומטוגרפיה כדי להמחיש תהליך זה.
- כרומטוגרפיה של חילופי יונים
- כרומטוגרפיה של אי הכללת ג'ל
- כרומטוגרפיה זיקה
- HPLC

וריאציות אלה על הכרומטוגרפיה מבוצעות כאשר השלב הנייח מוחזק בתוך מה שנקרא עמודות (איור\(\PageIndex{1}\)). אלה צינורות המכילים את השלב הנייח (נקרא גם "תמיכה" או שלב מוצק).
התומכים מורכבים מחרוזים זעירים התלויים במאגר (איור\(\PageIndex{3}\)) ונועדו לנצל את הבדלי הכימיה או הגודל של מרכיבי הדגימות ובכך לספק אמצעי הפרדה. עמודות "ארוזות" או מלאות בתמיכה, ומאגר או ממס נושאים את תערובת התרכובות להפרדה באמצעות התמיכה. מולקולות במדגם מקיימות אינטראקציה דיפרנציאלית עם התמיכה וכתוצאה מכך עוברות דרכה במהירויות שונות ובכך מאפשרות הפרדה.

כרומטוגרפיה של חילופי יונים
בכרומטוגרפיה של חילופי יונים, התמיכה מורכבת מחרוזים זעירים שאליהם מחוברים כימיקלים בעלי מטען. לפני השימוש, החרוזים מאוזנים בתמיסה המכילה יון נגד מתאים למולקולה הטעונה על החרוז. איור \(\PageIndex{5}\) מציג את היחידה החוזרת של polystyrolsulfonate, תרכובת המשמשת שרף חילופי קטיונים. כפי שאתה יכול לראות, מולקולה זו טעונה שלילית, ולכן החרוזים יהיו מאוזנים במאגר המכיל יון טעון חיובי, נניח נתרן. בהשעיה, הפוליסטירוסולפונט הטעון שלילי אינו מסוגל לעזוב את החרוזים, בשל ההתקשרות הקוולנטית שלו, אך ניתן "להחליף" את היונים הנגדיים (נתרן) במולקולות באותו מטען.
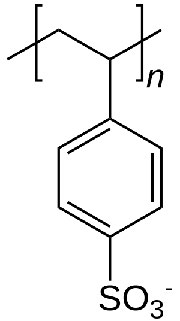
בורסות
לפיכך, בעמודת חילופי קטיונים יהיו יונים נגדיים בעלי מטען חיובי ומולקולות טעונות שלילי המחוברות באופן קוולנטי לחרוזים. תרכובות טעונות חיוביות מליזאט תא המועבר דרך העמוד יתחלפו עם היונים הנגדיים ו"ידבקו" לתרכובות הטעונות שלילי המחוברות באופן קוולנטי לחרוזים. מולקולות במדגם שהן ניטרליות במטען או טעונות שלילי יעברו במהירות דרך העמודה. בשלב זה, רק מולקולות טעונות חיוביות מהדגימה המקורית יהיו קשורות לעמודה. לאחר מכן ניתן לשטוף אותם, או לחמוק מהם, באמצעות מאגרים המכילים ריכוזים גבוהים של מלח. בתנאים אלה, האינטראקציה בין המולקולות הטעונות באופן חיובי לפוליסטירוסולפונט תופרע, ותאפשר לשחזר את המולקולות שהיו קשורות לעמוד.
חילופי אניונים
לעומת זאת, בכרומטוגרפיה של חילופי אניונים, הכימיקלים המחוברים לחרוזים טעונים באופן חיובי והנגדים טעונים שלילי (כלוריד, למשל). מולקולות טעונות שליליות בתא ליזאט "ידבקו" ומולקולות אחרות יעברו במהירות. כדי להסיר את המולקולות "תקועות" לעמוד, פשוט צריך להוסיף ריכוז גבוה של יונים נגדיים כדי לשחרר אותם.
שימושים
שרפים להחלפת יונים שימושיים להפרדת טעונים מביומולקולות לא טעונות, או טעונות הפוך, בתמיסה. לשרפים מגוון יישומים אחרים, כולל טיהור וריכוך מים. איור \(\PageIndex{5}\) מראה שימוש בפולימר פוליסטירולסולפונט בהסרת סידן לריכוך מים.
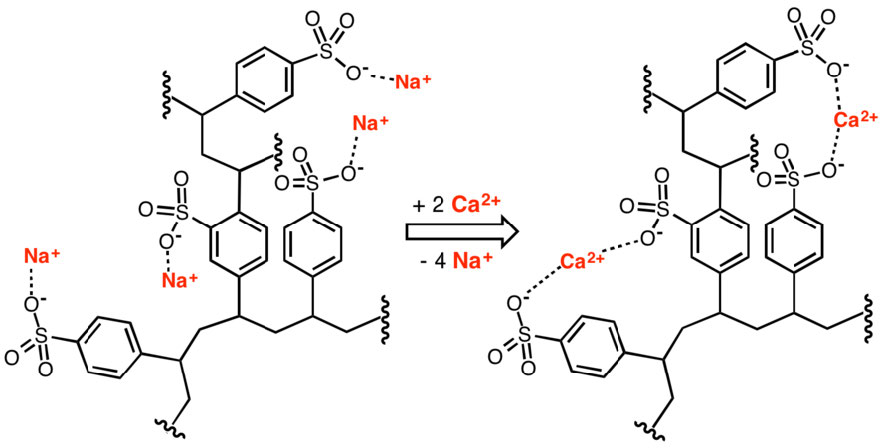
איור \(\PageIndex{5}\): הסרת יוני סידן על ידי מחליף יונים. ויקיפדיה
כרומטוגרפיה של אי הכללת גודל
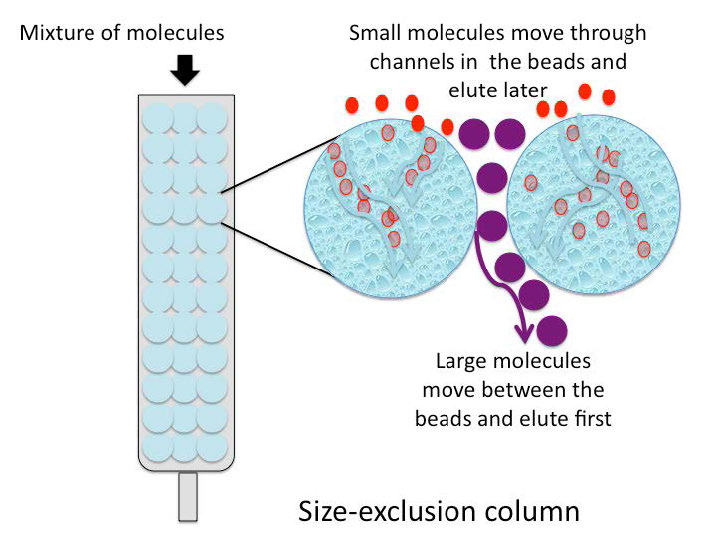
כרומטוגרפיה של אי הכללת גודל (נקראת גם כרומטוגרפיה של אי הכללה מולקולרית, כרומטוגרפיה של אי הכללת ג'ל או כרומטוגרפיה של סינון ג'ל) היא שיטת הפרדה ברזולוציה נמוכה המעסיקה חרוזים עם "מנהרות" זעירות בהן שלכל אחת מהן יש פתח מדויק. גודל הפתח מכונה "מגבלת הרחקה", כלומר מולקולות מעל משקל מולקולרי מסוים לא יוכלו לעבור במנהרות. מולקולות בגדלים פיזיים הגדולים ממגבלת ההדרה אינן נכנסות למנהרות ועוברות דרך העמוד במהירות יחסית, בחללים שמחוץ לחרוזים. מולקולות קטנות יותר, שיכולות להיכנס למנהרות, עושות זאת, וכך, יש להן נתיב ארוך יותר שהן עוברות דרך העמוד ונעלמות אחרון (איור\(\PageIndex{6}\)).
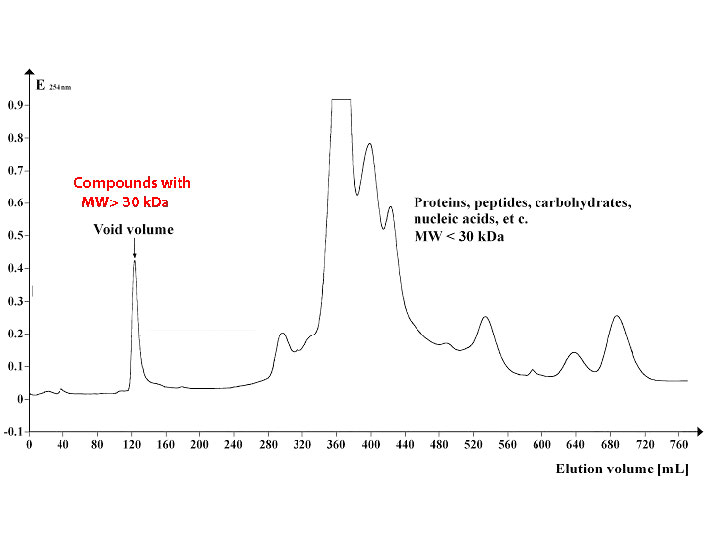
איור \(\PageIndex{7}\) מציג פרופיל של קבוצת חלבונים המופרדים על ידי כרומטוגרפיה של אי הכללת גודל באמצעות חרוזים עם מגבלת אי הכללה של כ -30,000 דלטון. חלבונים במשקל מולקולרי של 30,000 או יותר נפלטים בנפח הריק (משמאל) בעוד חלבונים קטנים יותר נעלמים מאוחר יותר (באמצע וימין).
כרומטוגרפיה זיקה
כרומטוגרפיה זיקה היא טכניקה חזקה וסלקטיבית מאוד המנצלת את זיקות הקישור של מולקולות מדגם (בדרך כלל חלבונים) למולקולות המקושרות באופן קוולנטי לחרוזי התמיכה. בניגוד לכרומטוגרפיה של חילופי יונים, שבה כל המולקולות של מטען נתון היו נקשרות לעמודה, כרומטוגרפיה של זיקה מנצלת את הקישור הספציפי של חלבון או חלבונים לליגנד המשותק על החרוזים בעמודה.
לדוגמה, אם רוצים להפריד את כל החלבונים בתא ליזאט הנקשרים ל- ATP מחלבונים שאינם קושרים ATP, אפשר להשתמש בעמודה שיש לה ATP המחובר לחרוזי התמיכה ולהעביר את הדגימה דרך העמודה. כל החלבונים הקושרים ATP "יידבקו" לעמודה, ואילו אלה שאינם קושרים ATP יעברו דרכו במהירות. לאחר מכן ניתן לשחרר את החלבונים הקשורים מהעמודה על ידי הוספת תמיסה של ATP שתעקור את החלבונים הקשורים על ידי תחרות, על החלבונים, עם ה- ATP המחובר למטריצת העמודים.
תיוג היסטידין
תיוג היסטידין (תיוג His) הוא סוג מיוחד של כרומטוגרפיה זיקה ומהווה כלי רב עוצמה לבידוד חלבון רקומביננטי מליזאט תא. תיוג His מסתמך על שינוי אזור קידוד ה-DNA לחלבון כדי להוסיף סדרה של לפחות שישה שאריות היסטידין למסוף האמינו או הקרבוקסיל של החלבון המקודד. "His-Tag" זה שימושי בטיהור החלבון המתויג מכיוון ששרשראות צד היסטידין יכולות להיקשר ליוני ניקל או קובלט. ההפרדה של חלבונים מתויגים ב-His מליזאט תא היא קלה יחסית (איור\(\PageIndex{8}\)). העברת ליזאט התא הגולמי דרך עמוד עם ניקל או קובלט המחוברים לחרוזים מאפשרת לחלבונים המתויגים ב-His "להידבק", בעוד שחלבוני התא הנותרים עוברים כולם במהירות. החלבונים המתויגים ב- His נפלטים לאחר מכן על ידי הוספת אימידאזול לעמוד. אימידאזול, הדומה לשרשרת הצדדית של היסטידין, מתחרה בחלבונים המתויגים ב- His ומעקר אותם מהעמודה. למרות שחלבונים שאינם מתויגים בליזאט עשויים להכיל גם היסטידין כחלק מהרצף שלהם, הם לא ייקשרו לעמודה חזק כמו החלבון המתויג His, ולכן יעקרו בריכוזי אימידאזול נמוכים יותר מהנדרש כדי לחמוק מה-His- חלבון מתויג. באופן מפתיע, נראה כי חלבונים רבים המתויגים ב- His מתפקדים כרגיל למרות ההיסטידינים הנוספים, אך במידת הצורך, תגי ההיסטידין עשויים להיבקע מהחלבון המטוהר על ידי טיפול בפרוטאז שכרות את ההיסטידינים הנוספים, ומאפשר התאוששות של החלבון הרצוי עם הרצף המקורי שלו.
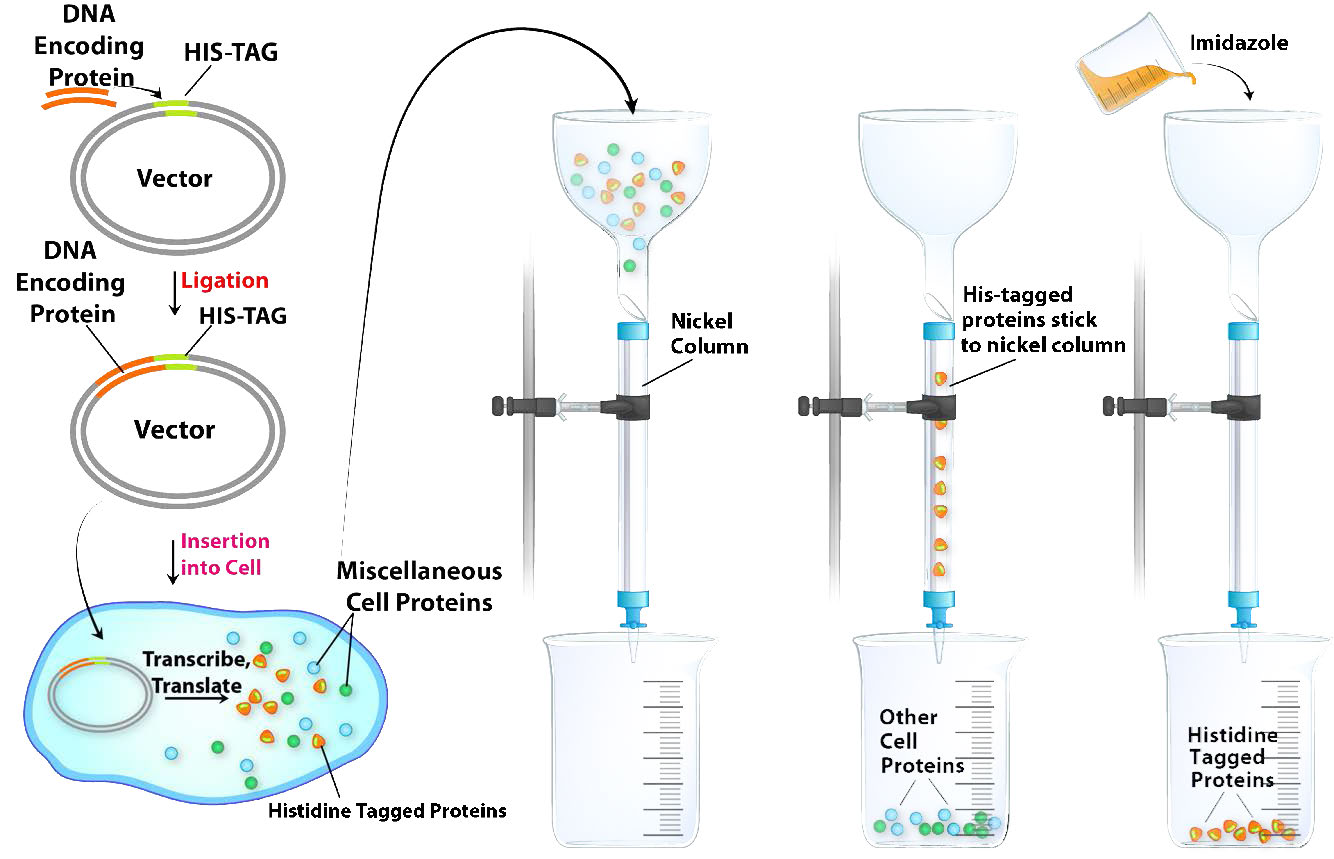
איור \(\PageIndex{8}\): טיהור כרומטוגרפי זיקה של חלבון על ידי תיוג היסטידין. תמונה מאת אליה קים
HPLC
כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) היא כלי רב עוצמה להפרדת מגוון מולקולות על סמך הקוטביות הדיפרנציאלית שלהן (איור). \(\PageIndex{9}\) צורה יעילה יותר של כרומטוגרפיה של עמודים, היא מעסיקה עמודים עם תומכים ארוזים היטב וחרוזים זעירים מאוד כך שזרימת ממיסים/מאגרים דרך העמודים דורשת לחצים גבוהים. התומכים המשמשים עשויים להיות קוטביים (הפרדת פאזה רגילה) או לא קוטביים (הפרדת פאזה הפוכה). בהפרדות פאזה רגילות, מולקולות לא קוטביות נפלטות תחילה ואחריהן התרכובות הקוטביות יותר. סדר זה מוחלף בכרומטוגרפיה של פאזה הפוכה. מבין השניים, שלב הפוך נפוץ הרבה יותר בשל פרופילים כרומטוגרפיים (הפרדות) הניתנים לשחזור שהוא מייצר בדרך כלל.

איור \(\PageIndex{9}\): HPLC: משאבות שמאל/עמודה במרכז/גלאי בצד ימין. ויקיפדיה


