7.4: תיקון DNA
- Page ID
- 207582
מקור: BiochemFFA_7_3.pdf. ספר הלימוד כולו זמין בחינם מהמחברים בכתובת http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
שמירה על הגנום
בחלק האחרון שקלנו את הדרכים שבהן תאים מתמודדים עם האתגרים הקשורים לשכפול ה-DNA שלהם, תהליך חיוני לכל התאים. ניכר שאם ה- DNA הוא העותק הראשי של הוראות לאורגניזם, חשוב לא לטעות בעת העתקת ה- DNA כדי להעביר לתאים חדשים. למרות שהגהה על ידי פולימראזות DNA מגבירה מאוד את דיוק השכפול, ישנם מנגנונים נוספים בתאים כדי להבטיח עוד יותר שה-DNA המשוכפל החדש הוא עותק נאמן של המקור, וגם לתיקון נזקים ל-DNA במהלך חייו הרגילים של התא.
נזק ל- DNA
כל ה-DNA סובל מנזק לאורך זמן, מחשיפה לקרינה אולטרה סגולה וקרינה אחרת, כמו גם מכימיקלים שונים בסביבה (איורים 7.34 ו-7.35). אפילו תגובות כימיות המתרחשות באופן טבעי בתוך תאים יכולות להוליד תרכובות שעלולות לפגוע ב- DNA. כפי שאתה כבר יודע, אפילו לשינויים קלים ברצף ה- DNA, כגון מוטציות נקודתיות יכולות לפעמים להיות השלכות מרחיקות לכת. כמו כן, נזק שלא תוקן שנגרם כתוצאה מקרינה, כימיקלים סביבתיים או אפילו כימיה תאית תקינה יכול להפריע להעברת מידע מדויקת ב- DNA. לשמירה על שלמות "התוכנית" של התא יש חשיבות חיונית וזה בא לידי ביטוי במנגנונים הרבים הקיימים לתיקון טעויות ונזקים ב- DNA.
תיקון אי התאמה לאחר שכפול
קודם לכן דנו בהגהה על ידי פולימראזות DNA במהלך השכפול. בעוד שהגהה מפחיתה באופן משמעותי את שיעור השגיאות, לא כל הטעויות מתוקנות תוך כדי תנועה על ידי פולימראזות DNA.
אילו מנגנונים קיימים לתיקון שגיאות השכפול שמוחמצות על ידי פונקציית קריאת ההוכחה של פולימראזות DNA? ניתן לתקן שגיאות המחליקות על ידי הגהה במהלך השכפול על ידי מנגנון הנקרא תיקון חוסר התאמה. בעוד ששיעור השגיאות של שכפול ה-DNA הוא בערך אחד מכל 107 נוקלאוטידים בהיעדר תיקון חוסר התאמה, זה מצטמצם עוד פי מאה לאחד מכל 109 נוקלאוטידים כאשר תיקון חוסר התאמה מתפקד.
מהן המשימות שעומדות בפני מערכת תיקון אי התאמה?
זה חייב:
- סרוק DNA חדש שנוצר כדי לראות אם יש בסיסים שגויים (למשל, G מזווג ל- T)
- זהה והסר את אזור חוסר ההתאמה.
- כראוי למלא את הפער שנוצר על ידי כריתה של אזור חוסר התאמה.
הבחנה בין גדילים
חשוב לציין, למערכת תיקון חוסר ההתאמה חייבת להיות אמצעי להבחין בין גדיל ה- DNA החדש שנוצר מגדיל התבנית, אם יש לתקן שגיאות שכפול בצורה נכונה. במילים אחרות, כאשר מערכת תיקון חוסר ההתאמה נתקלת בתפיסה שגויה של A-G, למשל, עליה לדעת אם יש להסיר את ה- A ולהחליף אותו ב- C או אם יש להסיר את ה- G ולהחליף אותו ב- T.
אך כיצד מערכת תיקון חוסר ההתאמה מבחינה בין גדילי ה- DNA המקוריים לחדשים? בחיידקים, קיומה של מערכת המתילציה את ה- DNA ברצפי GATC היא הפיתרון לבעיה זו. ל-E.coli יש אנזים, DNA אדנין מתילאז (Dam) שמוסיף קבוצות מתיל על אדנינים ברצפי GATC ב-DNA (איור 7.36). DNA ששוכפל לאחרונה עדיין לא עבר מתילציה ולכן ניתן להבחין בינו לבין גדיל התבנית, שהוא מתיל.
חלבוני תיקון חוסר ההתאמה מחליפים באופן סלקטיבי את הגדיל חסר מתילציה, ובכך מבטיחים כי טעויות בגדיל החדש שנוצר מוסרות ומוחלפות. מכיוון שמתילציה היא הקריטריון המאפשר למערכת תיקון חוסר ההתאמה לבחור את הגדיל המתוקן, מערכת תיקון חוסר ההתאמה החיידקית מתוארת כמכוונת מתיל.
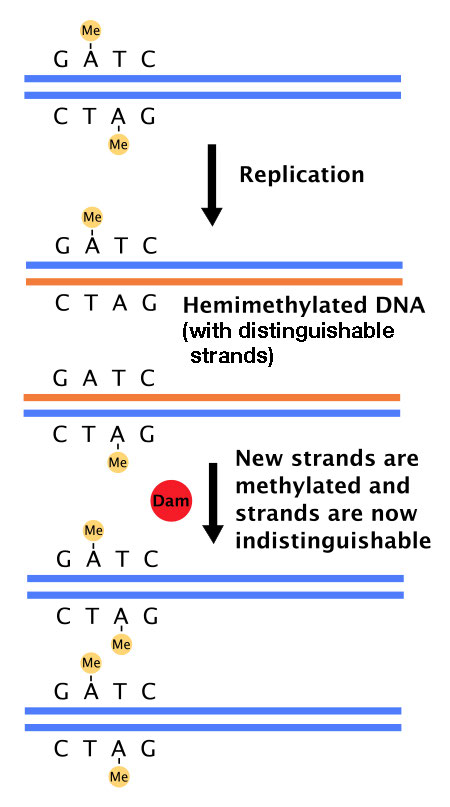
איור 7.36- Dam מתילאז מוסיף קבוצות מתיל ברצפי GATC
גנים לתיקון אי התאמה
תיקון אי התאמה נחקר היטב בחיידקים, והחלבונים המעורבים זוהו. ב- E.coli, חלבוני תיקון חוסר התאמה מקודדים על ידי קבוצת גנים המכונה ביחד גנים mut. מרכיבים חשובים של מכונות תיקון חוסר ההתאמה הם החלבונים MutS, mutL ו- MutH (איור 7.37).
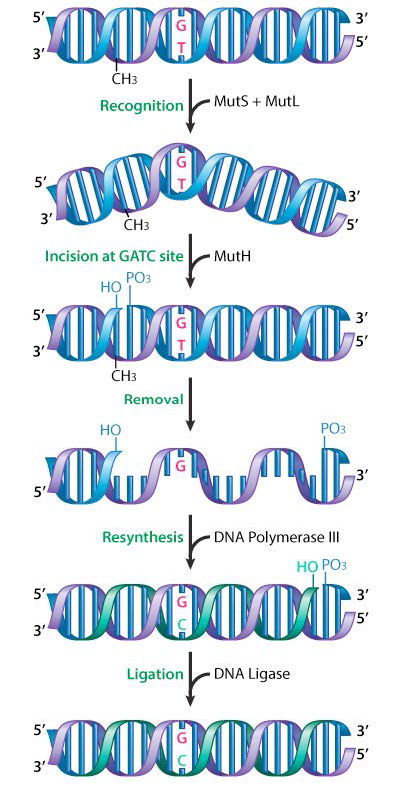
MutS פועל לזיהוי חוסר ההתאמה, בעוד MutL ו- MutH מגויסים לאתר חוסר ההתאמה על ידי קישור של MUTs. MutH הוא אנדונוקלאז החותך את גדיל ה- DNA החדש שסונתז ועדיין לא מתיל ב- GATC. זה מפעיל הליקאז DNA ואקסונוקלאז שעוזרים להירגע ולהסיר את האזור המכיל את חוסר ההתאמה. DNA פולימראז III ממלא את הפער, משתמש בגדיל הנגדי כתבנית, וליגאז מצטרף לקצוות, כדי לשחזר גדיל רציף.
לאיקריוטים יש גם מערכת תיקון חוסר התאמה שמתקנת לא רק אי התאמות בסיס בודדות אלא גם הוספות ומחיקות. הומולוגים ל אי - קולי MutS ו- MutL זוהו באורגניזמים אחרים, כולל בני אדם: HMSH1 ו- HMSH2 (הומולוג MutS אנושי 1 ו-2) הם הומולוגיים ל-MutS, בעוד HmLH 1 הוא הומולוגי ל-MutL. אלה, יחד עם חלבונים נוספים, מבצעים תיקון חוסר התאמה בתאים אוקריוטיים.
מתילציה של DNA אינה משמשת תאים אוקריוטיים כדרך להבחין בין הגדיל החדש מהתבנית, ועדיין לא מובן לחלוטין כיצד מערכת תיקון חוסר ההתאמה באיקריוטים "יודעת" איזה גדיל לתקן. ישנן עדויות לכך שה-DNA החדש שנוצר עשוי להיות מוכר על ידי העובדה שהוא נקרע, או לא רציף. זה מצביע על כך שאי-רציפות הנובעת משברי אוקזאקי שטרם חוברו יחד עשויה לאפשר להבדיל בין הגדיל החדש לבין גדיל התבנית הישן והרציף.
תיקון נזק ל- DNA
בחלק הקודם הסתכלנו על טעויות שנעשו בעת העתקת DNA, כאשר הבסיס הלא נכון מוכנס במהלך סינתזה של הגדיל החדש. אבל אפילו DNA שאינו משוכפל עלול להיפגע או למוטציה. נזקים מסוג זה אינם קשורים לשכפול DNA, אלא הם יכולים להתרחש בכל עת.
מה גורם נזק ל- DNA?
כמה גורמים עיקריים לנזק ל-DNA הם:
א. קרינה (למשל, קרני UV באור השמש ובדוכני שיזוף, או קרינה מייננת)
ב. חשיפה לכימיקלים מזיקים, כגון ניטרוסמינים או פחמימנים ארומטיים פוליציקליים, בסביבה (ראה איור 7.38)
ג. תגובות כימיות בתוך התא (כגון דימינציה של ציטוסין לתת אורציל, או מתילציה של גואנין לייצור מתילגואנין).
המשמעות היא שה- DNA בתאים שלך פגיע לנזק פשוט כתוצאה מפעולות רגילות, כגון הליכה בחוץ, תנועה או מהטרנספורמציות הכימיות המתרחשות בכל תא כחלק מפעילותו היומיומית. (באופן טבעי, הנזק גרוע בהרבה במצבים בהם החשיפה לקרינה או כימיקלים מזיקים גדולה יותר, למשל כאשר אנשים משתמשים במיטות שיזוף, או מעשנים, באופן קבוע.)
סוגי נזק
אילו סוגים של נזק גורמים גורמים גורמים גורמים אלה? קרינה יכולה לגרום לסוגים שונים של נזק ל- DNA.
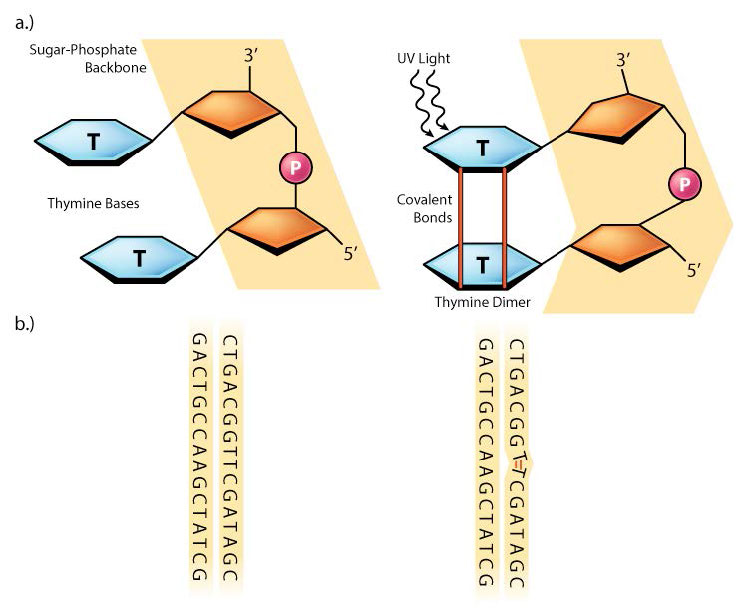
לפעמים, כמו בחלק גדול מהנזק שנגרם על ידי קרני UV, שני בסיסי פירמידין סמוכים ב-DNA יהיו מקושרים ליצירת דימרים או CPDs של ציקלובוטאן (ראה איור 7.39). שימו לב שמדובר בשני בסיסי פירמידין שכנים על אותו גדיל DNA. חשיפה לקרינת UV יכולה גם להוביל להיווצרות סוג אחר של נגע, המכונה מוצר צילום (6-4) או 6-4PP (איור 7.39). קרינה מייננת עלולה לגרום לשבירות בעמוד השדרה של ה- DNA, בגדיל אחד או בשניהם.
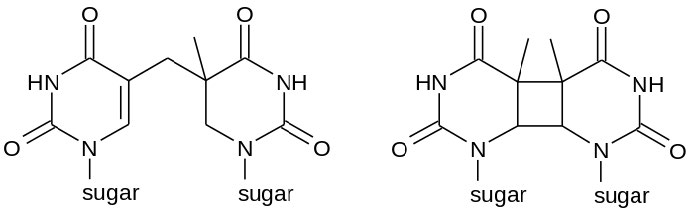
איור 7.39 - מבנים כימיים אפשריים של דימר פירמידין - 6-4PP (משמאל) ו-CPD (מימין) - ויקיפדיה
מולקולות כמו בנזופירן, המצויות בפליטה של מכוניות, יכולות להצמיד את עצמן לבסיסים, וליצור תוספות DNA מגושמות שבהן קבוצות כימיות גדולות מקושרות לבסיסים ב-DNA. נזק כמו דימרים פירמידין, 6-4PPs או תוספות כימיות יכול לעוות פיזית את סליל ה-DNA, ולגרום ל-DNA ו-RNA פולימראז להיעצר כאשר הם מנסים להעתיק את אזורי ה-DNA האלה (איור 7.40).
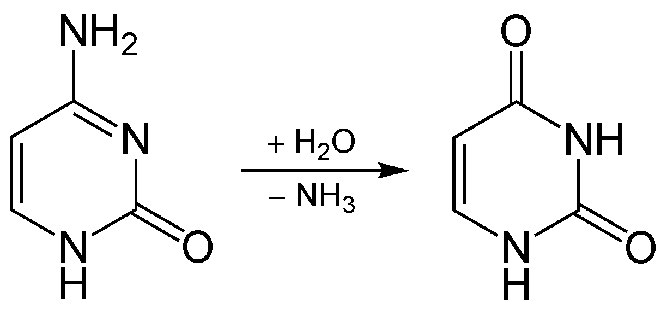
תגובות כימיות המתרחשות בתוך תאים עלולות לגרום לדימינציה של ציטוזינים ב-DNA לאורציל. סוגים אחרים של נזקים בקטגוריה זו כוללים היווצרות בסיסים מחומצנים כמו 8-אוקסו-גואנין או בסיסים אלקילטים כמו O6-מתילגואנין. אלה אינם משנים למעשה את המבנה הפיזי של סליל ה-DNA, אך הם עלולים לגרום לבעיות מכיוון שאורציל ו-8-אוקסו-גואנין מזדווגים עם בסיסים שונים מהציטוסין או הגואנין המקוריים, מה שמוביל למוטציות בסיבוב השכפול הבא. O6-methylguanine באופן דומה יכול ליצור זוגות בסיס עם תימין במקום ציטוסין.
הסרת נזק
לתאים יש מספר דרכים להסיר את סוגי הנזק שתוארו לעיל. הראשון שבהם מתואר כהיפוך ישיר. אורגניזמים רבים (אם כי, למרבה הצער עבורנו, לא בני אדם) יכולים לתקן נזקי UV כמו CPDs ו-6-4PPs מכיוון שיש להם אנזימים הנקראים פוטוליאזות (צילום = אור; ליאז = אנזים פירוק - איור 7.41). פוטוליאזות פועלות בתהליך הנקרא פוטו-אקטיבציה, ומשתמשות באנרגיית אור כחול כדי לזרז תגובה פוטוכימית השוברת את הקשרים החריגים ב-DNA הפגוע ומחזירה את ה-DNA למצבו המקורי.
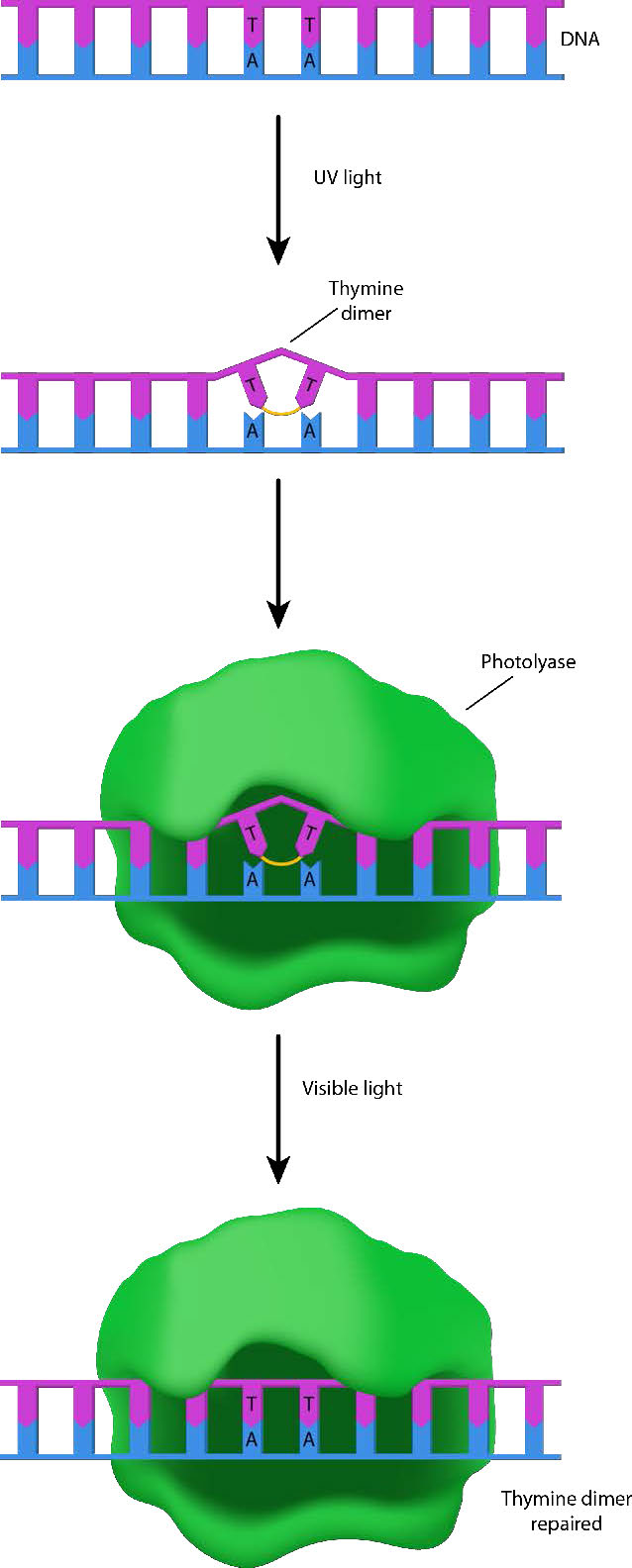
אנזים התאבדות
ניתן להסיר O6-מתילגואנין ב- DNA גם על ידי היפוך ישיר, בעזרת האנזים O6-מתילגואנין מתילטרנספראז. זהו אנזים יוצא דופן מאוד שמסיר את קבוצת המתיל מהגואנין ומעביר אותה לשארית ציסטאין באנזים. הוספת קבוצת המתיל לציסטאין הופכת את האנזים ללא תפקודי.
כידוע, רוב האנזימים הם זרזים שנשארים ללא שינוי במהלך התגובה, ומאפשרים למולקולת אנזים בודדת לזרז תגובה שוב ושוב. מכיוון שמתילטרנספראז O6-מתילגואנין אינו מתאים לתיאור זה, לעיתים הוא אינו נחשב כאנזים אמיתי. זה נקרא גם אנזים התאבדות, מכיוון שהאנזים "מת" כתוצאה מפעילותו שלו.
תיקון כריתה
תיקון כריתה הוא אסטרטגיה נפוצה נוספת. תיקון כריתה הוא מונח כללי לחיתוך וסינתזה מחדש של האזור הפגוע של DNA. ישנם מספר סוגים שונים של תיקון כריתה, אך כולם כרוכים בכריתת החלק של ה-DNA שניזוק, ואחריו סינתזת תיקון באמצעות הגדיל השני כתבנית, ולבסוף, קשירה כדי להחזיר את ההמשכיות לגדיל המתוקן. לתאים יש מספר סוגים שונים של תיקון כריתה, שכל אחד מהם מיועד לסוגים ספציפיים של נזק ל-DNA. ביניהם, מערכות תיקון אלה עוסקות במגוון רחב של עלבונות לגנום.
תיקון כריתת נוקלאוטידים
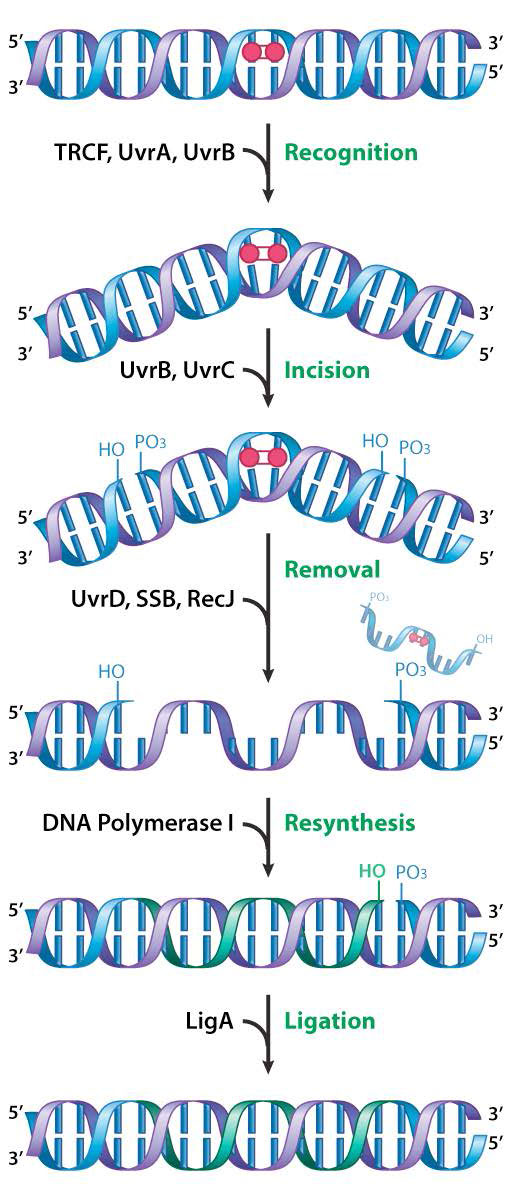
תיקון כריתת נוקלאוטידים (NER) מתקן נזקים כגון היווצרות תוספים כימיים, כמו גם נזקי UV. הן תוספות כימיות והן היווצרות CPDs או 6,4 תוצרי צילום עלולים לגרום לעיוות משמעותי של סליל ה- DNA. חלבוני NER פועלים לחיתוך הגדיל הפגוע משני צידי הנגע. לאחר מכן מוסר חלק קצר מגדיל ה- DNA המכיל את הנזק ופולימראז DNA ממלא את הפער בנוקלאוטידים המתאימים. תיקון כריתת נוקלאוטידים נחקר בהרחבה בחיידקים.
ב- E. coli, זיהוי וכריתת הנזק מתבצעת על ידי קבוצת חלבונים המקודדים על ידי הגנים UvRabc ו- UvrD. מוצרי החלבון של הגנים UvrA, UvrB ו- UvrC מתפקדים יחד בתור מה שמכונה אקסינוקלאז UvRabc. הנזק מזוהה בתחילה ונקשר על ידי קומפלקס של חלבוני UvrA ו- UvRb. ברגע שהקומפלקס נקשר, ה-UvrA מתנתק, ומשאיר את ה-uVrB מחובר ל-DNA, שם הוא מצטרף לאחר מכן לחלבון UvrC.
חיתוך סטרנד
זהו המתחם המורכב מ-UvrB ו-C שפועל לחיתוך עמוד השדרה הפוספודיסטר משני צידי הנזק, ויוצר חתכים בגדיל במרחק של כ-12-13 נוקלאוטידים זה מזה. הליקאז המקודד על ידי UvrD ואז משחרר את האזור המכיל את הנזק, ומעקר אותו מהסליל הכפול יחד עם UvRBC. הפער ב-DNA מתמלא על ידי DNA פולימראז, המעתיק את הגדיל הלא פגום, והניק אטום בעזרת ליגאז DNA.
תיקון כריתת נוקלאוטידים הוא גם מסלול חשוב באיקריוטים. זה חשוב במיוחד בהסרת נזקי UV בבני אדם, בהתחשב בכך שחסרים לנו פוטוליאזות. זוהו מספר חלבונים המתפקדים בדרכים דומות לחלבוני Uvr.
חשיבותם של חלבונים אלה ניכרת מהעובדה שמוטציות בגנים המקודדים אותם יכולות להוביל למספר מחלות גנטיות, כמו Xeroderma pigmentosum, או XP. אנשים עם XP רגישים ביותר לחשיפה לקרינת UV, מכיוון שלא ניתן לתקן את הנזק שנגרם כתוצאה מכך, מה שמותיר אותם בסיכון גבוה בהרבה לפתח סרטן עור.
שני מצבי תיקון
תיקון כריתת נוקלאוטידים פועל בשני מצבים, האחד המכונה תיקון גנומי עולמי והשני כתיקון צמוד לתעתיק. בעוד שתפקידם של שניהם הוא להסיר נזקים מעוררי יציבות סליל כמו דימרים של ציקלובוטאן פירמידין או תוספים כימיים, האופן שבו נגעים מזוהים שונה.
בתיקון גנומי עולמי, הנזק מזוהה על ידי מעקב אחר הגנום כולו אחר נגעים מעוותים של סליל. במקרה של תיקון צמוד שעתוק, עצירת פולימראז ה- RNA באתר של נזק ל- DNA היא האינדיקטור שמפעיל מצב זה של תיקון כריתת נוקלאוטידים.
תיקון כריתת בסיס
תיקון כריתת בסיס (BER) הוא מנגנון תיקון העוסק במצבים כמו דימינציה של ציטוסין לאורציל (איור 7.43) או מתילציה של בסיס פורין. שינויים אלה אינם מעוותים בדרך כלל את מבנה סליל ה- DNA, בניגוד לתוספות כימיות או נזקי UV.
בתיקון כריתת בסיס בסיס פגום אחד מוסר תחילה מה- DNA, ואחריו הסרת אזור של ה- DNA המקיף את הבסיס החסר. לאחר מכן תוקן הפער.
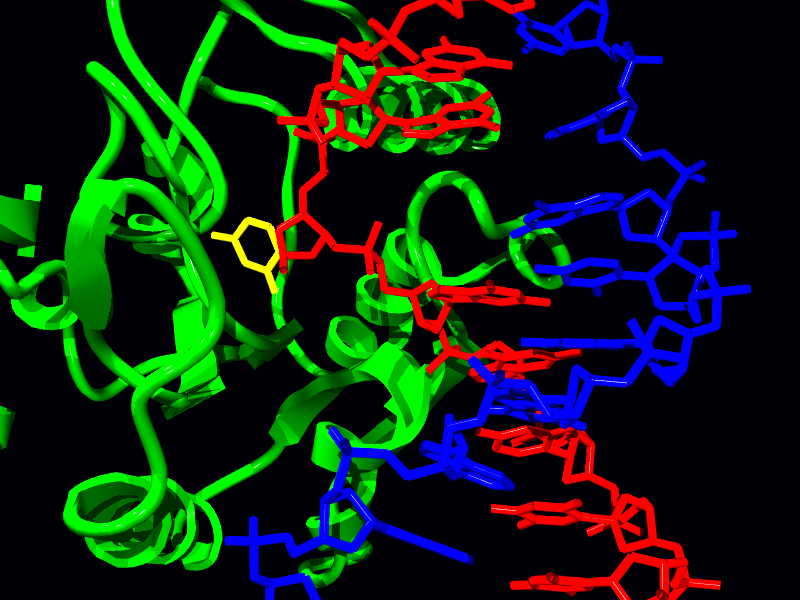
גליקוזילאז אורציל-DNA
הסרת האורציל מה-DNA מתבצעת על ידי האנזים Uracil-DNA glycosylase שיכול לזהות אורציל ב-DNA ולשבור את הקשר הגליקוזידי בין האורציל לסוכר בנוקלאוטיד (איור 7.44). הסרת הבסיס מותירה פער הנקרא אתר אפירימידיני (אתר AP) מכיוון שבמקרה זה הוסר אורציל, פירימידין. חשוב לזכור שבשלב זה עמוד השדרה של ה-DNA עדיין שלם, והסרת בסיס בודד פשוט יוצרת פער כמו שן שנדפקה.
היווצרות אתר AP מפעילה את פעילותו של אנזים המכונה אנדונוקלאז AP החותך את עמוד השדרה של ה-DNA 5' לאתר AP. בשלבים הנותרים, פולימראז DNA נקשר לניק, ולאחר מכן באמצעות פעילויות האקסונוקלאז והפולימראז שלו, מחליף את הרצף באזור זה. בהתאם למצב, ניתן להחליף נוקלאוטיד בודד (תיקון קצר BER) או להסיר ולהחליף קטע של מספר נוקלאוטידים (תיקון ארוך BER). לבסוף, כמו תמיד, ליגאז DNA פועל לאטום את הניק ב-DNA.
תיקון הפסקות גדילים כפולים
בעוד שכל מנגנוני התיקון דנו עד כה נזק קבוע בגדיל אחד של DNA באמצעות הגדיל השני, הלא פגום כתבנית, מנגנונים אלה אינם יכולים לתקן נזק לשני הגדילים. מה קורה אם שני הגדילים נפגעים? קרינה מייננת, חשיפה לכימיקלים מסוימים או מיני חמצן תגובתיים הנוצרים בתא עלולים להוביל להפסקות כפולות (DSBs) ב- DNA.
DSBs הם צורה שעלולה להיות קטלנית של נזק שבנוסף לחסימת שכפול ותעתיק, יכול להוביל גם לטרנסלוקציות כרומוזומליות, שבהן חלק מכרומוזום אחד מתחבר לחתיכה של כרומוזום אחר. קיימים שני מנגנונים סלולריים שונים המסייעים בתיקון DSBs (איור 7.45), רקומבינציה הומולוגית (HR) והצטרפות קצה לא הומולוגית (NHEJ).
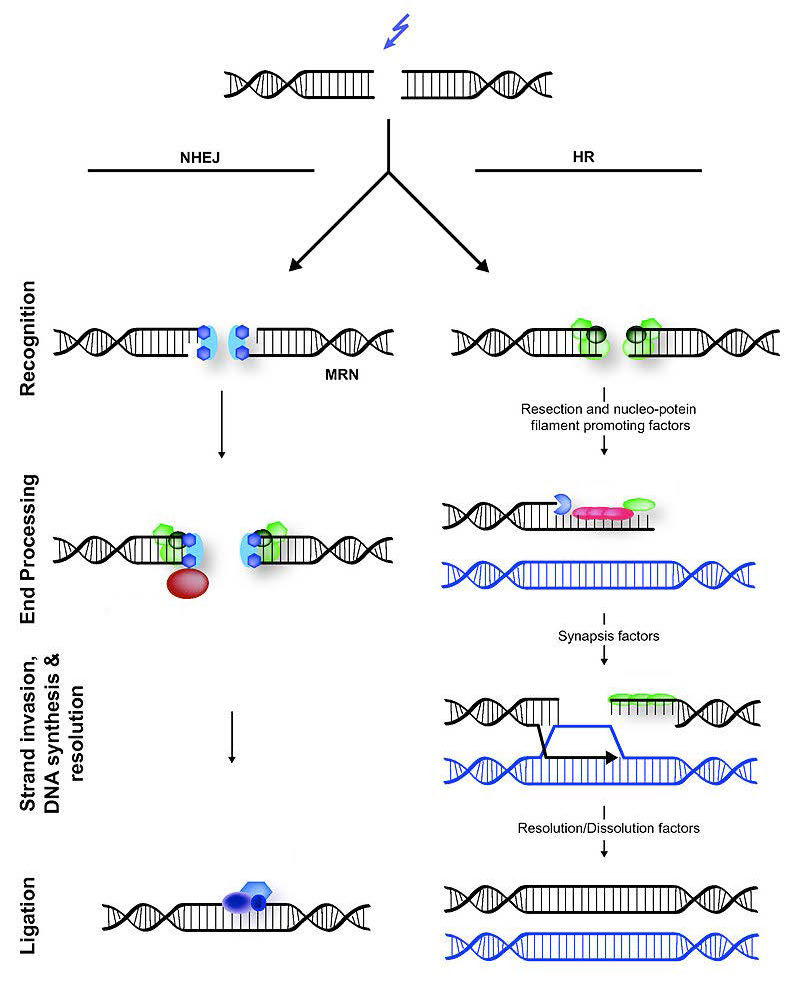
איור 7.45 - הצטרפות קצה לא הומולוגית (משמאל) לעומת רקומבינציה הומולוגית (מימין) - ויקיפדיה
תיקון רקומבינציה הומולוגי מתרחש בדרך כלל בשלבי S ו-G2 המאוחרים של התא, כאשר כל כרומוזום שוכפל ומידע מכרומטיד אחות יכול לשמש כתבנית להשגת תיקון ללא שגיאות. שים לב שבניגוד לתיקון כריתה, שבו הוסר הגדיל הפגוע וגדיל האחות הבלתי פגום שימש כתבנית למילוי האזור הפגוע, HR חייב להשתמש במידע ממולקולת DNA אחרת, מכיוון ששני גדילי ה-DNA ניזוקים ב-DSBs.
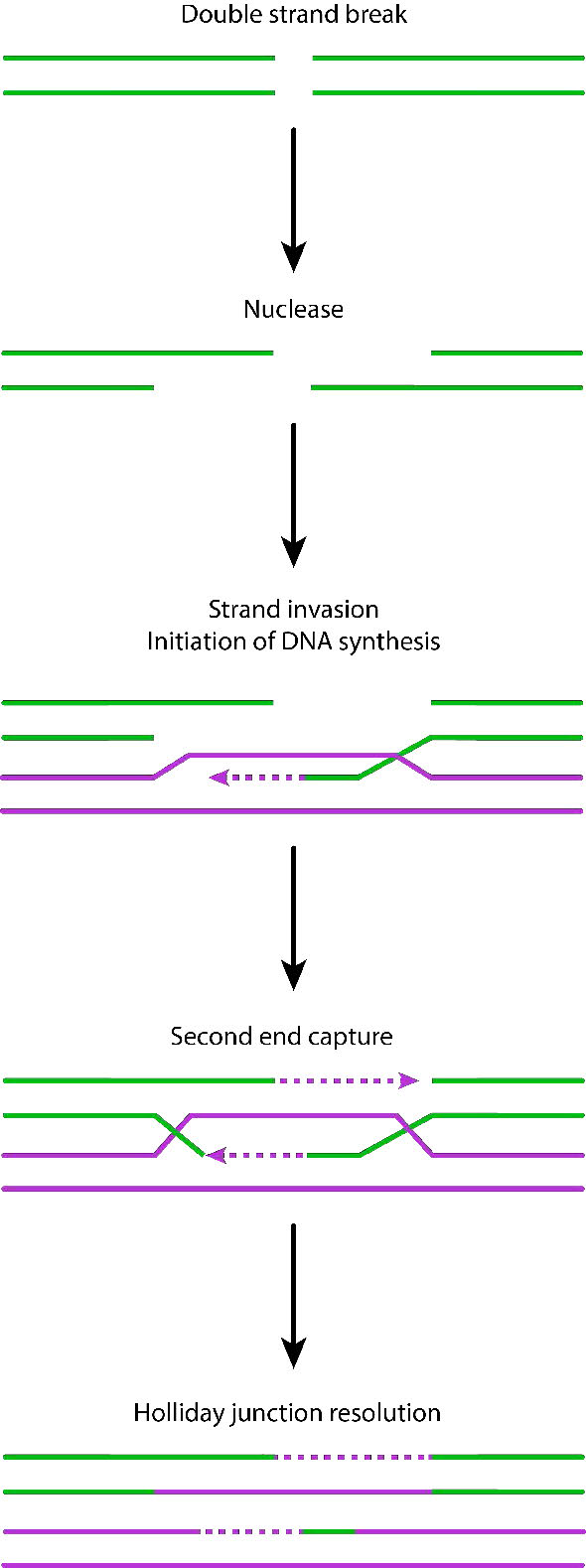
פעולת נוקלאז
זיהוי שבירת הגדילים הכפולים מעורר פעילות נוקלאז הלועסת גדיל אחד בכל קצה ההפסקה. התוצאה היא ייצור של תליית 3' חד-גדילית בכל קצה. קצוות חד-גדילים אלה קשורים במספר חלבונים, ויוצרים נימה נוקלאופרוטאין שיכולה "לחפש" רצפים הומולוגיים (תואמים) על כרומטיד אחות.
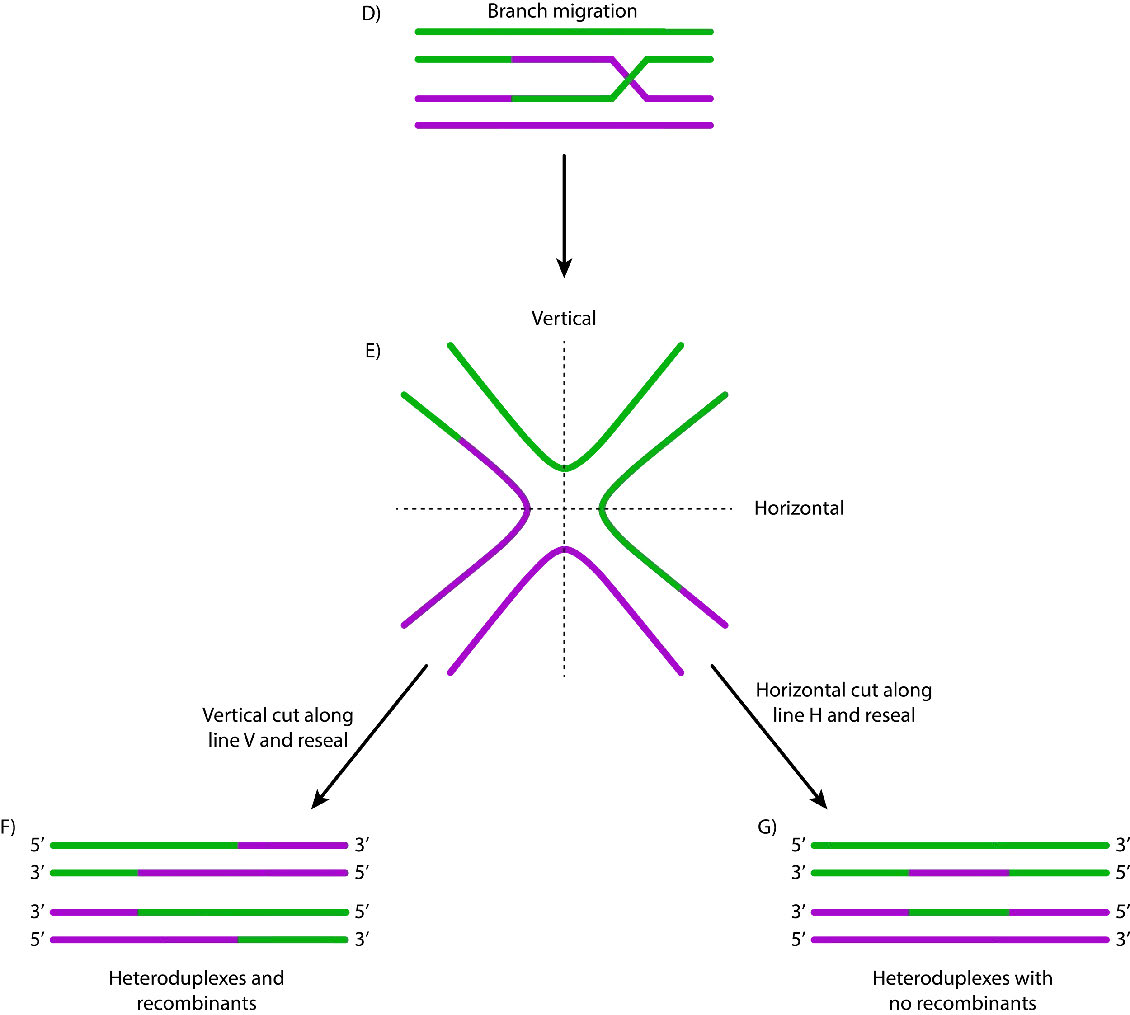
כאשר נמצאים רצפים כאלה, חוט הנוקלאופרוטאין פולש לכרומטיד האחות הבלתי פגום ויוצר הצלבה. זה יוצר הטרודופלקסים המורכבים מגדילי DNA מכרומטידים שונים. פלישת סטרנד (איור 7.47) מלווה נדידת ענפים, שבמהלכה צומת הולידיי נע לאורך ה-DNA, ומרחיב את ההטרודופלקס הרחק מהאתר המקורי של ההצלבה (איור 7.48). ב אי - קולי, נדידת הענפים תלויה בפעילותם של שני חלבונים, RuVa ו- RuvB. ניתן לפתור את ביניים הרקומבינציה המתקבל, בעזרת RuvC כדי לתת גדילים שלמים ונטולי שגיאות.
הצטרפות קצה לא הומולוגית
בניגוד לרקומבינציה הומולוגית, חיבור קצה לא הומולוגי (NHEJ) נוטה לשגיאות. הוא אינו משתמש או דורש תבנית הומולוגית להעתקה, ועובד פשוט על ידי לעיסה של הקצוות השבורים של DSBs וקשרתם יחד. באופן לא מפתיע, NHEJ מציגה מחיקות ב- DNA כתוצאה מכך.
סינתזת DNA של טרנסלציה
כפי שראינו, לתאים יש מגוון מנגנונים המסייעים בשמירה על שלמות המידע ב- DNA. מדד אחד למוצא אחרון הוא סינתזת DNA של טרנסלציה, הידועה גם בשם סינתזת מעקפים. סינתזת טרנסלציה מתרחשת כאשר פולימראז DNA נתקל בנזק ל- DNA בגדיל התבנית, אך במקום להתעכב או לדלג על פני הנזק, השכפול עובר למצב מועד לשגיאות, מתעלם מהתבנית ומשלב נוקלאוטידים אקראיים בגדיל החדש. ב- E.coli, סינתזת הטרנסלציה תלויה בפעילות של חלבונים המקודדים על ידי הגנים uMuC ו- UmuD. בתנאים המתאימים (ראה תגובת SOS להלן) uMuC ו- UmuD מופעלים כדי להתחיל בסינתזה עוקפת. בהיותה מועדת לשגיאות, סינתזת הטרנסלציה מולידה מוטציות רבות.
תגובת ה- SOS
המונח "תיקון SOS", הנקרא על שם אותות מצוקה סטנדרטיים של SOS, מתייחס לתגובה סלולרית לנזקי UV. כאשר תאים חיידקיים סובלים מנזק רב ל- DNA שלהם כתוצאה מחשיפה לקרינת UV, הם מפעילים את הביטוי המתואם של מספר רב של גנים הנחוצים לתיקון DNA. אלה כוללים את הגנים uvr הדרושים לתיקון כריתת נוקלאוטידים ו-RecA, המעורב ברקומבינציה הומולוגית. בנוסף למנגנונים אלה, שיכולים לבצע תיקון ללא שגיאות, תגובת SOS יכולה גם לגרום לביטוי של פולימראזות טרנסלסיה המקודדות על ידי הגנים DinA, DinB ו- uMuCD.
כיצד כל הגנים הללו נגרמים בצורה מתואמת בעקבות נזקי UV? כל הגנים המושרים בתגובת SOS מוסדרים על ידי שני מרכיבים. הראשון הוא נוכחות של רצף DNA קצר במעלה הזרם של אזור הקידוד שלהם, הנקרא תיבת SOS. השני הוא חלבון, מדכא LexA (איור 7.49), הנקשר לתיבת SOS ומונע שעתוק של הגנים במורד הזרם. ביטוי הגנים מחייב הסרה של LexA מאתר הקישור שלו. איך זה מושג?
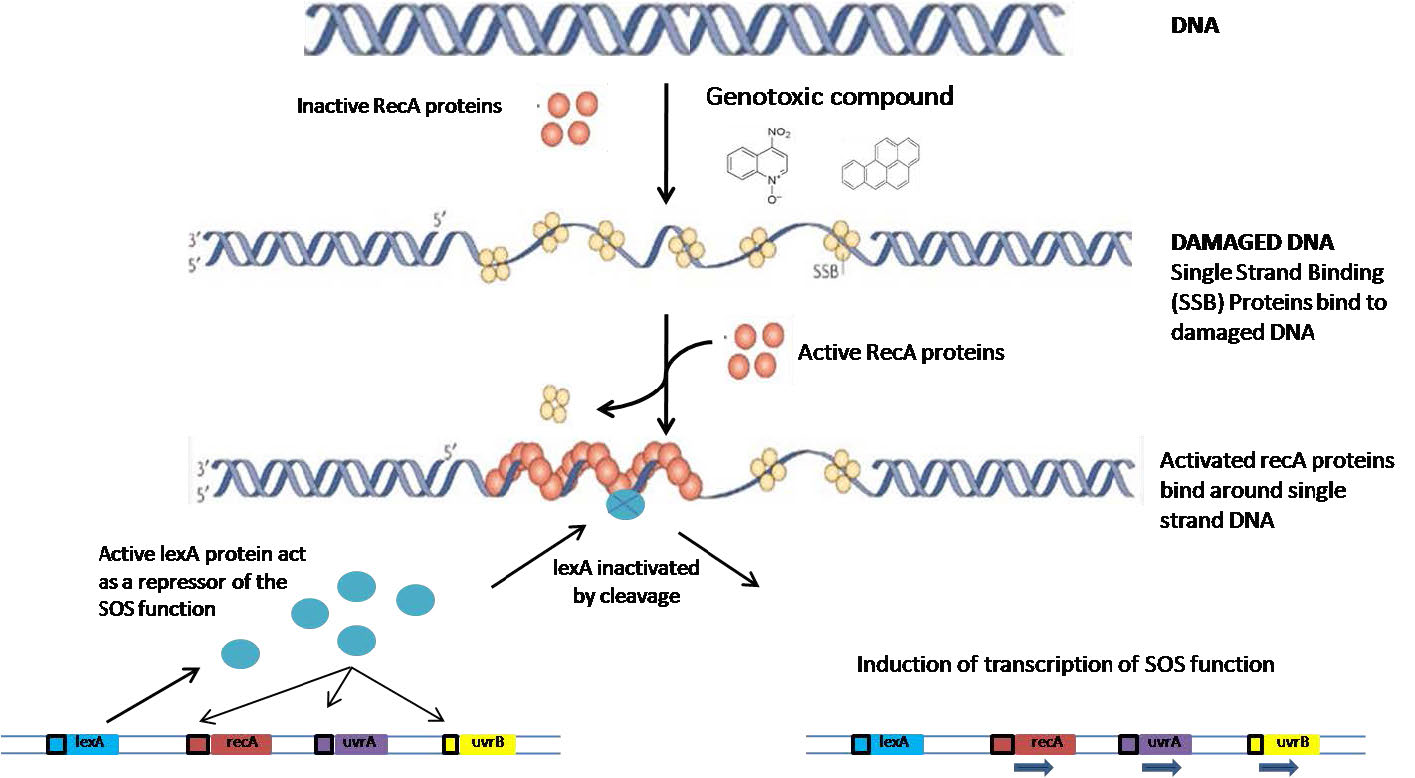
כאשר חשיפה לקרינה גורמת לשבירת DNA, נוכחותם של אזורים חד-גדילים מפעילה הפעלה וקשירה של חלבוני RecA לאזור החד-גדילי, ויוצרת נימה נוקלאופרוטאין. האינטראקציה של ה-RecA עם מדכא LexA מובילה ל-autocleavage של המדכא, ומאפשרת לבטא את הגנים במורד הזרם (איור 7.50).
הגנים הנשלטים על ידי מדכא LexA, כפי שהוזכר קודם לכן, מקודדים לחלבונים הדרושים לתיקון DNA מדויק וכן לסינתזת טרנסלציה מועדת לשגיאות. הגנים השונים המעורבים בתיקון DNA נגרמים בסדר מסוים. בשלבים הראשונים, גני התיקון שנדחקים מיועדים לתיקון כריתת נוקלאוטידים, ואחריו רקומבינציה הומולוגית, שניהם מנגנונים נטולי שגיאות לתיקון. אם הנזק נרחב מכדי לתקן אותו על ידי מערכות אלה, מנגנוני תיקון מועדים לשגיאות עשויים להיות מופעלים כמוצא אחרון.
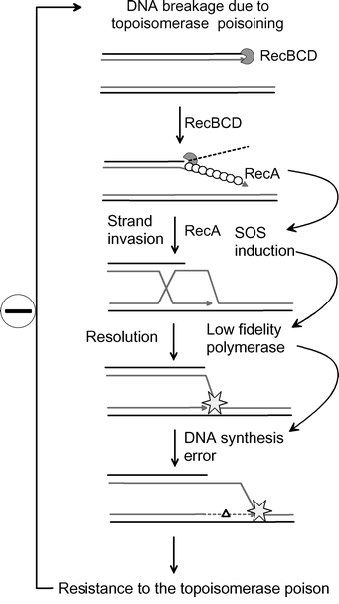
תגובת SOS ועמידות לאנטיביוטיקה
שיעור המוטציות המוגבר בתגובת SOS עשוי לשחק תפקיד ברכישת עמידות לאנטיביוטיקה בחיידקים (איור 7.51).
דוגמה לכך היא התפתחות עמידות לרעלים טופואיזומראז כמו משפחת התרופות הפלואורוקווינולון. פלואורוקווינולונים מעכבים את יכולתם של טופואיזומראזות לשנות מחדש את קצות המצעים שלהם לאחר שחותכים אותם כדי לאפשר ל- DNA המפותל להירגע. התוצאה היא הצטברות של שבירות גדילים שיכולות לעורר את תגובת SOS. כתוצאה מסינתזת DNA מועדת לשגיאות על ידי פולימראזות נאמנות נמוכה במהלך תגובת SOS, יש עלייה גדולה במספר המוטציות. בעוד שמוטציות מסוימות עשויות להיות קטלניות לחיידקים, אחרות יכולות לתרום להתפתחות מהירה של עמידות לתרופות באוכלוסייה.