5.2: הובלת אלקטרונים וזרחון חמצוני
- Page ID
- 207615
מקור: BiochemFFA_5_2.pdf. ספר הלימוד כולו זמין בחינם מהמחברים בכתובת http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy

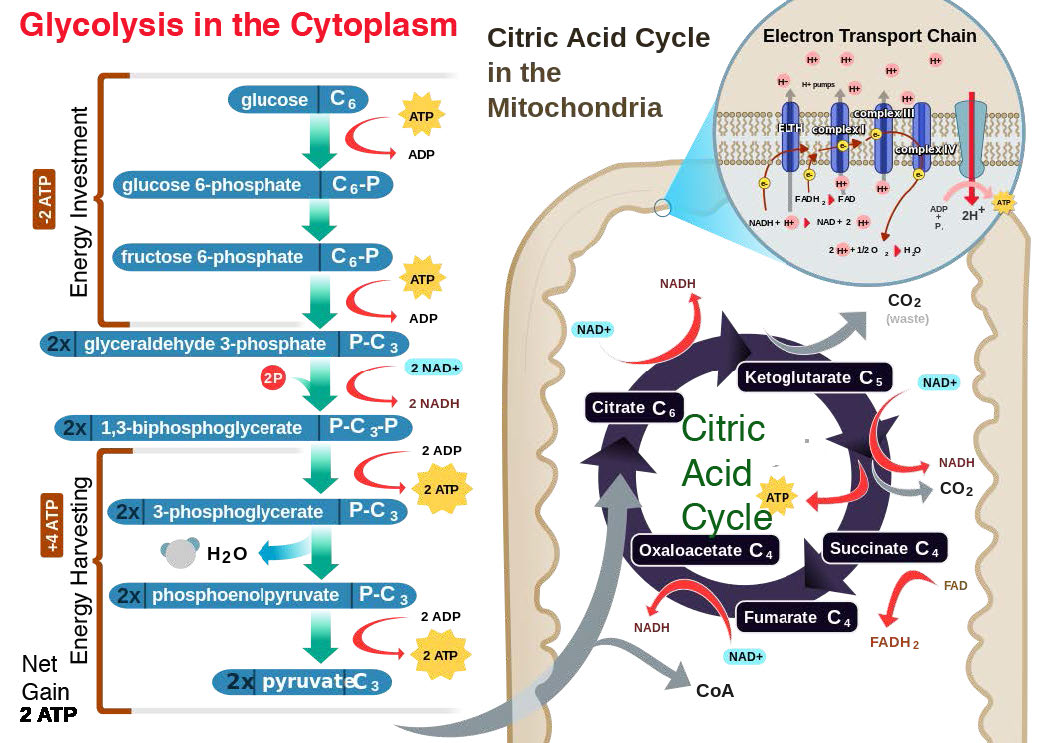
בתאים אוקריוטיים, הרוב המכריע של סינתזת ATP מתרחש במיטוכונדריה בתהליך הנקרא זרחון חמצוני. אפילו צמחים, המייצרים ATP על ידי פוטופוספורילציה בכלורופלסטים, מכילים מיטוכונדריה לסינתזה של ATP באמצעות זרחון חמצוני.
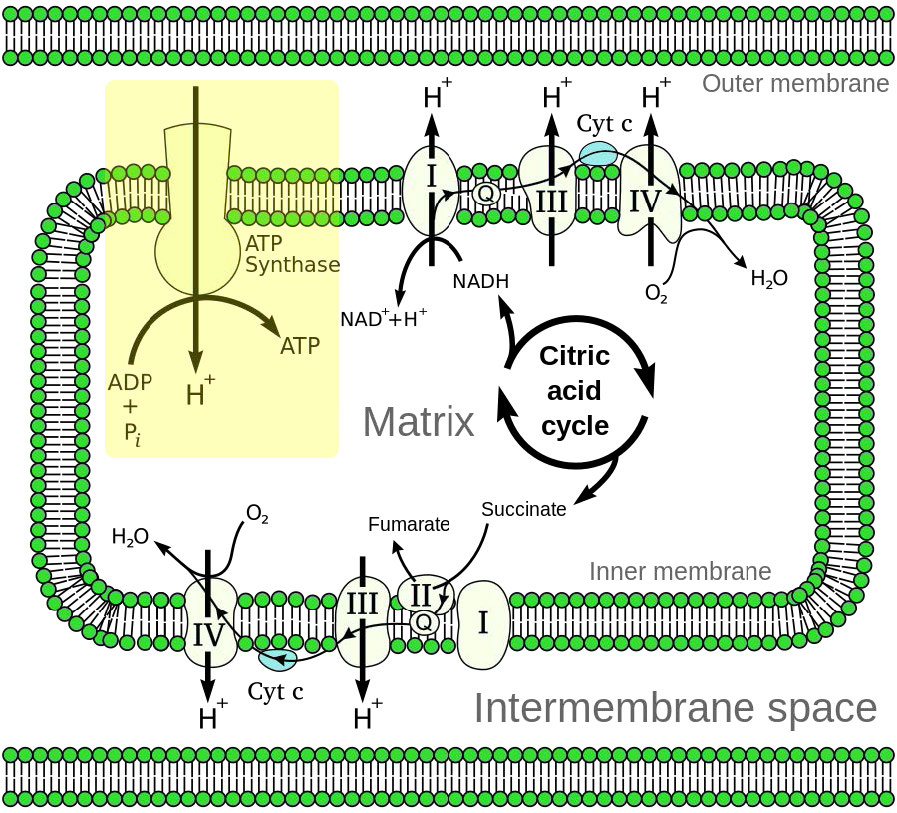
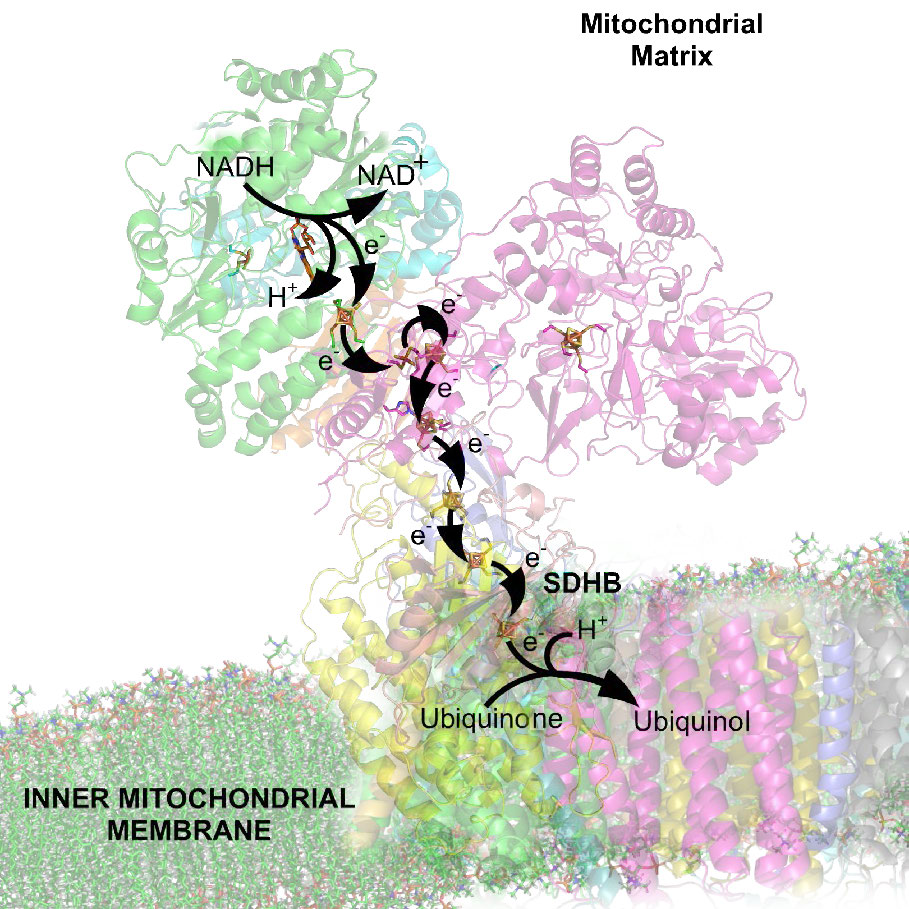
זרחון חמצוני מקושר לתהליך המכונה הובלת אלקטרונים (איור 5.14). מערכת הובלת האלקטרונים, הממוקמת בקרום המיטוכונדריאלי הפנימי, מעבירה אלקטרונים שנתרמו על ידי נשאי האלקטרונים המופחתים NADH ו- FADH2 (המתקבלים מגליקוליזה, מחזור חומצת לימון או חמצון חומצות שומן) דרך סדרה של מקבלי אלקטרונים, לחמצן. כפי שנראה, תנועת אלקטרונים דרך קומפלקסים של מערכת הובלת האלקטרונים בעצם "טוענת" סוללה המשמשת לייצור ATP בזרחן חמצוני. באופן זה, חמצון הסוכרים וחומצות השומן משולב לסינתזה של ATP, ומוציא ביעילות אנרגיה מהמזון.
מודל כימיוסמוטי
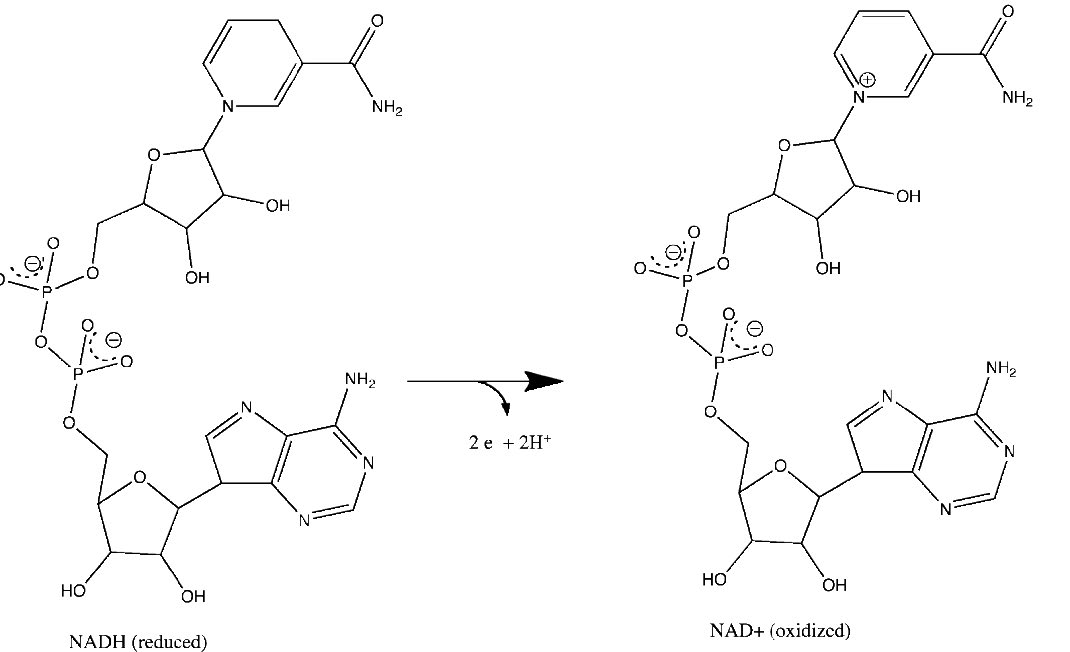
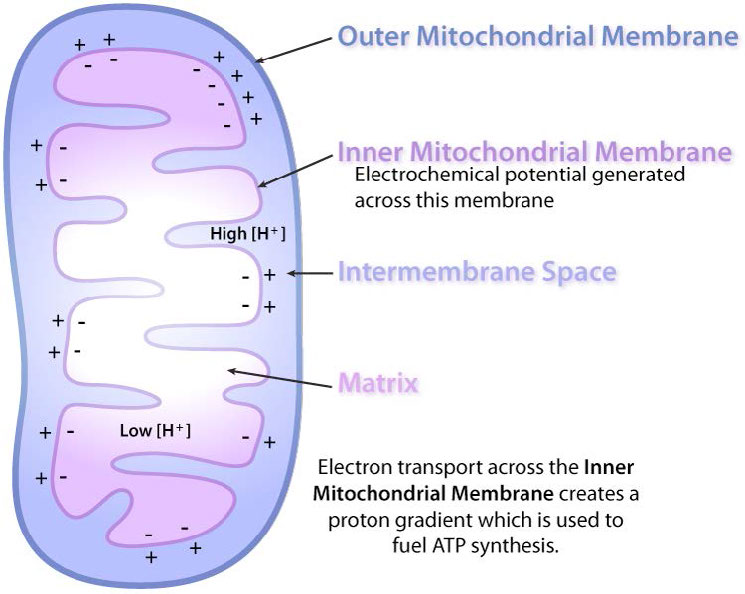
ד"ר פיטר מיטשל הציג הצעה רדיקלית בשנת 1961 להסביר את המנגנון שבאמצעותו המיטוכונדריה מייצרות ATP. היא ידועה בשם ההשערה הכימיוסמטית והוכחה לאורך השנים כנכונה. מיטשל הציע שסינתזה של ATP במיטוכונדריה תלויה בשיפוע אלקטרוכימי, על פני הממברנה הפנימית המיטוכונדריאלית, הנובע בסופו של דבר מהאנרגיה של נשאי אלקטרונים מופחתים, NADH ו- FADH2.
הובלת אלקטרונים
יתר על כן, ההצעה קובעת כי השיפוע נוצר כאשר NADH ו- FADH2 מעבירים את האלקטרונים שלהם למערכת הובלת אלקטרונים (ETS) הממוקמת בקרום המיטוכונדריאלי הפנימי. תנועת אלקטרונים דרך סדרה של נשאי אלקטרונים מחוברת לשאיבת פרוטונים מתוך המטריצה המיטוכונדריאלית על פני הממברנה המיטוכונדריאלית הפנימית לחלל שבין הממברנות הפנימיות והחיצוניות. התוצאה היא יצירת שיפוע של פרוטונים שניתן להשתמש באנרגיה הפוטנציאלית שלהם לייצור ATP. אלקטרונים משתלבים עם חמצן ופרוטונים בסוף ה- ETS ליצירת מים.
סינתאז ATP
בזרחן חמצוני, סינתזת ATP מתבצעת כתוצאה מחדירת פרוטונים מחדש למטריצה המיטוכונדריאלית באמצעות קומפלקס ATP סינתאז טרנסממברני, המשלב ADP עם פוספט אנאורגני לייצור ATP. מרכזי בתפקוד התקין של המיטוכונדריה בתהליך זה הוא נוכחות של קרום פנימי מיטוכונדריאלי שלם אטום לפרוטונים.
צימוד הדוק
כאשר זה המקרה, אומרים כי קיים צימוד הדוק בין הובלת אלקטרונים לסינתזה של ATP (הנקרא זרחון חמצוני). כימיקלים המחלחלים את הממברנה המיטוכונדריאלית הפנימית לפרוטונים גורמים לניתוק, כלומר הם מאפשרים לפרוטונים לדלוף חזרה למטריצה המיטוכונדריאלית, ולא דרך סינתאז ATP, כך שתנועת האלקטרונים דרך ה-ETS כבר לא קשורה לסינתזה של ATP.
תחנות כוח
מיטוכונדריה נקראות תחנות הכוח של התא מכיוון שרוב ה- ATP של התא מיוצר שם בתהליך של זרחון חמצוני. המנגנון שבאמצעותו מיוצר ATP בזרחן חמצוני הוא אחד המעניינים ביותר בכל הביולוגיה.
שיקולים
לתהליך שלושה שיקולים עיקריים. הראשון הוא חשמלי - אלקטרונים מנשאי אלקטרונים מופחתים, כגון NADH ו- FADH2, נכנסים למערכת הובלת האלקטרונים דרך קומפלקס I ו- II, בהתאמה. כפי שניתן לראות באיור 5.16 ובאיור 5.17, אלקטרונים עוברים ממכלול אחד למשנהו, שלא כמו הדרך בה הם נעים במעגל חשמלי. תנועה כזו מתרחשת כתוצאה ממערכת של תגובות הפחתה-חמצון (חיזור) עם אלקטרונים הנעים מפוטנציאל הפחתה שלילי יותר לחיובי יותר.
אפשר לחשוב על זה כעל תהליך שבו נשאים "לוקחים" אלקטרונים ממכלולים עם פוטנציאל הפחתה נמוך יותר, כמו שבריון לוקח כסף לארוחת צהריים מילד קטן יותר. בתכנית זו, "הבריון" הגדול ביותר הוא חמצן במתחם IV. אלקטרונים שנצברו על ידי נשא גורמים להפחתתו, ואילו המוביל המוותר על האלקטרונים מתחמצן.
כניסת אלקטרונים למערכת
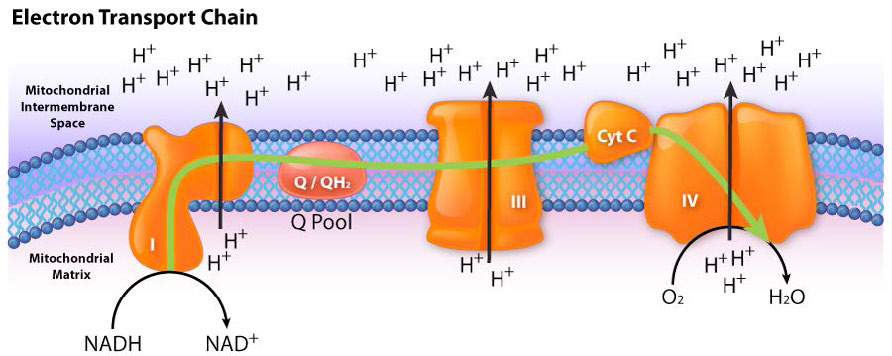
תנועת אלקטרונים דרך השרשרת מתחילה ב-1) העברה מ-NADH למתחם I (איור 5.16) או 2) תנועה של אלקטרונים דרך FADH2 קשור קוולנטית2 (איור 5.17) ב-succinate dehydrogenase הקשור לממברנה (קומפלקס II). (נקודת כניסה חלופית לאלקטרונים מ-FADH2 היא ה-Flavoprotein המעביר אלקטרונים דרך האלקטרונים-העברה-פלבופרוטאין דהידרוגנאז, לא מוצג).
שוטר תנועה
גם קומפלקס I וגם II מעבירים אלקטרונים לקואנזים Q של הממברנה הפנימית (CoQ - איורים 5.18 & 5.19). בכל מקרה, קואנזים Q מקבל אלקטרונים בזוגות ומעביר אותם למתחם III (CoQH2-ציטוכרום c רדוקטאז) בנפרד. קואנזים Q פועל אפוא כשוטר תנועה, המסדיר את זרימת האלקטרונים דרך ה- ETS.
תחנת עגינה
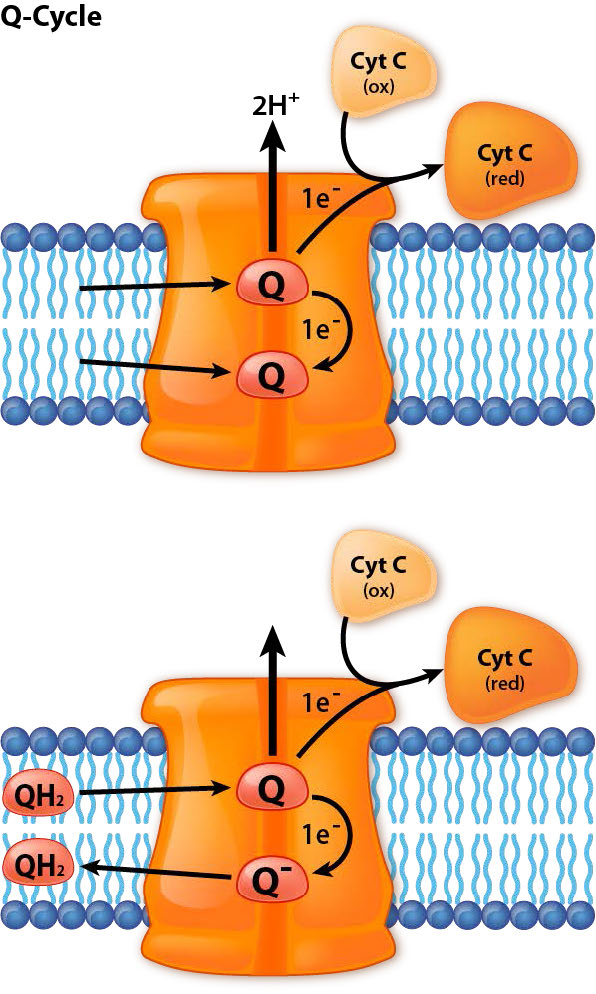
מתחם III הוא תחנת עגינה או מחלף עבור נושא האלקטרונים הנכנס (קואנזים Q) והנשא היוצא (ציטוכרום ג). תנועה של אלקטרונים מקואנזים Q למתחם III ולאחר מכן לציטוכרום C מתרחשת כתוצאה ממה שמכונה מחזור Q (ראה להלן).
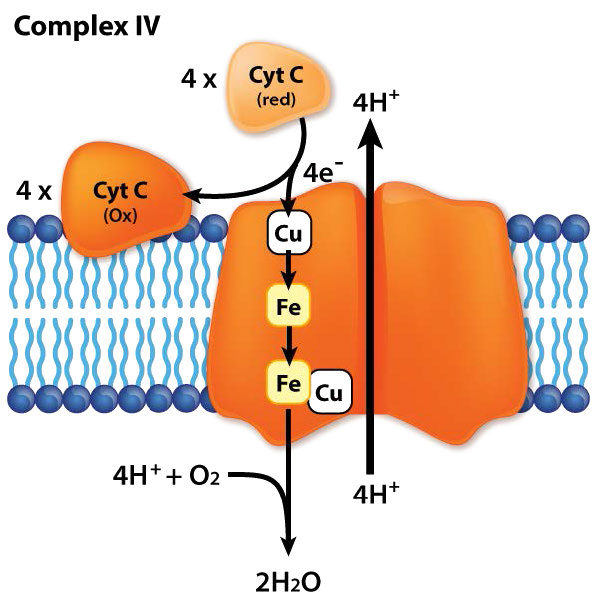
קומפלקס III פועל להעברת אלקטרונים מ-CoQ לציטוכרום ג ציטוכרום c לוקח אלקטרון אחד ממתחם III ומעביר אותו למתחם IV (ציטוכרום אוקסידאז). קומפלקס IV הוא מקבל החלבון הסופי של האלקטרונים. זה מעביר אותם לחמצן מולקולרי (O2) כדי ליצור שתי מולקולות מים. יצירת שתי מולקולות מים דורשת ארבעה אלקטרונים, ולכן מתחם IV חייב לקבל, לטפל ולהעביר לחמצן מולקולרי ארבעה אלקטרונים נפרדים, מה שגורם למצב החמצון של החמצן להשתנות ברצף עם תוספת של כל אלקטרון.
שאיבת פרוטון
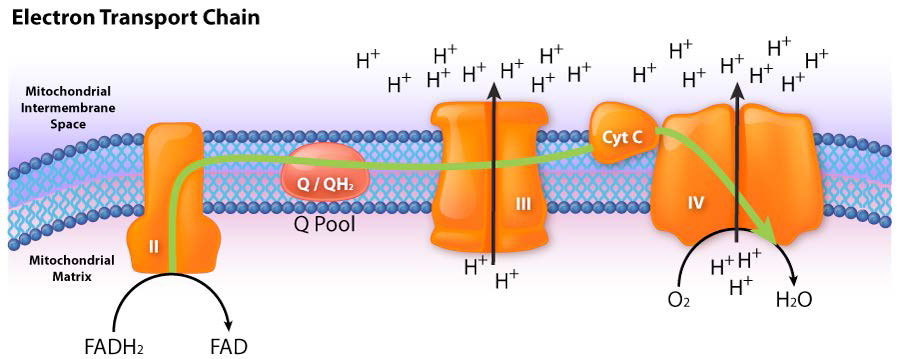
כאשר אלקטרונים עוברים דרך קומפלקסים I, III ו- IV, יש שחרור של כמות קטנה של אנרגיה בכל שלב, המשמשת לשאיבת פרוטונים מהמטריצה המיטוכונדריאלית (בתוך המיטוכונדריון) ולהפקידם בחלל הבין-ממברני (בין הממברנות הפנימיות והחיצוניות של המיטוכונדריון). ההשפעה של חלוקה מחדש זו היא הגדלת הפוטנציאל החשמלי והכימי על פני הממברנה.
אנרגיה פוטנציאלית
כפי שנדון קודם לכן, לשיפועים אלקטרוכימיים יש אנרגיה פוטנציאלית. התלמידים עשויים לחשוב על התהליך כ"טעינת הסוללה". בדיוק כמו סוללה טעונה, ניתן להשתמש בפוטנציאל הנובע מהפרש הפרוטונים על פני הממברנה כדי לעשות דברים. במיטוכונדריון, מה שעושה שיפוע הפרוטונים הוא להקל על ייצור ATP מ-ADP ו-Pi. תהליך זה ידוע בשם זרחון חמצוני, מכיוון שהזרחון של ADP ל- ATP תלוי בתגובות החמצוניות המתרחשות במיטוכונדריה.
לאחר שהבנו את התמונה הכוללת של הסינתזה של ATP המקושרת לתנועת האלקטרונים דרך ה- ETS, נבחן מקרוב את המרכיבים הבודדים של ה- ETS.
קומפלקס I
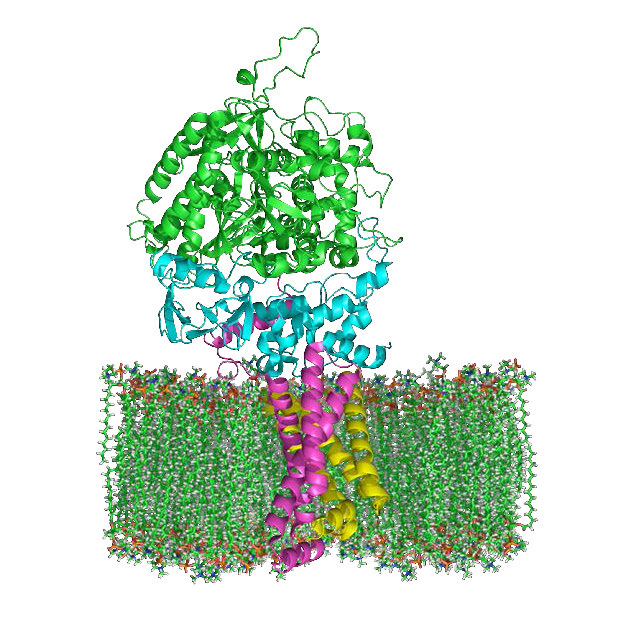
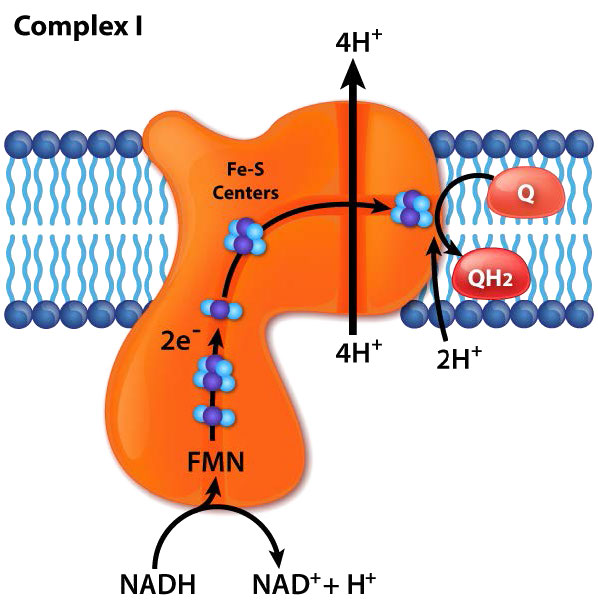
קומפלקס I (נקרא גם NADH: Ubiquinone oxidoreductase או NADH dehydrogenase (ubiquinone)) הוא מקבל האלקטרונים מ-NADH בשרשרת הובלת האלקטרונים והמתחם הגדול ביותר שנמצא בו.
קומפלקס I מכיל 44 שרשראות פוליפפטיד בודדות, מרכזי ברזל-גופרית רבים, מולקולה של פלבין מונונוקלאוטיד (FMN) ובעל צורת L עם כ-60 תחומים טרנסממברניים. בתהליך הובלת האלקטרונים דרכו, ארבעה פרוטונים נשאבים על פני הממברנה הפנימית לחלל הבין-ממברני ואלקטרונים עוברים מ- NADH לקואנזים Q, וממירים אותו מאוביקווינון (ללא אלקטרונים) לאוביקווינול (רווח של שני אלקטרונים). צורת ביניים, ubisemiquinone (רווח של אלקטרון אחד), נמצאת במחזור Q.
אלקטרונים עוברים במתחם דרך שבעה מרכזי גופרית ברזל ראשוניים. המעכב הידוע ביותר של המתחם, רוטנון, פועל על ידי קשירה לאתר הקישור CoQ. מעכבים אחרים כוללים ADP-ribose (נקשר לאתר NADH) ופירצידין A (אנלוגי רוטנון). תהליך העברת האלקטרונים דרך קומפלקס I הוא הפיך וכאשר זה קורה, סופראוקסיד (מין חמצן תגובתי) עשוי להיווצר בקלות.
קומפלקס II
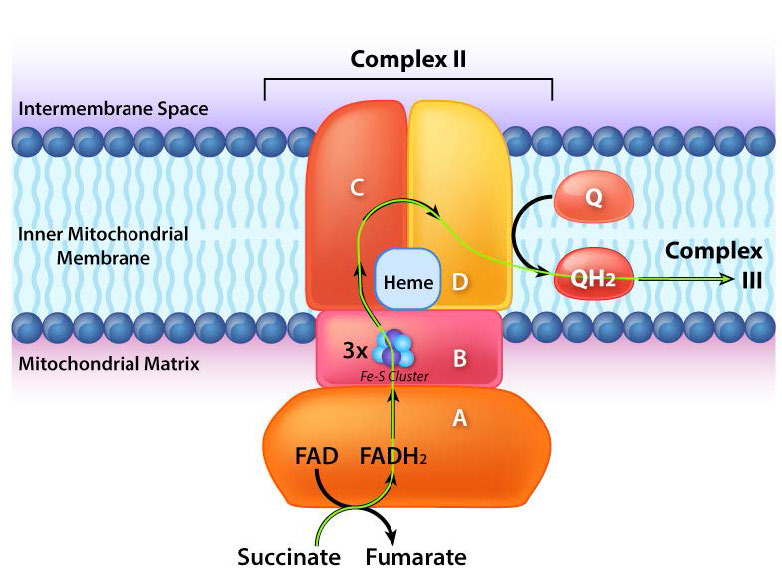
קומפלקס II (נקרא גם succinate dehydrogenase או succinate-coenzyme Q reductase) הוא אנזים הקשור לממברנה של מחזור חומצת הלימון הממלא תפקיד בתהליך הובלת האלקטרונים, ומעביר אלקטרונים מה- FADH2 הקשור לקו-אנזים Q התהליך מתרחש, כפי שמוצג באיור 5.20 ובאיור 5.21, עם העברת אלקטרונים מסוקסינאט ל- FAD ליצירת FADH2 ופומראט. FADH2, בתורו, תורם אלקטרונים למערכת ממסר של קבוצות ברזל-גופרית והם בסופו של דבר מפחיתים את האוביקינון (CoQ) יחד עם שני פרוטונים מהמטריצה לאוביקווינול. תפקידה של קבוצת ההם בתהליך אינו ברור. מעכבי התהליך כוללים קרבוקסין, מלונאט, מאלאט ואוקסלואצטט. תפקידם של תוצרי ביניים במחזור חומצת לימון כמעכבים נחשב כתוצאה מעיכוב היפוך תהליך ההעברה שיכול לייצר סופראוקסיד.
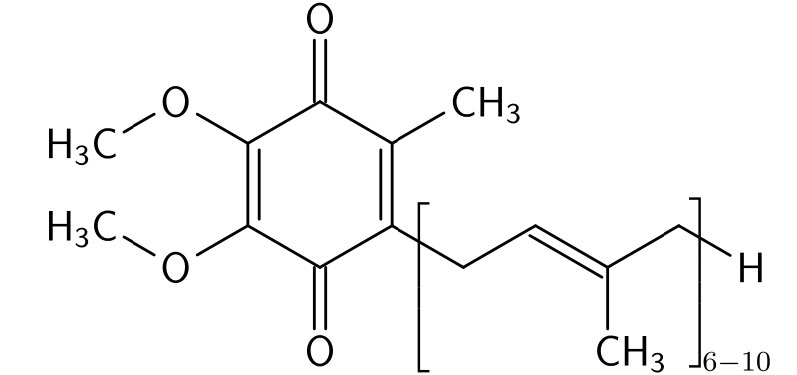
קואנזים Q
קואנזים Q (איור 5.23) הוא 1,4 בנזוקינון ששמו ניתן לעתים קרובות כקואנזים Q10, CoQ או Q10. ה- 10 בשם מתייחס למספר יחידות האיזופרניל שהוא מכיל המעגנות אותו לקרום הפנימי המיטוכונדריאלי. CoQ הוא חומר שומני דמוי ויטמין המצוי ברוב התאים האוקריוטיים כמרכיב במערכת הובלת האלקטרונים. הדרישה ל- CoQ עולה עם צרכי האנרגיה הגוברים של התאים, ולכן הריכוזים הגבוהים ביותר של CoQ בגוף נמצאים ברקמות הפעילות ביותר מבחינה מטבולית - לב, כבד וכליות.
שלוש צורות
CoQ שימושי בגלל יכולתו לשאת ולתרום אלקטרונים ובמיוחד משום שהוא יכול להתקיים בצורות עם שני אלקטרונים נוספים (מופחת לחלוטין - יוביקווינול), אלקטרון נוסף אחד (מופחת למחצה - ubisemiquinone), או ללא אלקטרונים נוספים (מחומצן לחלוטין - ubiquinone). יכולת זו מאפשרת ל- CoQ לספק מעבר בין החלק הראשון של מערכת הובלת האלקטרונים המניע אלקטרונים בזוגות לבין החלק האחרון של המערכת המניע אלקטרונים בזה אחר זה.
מתחם III
קומפלקס III (הידוע גם בשם קואנזים Q: ציטוכרום c — אוקסידורדוקטאז או קומפלקס ציטוכרום bc1 - איור 5.24) הוא הקומפלקס השלישי המקבל אלקטרונים של מערכת הובלת האלקטרונים. זהו חלבון טרנסממברני עם יחידות משנה מרובות הקיימות במיטוכונדריה של כל האורגניזמים האוקריוטיים האירוביים וקרום התא של כמעט כל החיידקים. המתחם מכיל 11 יחידות משנה, פרדוקסין דו-ברזל, ציטוכרומים b ו- c1 ושייך למשפחת אנזימי האוקסידורדוקטאז.
הוא מקבל אלקטרונים מקואנזים Q בהובלת אלקטרונים ומעביר אותם לציטוכרום ג במחזור זה, המכונה מחזור Q, אלקטרונים מגיעים מ- CoQ בזוגות, אך מועברים לציטוכרום c בנפרד. בתהליך הכולל נצרכים שני פרוטונים מהמטריצה וארבעה פרוטונים נשאבים לחלל הבין-ממברני. תנועת אלקטרונים דרך המתחם יכולה להיות מעוכבת על ידי אנטימיצין A, מיקסותיאזול וסטיגמטלין. מתחם III מעורב גם ביצירת סופראוקסיד (מין חמצן תגובתי) כאשר אלקטרונים ממנו דולפים משרשרת ההעברה. התופעה בולטת יותר כאשר אנטימיצין A קיים.
מחזור Q
במחזור Q, אלקטרונים מועברים מאוביקווינול (QH2) לציטוכרום c באמצעות קומפלקס III כתחנת עגינה מתווכת להעברה. שני זוגות אלקטרונים נכנסים מ-QH2 וזוג אחד מוחזר ל-CoQ אחר כדי ליצור מחדש את QH2. הזוג השני נתרם בנפרד לשתי מולקולות ציטוכרום c שונות.
שלב ראשון
מחזור ה- Q מתרחש בתהליך של שני שלבים. ראשית, מזח יוביקווינול (CoQH2) ואוביקינון (CoQ) במתחם III. יוביקווינול מעביר שני אלקטרונים למתחם III. אלקטרון אחד עובר לציטוכרום c מעוגן, מפחית אותו והוא יוצא (מוחלף בציטוכרום c מחומצן). השני הולך ליוניקינון המעוגן כדי ליצור את הסמיוביקינון המופחת למחצה (CoQ.-) ומשאיר אחריו יוביקינון, שיוצא. זהו סופו של שלב 1.
שלב שני
הפער שהותיר אחריו האוביקווינון (Q) שיצא מוחלף על ידי יוביקווינול אחר (QH2). גם הוא תורם שני אלקטרונים למתחם III, המפצל אותם. אחד הולך לציטוכרום c המחומצן החדש שעוגן, שמצטמצם ויוצא. השני הולך לאוביסמיקינון. שני פרוטונים מהמטריצה משתלבים איתו ליצירת יוביקווינול נוסף. זה והאוביקווינון שנוצר על ידי יציאת תרומת האלקטרונים ממתחם III והתהליך מתחיל שוב. בתהליך הכולל נצרכים שני פרוטונים מהמטריצה וארבעה פרוטונים נשאבים לחלל הבין-ממברני.
ציטוכרום ג
ציטוכרום ג (איור 5.26) הוא חלבון קטן (12,000 דלטון), שמור מאוד, ממינים חד-תאיים ועד לבעלי חיים, הקשור באופן רופף לקרום המיטוכונדריאלי הפנימי שבו הוא מתפקד בהובלת אלקטרונים. הוא מכיל קבוצת heme המשמשת לשאת אלקטרון בודד ממתחם III למתחם IV. ציטוכרום c ממלא גם תפקיד חשוב באפופטוזיס באורגניזמים גבוהים יותר. פגיעה במיטוכונדריון שגורמת לשחרור ציטוכרום c יכולה לעורר הרכבה של האפופטוזום והפעלה של מפל הקספאז המוביל למוות תאי מתוכנת.
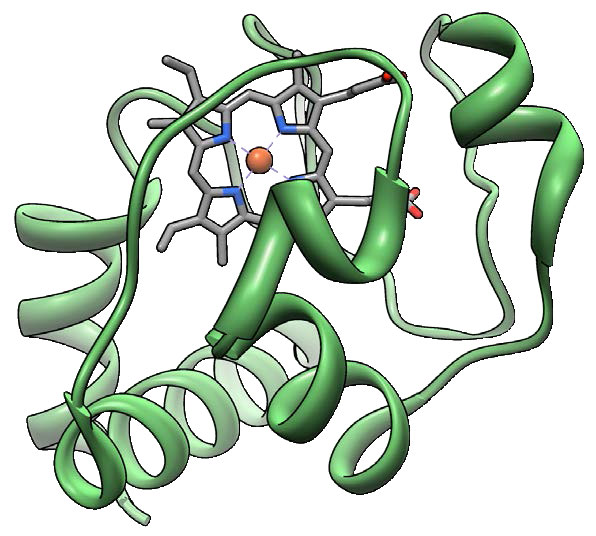
קומפלקס IV
קומפלקס IV, הידוע גם בשם ציטוכרום c אוקסידאז הוא חלבון ממברנה אינטגרלי בן 14 יחידות בקצה שרשרת הובלת האלקטרונים (איור 5.27). הוא אחראי על קבלת אלקטרון אחד כל אחד מארבעה חלבוני ציטוכרום c והוספתם לחמצן מולקולרי (O2) יחד עם ארבעה פרוטונים מהמטריצה המיטוכונדריאלית ליצירת שתי מולקולות מים. ארבעה פרוטונים מהמטריצה נשאבים גם הם לחלל הבין-ממברני בתהליך. לקומפלקס שתי מולקולות של heme, שני ציטוכרומים (a ו- a3) ושני מרכזי נחושת (הנקראים CuA ad CuB). ציטוכרום c עוגן ליד ה- CuA ותורם לו אלקטרון. ה-CuA המופחת מעביר את האלקטרון לציטוכרום a, מה שהופך אותו למרכז A3-CuB שבו החמצן מצטמצם. ארבעת האלקטרונים נחשבים לעבור דרך המתחם במהירות וכתוצאה מכך הפחתה מלאה של מולקולת החמצן ללא היווצרות של ביניים חמצן או סופראוקסיד, בניגוד לתחזיות קודמות.
נשימה
קיימות השערות במשך שנים רבות כי קומפלקס על של נשאי אלקטרונים בקרום הפנימי של המיטוכונדריון עשוי להתקיים בתאים עם נשאים בודדים היוצרים מגע פיזי זה עם זה. זה יביא לתגובות העברה יעילות יותר, למזער את הייצור של מיני חמצן תגובתיים ולהיות דומה למטבולונים של אנזימי מסלול מטבולי, שיש להם עדויות מסוימות. כעת נראה כי מצטברות עדויות לכך שמתחמים I, III ו- IV יוצרים קומפלקס על, שזכה לכינוי הנשימה 1.
זרחון חמצוני
תהליך הזרחון החמצוני משתמש באנרגיה של שיפוע הפרוטונים שהוקם על ידי מערכת הובלת האלקטרונים כאמצעי לזרחן ADP לייצור ATP. הקמת שיפוע הפרוטונים תלויה בהובלת אלקטרונים. אם הובלת האלקטרונים נעצרת או אם האטימות של הממברנה המיטוכונדריאלית הפנימית לפרוטונים נפגעת, זרחון חמצוני לא יתרחש מכיוון שללא שיפוע הפרוטונים להניע את סינתאז ATP, לא תהיה סינתזה של ATP.
סינתאז ATP
קומפלקס החלבון הקוצר אנרגיה משיפוע הפרוטונים ומשתמש בו לייצור ATP מ-ADP הוא אנזים בעל מספר שמות - קומפלקס V, PTAS (פרוטון טרנסלוקציה ATP Synthase) וסינתאז ATP (איור 5.29). מרכזי בתפקודו הוא תנועת הפרוטונים דרכו (מהחלל הבין-ממברני חזרה למטריצה). פרוטונים יספקו אנרגיה לייצור ATP רק אם ריכוזם גדול יותר בחלל הבין-ממברני מאשר במטריצה ואם ADP זמין.
יתכן, במקרים מסוימים, שריכוז הפרוטונים יהיה גדול יותר בתוך המטריצה מאשר מחוצה לה. כאשר זה קורה, סינתאז ה- ATP יכול לרוץ אחורה, כאשר פרוטונים נעים מבפנים החוצה, מלווים בהמרה של ATP ל- ADP+Pi. זה בדרך כלל לא נסיבה רצויה ויש כמה פקדים כדי להפחית את התרחשותה.
בדרך כלל, ריכוז ה- ATP יהיה גבוה יותר בתוך המיטוכונדריון וריכוז ADP יהיה גבוה יותר מחוץ למיטוכונדריון. עם זאת, כאשר קצב סינתזת ה- ATP עולה על קצב השימוש ב- ATP, אז ריכוזי ה- ATP עולים מחוץ למיטוכונדריון וריכוזי ADP יורדים בכל מקום.
זה יכול לקרות, למשל, בתקופות מנוחה. יש לו את ההשפעה הכוללת של הפחתת התחבורה ובכך להוריד את ריכוז ה- ADP בתוך המטריצה. הפחתת ריכוז ADP במטריצה מפחיתה זרחון חמצוני ויש לה השפעות על בקרת הנשימה (ראה כאן).
שיקול חשוב נוסף הוא שכאשר ATP מיוצר בזרחן חמצוני, הוא משתחרר למטריצה המיטוכונדריאלית, אך חייב להיות מועבר לתוך הציטוזול כדי לענות על צורכי האנרגיה של שאר התא. זה מושג על ידי פעולה של טרנסלוקאז נוקלאוטיד אדנין, אנטי-פורט שמעביר ATP מהמטריצה בתמורה ל-ADP שעובר לתוך המטריצה. מערכת הובלה זו מונעת על ידי ריכוזי ADP ו-ATP ומבטיחה שרמות ADP נשמרות בתוך המיטוכונדריון, מה שמאפשר המשך סינתזת ATP.
דרישה אחרונה לסינתזה של ATP מ- ADP היא שיש לייבא פוספט גם למטריצה. זה מושג על ידי פעולה של טרנסלוקאז פוספט, שהוא סימפורט שמעביר פוספט לתוך המטריצה המיטוכונדריאלית יחד עם פרוטון.
ישנן עדויות לכך ששני הטרנסלוקזות וסינתאז ATP עשויים להתקיים במכלול, שזכה לכינוי סינתזום ATP.
לסיכום, מערכת הובלת האלקטרונים טוענת את הסוללה עבור זרחון חמצוני על ידי שאיבת פרוטונים מהמיטוכונדריון. הממברנה הפנימית השלמה של המיטוכונדריון מרחיקה את הפרוטונים בחוץ, למעט אלה שנכנסים מחדש דרך ATP Synthase. סינתאז ATP מאפשר לפרוטונים להיכנס מחדש למטריצה המיטוכונדריאלית ולקצור את האנרגיה שלהם לייצור ATP.
מנגנון סינתאז ATP
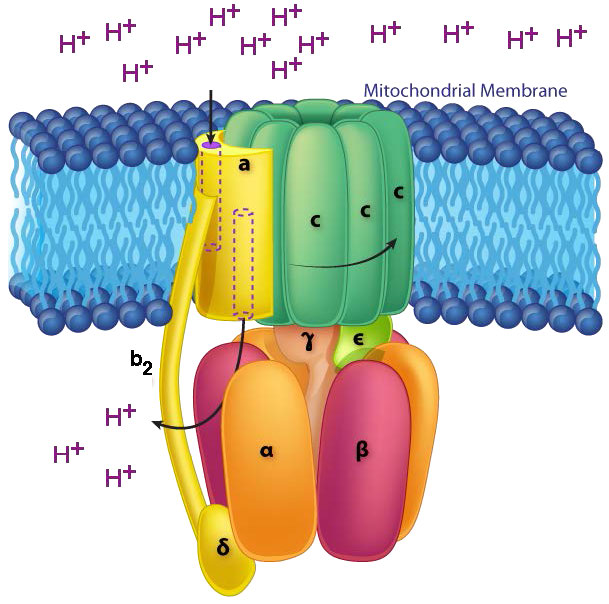
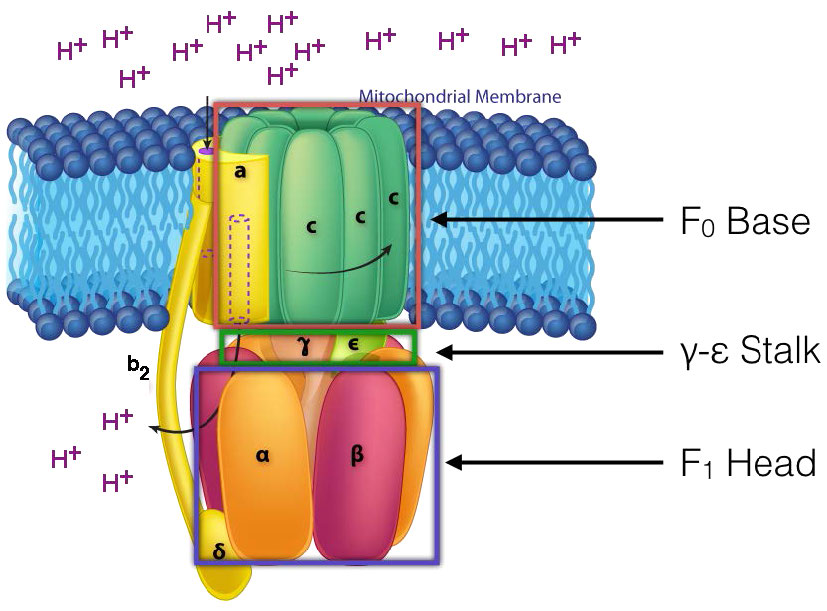
ב-ATP Synthase, הרכיבים המסתובבים, או הרוטור, הם חלק הממברנה (טבעת c) של בסיס F0 וגבעול γ-ε, המחובר אליו. גבעול γ-ε מקרין לראש F1 של מבנה הפטריות. ראש F1 מכיל את היכולת הקטליטית לייצר ATP. ראש F1 הוא הקסמרי במבנה עם חלבוני α ו- β מזווגים המסודרים בטרימר של דימרים. סינתזת ATP מתרחשת בתוך יחידות המשנה β.
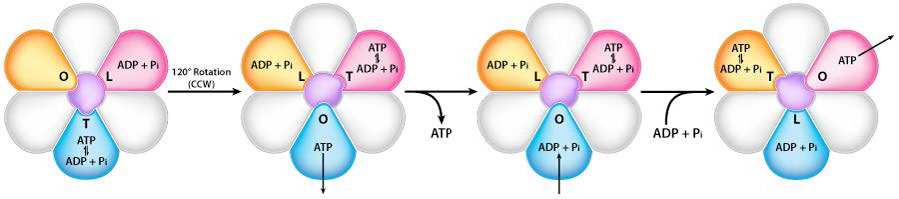
סיבוב יחידת γ
סיבוב פיר γ (הנגרם על ידי זרימת פרוטונים) בתוך הטרימר α-β של ראש F1 גורם לכל קבוצה של חלבוני β לשנות מעט את המבנה לשלוש צורות שונות הנקראות Loose, Tight ו- Open (L, T, O - איור 5.31). לכל אחת מהצורות הללו יש פונקציה.
הצורה הרופפת קושרת ADP+Pi. הצורה ההדוקה "לוחצת" אותם יחד ליצירת ה- ATP. הצורה הפתוחה משחררת את ה- ATP למטריצה המיטוכונדריאלית. לפיכך, כתוצאה מזרימת הפרוטונים דרך סינתאז ATP, מהחלל הבין-ממברני למטריצה, ATP עשוי מ-ADP ו-Pi.
בקרת נשימה
כאשר למיטוכונדריון יש קרום פנימי שלם ופרוטונים יכולים לחזור למטריצה רק על ידי מעבר דרך סינתאז ATP, אומרים כי תהליכי הובלת האלקטרונים והזרחון החמצוני מחוברים היטב.
תלות הדדית
במילים פשוטות, צימוד הדוק פירושו שתהליכי הובלת האלקטרונים והזרחון החמצוני תלויים זה בזה. מבלי שתתרחש הובלת אלקטרונים בתא, זרחון חמצוני ייפסק בקרוב.
ההפך הוא הנכון גם, מכיוון שאם זרחון חמצוני ייפסק, שיפוע הפרוטונים לא יתפוגג כשהוא נבנה על ידי מערכת הובלת האלקטרונים ויגדל יותר ויותר. ככל שהשיפוע גדול יותר, כך האנרגיה הדרושה לשאיבת פרוטונים מהמיטוכונדריון גדולה יותר. בסופו של דבר, אם שום דבר לא מקל על השיפוע, הוא הופך להיות גדול מדי והאנרגיה של הובלת אלקטרונים אינה מספיקה לביצוע השאיבה. כאשר השאיבה נעצרת, כך גם הובלת אלקטרונים.
תלות ADP
נקודה רלוונטית נוספת היא שסינתאז ATP תלוי לחלוטין באספקת ADP. בהיעדר ADP, סינתאז ה- ATP מפסיק לתפקד וכאשר הוא מפסיק, כך גם תנועת הפרוטונים חזרה למיטוכונדריון. בעזרת מידע זה ניתן להבין את הקשר בין צריכת אנרגיה לחילוף חומרים. שורש זה, כאמור, הוא בקרת הנשימה.
במנוחה
כדי להמחיש קישורים אלה, הבה נבחן תחילה אדם, בתחילה במנוחה, אשר פתאום קופץ ובורח. בהתחלה, רמות ה- ATP של האדם גבוהות ורמות ה- ADP נמוכות (אין פעילות גופנית לשריפת ATP), ולכן מתרחשת מעט זרחון חמצוני ולכן שיפוע הפרוטונים גבוה. הובלת אלקטרונים נעה לאט, אם בכלל, כך שהיא אינה משתמשת בחמצן ונשימתו של האדם איטית, כתוצאה מכך.
תרגיל
כאשר הריצה מתחילה, התכווצות שרירים, המשתמשת באנרגיה, גורמת להמרת ATP ל- ADP. הגדלת ADP בתאי שריר מעדיפה זרחון חמצוני כדי לנסות לפצות על ה-ATP שנשרף. סינתאז ATP מתחיל לעבוד ופרוטונים מתחילים לחזור למטריצה המיטוכונדריאלית. שיפוע הפרוטונים פוחת, ולכן הובלת האלקטרונים מתחילה מחדש.
הובלת אלקטרונים זקוקה למקבל אלקטרונים, ולכן השימוש בחמצן גדל וכאשר השימוש בחמצן גדל, האדם מתחיל לנשום בכבדות רבה יותר כדי לספק אותו. כאשר האדם מפסיק לרוץ, ריכוזי ATP נבנים מחדש על ידי סינתאז ATP. בסופו של דבר, כאשר רמות ה- ATP משוחזרות לחלוטין, רמות ה- ADP יורדות וסינתאז ATP נעצר או מאט במידה ניכרת. עם תנועת פרוטונים מועטה או ללא תנועת פרוטונים, הובלת האלקטרונים נעצרת מכיוון ששיפוע הפרוטונים גדול מדי. כאשר הובלת האלקטרונים נעצרת, השימוש בחמצן פוחת וקצב הנשימה מאט.
הובלת אלקטרונים קריטית
הקישורים המעניינים באמת למטבוליזם מתרחשים ביחס לשאלה האם מתרחשת הובלת אלקטרונים או לא. מהדוגמאות, אנו יכולים לראות כי הובלת האלקטרונים תואט יחסית כאשר לא מתאמנים ומהירה יותר כאשר מתרחשת פעילות גופנית (או שימוש אחר ב- ATP). זכור כי הובלת אלקטרונים היא הדרך שבה נושאי אלקטרונים מופחתים, NADH ו-FADH2, תורמים את האלקטרונים שלהם ל-ETS, מתחמצנים ל-NAD+ ו-FAD, בהתאמה.
נשאים מחומצנים, כגון NAD+ ו-FAD נחוצים במסלולים קטבוליים, כמו גליקוליזה, מחזור חומצת הלימון וחמצון חומצות שומן. מסלולים אנבוליים, כגון סינתזת חומצות שומן/שומן וגלוקונאוגנזה מסתמכים על נשאי אלקטרונים מופחתים, כגון FADH2, NADH והנשא הקשור, NADPH.
קישורים לפעילות גופנית
רמות גבוהות של NADH ו-FADH2 מונעות ממסלולים קטבוליים לפעול, מכיוון שרמות NAD+ ו-FAD יהיו נמוכות ואלו נחוצות כדי לקבל את האלקטרונים המשתחררים במהלך הקטבוליזם על ידי התהליכים החמצוניים.
הודות לבקרת הנשימה, כאשר מתאמנים, רמות NAD+ ו- FAD עולות (מכיוון שהובלת אלקטרונים פועלת), כך שמסלולים קטבוליים הזקוקים ל- NAD+ ו- FAD יכולים לתפקד. האלקטרונים שאבדו בתגובות החמצון של קטבוליזם נלכדים על ידי NAD+ ו-FAD כדי להניב NADH ו-FADH2, אשר לאחר מכן מספקים אלקטרונים למערכת הובלת האלקטרונים וזרחון חמצוני כדי ליצור ATP נחוץ יותר.
לפיכך, במהלך פעילות גופנית, התאים עוברים למצב של רכיבה מהירה בין נשאי אלקטרונים מופחתים (NADH/FADH2) לבין נשאי אלקטרונים מחומצנים (NAD+/FAD). זה מאפשר לרקמות המטבוליזם במהירות להעביר אלקטרונים ל- NAD+/FAD וזה מאפשר לנשאי האלקטרונים המופחתים להתחמצן במהירות, מה שמאפשר לתא לייצר ATP.
תנוח
כאשר פעילות גופנית נעצרת, רמות NADH ו- FADH2 עולות (מכיוון שהובלת האלקטרונים מאטה) וגורמות למסלולים קטבוליים להאטי/לעצור. אם אין את הכמות הנכונה של פעילות גופנית, נשאים מופחתים נשארים בריכוז גבוה לפרקי זמן ארוכים. זה אומר שיש לנו עודף אנרגיה ואז מסלולים אנבוליים, במיוחד סינתזת חומצות שומן, מועדפים, ולכן אנו משמינים יותר.
שינוי בקרת הנשימה
אפשר לחשוד שלשינוי בקרת הנשימה יכולות להיות השלכות קשות מאוד וזה יהיה נכון. שינויים יכולים ללבוש צורה של עיכוב הובלת אלקטרונים/זרחון חמצוני או ניתוק השניים. שינויים אלה ניתן להשיג באמצעות תרכובות עם השפעות ספציפיות על רכיבים מסוימים של המערכת.
כל הכימיקלים המתוארים כאן הם כלי מעבדה ולעולם אסור להשתמש בהם על ידי אנשים. הקבוצה הראשונה לדיון היא המעכבים. במיטוכונדריה צמודות היטב, לעיכוב הובלת אלקטרונים או זרחון חמצוני יש השפעה לעכב גם את השני.
מעכבי הובלת אלקטרונים
מעכבים נפוצים של הובלת אלקטרונים כוללים רוטנון ואמיטל, שעוצרים את תנועת האלקטרונים מעבר למתחם I, מלונאט, מאלאט ואוקסלואצטט, המעכבים את תנועת האלקטרונים דרך קומפלקס II, אנטימיצין A שעוצר את תנועת האלקטרונים מעבר למתחם III, וציאניד, פחמן חד חמצני, אזיד ומימן גופרתי, המעכבים את תנועת האלקטרונים דרך קומפלקס IV (איור 5.33). כל התרכובות הללו יכולות לעצור את הובלת האלקטרונים ישירות (ללא תנועה של אלקטרונים) וזרחון חמצוני בעקיפין (שיפוע פרוטונים יתפוגג). בעוד שחלק מהתרכובות הללו אינן ידועות בדרך כלל, כמעט כולם מודעים לסכנות של פחמן חד חמצני וציאניד, שניהם עלולים להיות קטלניים.
מעכב סינתאז ATP
אפשר גם להשתמש במעכב של סינתאז ATP כדי לעצור זרחון חמצוני ישירות (ללא ייצור ATP) והובלת אלקטרונים בעקיפין (שיפוע פרוטונים לא מוקל ולכן קשה יותר ויותר לשאוב פרוטונים מהמטריצה). אוליגומיצין A (איור 5.34) הוא מעכב של סינתאז ATP.
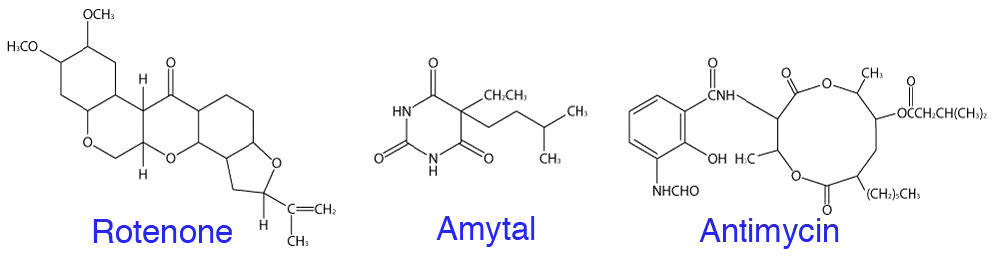
רוטנון
רוטנון, שהוא מוצר צמחי, משמש כחומר הדברה טבעי המותר לחקלאות אורגנית. כאשר מטפלים במיטוכונדריה בכך, הובלת האלקטרונים תיפסק במתחם I וכך גם שאיבת הפרוטונים מהמטריצה. כאשר זה קורה, שיפוע הפרוטונים מתפוגג במהירות, ועוצר זרחון חמצוני כתוצאה מכך. ישנן נקודות כניסה אחרות לאלקטרונים מאשר קומפלקס I, ולכן עיכוב מסוג זה אינו חמור כמו שימוש במעכבי מתחם IV, מכיוון שאין דרך חלופית לאלקטרונים. מסיבה זו ציאניד, למשל, הוא כל כך רעיל.
2,4-DNP
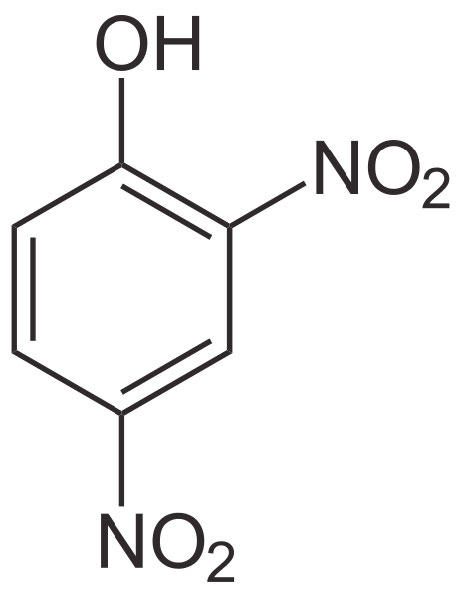
דמיין סכר המעכב מים עם טורבינה המייצרת חשמל דרכה חייבים לזרום מים. כאשר כל המים זורמים דרך הטורבינה, ניתן לייצר את כמות החשמל המרבית. עם זאת, אם תוקע חור בסכר, מים יזרמו דרך החור וייווצר פחות חשמל. ייצור החשמל יתנתק אפוא מזרימת המים. אם החור גדול מספיק, המים יתנקזו דרך החור ולא ייווצר חשמל.
עקיפת סינתאז ATP
תארו לעצמכם, כעת, ששיפוע הפרוטונים שווה ערך למים, הממברנה הפנימית היא המקבילה לסכר והסינתאז ATP הוא הטורבינה. כאשר לפרוטונים יש מסלול חלופי, מעט או ללא ATP ייעשה מכיוון שפרוטונים יעברו דרך חורי הממברנה במקום לסובב את הטורבינה של סינתאז ATP.
עם זאת, חשוב להכיר בכך שניתוק על ידי 2,4 DNP פועל באופן שונה ממעכבי הובלת האלקטרונים או מעכב סינתאז ATP. במצבים אלה, עצירת הזרחון החמצוני הביאה לעצירה עקיפה של הובלת אלקטרונים, מכיוון ששני התהליכים היו מחוברים והמעכבים לא ניתקו אותם. באופן דומה, עצירת הובלת אלקטרונים עצרה בעקיפין את הזרחון החמצוני מאותה סיבה.
זה לא המקרה עם 2,4 DNP. עצירת זרחון חמצוני על ידי השמדת שיפוע הפרוטונים מאפשרת להובלת אלקטרונים להמשיך ללא הפוגה (זה למעשה מגרה אותו), מכיוון ששיפוע הפרוטונים אינו יכול לבנות ולא משנה כמה הובלת אלקטרונים עוברת. כתוצאה מכך, הובלת אלקטרונים פועלת כמו מטורפת אך זרחון חמצוני נעצר. כשזה קורה, רמות NAD+ ו-FAD עולות, ומסלולים קטבוליים פועלים ללא הפוגה עם אספקה בשפע של מקבלי אלקטרונים אלה. הסיבה שתרחיש כזה מסוכן היא מכיוון שהגוף משתמש בכל משאבי התזונה שלו, אך לא נוצר ATP. מחסור ב- ATP מוביל למוות תאי (ואורגניזמי). בנוסף, כמויות החום הגדולות הנוצרות יכולות להעלות את טמפרטורת הגוף לרמות לא בטוחות.

תרמוגנין
אחד מתוצרי הלוואי של ניתוק הובלת אלקטרונים הוא ייצור חום. ככל שהמסלולים המטבוליים פועלים מהר יותר, כך נוצר יותר חום כתוצר לוואי. מכיוון ש -2,4 DNP גורם להאצת חילוף החומרים, ניתן לייצר כמות ניכרת של חום. ניתוק מבוקר משמש למעשה את הגוף ברקמות מיוחדות הנקראות שומן חום. במקרה זה, תאי שומן חומים משתמשים בחום שנוצר כדי לסייע בוויסות תרמי של הטמפרטורה של ילדים שזה עתה נולדו.
פרמביליזציה של הממברנה הפנימית מתבצעת בשומן חום על ידי סינתזה של חלבון הנקרא תרמוגנין (המכונה גם חלבון ניתוק). התרמוגנין נקשר לקרום הפנימי ומאפשר לפרוטונים לעבור דרכו ובכך עוקף את סינתאז ה- ATP. כפי שצוין עבור 2,4 DNP, התוצאה היא הפעלה של מסלולים קטבוליים וככל שמתרחש יותר קטבוליזם, כך נוצר יותר חום.
סם מסוכן
בניתוק, בין אם באמצעות פעולה של חלבון ניתוק אנדוגני או DNP, האנרגיה שבדרך כלל הייתה נלכדת ב-ATP הולכת לאיבוד כחום. במקרה של ניתוק על ידי תרמוגנין, הדבר משרת את המטרה החשובה של שמירה על חום תינוקות שזה עתה נולדו. אבל אצל מבוגרים, ניתוק רק מבזבז את האנרגיה שהייתה נקצרת כ- ATP. במילים אחרות, הוא מחקה רעב, למרות שיש הרבה מזון, מכיוון שהאנרגיה מתפזרת כחום.
עובדה זו, והעלייה הקשורה בקצב חילוף החומרים, הובילו לכך ש- DNP שימש כתרופה לירידה במשקל בשנות השלושים. היא הוצגה כדרך ללא מאמץ לרדת במשקל מבלי שתצטרך לאכול פחות או להתאמן יותר, והיא נקראה ככדור קסם לירידה במשקל. עם זאת, מהר מאוד התברר שזה מסוכן מאוד. אנשים רבים מתו משימוש בתרופה זו לפני שחוקקו חוקים לאסור את השימוש ב- DNP ככלי עזר לירידה במשקל.
אוקסידאז אלטרנטיבי
גישה נוספת ליצירת חום שאינה כרוכה בשבירת בקרת הנשימה נוקטת על ידי כמה פטריות, צמחים ופרוטוזואה. הם משתמשים בהובלת אלקטרונים חלופית. באורגניזמים אלה, יש אנזים הנקרא אוקסידאז חלופי (איור 5.36). אוקסידאז אלטרנטיבי מסוגל לקבל אלקטרונים מ- CoQ ולהעביר אותם ישירות לחמצן.
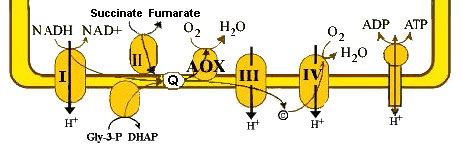
התהליך מתרחש במיטוכונדריה מצמידים. מנגנון הפעולה שלו הוא להפחית את התשואה של ATP, שכן פחות פרוטונים נשאבים לכל נושא אלקטרונים מופחת. כך ריכוזי NAD+ גדלים, צריכת החמצן עולה ויעילות ייצור ה- ATP יורדת.
אורגניזמים המשתמשים בשיטה זו חייבים להפעיל מסלולים קטבוליים על ידי העלייה בריכוז NAD+. זה, בתורו מייצר כמויות של NADH ו- FADH2 הדרושים לייצור כמויות מספיקות של ATP. תוצר הלוואי של קטבוליזם מוגבר זה הוא יותר חום. באופן לא מפתיע, ניתן להפעיל את מסלול האוקסידאז האלטרנטיבי על ידי טמפרטורות קרות.
יעילות אנרגטית
תאים אינם יעילים ב -100% בשימוש באנרגיה. שום דבר שאנחנו יודעים הוא. כתוצאה מכך, תאים אינם מקבלים אנרגיה רבה מתהליכים קטבוליים כפי שהם מכניסים לתהליכים אנבוליים. דוגמה טובה היא סינתזה ופירוק של גלוקוז, דבר שתאי הכבד עושים לעתים קרובות. ההמרה המלאה של גלוקוז לפירובט בגליקוליזה (קטבוליזם) מניבה שני פירובטים בתוספת 2 NADH בתוספת 2 ATPs. לעומת זאת, ההמרה המלאה של שני פירובטים לגלוקוז על ידי גלוקונאוגנזה (אנבוליזם) דורשת 4 ATP, 2 NADH ו-2 GTPs. מכיוון שהאנרגיה של GTP שווה במהותה לזו של ATP, גלוקונאוגנזה דורשת נטו של 4 ATP יותר מתשואות הגליקוליזה. יש להמציא את ההבדל הזה על מנת שהאורגניזם יענה על צרכי האנרגיה שלו. מסיבה זו אנו אוכלים. בנוסף, חוסר היעילות של לכידת האנרגיה שלנו בתגובות מביא לייצור חום ועוזר לחמם אותנו, כאמור. אתה יכול לקרוא עוד על גליקוליזה (כאן) וגלוקונאוגנזה (כאן).
בקרות מטבוליות של אנרגיה
כמו כן, ראוי לציין שלתאים אין בדרך כלל תהליכים קטבוליים ואנבוליים עבור אותן מולקולות המתרחשות בו-זמנית בתוכם (למשל, פירוק גלוקוז וסינתזה של גלוקוז) מכיוון שהתא לא יראה ייצור נטו של שום דבר מלבד חום ואובדן של ATP עם כל סיבוב של המחזור. מחזורים כאלה נקראים מחזורים חסרי תועלת ולתאים יש בקרות כדי להגביל את מידת התרחשותם. מכיוון שמחזורים חסרי תוחלת יכולים למעשה להניב חום, הם משמשים כמקורות חום בסוגים מסוימים של רקמות. רקמת שומן חומה של יונקים משתמשת באסטרטגיה זו, כפי שתואר קודם לכן. ראה גם כאן למידע נוסף על ייצור חום עם מחזור חסר תוחלת.
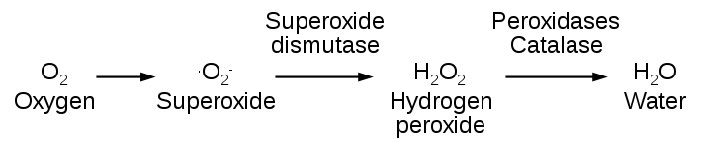
מיני חמצן תגובתי
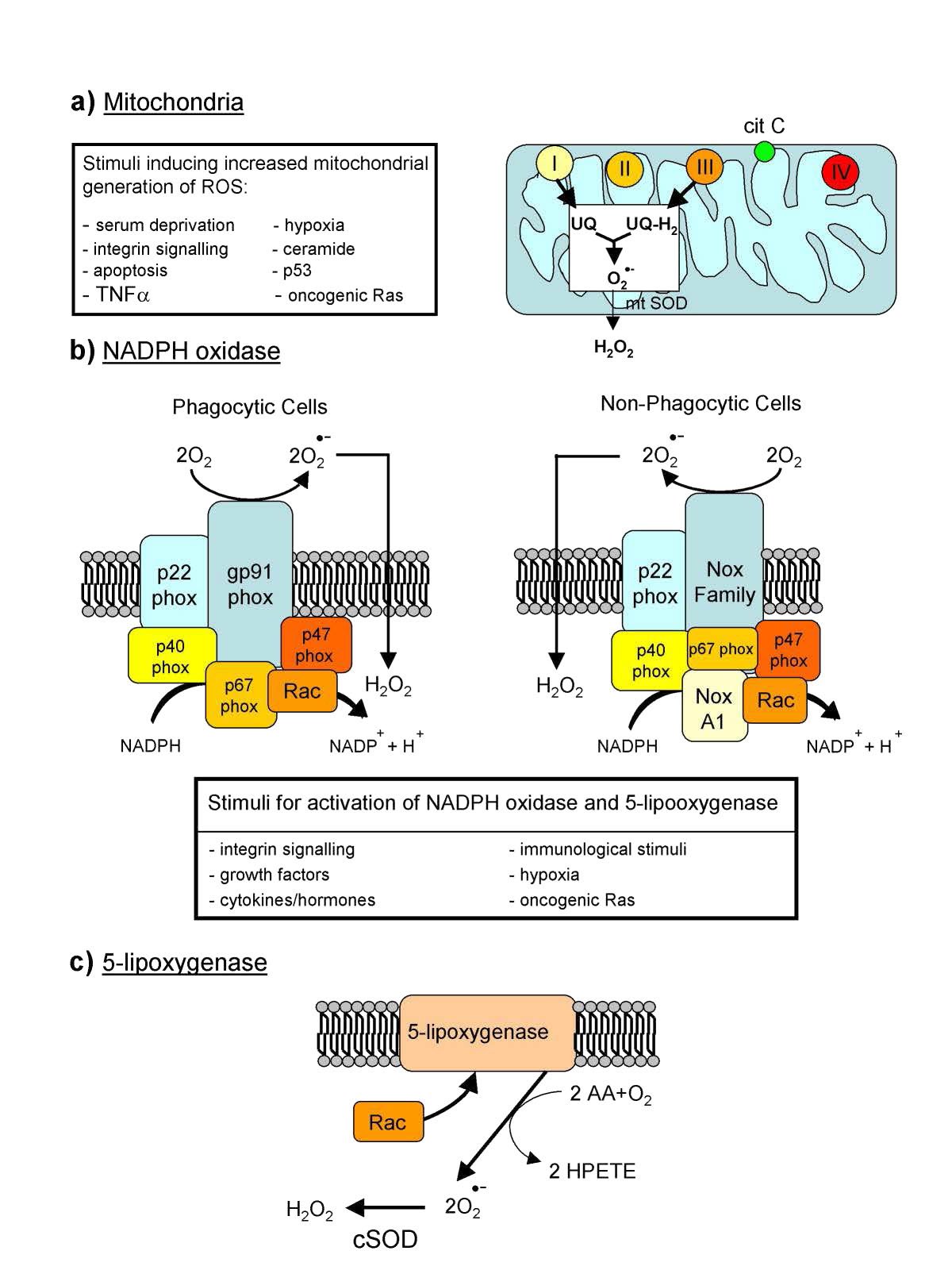
ייצור אנדוגני של ROS מכוון לאיתות תוך תאי (H2O2 ותחמוצת החנקן, למשל) והגנה. לתאים רבים, למשל, יש NADPH אוקסידאז (איור 5.38) מוטבע בחלק החיצוני של ממברנות הפלזמה, בפרוקסיזומים וברשת אנדופלזמית. הוא מייצר סופראוקסידים בתגובה למטה כדי להרוג חיידקים.
במערכת החיסון, תאים הנקראים פגוציטים בולעים תאים זרים ולאחר מכן משתמשים ב-ROS כדי להרוג אותם. ROS יכול לשמש אותות לפעולה. בדג הזברה, רקמות פגומות הגדילו את הרמות של H2O2 וזה נחשב לאות לתאי דם לבנים להתכנס באתר. בדגים חסרי הגנים לייצור מי חמצן, תאי הדם הלבנים אינם מתכנסים באתר הנזק. מקורות מי חמצן כוללים פרוקסיזומים, המייצרים אותו כתוצר לוואי של חמצון של חומצות שומן ארוכות שרשרת.
הזדקנות
מיני חמצן תגובתיים הם לב ליבה של תיאוריית ההזדקנות של הרדיקלים החופשיים, הקובעת כי אורגניזמים מזדקנים עקב הצטברות נזקים מרדיקלים חופשיים בתאיהם. בשמרים ותסיסנית, ישנן עדויות לכך שהפחתת נזק חמצוני יכולה להגדיל את תוחלת החיים. בעכברים, הגדלת הנזק החמצוני מפחיתה את תוחלת החיים, אם כי ב-Caenorhabditis, חסימת ייצור של סופראוקסיד דיסמוטאז למעשה מגדילה את תוחלת החיים, כך שתפקידו של ROS בהזדקנות אינו ברור לחלוטין.
ברור, עם זאת, כי הצטברות של נזק מיטוכונדריאלי היא בעייתית עבור תאים בודדים. חלבוני Bcl-2 על פני המיטוכונדריה עוקבים אחר הנזק ואם הם מזהים אותו, יפעילו חלבונים הנקראים Bax כדי לעורר את שחרור הציטוכרום c מהקרום המיטוכונדריאלי, ויעורר אפופטוזיס (מוות תאים מתוכנת). בסופו של דבר התא המת יעבור פגוציטוזה.
מקור אנדוגני נפוץ לסופרוקסיד הוא שרשרת הובלת האלקטרונים. ניתן לייצר סופראוקסיד כאשר תנועת אלקטרונים אל השרשרת ומחוצה לה אינה תואמת היטב. בנסיבות אלה, CoQ מופחת למחצה יכול לתרום אלקטרון ל-O2 ליצירת סופראוקסיד (O2-). סופראוקסיד יכול להגיב עם מולקולות רבות, כולל DNA שבו הוא יכול לגרום לנזק המוביל למוטציה. אם הוא מגיב עם האנזים אקוניטאז, ניתן לשחרר ברזל ברזלי (Fe++) אשר, בתורו, יכול להגיב בתגובת פנטון לייצר מין חמצן תגובתי נוסף, רדיקל ההידרוקסיל (איור 5.39).
נגד ההשפעות של ROS הם אנזימים, כגון קטלאז, סופראוקסיד דיסמוטאז ונוגדי חמצון, כגון גלוטתיון וויטמינים C ו- E.
גלוטתיון מגן מפני נזק חמצוני בכך שהוא מצע לאנזים גלוטתיון פרוקסידאז. גלוטתיון פרוקסידאז מזרז את ההמרה של מי חמצן למים (עמוד הבא).
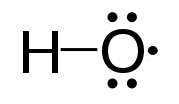
קטלאז
2 ח2O2 <=> 2 ח2O + O2
האנזים, המעסיק ארבע קבוצות heme בקטליזה שלו, פועל במהירות רבה, וממיר עד 40,000,000 מולקולות של מי חמצן למים וחמצן לאנזים בשנייה. הוא נמצא בשפע בפרוקסיזומים.
בנוסף ליכולתו של קטלאז לפרק מי חמצן, האנזים יכול להשתמש גם במי חמצן כדי לחמצן מגוון רחב של תרכובות אורגניות, כולל פנולים, חומצה פורמית, פורמלדהיד, אצטאלדהיד ואלכוהול, אך ביעילות נמוכה בהרבה.
בריאות
חשיבותו של קטלאז לבריאות אינה ודאית. עכברים חסרי אנזים נראים בריאים ובני אדם עם רמות נמוכות של האנזים מציגים מעט בעיות. מצד שני, עכברים שהונדסו לייצר רמות גבוהות יותר של קטלאז, במחקר אחד לפחות, חיו זמן רב יותר. יכולתם של אורגניזמים לחיות עם רמות נמוכות יותר או ללא קטלאז עשויה לנבוע מקבוצה אחרת של אנזימים, הפרוקסירדוקסינים, הפועלים גם על מי חמצן ועשויים לפצות על כמויות נמוכות יותר של קטלאז. לבסוף, ישנן עדויות לכך שרמות מופחתות של קטלאז עם ההזדקנות עשויות להיות אחראיות לאפיר השיער. רמות גבוהות יותר של H2O2 עם קטלאז מופחת מביא להלבנת זקיקי השיער.
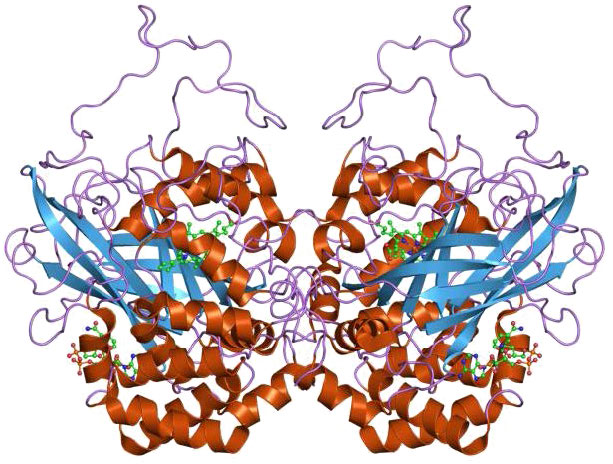
סופראוקסיד דיסמוטאז
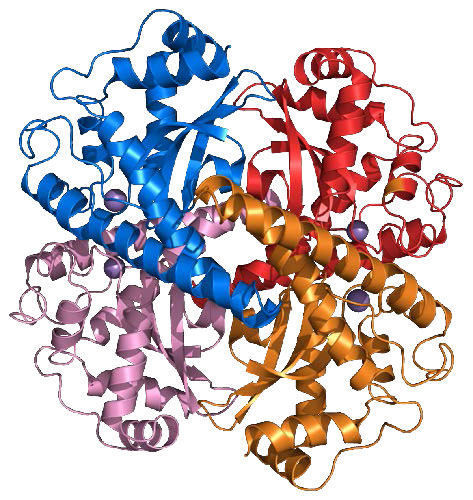
אנזים חשוב נוסף להגנה מפני מיני חמצן תגובתיים הוא סופראוקסיד דיסמוטאז (SOD), שנמצא, כמו קטלאז, כמעט בכל האורגניזמים החיים בסביבת חמצן. סופראוקסיד דיסמוטאז, גם כמו קטלאז, הוא בעל ערך Kcat גבוה מאוד ולמעשה יש לו את ה- Kcat/Km הגבוה ביותר הידוע בכל אנזים ידוע. זה מזרז את התגובות בחלק העליון של העמודה הבאה (סופראוקסידים המוצגים באדום):
האנזים פועל אפוא על ידי מנגנון פינג-פונג (עקירה כפולה) (ראה כאן), המומר בין שתי צורות שונות.
מי החמצן המיוצר בתגובה השנייה מטופל בקלות על ידי קטלאז והוא גם פחות מזיק מסופרוקסיד, שיכול להגיב עם תחמוצת החנקן (NO) ליצירת יוני פרוקסיניטריט רעילים מאוד (איור 5.43). לפרוקסיניטריט יש השפעות שליליות על התאים, כפי שמוצג באיור 5.45.
בנוסף לנחושת, יון של Zn++ נקשר גם לאנזים וככל הנראה ממלא תפקיד בקטליזה. צורות של סופראוקסיד דיסמוטאז המשתמשות במנגן, ניקל או ברזל ידועות גם הן ונמצאות בעיקר בפרוקריוטים ובפרוטיסטים, אם כי SOD מנגן נמצא ברוב המיטוכונדריה. אנזימי נחושת/אבץ נפוצים באיקריוטים.
שלוש צורות של סופראוקסיד דיסמוטאז נמצאות בבני אדם וממוקמות לציטופלזמה (SOD1 - איור 5.45), מיטוכונדריה (SOD2 - איור 5.46) ואזורים חוץ-תאיים (SOD3 - איור 5.47). עכברים חסרי כל אחת משלוש צורות האנזים רגישים יותר לתרופות, כגון פרקוואט. מחסור ב- SOD1 בעכברים מוביל לקרצינומה הפטוצלולרית ולאובדן מוקדם של רקמת השריר הקשורה להזדקנות. תסיסנית חסרת SOD2 מתה לפני הלידה ואלה חסרי SOD1 בגיל בטרם עת.
בבני אדם, מוטציות סופראוקסיד דיסמוטאז קשורות לצורה המקושרת גנטית של טרשת עורקים אמיוטרופית (ALS) וביטוי יתר של הגן קשור להפרעות עצביות הקשורות לתסמונת דאון.
אוקסידאזות בתפקוד מעורב
אנזימים אחרים המזרזים תגובות הכוללות חמצן כוללים את הפונקציה המעורבת אוקסידאזים. אנזימים אלה משתמשים בחמצן מולקולרי לשתי מטרות שונות בתגובה אחת. חלק הפונקציה המעורבת של השם משמש לציון תגובות שבהן שני מצעים שונים מתחמצנים בו זמנית. מונואוקסיגנזים הם דוגמאות לאוקסידאזים בתפקוד מעורב. דוגמה לתגובת אוקסידאז בתפקוד מעורב מוצגת להלן.
אה + BH2 + או2 <=> AOH + B + ח2O
במקרה זה, למולקולת החמצן יש אטום אחד המשמש כמקבל אלקטרונים והאטום השני מתווסף ל- AH ויוצר אלכוהול.
אנזימים ציטוכרום P450
אנזימי ציטוכרום P450 (הנקראים CYPs) הם משפחה של אנזימי אוקסידאז מעורבים המכילים heme הנמצאים בכל תחומי החיים. ידועים למעלה מ-21,000 אנזימי CYP. התגובה האופיינית ביותר המזרזת על ידי אנזימים אלה באה בעקבותיה
תגובות מונואוקסיגנאז כגון אלה נדירות יחסית בתא בשל השימוש בהן בחמצן מולקולרי. CYPs דורשים תורם אלקטרונים לתגובות כמו זו המוצגת כאן ולעתים קרובות דורשים חלבון שיסייע בהעברת אלקטרונים להפחתת ברזל ההמה. ישנם שישה סוגים שונים של אנזימי P450 המבוססים על האופן שבו הם מקבלים אלקטרונים
1. חיידקי P450 - אלקטרונים מפרדוקסין רדוקטאז ופרדוקסין
2. מיטוכונדריאלי P450 - אלקטרונים מאדרנודוקסין רדוקטאז ואדרנודוקסין
3. CyB5R/CyB5 - אלקטרונים מגיעים מציטוכרום b5
4. FMn/Fd - השתמש ברדוקטאז FMN התמזג
5. מיקרוסומלי P450 - אלקטרונים NADPH מגיעים דרך ציטוכרום P450 רדוקטאז או מציטוכרום b5 וציטוכרום b5 רדוקטאז
6. מערכות P450 בלבד - אינן דורשות כוח צמצום חיצוני
הגנים של CYP נמצאים בשפע בבני אדם ומזרזים אלפי תגובות על כימיקלים תאיים וחוץ-תאיים כאחד. ישנם 57 גנים אנושיים המסווגים ל-18 משפחות שונות של אנזימים. חלק מה- CYPs ספציפיים למצעים אחד או כמה, אך אחרים יכולים לפעול על מצעים רבים ושונים.
אנזימי CYP נמצאים ברוב רקמות הגוף ומבצעים תפקידים חשובים בסינתזה של סטרואידים (כולסטרול, אסטרוגן, טסטוסטרון, ויטמין D, למשל), פירוק תרכובות אנדוגניות (בילירובין), ובניקוי רעלים של תרכובות רעילות כולל תרופות. מכיוון שהם פועלים על תרופות רבות, שינויים בפעילות CYP יכולים לייצר תוצאות בלתי צפויות ולגרום לבעיות באינטראקציות בין תרופות.
תרכובות ביו-אקטיביות, למשל, במיץ אשכוליות, יכולות לעכב את פעילות CYP3A4, מה שמוביל לריכוזים מוגברים של תרופות שבדרך כלל היו פועלות על ידי CYP3A4. זו הסיבה שמומלץ לחולים שרשמו תרופות הידועות כמצעי CYP3A4 להימנע משתיית מיץ אשכוליות בזמן הטיפול. סנט ג'ונס וורט, טיפול בצמחי מרפא, לעומת זאת, גורם לפעילות CYP3A4, אך מעכב CYP1A1, CYP1B1 ו- CYP2D6. עשן טבק גורם CYP1A2 וגרגיר הנחלים מעכב CYP2E1.
ציטוכרומים
ציטוכרומים הם חלבונים המכילים heme הממלאים תפקידים מרכזיים בתהליך הובלת האלקטרונים במיטוכונדריון ובפוטוסינתזה בכלורופלסט. הם קיימים כמונומרים (ציטוכרום c) או כיחידות משנה בתוך מתחמי חיזור גדולים (מתחם III ומתחם IV של הובלת אלקטרונים. אטום ברזל במרכז קבוצת ההם ממלא תפקיד מרכזי בתהליך, כשהוא מתהפך בין מצבי הברזל (Fe++) לברזל (Fe+++) כתוצאה מתנועת האלקטרונים דרכו.
ישנם מספר ציטוכרומים שונים. ציטוכרום ג (איור 5.47) הוא חלבון מסיס הקשור באופן רופף למיטוכונדריון. ציטוכרומים a ו- a3 נמצאים במתחם IV. במתחם III יש ציטוכרומים b ו-c1 והפלסטוקינול-פלסטוציאנין רדוקטאז של הכלורופלסט מכיל ציטוכרומים b6 ו-f מחלקה חשובה נוספת של אנזימים המכילים ציטוכרומים היא קבוצת הציטוכרום P450 אוקסידאז (ראה לעיל). הם מקבלים את שמם מהעובדה שהם סופגים אור ב -450 ננומטר כאשר ברזל ההמה שלהם מצטמצם.
חלבוני ברזל-גופרית
חלבוני ברזל-גופרית מכילים אשכולות ברזל-גופרית במגוון פורמטים, כולל מרכזי di-, tri- ו-tetrairon המקושרים לסולפיד הקיימים במצבי חמצון שונים (איורים 5.48 ו-5.49). האשכולות ממלאים מגוון תפקידים, אך הידועים ביותר הם בהובלת אלקטרונים שם הם מתפקדים בתגובות החמצון המעורבות בתנועת האלקטרונים.
מתחמים I ומתחם II מכילים מרכזי Fe-S מרובים. עם זאת, לחלבוני ברזל-גופרית יש תפקידים רבים אחרים בתאים. אקוניטאז משתמש במרכז ברזל-גופרית בפעולה הקטליטית שלו ויכולתו של האנזים לקשור ברזל מאפשרת לו לתפקד כברומטר של ריכוז ברזל בתאים. מרכזי גופרית ברזל עוזרים לייצר רדיקלים באנזימים המשתמשים ב- S-Adenosyl Methionine (SAM) ויכולים לשמש מקור לגופרית בסינתזה של ביוטין וחומצה ליפואית. חלק מחלבוני ברזל-גופרית אף עוזרים לווסת את ביטוי הגנים.
פרדוקסין
פרדוקסינים הם חלבונים המכילים ברזל-גופרית המבצעים העברת אלקטרונים במגוון רחב של מערכות ותהליכים ביולוגיים. הם כוללים תפקידים בפוטוסינתזה בכלורופלסטים. פרדוקסינים מסווגים מבחינה מבנית על ידי המרכזים המקובצים ברזל-גופרית שהם מכילים. אשכולות Fe2S2 (איור 5.50) נמצאים בממברנות כלורופלסט ויכולים לתרום אלקטרונים לסינתאז גלוטמט, ניטראט רדוקטאז וסולפיט רדוקטאז ומשמשים כנשאי אלקטרונים בין רדוקטאז פלבופרוטאינים ומערכות דיאוקסיגנאז חיידקיות. אדרנודוקסין הוא פרדוקסין אנושי מסיס Fe2S2 (נקרא גם פרדוקסין 1) המשמש כמוביל אלקטרונים (לציטוכרום P450) במערכות מונואוקסיגנאז מיטוכונדריאליות. Fe4S4 פרדוקסינים מחולקים כפרדוקסינים בעלי פוטנציאל נמוך וגבוה, כאשר האחרונים מתפקדים בשרשראות הובלת אלקטרונים אנאירוביות.
פריטין
פריטין הוא חלבון אגירת ברזל תוך תאי המצוי כמעט בכל האורגניזמים החיים, מחיידקים ועד צמחים ובעלי חיים גבוהים יותר. זהו קומפלקס חלבון כדורי עם 24 יחידות משנה והוא החלבון העיקרי לאחסון ברזל תוך תאי באאוקריוטים ופרוקריוטים. פריטין מתפקד לשמירה על ברזל בצורה מסיסה ולא רעילה. יכולתו לאחסן ברזל בבטחה ולשחרר אותו בצורה מבוקרת מאפשרת לו לפעול כמו חיץ הברזל העיקרי והממיס בתאים - שמירה על ריכוז הברזל החופשי מלהיות גבוה או ליפול נמוך מדי. פריטין ממוקם בציטופלזמה ברוב הרקמות, אך הוא נמצא גם בסרום הפועל כמוביל ברזל. פריטין שאינו מכיל ברזל ידוע בשם אפופריטין.
מונואמין אוקסידאזים
מונואמין אוקסידאזים הם אנזימים המזרזים את הדימינציה החמצונית של מונואמינים, כגון סרוטונין, אפינפרין ודופמין. הסרת האמין עם חמצן גורמת לייצור אלדהיד ואמוניה. האנזימים נמצאים בתוך ומחוץ למערכת העצבים המרכזית.
ישנם שני סוגים של אנזימים מונואמין אוקסידאז - MAO-A ו- MAO-B. MAO-A חשוב במיוחד לחמצון מונואמינים הנצרכים בתזונה. גם MAO-A וגם MAO-B ממלאים תפקידים חשובים בהשבתת נוירוטרנסמיטורים מונואמינרגיים. שני האנזימים פועלים על דופמין, טירמין (איור 5.50) וטריפטמין. MAO-A הוא האנזים העיקרי לחילוף חומרים של מלטונין, סרוטונין, נוראדרנלין ואפינפרין, בעוד MAO-B הוא האנזים העיקרי לפנתילמין (איור 5.51) ובנזילאמין. דווח כי רמות MAO-B מופחתות במידה ניכרת עם השימוש בטבק.
פעולות של מונואמין אוקסידאזים משפיעות אפוא על רמות הנוירוטרנסמיטורים וכתוצאה מכך נחשבות למלא תפקידים בהפרעות נוירולוגיות ו/או פסיכיאטריות. רמות חריגות של MAOs נקשרו לבעיות פסיכולוגיות רבות, כולל דיכאון, הפרעת קשב (ADD), מיגרנות, סכיזופרניה ושימוש בסמים. תרופות המכוונות ל- MAOs משמשות לעיתים לטיפול בדיכאון כמוצא אחרון - בגלל תופעות לוואי אפשריות. רמות עודפות של קטכולאמינים, כגון אפינפרין, נוראדרנלין ודופמין, עלולות לגרום לאירועי יתר לחץ דם מסוכנים.
תיאוריית נזקי DNA של הזדקנות
תיאוריית נזקי ה-DNA של ההזדקנות מבוססת על התצפית שלאורך זמן התאים נתונים לאירועים חמצוניים נרחבים. כפי שכבר צוין, אלה מספקים הזדמנויות ליצירת ROS שעלול לפגוע במולקולות התאיות, ומכאן שהצטברות של נזק כזה, במיוחד ל-DNA תהיה מזיקה לתא. הצטברות הנזק ל- DNA יכולה, אם כן, להיות אחראית לשינויים בביטוי הגנים שאנו מקשרים להזדקנות.
אירועי נזק רבים
כמות הנזק ל- DNA שיכולה להתרחש היא ניכרת. בעכברים, למשל, מעריכים כי כל תא חווה 40,000 עד 150,000 אירועי נזק ביום. הנזק, שקורה ל- DNA גרעיני כמו גם ל- DNA המיטוכונדריאלי, עלול לגרום לאפופטוזיס ו/או להזדקנות תאית. מערכות תיקון DNA, כמובן, מגנות מפני נזק ל- DNA, אך עם הזמן עלול להצטבר נזק בלתי ניתן לתיקון.
נזק חמצוני
נזק ל- DNA יכול להתרחש בכמה דרכים. חמצון עלול לפגוע בנוקלאוטידים ולשנות את נטיות זיווג הבסיסים שלהם. חמצון של גואנין על ידי מיני חמצן תגובתיים, למשל, יכול לייצר 8-אוקסו-גואנין (איורים 5.52 ו-5.53). נוקלאובאז מחומצן זה מייצר בדרך כלל נגע ב- DNA הנובע מפעולה של מיני חמצן תגובתיים כמו סופראוקסידים. 8-אוקסוגואנין מסוגל ליצור אינטראקציה יציבה של זיווג בסיסים בתוך דופלקס DNA עם אדנין, מה שעלול לגרום למוטציה כאשר שכפול ה- DNA ממשיך. ניתן לתקן 8-oxoguanine אם הוא מזוהה בזמן על ידי גליקוזילאז DNA, הפועל לחיתוך הבסיס הפגוע ואז ניתן להחליפו בבסיס הנכון. פחמימנים ארומטיים פוליציקליים מעשן סיגריות, פליטת דיזל או בשר מבושל יתר על המידה יכולים להיקשר באופן קוולנטי ל- DNA, ואם לא מתוקנים, להוביל למוטציה. נזק כימי ל-DNA עלול לגרום ל-DNA שבור או מקושר.
מחלות של תיקון DNA
החשיבות של תיקון DNA בתהליך ההזדקנות מובהרת על ידי מחלות המשפיעות על תיקון DNA המובילות להזדקנות מוקדמת. אלה כוללים תסמונת ורנר, שתוחלת החיים שלה היא 47 שנים. זה נובע כתוצאה מאובדן של שני אנזימים בתיקון כריתת בסיס. לאנשים הסובלים מתסמונת קוקיין יש תוחלת חיים של 13 שנים עקב מוטציות המשנות את תיקון כריתת הנוקלאוטידים בשילוב שעתוק, המהווה מערכת חשובה לתיקון נזקים חמצוניים.
יתר על כן, תוחלת החיים של 13 מינים של אורגניזמים יונקים מתואמת עם רמת הביטוי של החלבון המעורר תיקון DNA PARP. מעניין שאנשים שחיו מעבר לגיל 100 היו בעלי רמה גבוהה יותר של PARP מאשר אנשים צעירים יותר באוכלוסייה.
נוגדי חמצון
יש עניין גובר בנושא נוגדי חמצון בגלל חששות בריאותיים שמעלים הידע שלנו על בעיות שנוצרו כתוצאה מחמצון ספונטני של ביומולקולות על ידי מינים חמצן תגובתיים (ROS), כגון סופראוקסיד. לנוגדי חמצון יש את התכונה הכימית של הגנה מפני נזק חמצוני על ידי חמצון בקלות בעצמם, עדיף על ביומולקולות אחרות.
מבחינה ביולוגית, לתאים יש כמה שורות של הגנה נוגדת חמצון. הם כוללים מולקולות, כגון ויטמינים C, A ו- E, גלוטתיון ואנזימים ההורסים ROS כגון סופראוקסיד דיסמוטאז, קטלאז ופרוקסידאזים.

השפעות בריאותיות
חמצון על ידי ROS הוא מוטגני ונקשר לטרשת עורקים. עם זאת, מחקרים אקראיים על תוספי דרך הפה של שילובי ויטמינים שונים לא הראו השפעה מגנה מפני סרטן ותוספי ויטמין E וסלניום לא גילו ירידה בסיכון למחלות לב וכלי דם. יתר על כן, לא נמצאה ירידה בשיעורי התמותה כתוצאה מתוסף עם חומרים אלה, כך שההשפעות המגנות, אם בכלל, של נוגדי חמצון על ROS בבריאות האדם נותרות לא מובנות.
גלוטתיון
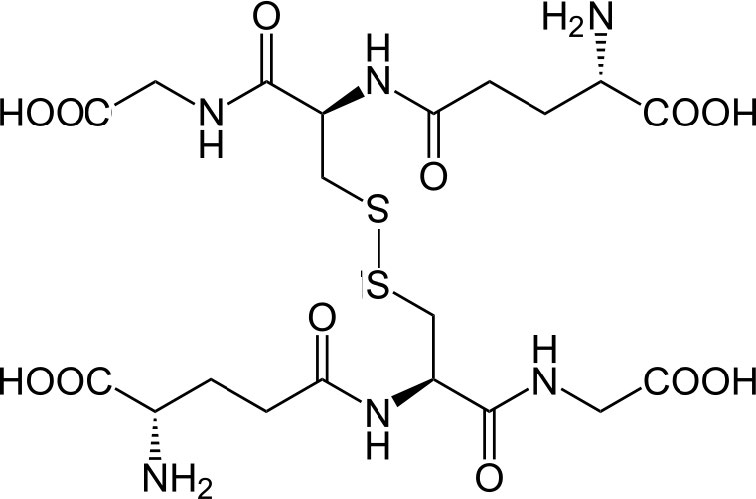
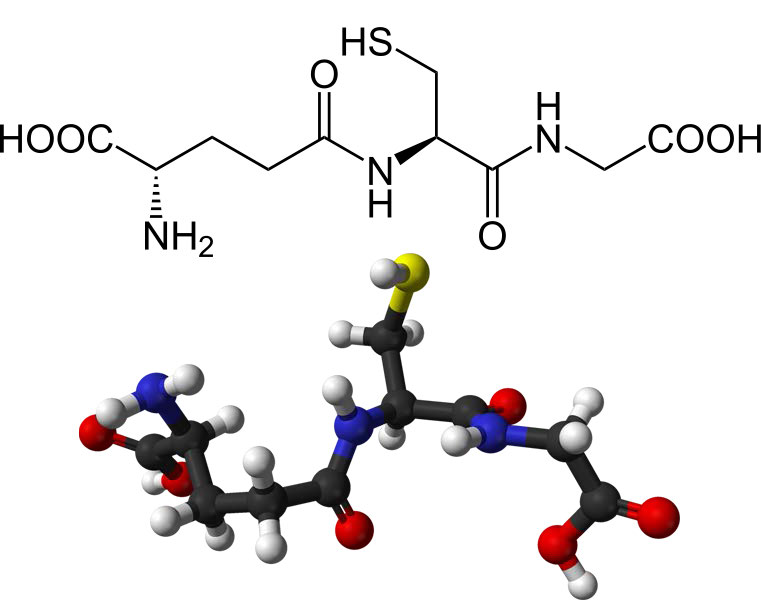
קבוצת התיול של ציסטאין היא חומר מפחית המפחית את קשרי הדיסולפיד לסולפהידרילים בחלבונים ציטופלסמיים. זהו, בתורו, הגשר כאשר שני גלוטתיון מתחמצנים ויוצרים קשר דיסולפיד זה עם זה (איור 5.56). שני מצבי החמצון של גלוטתיון מקוצרים כדלקמן: GSH (מופחת) ו- GSSG (מחומצן).
ניתן להפריד גלוטתיון המחובר לדיסולפיד על ידי הפחתת הקשרים שלהם עם גלוטתיון רדוקטאז, באמצעות אלקטרונים מ- NADPH להפחתה.
סינתזה לא ריבוזומלית
גלוטתיון אינו מיוצר על ידי ריבוזומים. במקום זאת, שני אנזימים מזרזים את הסינתזה שלו. האנזים γ-glutamylcysteine synthetase מזרז את חיבור הגלוטמט לציסטאין ואז גלוטתיון סינתטאז מזרז את היווצרות הקשר הפפטיד בין הציסטאין לגליצין. כל שלב דורש אנרגיה מ- ATP.
חיוני לכל החיים
גלוטתיון חשוב לכל החיים. עכברים חסרי האנזים הראשון המעורב בסינתזה שלו בכבד מתים בחודש הראשון לאחר הלידה. בתאים בריאים, 90% של גלוטתיון הוא במצב GSH. רמות גבוהות יותר של GSSG מתאימות לתאים שנלחצים באופן חמצוני.
מלבד הפחתת קשרי דיסולפיד בתאים, גלוטתיון חשוב גם לדברים הבאים:
• נטרול רדיקלים חופשיים ומיני חמצן תגובתיים.
• תחזוקה של נוגדי חמצון אקסוגניים כגון ויטמינים C ו- E בצורות מופחתות שלהם.
ויסות מחזור תחמוצת החנקן
רזברטרול
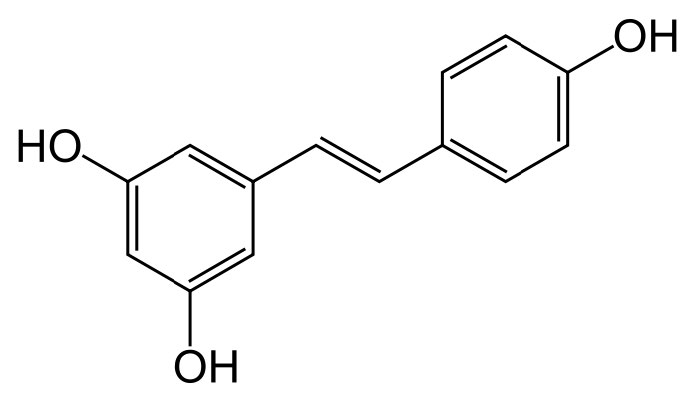
נתונים מסוימים מצביעים על כך שרזברטרול עשוי לשפר את תפקוד המיטוכונדריה. זה גם פועל כנוגד חמצון וגורם לריכוז של נוגד חמצון אחר, גלוטתיון, לעלות. נראה כי התרכובת מעוררת ביטוי של מנגן סופראוקסיד דיסמוטאז (מגן מפני מיני חמצן תגובתיים) ומעכב מספר פוספודיאסטראזים. זה גורם לעלייה ב-cAMP אשר גורמת לעלייה בחמצון של חומצות שומן, היווצרות מיטוכונדריה, גלוקונאוגנזה ופירוק גליקוגן. נטען כי הוא הגורם לפרדוקס הצרפתי בו שתיית יין אדום אמורה להעניק הגנה על מערכת הלב וכלי הדם. עם זאת, נתוני המחקר חסרים תמיכה בטענה. ידוע כי רזברטרול מפעיל חלבוני Sirtuin, הממלאים תפקידים בהשבתת גנים.
סיכום
לסיכום, יש צורך באנרגיה כדי שהתאים יבצעו את הפונקציות שעליהם לבצע על מנת להישאר בחיים. ברמה הבסיסית ביותר שלה, זה אומר להילחם בקרב מתמשך עם אנטרופיה, אבל זה לא הצורך היחיד באנרגיה שיש לתאים.
הפניות
1. ווינג ', דר., מול תא ביול 2012 יולי; 32 (14): 2647—2652. דוי: 10.1128/MCB.00573-12
אנרגיה: הובלת אלקטרונים וזרחון חמצוני
429
הרצאות ביוטיוב
מאת קווין
כאן & כאן
הרצאות ביוטיוב
מאת קווין
כאן & כאן
430
איור 5.14 - סקירה כללית של הובלת אלקטרונים (למטה משמאל ומימין למעלה) וזרחון חמצוני (למעלה משמאל - קופסה צהובה) במיטוכונדריון
431
איור 5.15 - אובדן אלקטרונים על ידי NADH ליצירת NAD+. תגובות רלוונטיות מתרחשות בטבעת העליונה של המולקולה.
432
איור 5.16 - זרימת אלקטרונים מ- NADH למערכת הובלת האלקטרונים. הכניסה היא דרך מתחם I
תמונה על ידי אליה קים
איור 5.17 - זרימת אלקטרונים מ-FADH2 לשרשרת הובלת האלקטרונים. הכניסה היא דרך מתחם II.
תמונה על ידי אליה קים
למידה אינטראקטיבית
מודול
פה
433
איור 5.18 - מתחם I מוטבע בקרום המיטוכונדריאלי הפנימי. המטריצה המיטוכונדריאלית בחלק העליון
ויקיפדיה
434
איור 5.19 - קומפלקס II מוטבע בקרום המיטוכונדריאלי הפנימי. מטריקס עולה.
ויקיפדיה
הרצאות ביוטיוב
מאת קווין
כאן & כאן
435
איור 5.20 - תנועת אלקטרונים דרך קומפלקס I מ-NADH לקואנזים Q המטריצה המיטוכונדריאלית נמצאת בתחתית
תמונה על ידי אליה קים
איור 5.21 - תנועת אלקטרונים מסוקסינאט דרך קומפלקס II (A->B->C->D->Q). מטריצה מיטוכונדריאלית בתחתית.
תמונה על ידי אליה קים
436
איור 5.22 - מתחם II בקרום המיטוכונדריאלי הפנימי המציג זרימת אלקטרונים. מטריקס עולה.
ויקיפדיה
איור 5.23 - קואנזים Q
437
סרט 5.2 - מחזור Q
ויקיפדיה
איור 5.24 - תמונת מחזור Q מאת אליה קים
איור 5.24 - מתחם III
ויקיפדיה
438
הרצאות ביוטיוב
מאת קווין
כאן & כאן
איור 5.25 - מחזור Q. מטריקס הוא למטה.
תמונה על ידי אליה קים
439
איור 5.26 - תנועה של אלקטרונים ופרוטונים דרך קומפלקס IV. מטריקס מושפל
תמונה על ידי אליה קים
איור 5.25 - ציטוכרום c עם קבוצת heme קשורה
ויקיפדיה
440
איור 5.27 - אנטומיה מיטוכונדריאלית. מתחמי הובלת אלקטרונים וסינתאז ATP מוטבעים בקרום המיטוכונדריאלי הפנימי
תמונה על ידי אליה קים
441
איור 5.28 - סינתאז ATP. פרוטונים עוברים מהחלל הבין-ממברני (למעלה) דרך המתחם ויוצאים במטריצה (למטה).
תמונה על ידי אליה קים
למידה אינטראקטיבית
מודול
פה
442
סרט 5.3 - סינתאז ATP - ADP+Pi (ורוד) ו- ATP (אדום). התצוגה מסתיימת מהצד הציטופלזמי הצופה ביחידות המשנה β
סרט 5.3 - ATP Synthase - ADP+Pi (ורוד) ו- ATP (אדום). הנוף מסתיים מהצד הציטופלזמי הצופה ביחידות המשנה β
443
איור 5.29 - מאפיינים מבניים חשובים של סינתאז ATP
תמונה על ידי אליה קים
444
איור 5.30 - מבנים רופפים (L), הדוקים (T) ופתוחים (O) של ראש F1 של סינתאז ATP. שינוי המבנה מתרחש על ידי סיבוב של γ-חלבון (סגול) במרכז כתוצאה מתנועת פרוטונים. יחידות α ו- β בודדות אינן מסתובבות
תמונה על ידי אליה קים
445
איור 5.31 - סקירת נשימה בתאים אוקריוטיים
ויקיפדיה
הרצאות ביוטיוב
מאת קווין
כאן & כאן
446
מנוחה
ATP גבוה/ ADP נמוך
זרחון חמצוני נמוך
הובלת אלקטרונים נמוכה
שימוש בחמצן נמוך
NADH גבוה/ NAD+נמוך
מחזור חומצת לימון איטי
תרגיל
ATP נמוך/ADP גבוה
זרחון חמצוני גבוה
הובלת אלקטרונים גבוהה
שימוש בחמצן גבוה
NADH נמוך/NAD+גבוה
מחזור חומצת לימון מהיר
למידה אינטראקטיבית
מודול
פה
447
איור 5.32 - שלושה מעכבים של הובלת אלקטרונים
תמונה על ידי אליה קים
448
איור 5.33 - אוליגומיצין A - מעכב של סינתאז ATP
איור 5.34 - 2,4 DNP - מפרק של בקרת נשימה
449
בתאים עם צימוד הדוק
שימוש ב- O2 תלוי בחילוף החומרים רמות
NAD+ משתנות עם פעילות גופנית שיפוע
פרוטון גבוה ללא פעילות גופנית
קטבוליזם תלוי בצרכי האנרגיה
ETS פועל כאשר OxPhos פועל ולהיפך
בתאים שאינם מקושרים
O2 משתמש ברמות
NAD+ גבוהות גבוהות שיפוע פרוטון
קטן או ללא
קטבוליזם
OXPHOS גבוה אינו פועל, אך ETS פועל במהירות
הרצאות ביוטיוב
מאת קווין
כאן & כאן
450
451
איור 5.35 - אוקסידאז אלטרנטיבי (AOX) של פטריות, צמחים ופרוטוזואה עוקף חלק מהובלת האלקטרונים על ידי לקיחת אלקטרונים מ-CoQ והעברתם לחמצן.
452
איור 5.36 - מבנה של רדיקל חופשי מחמצן
ויקיפדיה
נאף + 2O2
נאדפ+ + 2O2− + שעות +
איור 5.37 - שלושה מקורות למיני חמצן תגובתיים (ROS) בתאים
ויקיפדיה
453
454
הרצאות ביוטיוב
מאת קווין
כאן & כאן
איור 5.38 רדיקל הידרוקסיל
ויקיפדיה
455
גלוטתיון מופחת (GSH) +H2O2
גלוטתיון מחומצן (GSSG) + H2O
איור 5.40 - ניקוי רעלים של מיני חמצן תגובתיים
איור 5.39 - קטלאז
456
1. O2- + אנזים-Cu ++
O2 + אנזים-Cu+
2. O2- + אנזים-Cu+ + 2H+
H2O2 + אנזים-Cu++
איור 5.41 - SOD2 של בני אדם
איור 5.42 3 - יון פרוקסיניטריט
איור 5.44 - SOD1 של בני אדם
ויקיפדיה
איור 5.45 - SOD3 של בני אדם
457
איור 5.43 - ההשפעות של פרוקסיניטריט על תאים מובילות לנמק או אפופטוזיס
ויקיפדיה
458
RH + או2 + נאף + H+
רוה+ ח2או+נאפ +
459
איור 5.46 - ציטוכרום c עם קבוצת ההם שלו
460
הרצאות ביוטיוב
מאת קווין
כאן & כאן
איור 5.47 - אשכול Fe2S2
איור 5.48 - תגובות חיזור עבור אשכולות Fe4S4
461
איור 5.49 - טירמין
איור 5.50 - פנתילאמין
462
איור 5.51 - גואנין ו-8-אוקסו-גואנין
איור 5.52 - זוג בסיסים אדנין-8-אוקסו-גואנין. dR = דאוקסיריבוז
463
איור 5.53 - מקורות נוגדי חמצון טובים
464
איור 5.55 - גלוטתיון מחומצן (GSSG) המחובר לקשר דיסולפיד
ויקיפדיה
איור 5.54 - מבנה גלוטתיון מופחת (GSH)
465
איור 5.56 - רזברטרול
הרצאות ביוטיוב
מאת קווין
כאן & כאן
466
תמונות גרפיות בספר זה היו תוצרים של עבודתם של כמה תלמידים מוכשרים. קישורים לדפי האינטרנט שלהם נמצאים למטה
לחץ כאן עבור
מרתה בייקר
דף אינטרנט
לחץ כאן עבור
של פר ג'ייקובסון
דף אינטרנט
לחץ כאן עבור
של אליה קים
דף אינטרנט
לחץ כאן עבור
של פנלופה אירווינג
דף אינטרנט
ערכת בעיות הקשורה לסעיף זה כאן
סיכום נקודה אחר נקודה של סעיף זה כאן
לקבלת תעודה לשליטה בחלק זה של הספר, לחץ כאן
קורסי iTunes U בחינם של קווין אהרן - בית ספר בסיסי/רפואה/מתקדם
ביוכימיה חינם וקל (הספר האחר שלנו) כאה/עמוד פייסבוק
המדריך של קווין ואינדירה לכניסה לבית הספר לרפואה - קורס U של iTunes /ספר
כדי לראות קורסים בקמפוס OSU של קווין אהרן - BB 350/BB 450/BB 451
להרשמה לקורסי קמפוס OSU של קווין אהרן - BB 350 /BB 450/BB 451
ביוכימיה חינם לכל עמוד הפייסבוק (אנא עשו לנו לייק)
דף האינטרנט של קווין אהרן/עמוד הפייסבוק/דף האינטרנט של טרלין טאן
ההורדות החינמיות של קווין אהרן כאן
התוכנית לביוכימיה/ביופיזיקה של OSU כאן
המכללה למדעים של OSU כאן
אוניברסיטת אורגון סטייט כאן
שלח דוא"ל לקווין אהרן/אינדירה רג'גופל/טרלין טאן
אני מיטוכונדריון קטן
שנותן לך אנרגיה
אני משתמש בשיפוע הפרוטונים שלי
כדי ליצור את ה-ATPs
הוא מיטוכונדריון קטן
שנותן לנו אנרגיה
הוא משתמש בשיפועי פרוטונים
כדי לגרום לכמה ATPs
אלקטרונים לזרום דרך קומפלקס II
לשוטר התנועה Co-Q
בכל פעם שהם מגיעים לשם
ב-FADH-שני אלקטרונים זורמים דרך מתחם II
לשוטר התנועה Co-Q
בכל פעם שהם מגיעים לשם ב-
FADH-2
מחובר היטב הוא המצב שלי
אלא אם כן אני מקבל חור
שנוצר בממברנה שלי על ידי
איזה די-ני-טרו-פה-נול
כן מצמידים היטב הוא מצבו
אלא אם כן הוא מקבל חור
שנוצר בממברנה שלו על ידי
איזה די-ני-טרו-פנול
גם רוטנון וגם
ציאניד עצור את זרימת האלקטרונים שלי ועצור את החישוב של יחס ה- "P" ל- "O" שלי
הקלטה מאת טים קרפלוס
מילים על ידי קווין אהרן
הקלטה על ידי טים Karplus מילים על ידי קווין אהרן
אני מיטוכונדריון קטן
למנגינה של "אני חוטב עצים"
אתר מנגינות מטבוליות כאן
במסלולים הקטבוליים שהתאים שלנו משתמשים
בחמצון עוזרים ליצור את ה- ATP
בזמן שהם מורידים את האנרגיה החופשית של גיבס הודות לאנטלפיה
אם מצע הופך מאלכוהול
לאלדהיד או קטון זה ברור האלקטרונים
האלה לא נעלמים
הם פשוט מסדרים מחדש - מוזר מאוד
N-A-D נמצא באוזניי ובעיניים שלי עוזר לחפרפרת
להתחמצן עושה N-A-D-H אז
והאחרון הוא בעיה אנאירובית
'כי הצטברות השרירים שלו שונאים
הם מגיבים באמצעות פירובט
כדי לייצר לקטט
זרז חיוני לתאים לחיות
אז האנזימים תופסים את המצעים שלהם בשקיקה
אם הם נקשרים עם זיקה גבוהה
Low Km אתה רואה, בדיוק כמו שאני
N-A-D נמצא באוזניי ובעיני עוזר ל-mol-e-cules להתחמצן מה שהופך N-A-D-H אז
נ-א-ד
למנגינה של "פני ליין"
אתר מנגינות מטבוליות כאן
הוקלט על ידי טים קרפלוס
מילים על ידי קווין אהרן
הוקלט על ידי טים Karplus מילים על ידי קווין אהרן
כאשר האלקטרונים של החמצן כולם במצב מאוזן
יש שתים עשרה מהם עבור הו שתיים. המולקולה נהדרת
אך לפעמים מתרחשות בעיות בדרך למתחם IV
יצירת מינים תגובתיים שהתא לא יכול להתעלם מהם
הו סופראוקסיד דיסמוטאז הוא סופר קטליטי
שמירה על תאים מלהיות פרוקסיניטריטיים מאוד
מהיר יותר מרדיקל, פעולותיו נהדרות
סופראוקסיד דיסמוטאז הוא סופר קטליטי
אנזים, אנזים עמוק בפנים
חסימת כל התחמוצות הרעות
היתרון העיקרי של האנזים הוא שהוא לא צריך לחכות
על ידי קשירת סופראוקסיד במצב כמעט מעבר
זה הופך אותו לחמצן במנגנון אחד
הפקת "h שתיים הו שתיים" כאשר המחזור נעשה
הו סופראוקסיד דיסמוטאז אתה מהיר יותר מכולם
יש לך את היחס הגבוה ביותר של kcat מעל KM
המשמעות היא שסופראוקסיד לא יכול לגרום ליותר מדי מהומה
סופראוקסיד דיסמוטאז מהיר יותר מכולם
סופראוקסיד דיסמוטאז
עצירת הדרכים של סופראוקסיד
האנזים הוא כמו כדור פינג-פונג בצורה מכנית
מקפץ בין שני מצבי נחושת, פלוס אחד ושניים שאתה רואה
אז S-O-D מתנהג בדיוק כמו נוגד חמצון
מתן הגנה רבה ככל שתא יכול לרצות אי פעם
הו סופראוקסיד דיסמוטאז, התא מאוהב בך
כי אתה נותן להובלת אלקטרונים לעשות את מה שהיא חייבת לעשות
ללא הצטברות של רדיקל הו שניים
סופראוקסיד דיסמוטאז - בגלל זה תא אוהב אותך
סופראוקסיד דיסמוטאז
למנגינה של "סופרקליפראגיליסטיאקספליסטי"
אתר מנגינות מטבוליות כאן
מילים על ידי קווין אהרן
עדיין אין הקלטה לשיר הזה


