5.1: יסודות האנרגיה
- Page ID
- 207634
מקור: ביוכימפה _5_1.pdf. ספר הלימוד כולו זמין בחינם מהמחברים בכתובת http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy

אורגניזמים חיים מורכבים מתאים, והתאים מכילים עדר של רכיבים ביוכימיים. תאים חיים, לעומת זאת, אינם אוספים אקראיים של מולקולות אלה. הם מאורגנים בצורה יוצאת דופן או "מסודרים". לעומת זאת, בעולם הלא-חי, קיימת נטייה אוניברסלית להגברת ההפרעה. שמירה ויצירת סדר בתאים לוקחת את קלט האנרגיה. ללא אנרגיה, החיים אינם אפשריים.
אנרגיה חמצונית
המנגנון העיקרי המשמש אורגניזמים שאינם פוטוסינתטיים להשגת אנרגיה הוא חמצון ופחמן הוא מקור האנרגיה המחומצן הנפוץ ביותר. האנרגיה המשתחררת במהלך שלבי החמצון "נלכדת" ב- ATP וניתן להשתמש בה מאוחר יותר לצימוד אנרגיה. ככל שאטום פחמן מופחת יותר, כך ניתן לממש יותר אנרגיה מחמצון שלו. חומצות שומן מופחתות מאוד, ואילו הפחמימות הן בינוניות. חמצון מלא של שניהם מוביל לפחמן דו חמצני, בעל מצב האנרגיה הנמוך ביותר. לעומת זאת, ככל שאטום פחמן מחומצן יותר, כך נדרש יותר אנרגיה כדי להפחית אותו.
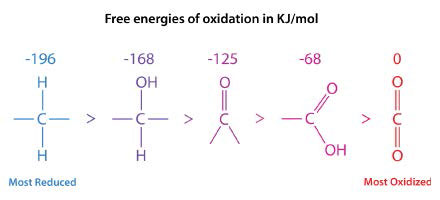
בסדרה המוצגת באיור\(\PageIndex{1}\), הצורה המופחתת ביותר של פחמן נמצאת בצד שמאל. אנרגיית החמצון של כל צורה מוצגת מעליה. ניתן לראות את מצבי ההפחתה של חומצות שומן ופחמימות על ידי הנוסחאות שלהם.
- חומצה פלמיטית: \(\ce{C16H34O2}\)
- גלוקוז: \(\ce{C6H12O6}\)
חומצה פלמיטית מכילה רק שני חמצן לכל שש עשרה פחמנים, ואילו לגלוקוז יש שישה אטומי חמצן לכל שישה פחמנים. כתוצאה מכך, כאשר חומצה פלמיטית מתחמצנת במלואה, היא מייצרת יותר ATP לפחמן (128/16) מאשר גלוקוז (38/6). בגלל זה אנו משתמשים בשומן (מכיל חומצות שומן) כחומר אחסון האנרגיה העיקרי שלנו.
איור \(\PageIndex{2}\): פוטוסינתזה: המקור העיקרי לאנרגיה ביולוגית. תמונה על ידי אליה קים
חמצון לעומת הפחתה בחילוף החומרים
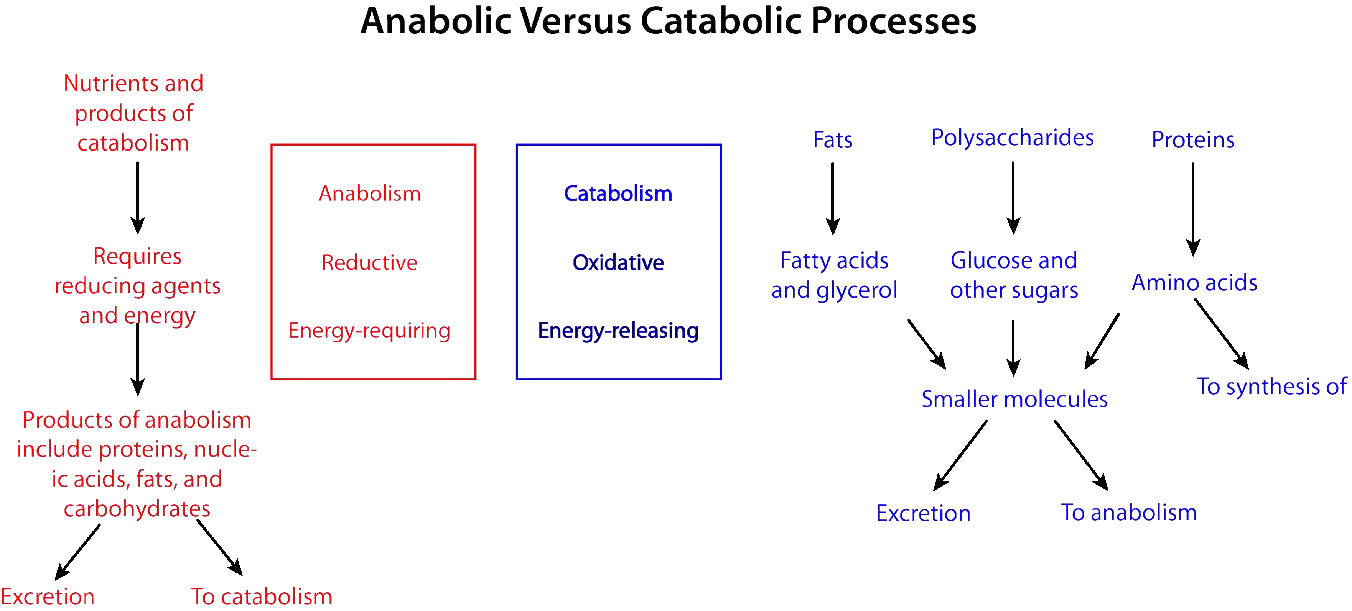
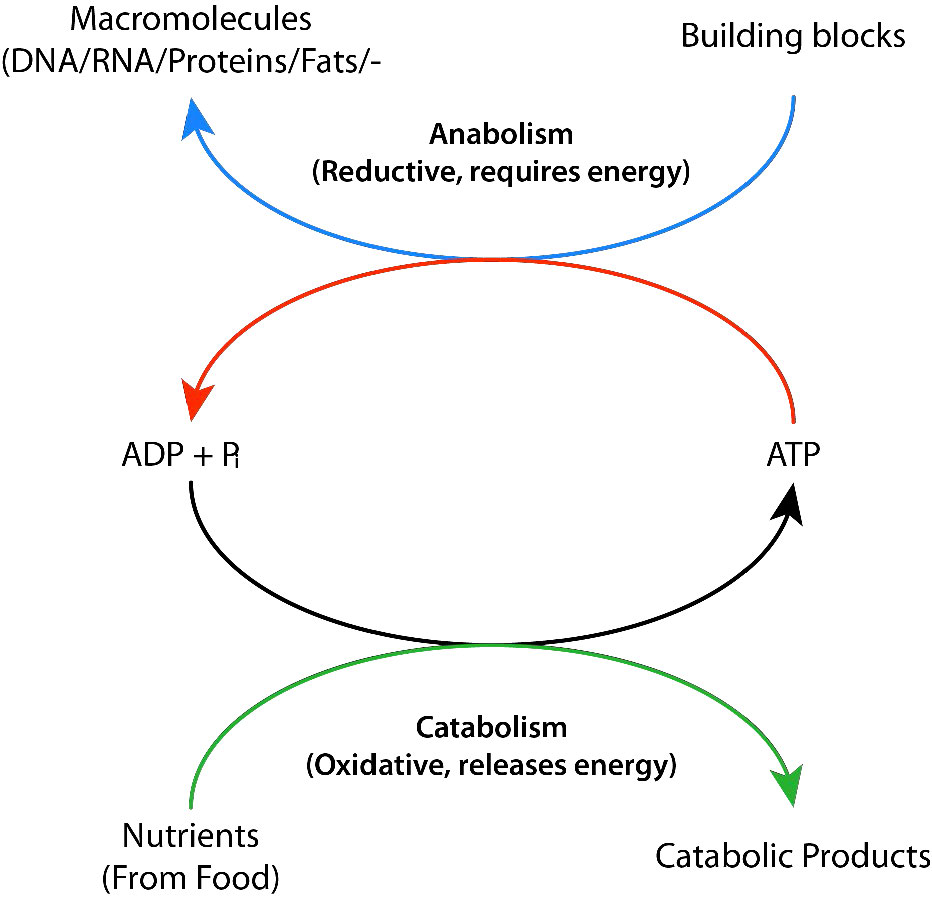
תהליכים ביוכימיים המפרקים דברים מגדולים לקטנים יותר נקראים תהליכים קטבוליים. תהליכים קטבוליים הם לרוב חמצוניים באופיים ומשחררים אנרגיה. חלק מהאנרגיה הזו, אך לא כולה, נלכדת כ- ATP. אם לא כל האנרגיה נלכדת כ- ATP, מה קורה לשאר זה? התשובה היא פשוטה. הוא משתחרר כחום ומסיבה זו אנו מתחממים כשאנחנו מתאמנים.
לעומת זאת, סינתזה של מולקולות גדולות מקטנות יותר (למשל, יצירת חלבונים מחומצות אמינו) מכונה אנבוליזם. תהליכים אנבוליים הם לרוב רדוקטיביים באופיים (איורים 5.3 ו- 5.4) ודורשים הזנת אנרגיה. כשלעצמם, הם לא היו מתרחשים, מכיוון שהם הופכים את החמצון ומפחיתים את האנטרופיה (הופכים דברים קטנים רבים לגדול יותר). כדי להתגבר על מחסום אנרגיה זה, התאים חייבים להוציא אנרגיה. לדוגמה, אם רוצים להפחית \(\ce{CO2}\) לפחמימות, יש להשתמש באנרגיה לשם כך. צמחים עושים זאת במהלך התגובות האפלות של הפוטוסינתזה (איור\(\PageIndex{3}\)). מקור האנרגיה להפחתה הוא בסופו של דבר השמש. האלקטרונים להפחתה מגיעים ממים, וה \(\ce{CO2}\) מוסר מהאטמוספירה ומשתלב בסוכר.
צימוד אנרגיה
הסינתזה של המולקולות הרבות הדרושות לתאים זקוקה לקלט האנרגיה כדי להתרחש. תאים מתגברים על מכשול אנרגיה זה באמצעות ATP כדי "להניע" את התגובה (איור\(\PageIndex{6}\)). האנרגיה הדרושה להנעת תגובות נקצרת בתנאים מבוקרים מאוד באנזימים. זה כרוך בתהליך שנקרא 'צימוד'. תגובות מצמדות מסתמכות על קישור תגובה חיובית מבחינה אנרגטית (כלומר, אחת עם ∆G° שלילי) עם התגובה הדורשת קלט אנרגיה, שיש לה ∆G° חיובי. כל עוד ∆G °' הכולל של שתי התגובות יחד הוא שלילי, התגובה יכולה להמשיך. הידרוליזה של ATP היא תגובה חיובית מאוד מבחינה אנרגטית המקושרת בדרך כלל לאנרגיה רבה הדורשת תגובות בתאים. ללא הידרוליזה של ATP (או GTP, במקרים מסוימים), התגובה לא תהיה ריאלית.
אנטרופיה ואנרגיה
רוב התלמידים שעברו כימיה מסוימת יודעים על החוק השני של התרמודינמיקה ביחס להפרעה גוברת במערכת. תאים הם מבנים מאוד מאורגנים או מסודרים, מה שמוביל כמה להסיק בטעות שהחיים איכשהו מפרים את החוק השני. למעשה, הרעיון הזה אינו נכון. החוק השני לא אומר שהאנטרופיה תמיד עולה, רק שאם נותר לבד, היא נוטה לעשות זאת, במערכת מבודדת. עם זאת, תאים אינם מערכות מבודדות בכך שהם מקבלים אנרגיה, לא מהשמש, אם הם אוטוטרופיים, או מזון, אם הם הטרוטרופיים.
כדי להתמודד עם הנטייה האוניברסלית לאי סדר בקנה מידה מקומי דורש אנרגיה. כדוגמה, קח חפיסת קלפים חדשה אשר מיושרת בצורה מסודרת עם אייס-קינג-קווין.... 4,3,2 לכל חליפה. לזרוק את הסיפון לאוויר, לתת את הקלפים להתפזר. כאשר אתה מרים אותם, הם יהיו יותר מופרעים מאשר כאשר הם התחילו. עם זאת, אם אתה מבלה כמה דקות (ומוציא מעט אנרגיה), אתה יכול לארגן מחדש את אותו סיפון בחזרה למצבו הקודם והמאורגן. אם האנטרופיה תמיד גדלה בכל מקום, לא היית יכול לעשות זאת. עם זאת, עם קלט האנרגיה, התגברת על ההפרעה. זה ממחיש מושג חשוב: עלות הלחימה בהפרעה היא אנרגיה.
אנרגיה ביולוגית
ישנן, כמובן, סיבות אחרות לכך שאורגניזמים זקוקים לאנרגיה. התכווצות שרירים, סינתזה של מולקולות, העברה עצבית, איתות, ויסות תרמי ותנועות תת-תאיות הן דוגמאות. מאיפה האנרגיה הזו מגיעה? מטבעות האנרגיה הם בדרך כלל מולקולות המכילות פוספט עתיר אנרגיה. ATP הוא הידוע והשופע ביותר, אך GTP הוא גם מקור אנרגיה חשוב (מקור אנרגיה לסינתזת חלבונים). CTP מעורב בסינתזה של גליצרופוספוליפידים ו- UTP משמש לסינתזה של גליקוגן ותרכובות סוכר אחרות. בכל אחד מהמקרים הללו האנרגיה היא בצורה של אנרגיה כימית פוטנציאלית המאוחסנת בקשרים הרב-פוספטים. הידרוליזה של קשרים אלה משחררת את האנרגיה בהם.
מבין הטריפוספטים, ATP הוא מקור האנרגיה העיקרי, הפועל להקל על הסינתזה של האחרים על ידי פעולת האנזים NDPK. ATP מיוצר על ידי שלושה סוגים שונים של זרחון - זרחון חמצוני (במיטוכונדריה), פוטופוספורילציה (בכלורופלסטים של צמחים) וזרחון ברמת המצע (בתגובות מזורזות אנזימטית).
אנרגיה חופשית של גיבס בביולוגיה
ATP נחשב בדרך כלל ל"סוללת האחסון "של תאים (ראה גם 'גיבויים של סוללות מולקולריות לשרירים כאן). על מנת להבין כיצד נלכדת אנרגיה, עלינו להבין תחילה את האנרגיה החופשית של גיבס ובכך אנו מתחילים לראות את תפקיד האנרגיה בקביעת הכיוונים שהתגובות הכימיות לוקחות.
ניתן לחשוב על אנרגיה חופשית של גיבס כאנרגיה הזמינה לעבודה במערכת תרמודינמית בטמפרטורה ולחץ קבועים. מבחינה מתמטית, האנרגיה החופשית של גיבס ניתנת כ:
\[G = H – TS\]
איפה \(H\) האנטלפיה, \(T\) היא הטמפרטורה בקלווין, \(S\) והיא האנטרופיה. בטמפרטורה ולחץ סטנדרטיים, כל מערכת מבקשת להשיג מינימום אנרגיה חופשית. לפיכך, הגדלת האנטרופיה,\(S\), תפחית את האנרגיה החופשית של גיבס. באופן דומה, אם עודף חום זמין (הפחתת האנטלפיה,\(H\)), ניתן גם להפחית את האנרגיה החופשית.
תאים חייבים לפעול במסגרת חוקי התרמודינמיקה, כאמור, כך שגם כל התגובות הביוכימיות שלהם נשלטות על ידי חוקים אלה. עכשיו נשקול אנרגיה בתא. השינוי באנרגיה החופשית של גיבס (\(∆G\)) לתגובה הוא קריטי, שכן הוא, והוא לבדו, קובע אם תגובה מתקדמת או לא.
\[∆G = ∆H – T ∆S.\]
ישנם שלושה מקרים
- ∆G < 0: התגובה ממשיכה כפי שנכתב
- ∆G = 0: התגובה נמצאת בשיווי משקל
- ∆G > 0: התגובה פועלת הפוך
לתגובה
\[\ce{aA <=> bB}\]
(כאשר 'a' ו- 'b' הם מספרים שלמים ו- A ו- B הם מולקולות) ב- pH 7, ניתן לקבוע ∆G על ידי המשוואה הבאה,
\[∆G = ∆G°’ + RT \ln(\frac{[B]^b}{[A]^a})\]
לתגובות מצע מרובות, כגון
\[\ce{aA + cC <=> bB + dD}\]
\[∆G = ∆G°’ + RT \ln(\frac{[B]^b [D]^d}{[A]^a[C]^c})\]
המונח ∆G° נקרא השינוי באנרגיה החופשית הסטנדרטית של גיבס, שהוא השינוי באנרגיה המתרחש כאשר כל המוצרים והמגיבים נמצאים בתנאים סטנדרטיים וה- pH הוא 7.0. זה קבוע לתגובה נתונה.
במילים פשוטות, אנו יכולים לאסוף את כל מונחי המונה יחד ולקרוא להם {מוצרים} וכל מונחי המכנה יחד ולקרוא להם {מגיבים},
\[∆G = ∆G°’ + RT \ln(\frac{\rm{\{Products\}}}{\rm{\{Reactants\}}})\]
עבור רוב המערכות הביולוגיות, הטמפרטורה, T, היא קבועה לתגובה נתונה. מכיוון ש- ∆G °' הוא גם קבוע לתגובה נתונה, ה-∆G משתנה כמעט אך ורק כאשר היחס בין {Products}/{מגיבים} משתנה.
החשיבות של ∆G °'
אם מתחילים בתנאים סטנדרטיים, שבהם הכל מלבד פרוטונים נמצא ב-1M, המונח rTLN ({Products}/{Reactants}) הוא אפס, כך שהמונח ∆G° שווה ל-∆G, וה-∆G °' קובע את כיוון התגובה תיקח (רק בתנאים אלה). זו הסיבה שאנשים אומרים ש- ∆G° שלילי מצביע על תגובה חיובית מבחינה אנרגטית, ואילו ∆G° חיובי מתאים לתגובה שלילית.
הגדלת היחס בין {Products}/{מגיבים} גורמת לערך המונח הטבעי (ln) להיות חיובי יותר (פחות שלילי), ובכך הופך את הערך של ∆G לחיובי יותר. לעומת זאת, ככל שהיחס בין {Products}/{מגיבים} יורד, הערך של מונח היומן הטבעי הופך פחות חיובי (שלילי יותר), ובכך הופך את הערך של ∆G לשלילי יותר.
תגובת מערכת ללחץ
באופן אינטואיטיבי, זה הגיוני ועולה בקנה אחד עם העיקרון של לה שאטלייה - מערכת מגיבה ללחץ על ידי פעולה להפגת הלחץ. אם נבחן את ∆G לתגובה במערכת סגורה, נראה שהוא תמיד יעבור לערך של אפס (שיווי משקל), לא משנה אם הוא מתחיל בערך חיובי או שלילי.
סוג אחר של אנרגיה חופשית הזמינה לתאים הוא זה שנוצר על ידי פוטנציאל חשמלי. לדוגמה, מיטוכונדריה וכלורופלסטים משתמשים בחלקם באנרגיה קולומבית (המבוססת על מטען) משיפוע פרוטונים על פני הממברנות שלהם כדי לספק את האנרגיה הדרושה לסינתזה של ATP. אנרגיות דומות מניעות את העברת אותות העצבים (שיפועי נתרן ואשלגן) ואת התנועה של כמה מולקולות בתהליכי הובלה פעילים משניים על פני ממברנות (למשל, H+ דיפרנציאל המניע את תנועת הלקטוז). ממשוואת שינוי האנרגיה החופשית של גיבס,
\[∆G = ∆H – T∆S\]
יש לציין כי עלייה באנטרופיה תסייע לתרום לירידה ב- ∆G זה קורה, למשל כאשר מולקולה גדולה מתפרקת לחתיכות קטנות יותר או כאשר סידור מחדש של מולקולה מגביר את הפרעת המולקולות סביבה. המצב האחרון מתעורר באפקט ההידרופובי, המסייע להניע את קיפול החלבונים.
פוטנציאל כימי וחשמלי
הוא אמר כי היעדרות עושה את הלב לגדול יותר. לא נתמודד עם הנושא הפילוסופי הזה כאן, אבל נגיד שהפרדה מספקת אנרגיה פוטנציאלית שתאים יכולים לקצור. דו שכבת השומנים של התא ו (בתאים אוקריוטיים) ממברנות האברון מספקות את המחסום הדרוש להפרדה.
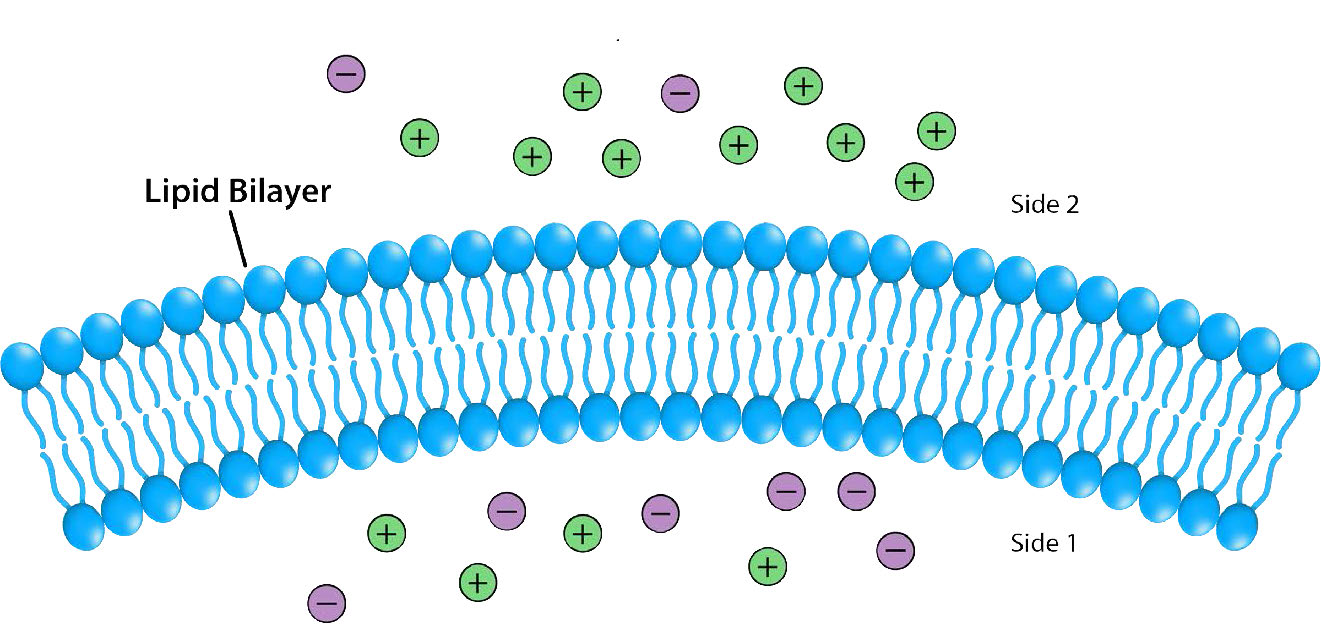
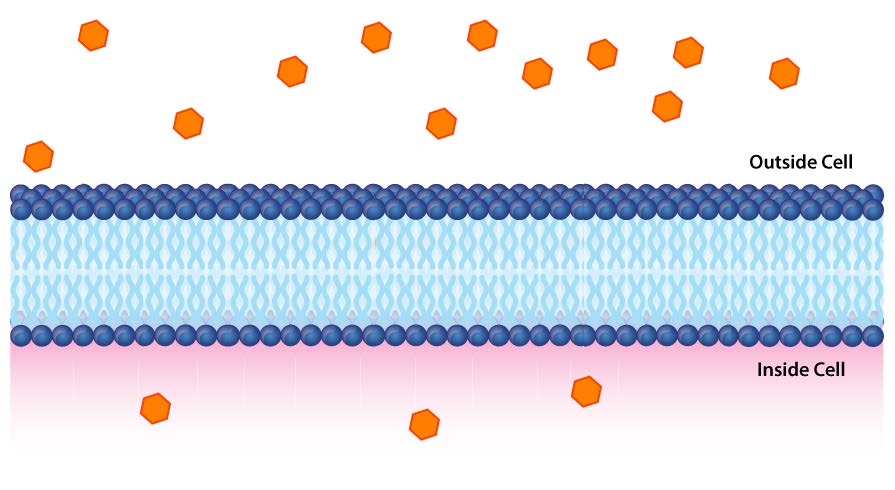
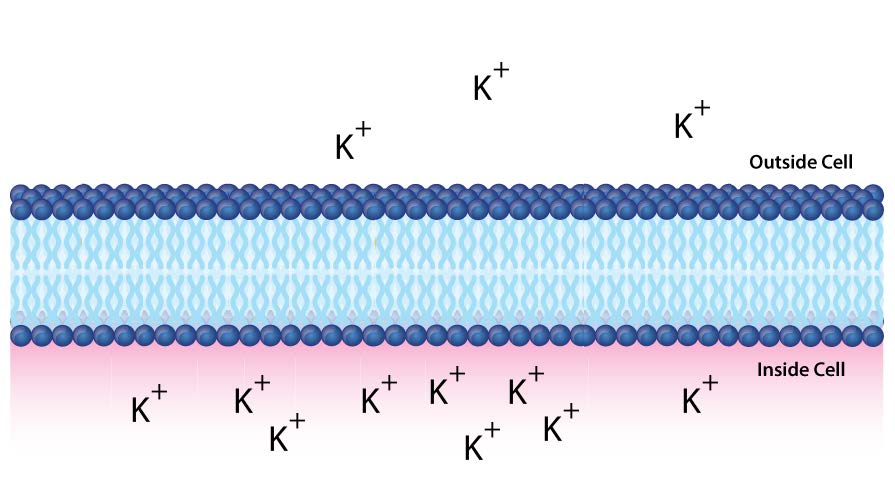
בלתי חדיר לרוב היונים והתרכובות הקוטביות, ממברנות ביולוגיות חיוניות לתהליכים המייצרים אנרגיה תאית. שקול איור 5.8. דו שכבה שומנית מפרידה בין שתי תמיסות בריכוזים שונים של מומס. יש ריכוז גדול יותר של יונים שליליים בתחתית וריכוז גדול יותר של יונים חיוביים בחלק העליון.
בכל פעם שיש הבדל בריכוז המולקולות על פני קרום, אומרים שיש שיפוע ריכוז על פניו. הבדל בריכוז היונים על פני קרום יוצר גם שיפוע מטען (או חשמלי). מכיוון שיש הבדל הן בריכוז הכימי של היונים והן במטען משני צידי הממברנה, זה מתואר כשיפוע אלקטרוכימי (איורים 5.8 -5.10).
אנרגיה פוטנציאלית
שיפועים כאלה מתפקדים כמו סוללות ומכילים אנרגיה פוטנציאלית. כאשר האנרגיה הפוטנציאלית נקצרת על ידי תאים, הם יכולים ליצור ATP, להעביר אותות עצביים, לשאוב מולקולות על פני ממברנות ועוד. חשוב אפוא להבין כיצד לחשב את האנרגיה הפוטנציאלית של שיפועים אלקטרוכימיים.
ראשית, אנו רואים שיפועים כימיים (מומסים). באיור 5.9, שני ריכוזי גלוקוז מופרדים על ידי דו שכבה שומנית. נניח ש-C2 הוא ריכוז הגלוקוז בתוך התא (למטה) ו-C1 להיות ריכוז הגלוקוז בחוץ (למעלה). האנרגיה החופשית של גיבס הקשורה להזזת גלוקוז לכיוון C2 (לתוך התא) ניתנת על ידי
∆G = RTLN [ג2/ג1]
כדי להזיז אותו לכיוון C1 (לחלק החיצוני של התא) הביטוי יהיה
\[∆G = RT\ln[C_1/C_2]\]
מכיוון ש-C2 קטן מ-C1 (כלומר, יש פחות מולקולות גלוקוז בתוך התא) אז ה-∆G הוא שלילי והדיפוזיה תהיה מועדפת לתוך התא, אם הגלוקוז יכול לחצות את הדו-שכבה.
לעומת זאת, אם C2 היה גדול מ-C1 (יותר גלוקוז היה בתא מאשר בחוץ) ה-∆G יהיה חיובי, כך שתנועה לכיוון C2 לא תהיה מועדפת ובמקום זאת הגלוקוז נוטה לנוע לכיוון C1, כלומר מחוץ לתא.
אם ג2 = ג1, עם אותו ריכוז גלוקוז בפנים ובחוץ, אז ה- ∆G יהיה אפס ולא תהיה תנועה נטו, מכיוון שהמערכת תהיה בשיווי משקל.
בדוגמה לעיל, שקלנו גלוקוז, שהוא מולקולה לא טעונה. כאשר מעורבים יונים, יש לקחת בחשבון גם את המטענים שלהם. איור \(\PageIndex{1}\) 0 מתאר מצב דומה על פני דו שכבה שומנית. במקרה זה, קיים הבדל של ריכוז ומטען. יש יותר מטענים חיוביים בתוך התא מאשר בחוץ.
שימוש ב-C2 כדי לציין את ריכוז החומרים בתוך התא ו-C1 לריכוז מחוץ לתא (כמו קודם), אז האנרגיה החופשית לתנועה של יון מלמעלה למטה ניתנת על ידי המשוואה הבאה
\[∆G = RT\ln[C_2/C_1] + ZF∆ψ\]
שים לב כאן שמשוואה זו חייבת לקחת בחשבון הן את הפרשי הריכוז והן את הפרשי המטען. Z מתייחס למטען של המינים המועברים, F הוא קבוע פאראדיי (96,485 קולומבים/מול), ו ∆ψ הוא הפרש הפוטנציאל החשמלי (הפרש המתח) על פני הממברנה.
אם היינו מחשבים את ∆G לתנועה של יון האשלגן מלמעלה למטה, זה יהיה חיובי, שכן [C2/C1] גדול מ-1 (מה שהופך למונח ln חיובי), וה-ZF∆ψ חיובי מכיוון שיונים טעונים חיוביים (Z) נעים כנגד שיפוע מטען חיובי הניתן על ידי ∆ψ (ריכוז גדול יותר ביעד (למטה) מנקודת ההתחלה (למעלה)). אם היינו מחשבים את ריכוז היונים הנעים מלמטה למעלה, אז המונח ln יהיה שלילי (ג2<ג1) וגם ה-ZF∆ψ יהיה שלילי (Z=חיובי, אבל ∆ψ שלילי).
פוטנציאל הפחתה
בדיון על פוטנציאל כימי, עלינו לשקול גם פוטנציאל הפחתה. פוטנציאל הפחתה מודד את הנטייה של כימיקל להיות מופחת על ידי אלקטרונים. זה מיועד גם על ידי מספר שמות/משתנים אחרים. אלה כוללים פוטנציאל חיזור, פוטנציאל חמצון/הפחתה, ORP, pE, ε, E ו- Eh.
פוטנציאל ההפחתה נמדד בוולט, או במיליוולט. לחומר בעל פוטנציאל הפחתה גבוה יותר תהיה נטייה גדולה יותר לקבל אלקטרונים ולהצטמצם. אם מערבבים שני חומרים בתמיסה מימית, זה עם פוטנציאל ההפחתה הגדול יותר (החיובי יותר) נוטה להרחיק אלקטרונים ובכך להיות מופחת מזה עם פוטנציאל ההפחתה הנמוך יותר, שמתחמצן.
מדדים יחסיים
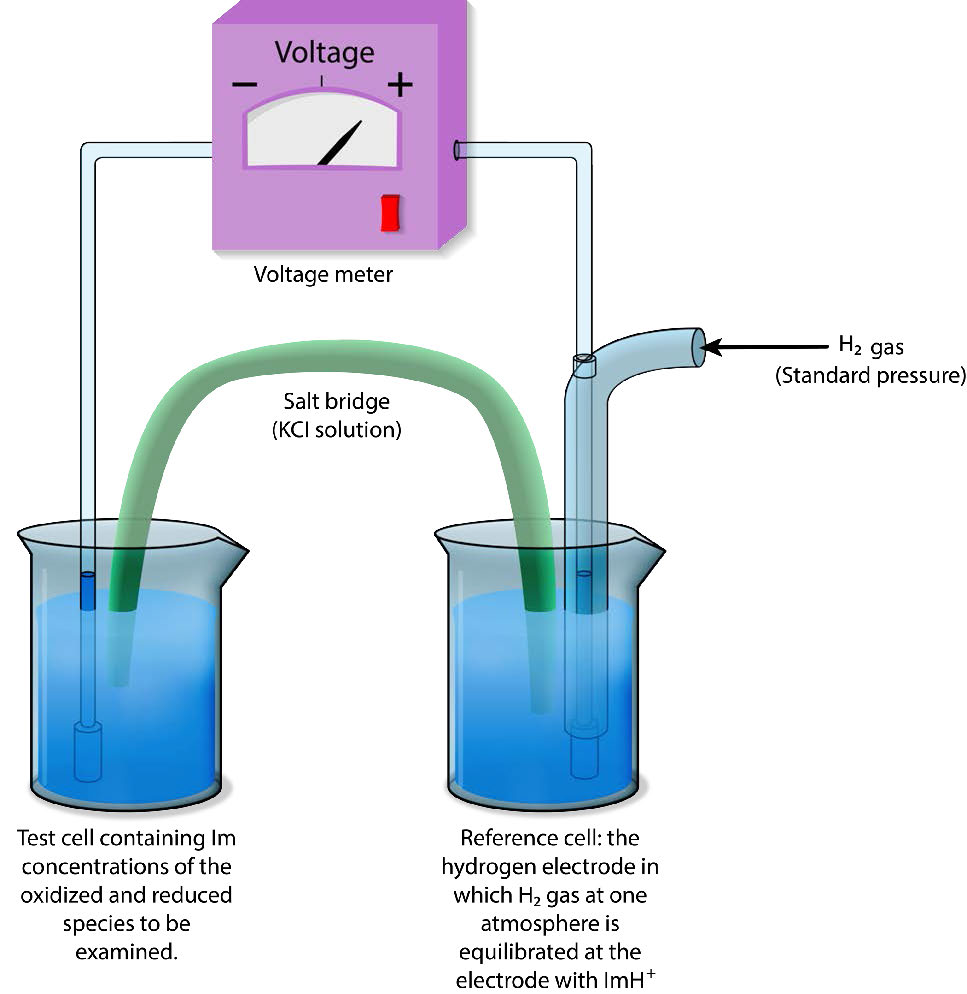
קשה למדוד פוטנציאל הפחתה מוחלט, ולכן פוטנציאל הפחתה מוגדר בדרך כלל ביחס לאלקטרודת ייחוס. בתמיסות מימיות, פוטנציאל ההפחתה נמדד כהבדל הפוטנציאלי בין אלקטרודת חישה אינרטית (בדרך כלל פלטינה) במגע עם תמיסת הבדיקה לבין אלקטרודת ייחוס יציבה (נמדדת כאלקטרודת מימן סטנדרטית: SHE) כפי שמוצג באיור \(\PageIndex{1}\) 1. תקן ההתייחסות למדידה הוא חצי התגובה
H + ה — → ½ ח 2
האלקטרודה שבה מתרחשת תגובה זו (המכונה חצי תא) ניתנת הערך של E° (פוטנציאל הפחתה סטנדרטי) של 0.00 וולט. אלקטרודת המימן מחוברת באמצעות מעגל חיצוני לחצי תא נוסף המכיל תערובת של המינים המופחתים והמחומצנים של מולקולה אחרת (לדוגמה, Fe ++ ו- Fe +++) ב-1M כל אחד ותנאי טמפרטורה סטנדרטיים (25° C) ולחץ (אטמוספרה אחת).
כיוון ומתח נמדד
לאחר מכן נמדדים הכיוון והגודל של תנועת האלקטרונים. אם תערובת הבדיקה לוקחת אלקטרונים מאלקטרודת המימן, סימן המתח חיובי ואם הכיוון הפוך, המתח שלילי.
לפיכך, תרכובות בעלות זיקה גדולה יותר לאלקטרונים מאשר מימן ירשמו מתח חיובי ומתחים שליליים תואמים לתרכובות בעלות זיקה פחותה לאלקטרונים מאשר מימן.
תנועה של אלקטרונים
בתנאים סטנדרטיים, אלקטרונים יעברו מתרכובות המייצרות מתח נמוך יותר לאלו שיוצרות מתח גבוה יותר (חיובי יותר). כשם ששינוי האנרגיה החופשית הסטנדרטי של גיבס הוא שינוי האנרגיה החופשית של גיבס בתנאים סטנדרטיים, כך גם פוטנציאל ההפחתה הסטנדרטי E° פוטנציאל ההפחתה E בתנאים סטנדרטיים.
פוטנציאל ההפחתה בפועל של חצי תא ישתנה עם הריכוז של כל מין כימי בתא. הקשר בין פוטנציאל ההפחתה E ופוטנציאל ההפחתה הסטנדרטי E° ניתן על ידי המשוואה הבאה (נקראת גם משוואת נרנסט)
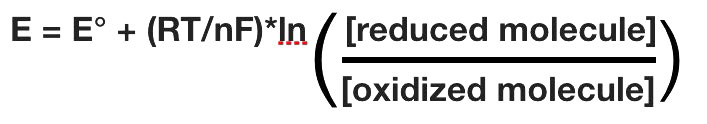
כאשר F הוא קבוע פאראדיי (96,480 J/ (וולט*שומות), R הוא קבוע הגז (8.315 J/ (שומות*K), n הוא מספר השומות של האלקטרונים המועברים, ו- T היא הטמפרטורה המוחלטת בקלווין.
בטמפרטורה של 25 מעלות צלזיוס, משוואה זו הופכת
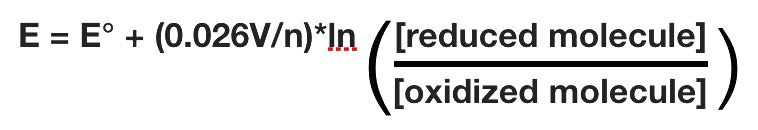
באשר לאנרגיה החופשית של גיבס, כדאי למדוד ערכים בתנאים המצויים בתאים. המשמעות היא ביצוע מדידות ב- pH = 7, השונה מכך שיש את כל המינים ב- 1M.
התאמה
בגלל התאמה זו, מוגדר פוטנציאל הפחתה סטנדרטי שונה במקצת ואנו מייעדים אותו לפי E °', בדיוק כפי שהגדרנו שינוי אנרגיה חופשית סטנדרטית מיוחדת של גיבס ב-pH 7 כ-ΔG °'.
קיים קשר בין השינוי באנרגיה החופשית של גיבס ΔG לבין השינוי בפוטנציאל ההפחתה (ΔE). זה
\[ΔG = -nFΔE\]
באופן דומה, הקשר בין השינוי באנרגיה החופשית הסטנדרטית של גיבס לבין השינוי בפוטנציאל ההפחתה הסטנדרטי הוא
\] ΔG °' = -nfΔה°'\]
אחסון אנרגיה בטריפוספטים
סרט 5.1: ATP: הדלק של התא
היווצרות טריפוספטים, כמו ATP, חיונית כדי לענות על צורכי האנרגיה של התא לסינתזה, תנועה ואיתות. ביום נתון, גוף אנושי ממוצע מייצר ומתפרק יותר ממשקלו בטריפוספטים. זה מדהים במיוחד בהתחשב בכך שיש רק כ 250 גרם של המולקולה נוכח בגוף בכל זמן נתון. אנרגיה ב- ATP משתחררת על ידי הידרוליזה של פוספט מהמולקולה.
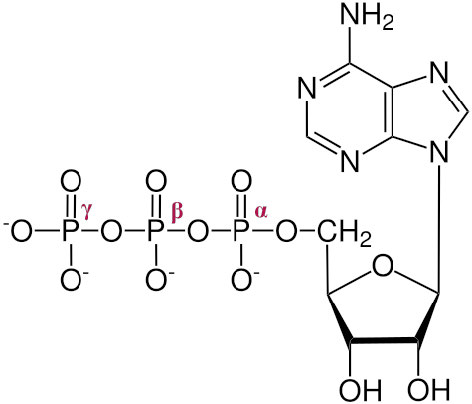
שלושת הפוספטים, המתחילים בזה הקרוב ביותר לסוכר מכונים α, β ו- γ (איור \(\PageIndex{1}\) 2). זהו הפוספט γ שנבקע בהידרוליזה והמוצר הוא ADP. בכמה תגובות, הקשר בין α ל- β נבקע. כאשר זה קורה, משתחרר פירופוספט (β המקושר ל- γ) ומיוצר AMP. תגובה אחרונה זו לייצור AMP משחררת יותר אנרגיה (ΔG°' = -45.6 kJ/mol) מהתגובה הראשונה המייצרת ADP (ΔG °' = -30.5 kJ/mol).
מכיוון שטריפוספטים הם ה"מטבע "העונים על הצרכים המיידיים של התא, חשוב להבין כיצד נוצרים טריפוספטים. ישנם שלושה מנגנוני זרחון - 1) רמת המצע; 2) חמצוני; ו 3) פוטופוספורילציה. אנו רואים אותם כאן בנפרד.
זרחון ברמת המצע
הסוג הקל ביותר של זרחון להבנה הוא זה המתרחש ברמת המצע. סוג זה של זרחון כולל סינתזה ישירה של ATP מ- ADP ותווך בעל אנרגיה גבוהה, בדרך כלל מולקולה המכילה פוספט. זרחון ברמת המצע הוא תורם מינורי יחסית לסינתזה הכוללת של טריפוספטים על ידי תאים. זרחון מצע לדוגמה מגיע מגליקוליזה.
פוספנולפירובט (PEP) + ADP פירובאט+ATP
לתגובה זו יש ∆G°' שלילי מאוד (-31.4 kJ/mol), מה שמצביע על כך שה-PEP מכיל יותר אנרגיה מ-ATP, ובכך נוטה להעדיף אנרגטית את הסינתזה של ATP. טריפוספטים אחרים יכולים להתבצע גם על ידי זרחון ברמת המצע. לדוגמה, GTP יכול להיות מסונתז על ידי התגובה הבאה של מחזור חומצת לימון.
סוקסיניל-CoA + תוצר +פי סוקסינאט +GTP + CoA-SH
ניתן להחליף טריפוספטים בקלות בזרחן ברמת המצע המזרז על ידי האנזים נוקלאוזיד דיפוספט קינאז (NDPK). צורה כללית של התגובות המזרזות על ידי אנזים זה היא כדלקמן:
XTP + YDP XD+YTP
כאשר X = אדנוסין, ציטידין, אורידין, תימידין או גואנוסין ו- Y יכולים להיות גם כל אחד מאלה. יתר על כן, XTP ו- YDP יכולים להיות גם כל אחד מהדאוקסינוקלאוטידים.
לבסוף, דרך יוצאת דופן לסנתז ATP על ידי זרחון ברמת המצע היא באמצעות התגובה המזרזת על ידי אדנילט קינאז
2 ADP ATP + אמפר
מקור ATP
תגובה זו היא אמצעי חשוב ליצירת ATP כאשר לתא אין מקורות אנרגיה אחרים. הצטברות AMP הנובעת מתגובה זו מפעילה אנזימים, כגון פוספרוקטוקינאז, של גליקוליזה, אשר יזרזו תגובות כדי לתת לתא אנרגיה נוספת ונחוצה.
חשוב לציין כי אנזימים אינם יכולים לגרום לתגובות להתרחש שאינן חיוביות מבחינה אנרגטית. אנזימים מאיצים תגובות, אך אינם משנים את כיווןם. תאים מחויבים אפוא לחוקי האנרגיה החופשית של גיבס. אז איך מתרחשות תגובות שליליות מבחינה אנרגטית בתא?
צימוד תגובה
תגובות שאינן חיוביות מבחינה אנרגטית, יכולות להיות חיוביות על ידי צימודן עם הידרוליזה של ATP, תגובה חיובית מאוד מבחינה אנרגטית. ישנן הקבלות רבות ב"עולם האמיתי". תנועת מכוניות אינה חיובית מבחינה אנרגטית, אך צימוד תנועת הרכב לחמצון בנזין הופך תהליך שלילי לטובה. גישה נוספת להפיכת תגובה שלילית לטובה היא לתפעל את ריכוז המגיבים והמוצרים. שקול את התגובה שלהלן, המתרחשת במטבוליזם של נוקלאוטיד פירמידין:
אורטאט + PRPP OMP+PP i
ΔG °' לתגובה זו הוא -0.8 kJ/mol, כלומר אם מתחילים בריכוזים שווים של מגיבים ומוצרים, בשיווי משקל, יהיה עודף קטן של מוצרים. בתא, לעומת זאת, תגובה זו נעה חזק ימינה (ΔG = שלילי מאוד). בהתחשב בכך ש- ΔG °' קרוב מאוד לאפס, ΔG שלילי מאוד יכול להתרחש רק אם ריכוזי המגיבים והמוצרים משתנים, שכן
\[ΔG = ΔG°’ + RT \ln(\frac{[\rm{OMP}][\rm{PP_i}]}{[\rm{Orotate}][\rm{PRPP}]})\]
מניפולציה היא בדיוק מה שקורה כאן. פריט המפתח שריכוזו מותאם בתגובה זו הוא הפירופוספט (PPi). זה אפשרי מכיוון שתאים מכילים אנזים הנקרא פירופוספורילאז המזרז את התגובה הבאה
PP i + H 2 O 2 P i
הידרוליזה של פירופוספט מועדפת מאוד מבחינה אנרגטית, וגורמת להידרוליזה מהירה של ה- PPi המיוצר בתגובה. כתוצאה מכך, הריכוז של PPi בתא נשמר נמוך מאוד. ריכוז נמוך של מוצר (PPi) גורם למונח היומן הטבעי (ln) של משוואת האורוטאט להיות שלילי יותר, מה שמניע את המונח ΔG לתגובה הכוללת להיות הרבה יותר שלילית.
דוחף ומושך
תגובות המניבות פירופוספט כמוצר מיוצרות בסינתזה של DNA ו- RNA, כמו גם מולקולות רבות אחרות. כפי שמוצג בדוגמה הקודמת, פירופוספט זה עובר הידרוליזה מהירה, וגורם לתגובה הכוללת לנוע לכיוון ייצור הפירופוספט. כאשר מגיבים מוסרים/מופחתים בתגובה מטבולית להפחתת ריכוז המוצר, אנו אומרים שהתגובה "נמשכת", כדי לייצג את העלייה בתגובה קדימה כתוצאה מדלדול המוצר.
דחיפה מתרחשת כאשר מגיבים בתגובה מתוספים/מוגברים. גם לזה יש השפעה של הפחתת ΔG של תגובה והפיכתה לטובה יותר מכיוון שהיחס בין [מוצרים]/[מגיבים] יורד עם עלייה [מגיבים]. דחיפה ומשיכה של תגובות הן כלים נוספים לתאים להתגבר על מחסומי אנרגיה, בדיוק כמו צימוד תהליכים נוחים מבחינה אנרגטית לתהליכים שליליים מבחינה אנרגטית.


