4.4: קרישת דם
- Page ID
- 207575
גרסה להדפסה של סעיף זה נמצאת כאן: BiochemFFA_4_4.pdf. ספר הלימוד כולו זמין בחינם מהמחברים בכתובת http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
קרישה היא תהליך שבו הדם הנוזלי הופך לחומר ג'לטיני שבסופו של דבר מתקשה. המטרה היא לעצור את זרימת הדם מכלי. היווצרות קריש דם היא תוצאה של סדרה של תגובות אנזימטיות המופעלות לאחר פציעה. התהליך כולל:
- שלב הפעלה (פציעה) ואחריו
- תגובה תאית (צבירה של טסיות דם) ו
- תגובה מולקולרית (פילמור של החלבון הנקרא פיברין ליצירת רשת שמתקשה).
גורמים המשתחררים בתגובה התאית עוזרים להפעיל את התגובה המולקולרית. התהליך שמור מאוד על פני מינים.
תגובה סלולרית
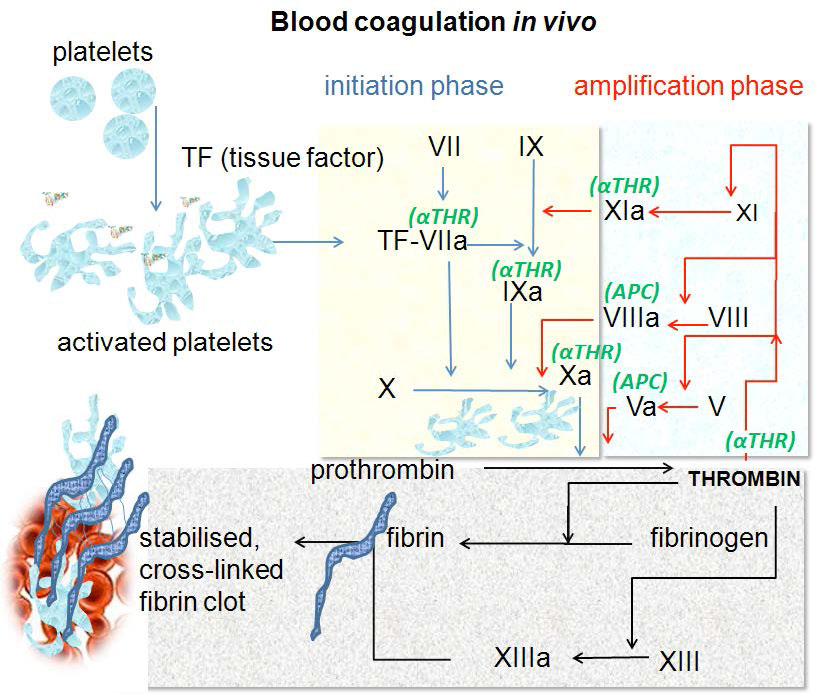
פגיעה ברירית האפיתל של כלי דם מתחילה את תהליך הקרישה כמעט באופן מיידי. לתגובה הסלולרית יש פעולה ראשונית ואחריה שלב הגברה. בתגובה התאית (איור 4.68), הטסיות נקשרות ישירות לקולגן באמצעות קולטני משטח קושרים לקולגן IA/IIa וגליקופרוטאין VI ליצירת תקע. האות לטסיות לבצע פעולה זו הוא חשיפה של הקולגן הבסיסי, דבר שלא היה קורה בהיעדר פצע. עם הפציעה, אינטגרינים של טסיות הדם מופעלים ונקשרים בחוזקה למטריצה החוץ-תאית כדי לעגן אותם לאתר הפצע.
גורם פון וילברנד (ראה להלן גם) מסייע ביצירת קשרים נוספים בין הגליקופרוטאין Ib/IX/V של הטסיות לבין סיבי הקולגן.
הגברה
בחלק ההגברה של התגובה התאית, הטסיות המופעלות משחררות מספר רב של גורמים, כולל גורם טסיות דם 4 (ציטוקין המעורר דלקת ופעולה מתונה של נוגד קרישה הפרין) וטרומבוקסן A2, זה האחרון משפיע על הגברת "הדביקות" של טסיות הדם, ומעדיף את צבירתם. בנוסף, מופעל מפל קולטן מקושר חלבון GQ, וכתוצאה מכך שחרור סידן ממאגרים תוך תאיים. זה ישחק תפקיד בתגובה המולקולרית.
תגובה מולקולרית
התגובה המולקולרית מביאה ליצירת רשת המורכבת מפולימרים של חלבון פיברין. בדומה למסלול הסלולרי, המסלול המולקולרי מתחיל בשלב התחלה וממשיך בשלב הגברה. פילמור של פיברין נובע מהתכנסות של שני מסלולים קטליטיים מדורגים. הם המסלול הפנימי (נקרא גם מסלול הפעלת המגע) והמסלול החיצוני (המכונה גם מסלול גורם הרקמה). מבין שני המסלולים, מסלול גורם הרקמה הוכח לאחרונה כחשוב יותר.
מפל פרוטאז סרין
בשני המסלולים, סדרה של זימוגנים של פרוטאזות סרין מופעלות ברצף מהיר. היתרון של מערכת מדורגת כזו הוא הגברה עצומה של אות קטן. בכל שלב של המפל, הפעלת זימוגן גורמת לייצור כמות ניכרת של פרוטאז סרין פעיל, אשר לאחר מכן מסוגל להפעיל את הזימוגן הבא, אשר בתורו מפעיל כמות גדולה עוד יותר של הזימוגן הבא במערכת. התוצאה היא הפעלה אולטימטיבית של כמות עצומה יותר פיברין ממה שניתן היה להשיג אם היה רק שלב אחד שבו אנזים הפעיל פיברינוגן לפיברין.
המינוח
גורמי הזימוגן בתגובה המולקולרית מסומנים בדרך כלל בספרות רומיות. אות קטנה, כתובה 'a' משמשת לייעוד טופס מופעל.
מסלול גורם הרקמה מתפקד ליצירת פרץ תרומבין, תהליך בו מופעל תרומבין במהירות רבה. זהו שלב החניכה. זה די פשוט כי יש לו מוקד אחד - הפעלה של תרומבין. תרומבין, הממיר פיברינוגן לפיברין של הקריש, הוא מרכזי גם בשלב ההגברה, מכיוון שהוא מפעיל חלק מהגורמים המפעילים אותו, ויוצר עלייה עצומה באות והופך הרבה תרומבין לפעיל בבת אחת.
שלב החניכה
שלב ההתחלה של התגובה המולקולרית מתחיל כאשר פקטור VII (האות 'F' לפני הספרה הרומית משמשת לעתים קרובות כקיצור של 'גורם') מופעל ל- FVIIa לאחר פגיעה בכלי הדם (איור 4.69 & 4.70). זה קורה כתוצאה מהאינטראקציה שלו עם גורם רקמות (TF, המכונה גם גורם קרישה III) ליצירת קומפלקס TF-FVIIA. המאמצים המשולבים של TF-FVIIa, FixA וסידן (מהתגובה הסלולרית) ממירים בצורה לא יעילה FX ל- FxA. FxA, FV וסידן ממירים בצורה לא יעילה פרותרומבין (זימוגן) לתרומבין (פעיל). כמות זעירה של תרומבין הופעלה בסוף שלב ההתחלה.
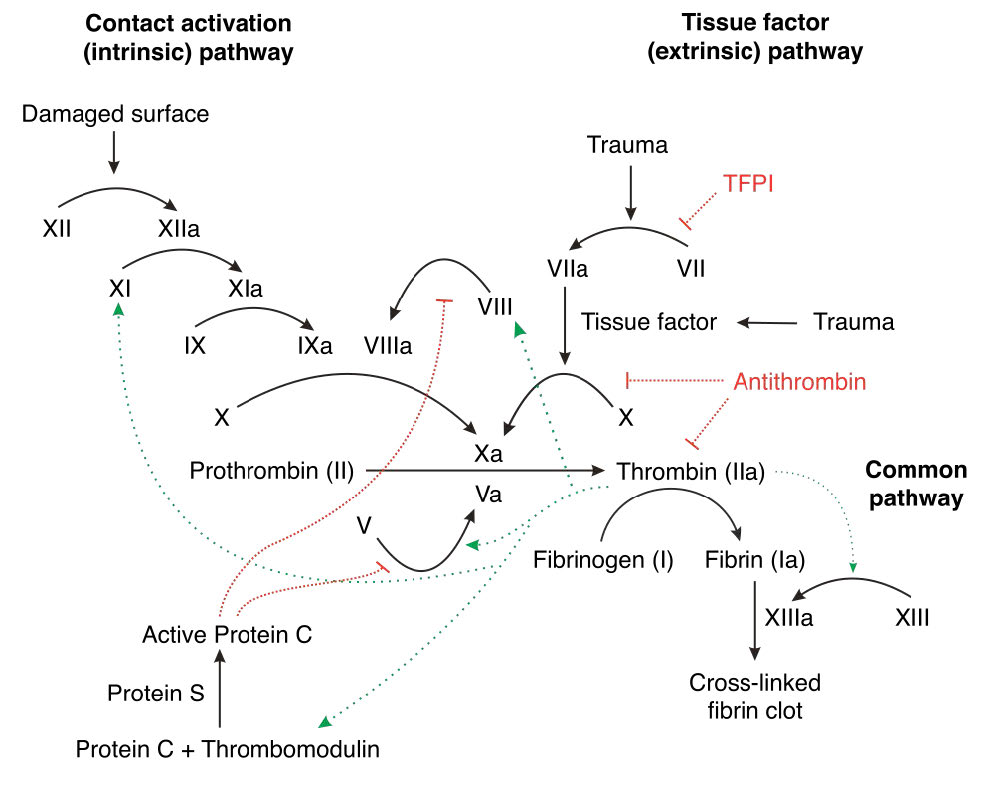
איור 4.69 - מסלולים פנימיים וחיצוניים של קרישת דם. המטרה היא יצירת קריש פיברין (מימין למטה). ויקיפדיה

איור 4.70 - מבט נוסף על התגובה המולקולרית של מסלול קרישת הדם. ויקיפדיה
שלב הגברה
כדי ליצור תרומבין מספיק כדי להמיר מספיק פיברינוגן לפיברין כדי ליצור קריש דם, תרומבין מפעיל גורמים אחרים (FV, FXI, FVIII) שעוזרים לייצר יותר תרומבין. זהו שלב ההגברה של התהליך המולקולרי ומוצג בחלק התכלת בחלק הימני העליון של איור 4.68. שלב ההגברה כולל גורמים במסלולים הפנימיים והחיצוניים כאחד. FVIII נקשר בדרך כלל במתחם עם גורם פון וילברנד ואינו פעיל עד שהוא משתחרר על ידי פעולה של תרומבין. הפעלת FXI ל- FXia עוזרת להעדיף ייצור של יותר FixA. FixA פלוס FVIIIa מעוררים ייצור של כמות ניכרת של FXa. FVa מצטרף FxA וסידן כדי ליצור כמות גדולה בהרבה של תרומבין. גורמים FVA ו- FVIIIa הם קריטיים לתהליך ההגברה. FVIIIa מגרה את הייצור של FixA של FXa ב 3-4 סדרי גודל. FVA עוזר לעורר את ייצור התרומבין של FXa בערך באותו גודל. לפיכך, thrombin מגרה הפעלה של גורמים, בתורו, לעורר הפעלה של תרומבין יותר.
טרנסגלוטמינאז
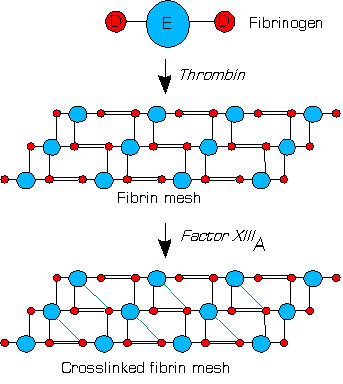
בנוסף לסיוע בהגברת התוצר של עצמו והמרה של פיברינוגן לפיברין, תרומבין מזרז את ההפעלה של FXIII ל- FXIIa. FxiIIa הוא טרנסגלוטמינאז שעוזר "להקשיח" את הקריש (איור 4.71 & 4.73). זה משיג זאת על ידי זרז היווצרות של קשר קוולנטי בין שרשראות צד גלוטמין וליצין סמוכות בפולימרי הפיברין.
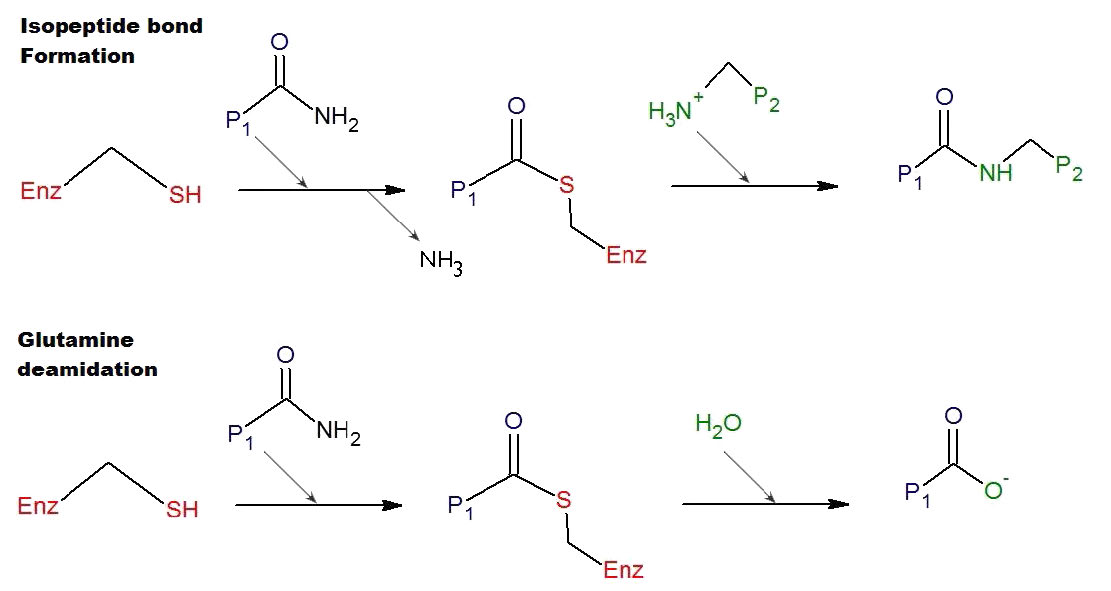
לא כל הגורמים המעורבים בתהליך הקרישה מופעלים על ידי המסלול, וגם לא כל הגורמים סרין פרוטאזות. זה כולל FVIII ו- FV שהם גליקופרוטאינים, ו- FXIII, שהוא הטרנסגלוטמינאז שתואר לעיל.
תהליך קרישת הדם חייב להיות מוסדר היטב. היווצרות קרישים במקומות בהם לא נגרם נזק עלולה להוביל לקרישים פנימיים (פקקת) המנתקים את זרימת הדם לאזורים קריטיים בגוף, כמו לב או מוח. לעומת זאת, חוסר קרישה יכול להוביל לדימום פנימי או, במקרים חמורים, למוות כתוצאה מדימום חיצוני לא מוסדר. כזו היא סכנה עבור אנשים הסובלים המופיליה.
איור 4.72 - α-תרומבין. ויקיפדיה
מחלות של קרישת דם: המופיליה
המופיליה היא הפרעה גנטית תורשתית המשפיעה על תהליך קרישת הדם אצל אנשים נגועים. המחלה קשורה ל- X ולכן מתרחשת הרבה יותר נפוץ אצל גברים. מחסור ב- FVIII מוביל להמופיליה A (כ -1 מכל 5000 עד 10,000 לידות גברים) ומחסור ב- FIX מייצר המופיליה B (כ -1 מכל 20,000 עד 35,000 לידות גברים).
המופיליה B התפשטה במשפחות המלוכה באירופה, החל מבנה של המלכה ויקטוריה, לאופולד. שלושה מנכדיה של המלכה ושישה מניניה סבלו מהמחלה. המופיליה מטופלת על ידי אספקה אקסוגנית של גורמי קרישה חסרים ושיפרה את תוחלת החיים באופן דרמטי. בשנת 1960 תוחלת החיים של המופיליה הייתה כ -11 שנים. היום, זה מעל 60.

מחלות של קרישת דם: מחלת פון וילברנד
מחלה קשורה להמופיליה שקשורה גם גנטית היא מחלת פון וילברנד. גורם פון וילברנד ממלא תפקיד הן בתגובות התאיות והן בתגובות המולקולריות בקרישת הדם. ראשית, הגורם הוא גליקופרוטאין מולטימרי גדול הקיים בפלסמת הדם ומיוצר גם באנדותל המצפה את כלי הדם.
גורם פון וילברנד עוזר לעגן טסיות דם בסמוך לאתר הפצע בתגובה התאית. זה נקשר למספר דברים. ראשית, הוא נקשר לגליקופרוטאין Ib של טסיות הדם. שנית, הוא נקשר להפרין ומסייע למתן את פעולתו. שלישית, הוא נקשר לקולגן ורביעי, הגורם נקשר ל- FVIII בתגובה המולקולרית, וממלא תפקיד מגן עבורו. בהיעדר גורם פון וילברנד, FVIII נהרס. חמישית, גורם פון וילברנד נקשר לאינטגרין של טסיות הדם, ועוזר להם להיצמד זה לזה וליצור תקע. פגמים בגורם פון וילברנד מובילים להפרעות דימום שונות.
דם "מדללי"
קרישת הדם חיונית להישרדות פצעים הגורמים לאובדן דם. עם זאת, יש אנשים הסובלים ממצבים המניעים אותם להיווצרות קרישים העלולים להוביל לשבץ מוחי, התקף לב או בעיות אחרות, כמו תסחיף ריאתי. עבור אנשים אלה משתמשים בתכשירים נגד קרישה (המכונים בדרך כלל מדללי דם) כדי להפחית את הסבירות לקרישה לא רצויה.
הראשון, הנפוץ יותר של אלה הוא אספירין. אספירין הוא מעכב של ייצור של פרוסטגלנדינים. פרוסטגלנדינים הם מולקולות עם 20 פחמנים שמקורם בחומצה ארכידונית שיש להן השפעות פיזיולוגיות רבות. מבחינה מטבולית, הפרוסטגלנדינים הם מבשרי סוג של מולקולות הנקראות תרומבוקסנים. תרומבוקסנים ממלאים תפקידים בסיוע לטסיות להידבק זו לזו בתגובה התאית לקרישה. על ידי עיכוב הייצור של prostaglandins, אספירין מפחית את הייצור של thromboxanes ומפחית דביקות טסיות ואת הסבירות של קרישה.
פעולת ויטמין K
גישה נוספת למניעת קרישת דם היא גישה שמפריעה לפעולה מולקולרית חשובה של ויטמין K. גורם פרו-קרישה המצוי בדם, ויטמין K נחוץ לשינוי חשוב בפרותרומבין ובחלבוני קרישת דם אחרים. ויטמין K משמש כקופקטור אנזים המסייע לזרז הוספה של קבוצת קרבוקסיל נוספת לשרשרת הצדדית של שאריות חומצה גלוטמית של מספר אנזימי קרישה (ראה כאן). שינוי זה נותן להם את היכולת להיקשר לסידן (איור 4.77), שחשוב להפעלת מפל הפרוטאז הסרין. במהלך התגובה שמוסיפה קבוצות קרבוקסיל לגלוטמט, הצורה המופחתת של ויטמין K מתחמצנת. על מנת שוויטמין K יעורר תגובות קרבוקסילציה נוספות להתרחש, יש להפחית את הצורה המחומצנת של ויטמין K על ידי האנזים ויטמין K אפוקסיד רדוקטאז.
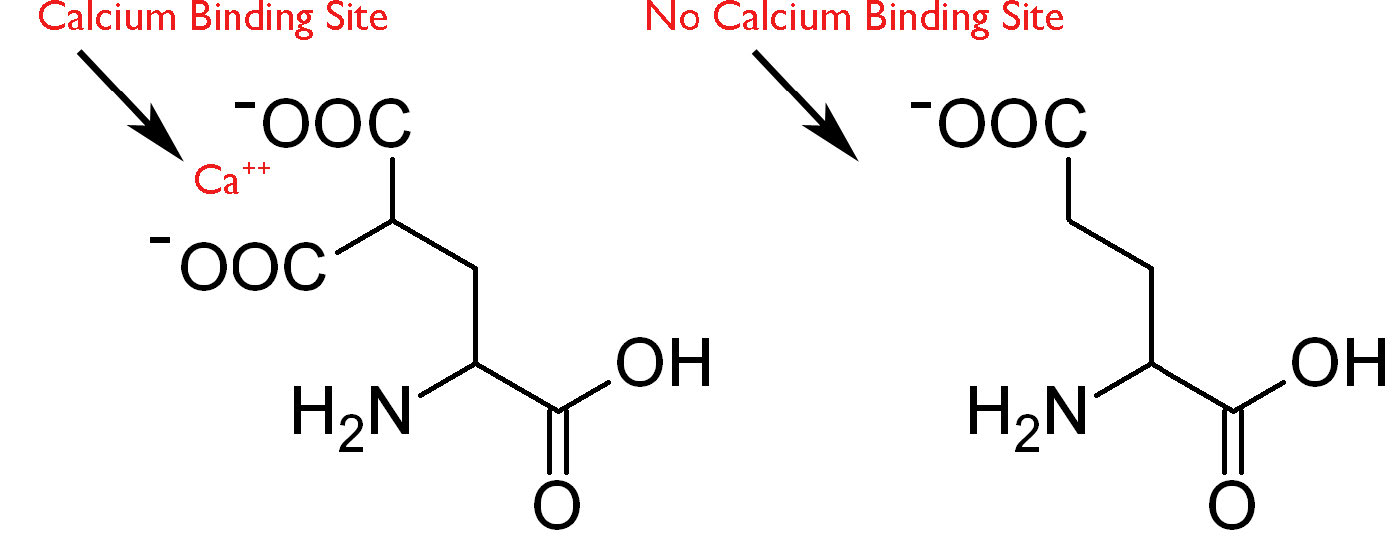
איור 4.77 - לחומצה γ-קרבוקסילגלוטמית (משמאל) יש אתר מחייב סידן. חומצה גלוטמית ללא שינוי (מימין) לא.
וורפרין חוסם הפחתה
התרכובת הידועה בשם warfarin (שם מותג = קומדין - איור 4.78) מפריעה לפעולה של ויטמין K אפוקסיד רדוקטאז ובכך חוסמת מיחזור של ויטמין K. כתוצאה מכך, פחות פרוטרומבינים (וחלבונים אחרים לקרישת דם) מקבלים קרבוקסילציה, ופחות קרישה מתרחשת.
קרבוקסילציה בתיווך ויטמין K של גלוטמט מתרחשת על פחמן γ של שרשרת הצד של חומצת האמינו, עבור 16 חלבונים שונים, 7 מהם מעורבים בקרישת דם, כולל פרותרומבין. כאשר מוסיפים את קבוצת הקרבוקסיל כמתואר, השרשרת הצדדית מסוגלת להיקשר ביעילות ליוני סידן. בהיעדר קבוצת הקרבוקסיל, השרשרת הצדדית לא תיקשר לסידן. סידן המשתחרר בסמוך לאתר הפצע בתגובה התאית לקרישה עוזר לעורר הפעלה של חלבונים במפל הפרוטאז הסרין של התגובה המולקולרית.
ויטמין K מגיע במספר צורות. זה מתואר בצורה הטובה ביותר מבחינה כימית כקבוצה של נגזרות 2-מתיל-1,4-נפטוקינון. ישנן חמש צורות שונות המוכרות כוויטמין Ks (K1, K2, K3, K4 ו- K5). מתוכם, ויטמינים K1 ו- K2 מגיעים ממקורות טבעיים והאחרים סינתטיים. ויטמין K2, אשר עשוי ויטמין K1 על ידי מיקרואורגניזמים במעיים, יש מספר צורות, עם אורכים שונים של שרשראות צד איזופרנואידים. הצורות השונות נקראות בדרך כלל MK-X, כאשר X הוא מספר, ו- MK מייצג menaquinone, שהוא השם שניתן לצורה זו של ויטמין K. איור 4.79 מציג צורה נפוצה המכונה MK-4 (menatetrenone).
איור 4.79 - MK-4 (מנטטרנון)
סכנת דימום
זה מאוד קריטי כי הכמות הנכונה של warfarin תינתן לחולים. יותר מדי יכול לגרום לדימום. על המטופלים לבדוק את זמני הקרישה שלהם באופן קבוע כדי לוודא שהם נוטלים את המינון הנכון של תרופות נגד קרישה. תזונה ומטבוליזם של ויטמין K בגוף יכולים להשפיע על כמות הקומדין הדרושה. ויטמין K מסונתז בצמחים וממלא תפקיד בפוטוסינתזה. ניתן למצוא אותו בכמויות הגבוהות ביותר בירקות ירוקים ועלים. חולים אשר התזונה שלהם גבוהה בירקות אלה עשויים לדרוש מנה שונה מזו של אלה אשר לעתים רחוקות לאכול ירקות. ויטמין K תזונתי הוא גם, כאמור, מטבוליזם על ידי חיידקים במעי הגס, שם הם ממירים ויטמין K1 לוויטמין K2.
פלסמין
קרישים, שנעשו פעם בגוף, לא נשארים שם לנצח. במקום זאת, אנזים מווסת היטב המכונה פלסמין מופעל, במידת הצורך, כדי לפרק את הקריש הסבוך בפיברין. כמו רבים מהאנזימים במפל קרישת הדם, פלסמין הוא פרוטאז סרין. הוא מסוגל לבקע מגוון רחב של חלבונים. הם כוללים קרישי פיברין מפולימרים, פיברונקטין, טרומבוספונדין, למינין וגורם פון וילברנד.
פלסמין ממלא תפקיד בהפעלת קולגן ובתהליך הביוץ על ידי היחלשות דופן הזקיק הגראפי בשחלה. פלסמין מיוצר בכבד כזימוגן המכונה פלסמינוגן. מספר אנזימים שונים יכולים להפעיל אותו.
מפעיל פלסמינוגן רקמות (tPA), המשתמש בפיברין כגורם משותף, הוא אחד. אחרים כוללים מפעיל פלסמינוגן אורוקינאז (באמצעות קולטן מפעיל פלסמינוגן אורוקינאז כגורם משותף), קליקריין (פרוטאז פלזמה סרין עם צורות ותפקודי דם רבים), ו- FxIA ו- fXIIa ממפל הקרישה.
עיכוב פלסמין
ניתן לעכב גם את הפעילות של פלסמין. מעכב מפעיל פלסמינוגן, למשל, יכול להשבית tPA ואורוקינאז. לאחר הפעלת פלסמין, ניתן לעכב אותו גם על ידי α2-אנטיפלסמין ו-α2-מקרוגלובולין (איור 4.80). תרומבין ממלא גם תפקיד בהשבתת הפלסמין, וממריץ פעילות של מעכב פיברינוליזה המופעל על ידי תרומבין. אנגיוסטטין הוא תת-תחום של פלסמין המיוצר על ידי מחשוף אוטו-פרוטאוליטי. הוא חוסם את צמיחתם של כלי דם חדשים ונחקר על תכונותיו האנטי-סרטניות.
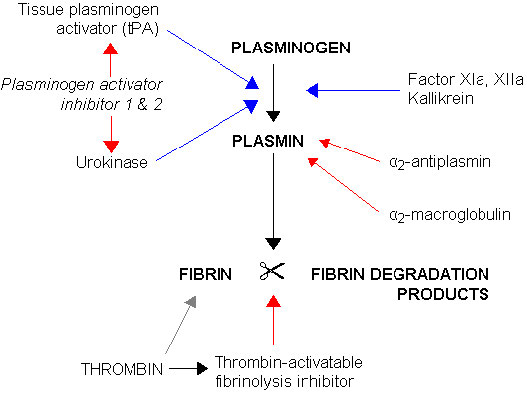
איור 4.80 - ויסות פירוק הפיברין. מפעילים בכחול. מעכבים באדום. ויקיפדיה
פיברונקטין
פיברונקטין הוא גליקופרוטאין גדול (440 kDa) המצוי במטריצה החוץ-תאית הנקשר לחלבונים תאיים אינטגרליים הנקראים אינטגרינים ולחלבונים חוץ-תאיים, כולל קולגן, פיברין והפראן סולפט. זה בא בשתי צורות. הצורה המסיסה נמצאת בפלסמת הדם ונעשית על ידי הכבד. הוא נמצא בריכוז גבוה בזרם הדם (300 מיקרוגרם/מ"ל). הצורה הבלתי מסיסה נמצאת בשפע במטריצה החוץ תאית.
החלבון מורכב במטריצה החוץ -תאית וממלא תפקידים בצמיחה תאית, הידבקות, נדידה והתמיינות. זה חשוב מאוד בריפוי פצעים.
איור 4.82 - פיברונקטין 1. ויקיפדיה
מסייע בהיווצרות קריש דם
פיברונקטין מפלסמת הדם מקומי לאתר הפצע, ומסייע ביצירת קריש הדם להפסקת הדימום. בשלבים הראשונים של ריפוי פצעים, פיברונקטין בפלזמה מתקשר עם הפיברין ביצירת קריש דם. זה גם מגן על רקמות המקיפות את הפצע. בהמשך תהליך התיקון, שיפוץ האזור הפגוע מתחיל בפעולה של פיברובלסטים ותאי אנדותל באתר הפצע. המשימה שלהם היא להשפיל חלבונים של מטריצת קריש הדם, להחליף אותם במטריצה חדשה כמו הרקמה הבלתי פגומה, הסובבת.
פיברובלסטים פועלים על מטריצת הפיברונקטין-פיברין הזמנית, ומשפצים אותה מחדש כדי להחליף את פיברונקטין הפלזמה בפיברונקטין תאי. זה עלול לגרום לתופעה של התכווצות פצעים, אחד השלבים בריפוי פצעים. הפרשת פיברונקטין תאי על ידי פיברובלסטים מלווה בהרכבת פיברונקטין ושילוב עם המטריצה החוץ תאית.
אמבריוגנזה
פיברונקטין חיוני לעוברוגנזה. מחיקת הגן בעכברים גורמת לקטלניות לפני הלידה. סביר להניח שזה נובע מתפקידו בהגירה ובהנחיית התקשרות התאים עם התפתחות העובר. לפיברונקטין יש גם תפקיד בפה. הוא נמצא ברוק ונחשב כמעכב את הקולוניזציה של הפה על ידי חיידקים פתוגניים.
גורם מפעיל טסיות
גורם מפעיל טסיות דם (PAF) הוא תרכובת (איור 4.83) המיוצרת בעיקר בתאים המעורבים בהגנה על המארח. אלה כוללים טסיות דם, מקרופאגים, נויטרופילים ומונוציטים, בין היתר. הוא מיוצר בכמויות גדולות יותר בתאים דלקתיים על גירוי תקין. התרכובת פועלת כמו הורמון ומתווכת צבירת טסיות דגרנולציה, דלקת ואנפילקסיס. זה יכול להעביר אותות בין תאים כדי להפעיל ולהגביר מפל דלקתי וקרישה.
כאשר אינו מוסדר, איתות על ידי PAF עלול לגרום לדלקת חמורה וכתוצאה מכך אלח דם ופציעה. דלקת בתגובות אלרגיות נובעת בחלקה כתוצאה מ- PAF והיא גורם חשוב בהתכווצות הסימפונות באסתמה. למעשה, בריכוז של 10 פיקומולרים בלבד, PAF יכול לגרום לדלקת אסתמטית בדרכי הנשימה המסכנת חיים.
איור 4.83 - גורם מפעיל טסיות דם. ויקיפדיה
אני מרגיש כל כך עצוב
כי חתכתי את עצמי רע
עכשיו אני מודאג לגבי התוצאות.
זה מתחיל לדמם
יש קצת קלו. בטח שאני צריך
אז הגוף בועט.
זה קרה כל כך הרבה פעמים בעבר
הדם זורם החוצה ואז הוא סוגר את הדלת
תודה לאל שהדם שלי נקרש
שילוב שרשראות הפיברין
תודה לאל שהדם שלי נקרש
הזימוגנים
מפעילים והכל בסדר
אז אני אפסיק לדמם שוב
ויטמין K
לעזור... להיקשר לסי-אייז.
הוספת C-O-... O-H כדי לתקן דברים
אם-מ-אם-אם-אממ
זה מתקשה ונשאר
כאשר glu..... טמינאז
יוצר קשרים ערכיים משותפים.... עבור מלט
בתוך רגע, דברים טובים ללכת
הקריש במקום והוא עצר את הזרימה
אבל מה עם המסת קריש דם?
שרשראות פיברין מתנתקות?
זה דורש פתרון בעיות כלשהו
יש דרך
פשוט הפעל קצת t-PA
קבל פלסמין פעיל בוורידים
הו, הו, הו.
"ותודה ל "גילוי עטיפות"
כחלק מתיקוני ורידים
זה חלק מהתכנית של הגוף שלי
הפצע נעלם
חזרתי למקום בו התחלתי ו
שום דבר לא בסדר
זרימת הדם שלי שוב תקינה.
תודה לאל שהדם שלי נקרש
למנגינה של "אל תישן ברכבת התחתית יקירתי"
אתר מנגינות מטבוליות כאן
הקלטה של ליז בייקון ודייויד סימונס
מילים על ידי קווין אהרן
הקלטה על ידי ליז בייקון ודייויד סימונס מילים על ידי קווין אהרן


