4.3: מנגנוני קטליזה
- Page ID
- 207555
גרסה להדפסה של סעיף זה נמצאת כאן: BiochemFFA_4_3.pdf. ספר הלימוד כולו זמין בחינם מהמחברים בכתובת http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
הקסם של אנזימים, כאמור, הוא ביכולתם ליצור סביבות אלקטרוניות התורמות ליזום תגובה. ישנם יותר מנגנוני תגובה ממה שיכולנו לקוות לכסות בספר כזה, ודיון מקיף בהם אינו מטרתנו. במקום זאת, נביא כמה דוגמאות ונפרט על אחת מהן - מנגנון הפעולה של פרוטאזות סרין.
כימוטריפסין
נתחיל עם מנגנון הפעולה של אנזים אחד - chymotrypsin. נמצא במערכת העיכול שלנו, הפעילות הקטליטית של כימוטריפסין היא ביקוע קשרי פפטיד בחלבונים והיא משתמשת בשרשרת הצדדית של סרין במנגנון הקטליזה שלו. אנזימים רבים אחרים לחיתוך חלבונים משתמשים במנגנון דומה מאוד והם ידועים ביחד בשם פרוטאזות סרין (איור 4.52).
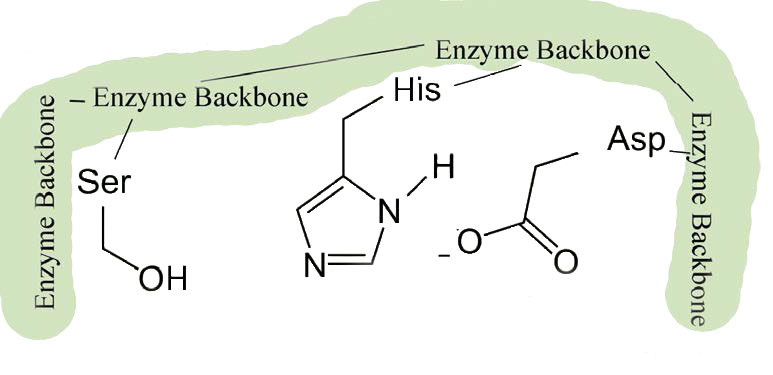
אנזימים אלו נמצאים בתאים פרוקריוטים ואיקריוטים וכולם משתמשים בקבוצה משותפת של שלוש חומצות אמינו באתר הפעיל הנקראת שלישייה קטליטית (איור 4.53). הוא מורכב מחומצה אספרטית, היסטידין וסרין. הסרין מופעל במנגנון התגובה ליצירת נוקלאופיל באנזימים אלו ונותן לכיתה את שמם. למעט ההכרה המתרחשת באתר הקישור של המצע, המנגנון המוצג כאן עבור כימוטריפסין יהיה ישים לכל אחד מהפרוטאזות הסרין.
ספציפיות
כפרוטאז, כימוטריפסין פועל באופן ספציפי למדי, חותך לא את כל קשרי הפפטיד, אלא רק את אלה הסמוכים לחומצות אמינו לא קוטביות יחסית בחלבון. אחת מחומצות האמינו שהיא חותכת בסמוך אליה היא פנילאלנין. פעולת האנזים מתרחשת בשני שלבים - שלב מהיר המתרחש ראשון ושלב איטי יותר שאחריו. לאנזים יש אתר קישור סובסטרט הכולל אזור של האנזים המכונה כיס S1. הבה נעבור דרך המנגנון שבאמצעותו חותך צ'ימוטריפסין בצמוד לפנילאלנין.
כריכת מצע
התהליך מתחיל עם הכריכה של המצע בכיס S1 (איור 4.54). לכיס S1 בכימוטריפסין יש חור הידרופובי בו המצע קשור. מצעים מועדפים יכללו שרשראות צד של חומצות אמינו מגושמות והידרופוביות, כמו פנילאלנין. אם שרשרת צד מיוננת, כמו זו של חומצה גלוטמית נקשרת בכיס S1, היא תצא במהירות, ממש כמו שמים ימנעו פנים שמנוני.
שינוי צורה בכריכה
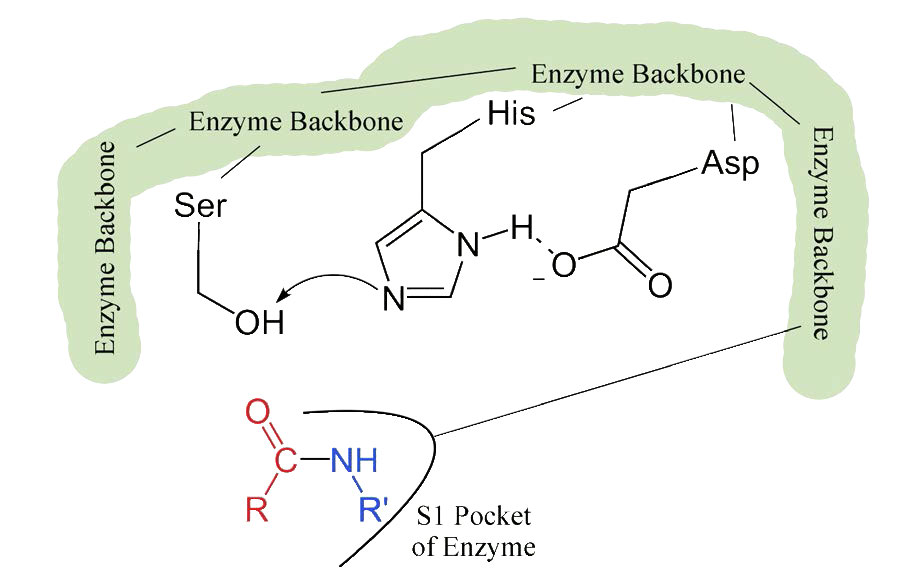
כאשר המצע המתאים נקשר בכיס S1, נוכחותו גורמת לשינוי קל כל כך בצורת האנזים. שינוי צורה עדין זה בקשירת המצע המתאים מתחיל את שלבי הקטליזה. מכיוון שהתהליך הקטליטי מתחיל רק כאשר המצע המתאים נקשר, זו הסיבה שהאנזים מראה ספציפיות לחיתוך בחומצות אמינו ספציפיות בחלבון המטרה. רק חומצות אמינו עם שרשראות הצד המתקשרות היטב עם כיס S1 מתחילות את הגלגלים הקטליטיים להסתובב.
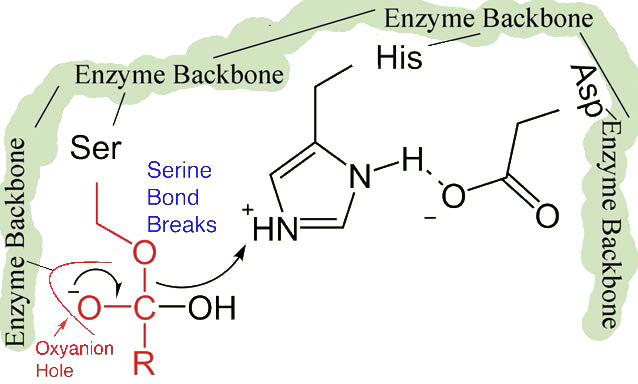
השינויים הקלים בצורה כרוכים בשינויים במיקום של שלוש חומצות אמינו (חומצה אספרטית, היסטידין וסרין) באתר הפעיל המכונה השלישייה הקטליטית.
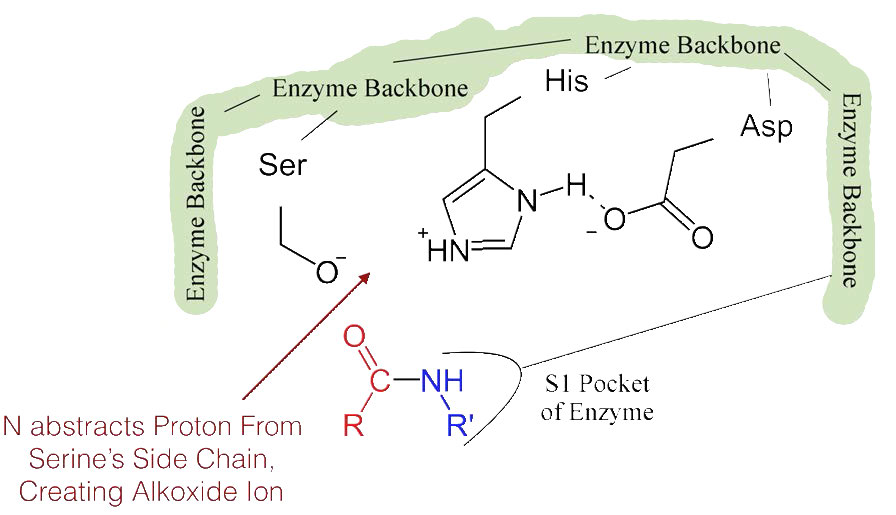
המעבר של החומצה האספרטית הטעונה שלילית לכיוון טבעת ההיסטידין העשירה באלקטרונים מעדיף הפשטה של פרוטון על ידי ההיסטידין מקבוצת ההידרוקסיל בשרשרת הצדדית של סרין, וכתוצאה מכך ייצור יון אלקוקסיד תגובתי מאוד באתר הפעיל (איור 4.55).
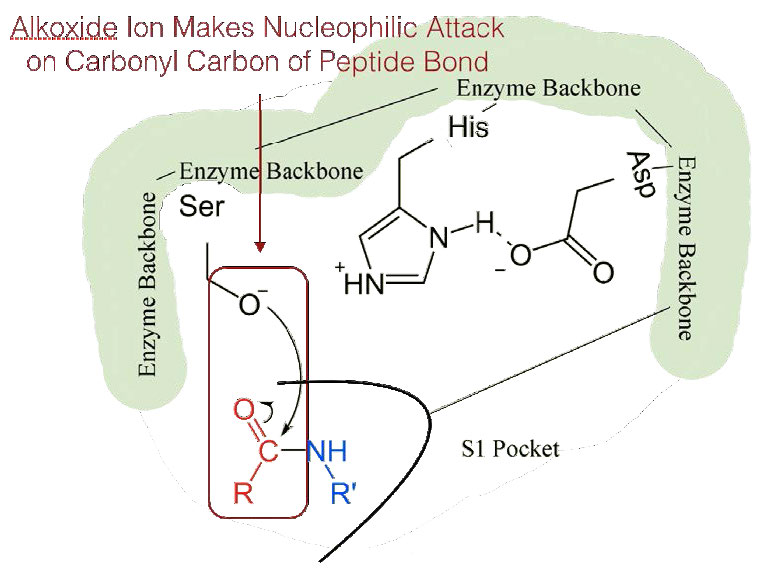
מכיוון שהאתר הפעיל בנקודה זו מכיל גם את שרשרת הפוליפפטיד הממוקמת עם שרשרת הצד הפנילאלנין המוטמעת בכיס S1, יון האלקוקסיד מבצע התקפה נוקלאופילית על הקשר הפפטיד בצד הקרבוקסיל של פנילאלנין היושב בכיס S1 (איור 4.56). תגובה זו שוברת את הקשר הפפטיד (איור 4.57) וגורמת לשני דברים לקרות.
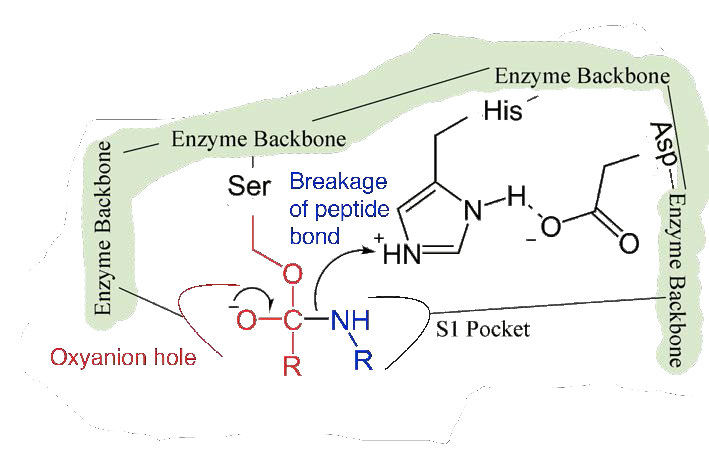
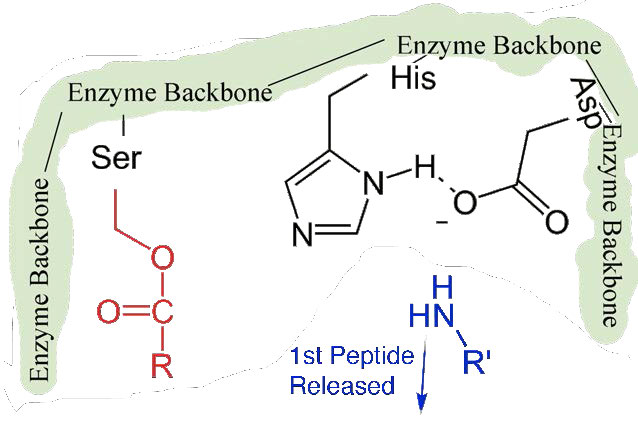
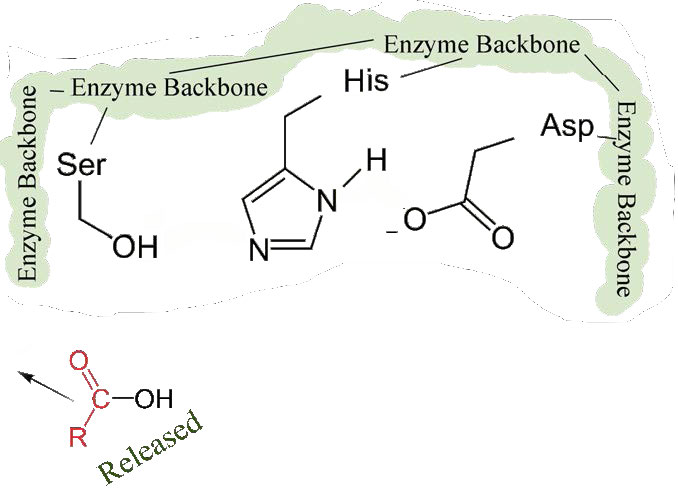
ראשית, קצה אחד של הפוליפפטיד המקורי משוחרר ויוצא מהאתר הפעיל (איור 4.58). השני הוא שהקצה המכיל את הפנילאלנין קשור קוולנטית לחמצן של שרשרת הצד הסרין. בשלב זה השלמנו את השלב הראשון (המהיר) של הקטליזה.
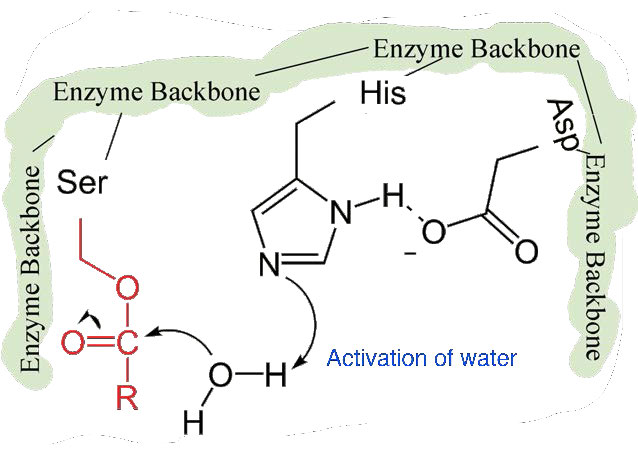
שלב שני איטי יותר
השלב השני של הקטליזה על ידי כימוטריפסין איטי יותר. זה דורש לשבור את הקשר הקוולנטי בין פנילאלנין לחמצן של סרין כדי שניתן יהיה לשחרר את הפפטיד והאנזים יוכל לחזור למצבו המקורי. התהליך מתחיל עם כניסת מים לאתר הפעיל. מים מותקפים בצורה דומה לזו של שרשרת הצד הסרין בשלב הראשון, ויוצרים קבוצת הידרוקסיל תגובתית (איור 4.59) המבצעת התקפה נוקלאופילית על הקשר פנילאלנין-סרין (איור 4.60), משחררת אותו ומחליפה את פרוטון על סרין. הפפטיד השני משתחרר בתהליך והתגובה הושלמה עם האנזים בחזרה למצבו המקורי (איור 4.61).
פרוטאזות סרין
רשימת פרוטאזות הסרין ארוכה למדי. הם מקובצים בשתי קטגוריות רחבות - 1) אלה דמויי כימוטריפסין ו -2) כאלה דמויי סובטיליסין. למרות שאנזימים מסוג סובטיליסין ודמויי כימוטריפסין משתמשים באותו מנגנון פעולה, כולל השלישייה הקטליטית, האנזימים בדרך כלל אינם קשורים זה לזה ברצף ונראה שהם התפתחו באופן עצמאי. הם, אם כן, דוגמה לאבולוציה מתכנסת - תהליך שבו אבולוציה של צורות שונות מתכנסת על מבנה כדי לספק פונקציה משותפת.
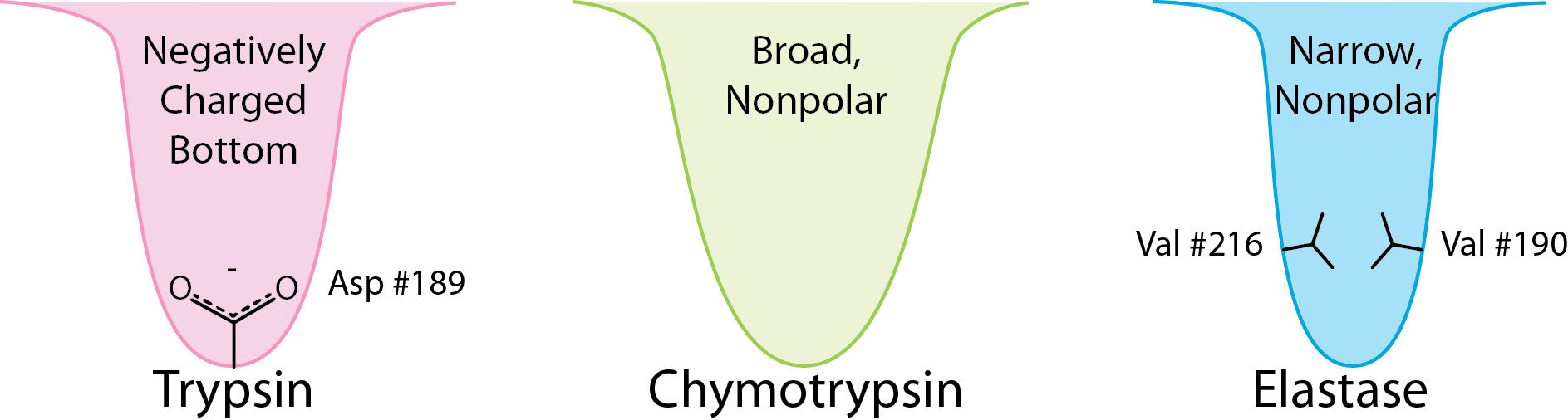
אנזימי הסרין פרוטאז נחתכים בסמוך לחומצות אמינו ספציפיות והספציפיות נקבעת על פי גודל/צורה/מטען של שרשרת הצד של חומצות אמינו שמתאימה לכיס הקישור S1 של האנזים (איור 4.62).
דוגמאות לפרוטאזות סרין כוללות טריפסין, כימוטריפסין, אלסטאז, סובטיליסין, אות פפטידאז I ונוקלאופורין. פרוטאזות סרין משתתפות בתהליכים פיזיולוגיים רבים, כולל קרישת דם, עיכול, רבייה והתגובה החיסונית.
פרוטאזות ציסטאין
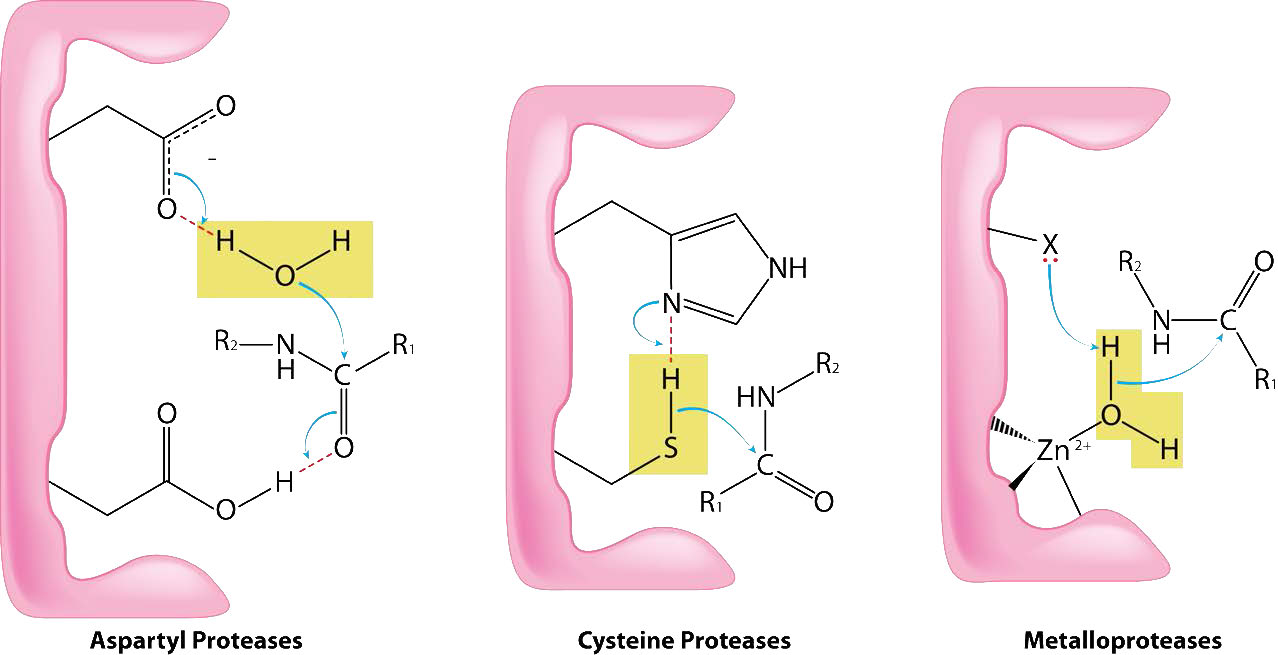
פרוטאזות ציסטאין (הידועות גם בשם פרוטאזות תיול) מזרזות את פירוק החלבונים על ידי ביקוע קשרי פפטיד באמצעות תיול נוקלאופילי מציסטאין (איור 4.63). הציסטאין נמצא בדרך כלל בדיאדה קטליטית או בשלישייה הכוללת גם היסטידין וחומצה אספרטית (לפעמים) (דומה מאוד לפרוטאזות סרין). קבוצת הסולפידריל של פרוטאזות ציסטאין חומצית יותר מההידרוקסיל של פרוטאזות סרין, ולכן לא תמיד יש צורך בחומצה אספרטית של השלישייה.
מנגנון הפעולה דומה מאוד לזה של פרוטאזות סרין. קשירה של מצע תקין גורמת להפעלה של התיול (הסרת הפרוטון על ידי קבוצת ההיסטידין). התיול המופעל פועל כנוקלאופיל, תוקף את הקשר הפפטיד וגורם לו להישבר. פפטיד אחד משתחרר והפפטיד השני נקשר קוולנטית לגופרית. הידרוליזה על ידי מים משחררת את הפפטיד השני ומשלים את המחזור. דוגמאות לפרוטאזות ציסטאין כוללות פפאין, קספסות, חלבון קיפוד, קלפין וקתפסין ק.
קספאס
קספסות (פרוטאזות ציסטאין-אספרטיות) הן משפחה של פרוטאזות ציסטאין הממלאות תפקידים חשובים בגוף. ברמה התאית הם מתפקדים באפופטוזיס ונמק ובגוף, הם מעורבים בדלקת ובמערכת החיסון. התבגרות של לימפוציטים היא תפקיד אחד כזה. עם זאת, הם ידועים בעיקר בזכות תפקידם באפופטוזיס, שהוליד תיאורים שלהם כחלבונים "מוציאים להורג" או "פרוטאזות התאבדות" המפרקות תאים במוות תאים מתוכנת.
ישנם 12 קספסות אנושיות ידועות. האנזימים מסונתזים כזימוגנים פרו-קספאז עם פרודומיין ושתי יחידות משנה נוספות. הפרודומיין מכיל אזורים המאפשרים לו לקיים אינטראקציה עם מולקולות אחרות המווסתות את פעילות האנזים. הקספסות מגיעות בשתי צורות. קספסות היוזם, כאשר הן מופעלות, מפעילות את קספסות האפקטור. קספאזות האפקטור מבקעות חלבונים אחרים בתא. המטרות לפעולת מחשוף קספאז אפקטור כוללות את הלמינים הגרעיניים (חלבונים סיביים המספקים שלמות מבנית לגרעין), ICAD/DFF45 (מעכב DNase), PARP (דגלים אזורים שבהם יש צורך בתיקון DNA) ו- PAK2 (ויסות אפופטוטי).
מפל ההפעלה של קספאז יכול להיות מופעל בעצמו על ידי גרנזים B (פרוטאז סרין המופרש על ידי תאי רוצח טבעיים ותאי T ציטוטוקסיים), קולטני מוות תאי והאפופטוזום (מבנה חלבון גדול בתאים אפופטוטיים המעוררים על ידי שחרור ציטוכרום C מהמיטוכונדריה). כל אחד מהמפעילים הללו אחראי על הפעלת קבוצות שונות של קספסות.
מטלופרוטאזות
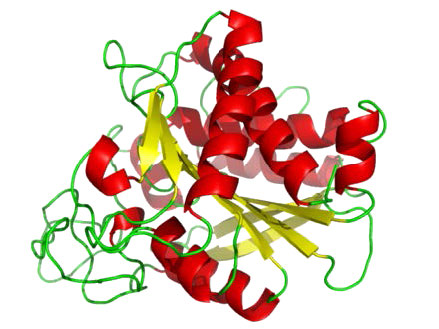
Metalloproteases (איור 4.64) הם אנזימים שהמנגנון הקטליטי שלהם לשבירת קשרי פפטיד כרוך במתכת. רוב המטלופרוטאזות משתמשות באבץ כמתכת שלהן, אך מעטים משתמשים בקובלט, המתואם לחלבון על ידי שלוש שאריות חומצות אמינו עם מים גמישים במיקום הרביעי. משתמשים במגוון שרשראות צד - היסטידין, אספרטט, גלוטמט, ארגינין וליסין. המים הם יעד הפעולה של המתכת אשר, עם קישור המצע המתאים, מפשטת פרוטון ליצירת קבוצת הידרוקסיל נוקלאופילית שתוקפת את הקשר הפפטיד, ומבקעת אותו (איור 4.64). מכיוון שהנוקלאופיל כאן אינו מחובר באופן קוולנטי לאנזים, אף אחד מהפפטידים המבוקעים לא מחובר בסופו של דבר לאנזים במהלך התהליך הקטליטי. דוגמאות למטלופרוטאזות כוללות קרבוקסיפפטידאזות, אמינופפטידאזות, אינסולינאזות ותרמוליסין.
פרוטאזות אספרטיל
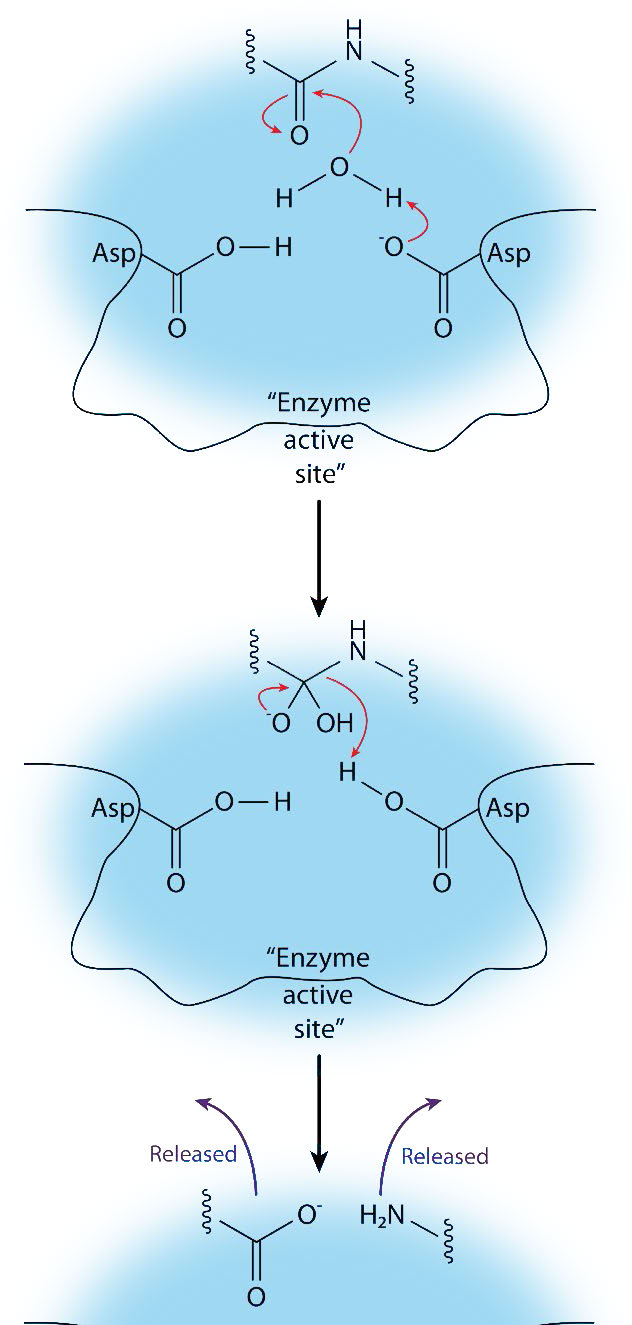
כפי שהשם מרמז, אספרטיל פרוטאזות משתמשות בחומצה אספרטית במנגנון הקטליטי שלהן (איורים 4.63 ו-4.65). כמו המטלופרוטאזות, פרוטאזות אספרטיל מפעילות מים ליצירת נוקלאופיל לקטליזה (איור 4.65). המים המופעלים תוקפים את הקשר הפפטיד של המצע הקשור ומשחררים את שני החלקים ללא צורך בשחרור ביניים קשור, שכן מים אינם מחוברים קוולנטית לאנזים. פרוטאזות אספרטיל נפוצות כוללות פפסין, אות פפטידאז II ופרוטאז HIV-1.
פרוטאזות תראונין
למרות שלתראונין יש קבוצת R עם הידרוקסיל כמו סרין, מנגנון הפעולה של סוג זה של פרוטאזות שונה במקצת מהפרוטאזות הסרין. יש כמה קווי דמיון. ראשית, ההידרוקסיל של התראונין ממלא תפקיד בקטליזה וזה לפעול כנוקלאופיל. הנוקלאופיל נוצר, לעומת זאת, לא על ידי שלישייה קטליטית, אלא כתוצאה מקבוצת α-amine של תראונין עצמה המפשטת פרוטון.
בגלל זה, התראונין הנוקלאופילי בפרוטאז תראונין חייב להיות בקצה ה- n של האנזים. התקפה נוקלאופילית של קשר הפפטיד בפרוטאז המטרה גורמת לשבירה של הקשר לשחרור פפטיד אחד והשני מחובר קוולנטית לסרין, כמו פרוטאזות הסרין. כמו כן, כמו בפרוטאזות הסרין, מים חייבים להיכנס כדי לשחרר את הפפטיד השני המקושר קוולנטית כדי לסיים את המנגנון הקטליטי.
דוגמאות
דוגמאות לפרוטאזות תראונין כוללות את יחידות המשנה הקטליטיות של הפרוטאזום. כמה אציל טרנספראזות (כגון אורניטין אצילטרנספראז) פיתחו את אותו מנגנון קטליטי על ידי אבולוציה מתכנסת. האנזימים האחרונים משתמשים באורניטין במקום במים כדי לשבור את הקשר הקוולנטי האנזים-סובסטרט, וכתוצאה מכך קבוצת האציל נקשרת לאורניטין, במקום למים.
מעכבי פרוטאז
מולקולות המעכבות את הפעולה הקטליטית של פרוטאזות ידועות כמעכבי פרוטאז. אלה מגיעים במגוון צורות ויש להם שימושים ביולוגיים ורפואיים. מעכבים ביולוגיים רבים הם חלבונים עצמם. מעכבי פרוטאז יכולים לפעול בכמה דרכים, כולל כמעכב התאבדות, מעכב מצב מעבר, דנטורנט וכחומר צ'לציה. חלקם עובדים רק על סוגים ספציפיים של אנזימים. לדוגמה, רוב הפרוטאזות האספרטיל הידועות מעוכבות על ידי פפסטטין. Metalloproteases רגישים לכל דבר שמסיר את המתכת הדרושה להם לקטליזה. מטלופרוטאזות המכילות אבץ, למשל, רגישות מאוד ל- EDTA, אשר chelates את יון האבץ.
קטגוריה אחת של מעכבי פרוטאז חלבוניים ידועה בשם סרפינים. סרפינים מעכבים פרוטאזות סרין הפועלות כמו כימוטריפסין. 36 מהם ידועים בבני אדם.
סרפינים הם יוצאי דופן בפעולה על ידי קשירה לפרוטאז מטרה באופן בלתי הפיך ועוברים שינוי קונפורמטיבי כדי לשנות את האתר הפעיל של המטרה שלו. מעכבי פרוטאז אחרים פועלים כמעכבים תחרותיים החוסמים את האתר הפעיל.
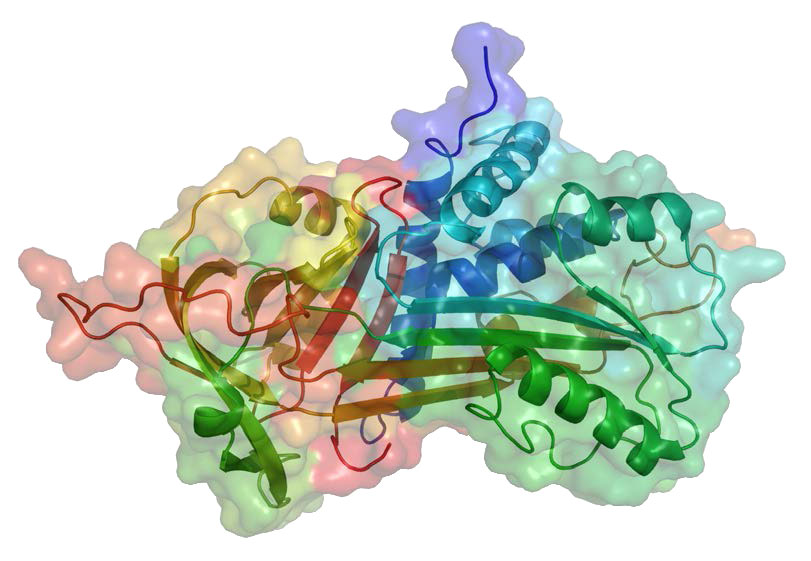
סרפינים יכולים להיות רחבים בספציפיות שלהם. חלקם, למשל, יכולים לחסום את פעילותם של פרוטאזות ציסטאין. אחד הסרפינים הביולוגיים הידועים ביותר הוא α-1-anti-trypsin (A1AT - איור 4.66) בגלל תפקידו בריאות, שם הוא מתפקד לעכב את פרוטאז האלסטאז. מחסור של A1AT מוביל אמפיזמה. זה יכול להיווצר כתוצאה ממחסור גנטי או מעישון סיגריות. מיני חמצן תגובתיים המיוצרים על ידי עישון סיגריות יכולים לחמצן שאריות מתיונין קריטיות (#358 של הצורה המעובדת) ב-A1AT, מה שהופך אותו לא מסוגל לעכב אלסטאז. ללא מעצורים, אלסטז יכול לתקוף רקמת ריאה ולגרום לאמפיזמה. רוב הסרפינים עובדים מחוץ לתאים. בדם, למשל, סרפינים כמו אנטיתרומבין יכולים לעזור בוויסות תהליך הקרישה.
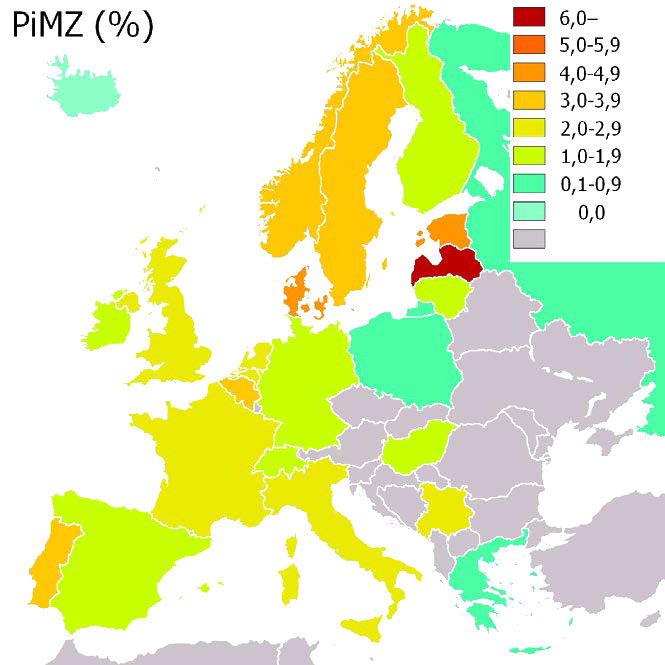
איור 4.67 - שכיחות מחסור α-1-אנטיטריפסין (PIMZ) באירופה באחוזים. ויקיפדיה
סוכנים אנטי ויראליים
מעכבי פרוטאז משמשים כסוכנים אנטי-ויראליים לאיסור התבגרות של חלבונים נגיפיים - בדרך כלל חלבוני מעיל ויראלי.
הם חלק מ"קוקטיילים "תרופתיים המשמשים לעיכוב התפשטות ה- HIV בגוף ומשמשים גם לטיפול בזיהומים נגיפיים אחרים, כולל הפטיטיס C. הם נחקרו גם לשימוש בטיפול במלריה וייתכן שיש להם יישום כלשהו גם בטיפולים נגד סרטן.


