4.2: שליטה בפעילות אנזימטית
- Page ID
- 207556
גרסה להדפסה של סעיף זה נמצאת כאן: BiochemFFA_4_2.pdf. ספר הלימוד כולו זמין בחינם מהמחברים בכתובת http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
ויסות פעילות האנזים
מלבד יכולתם להאיץ מאוד את שיעורי התגובות הכימיות בתאים, לאנזימים יש תכונה נוספת שהופכת אותם לבעלי ערך. מאפיין זה הוא שניתן להסדיר את פעילותם, מה שמאפשר להפעיל אותם ולהשבית אותם, לפי הצורך. זה חשוב מאוד בשמירה על הומאוסטזיס, ומאפשר לתאים להגיב בדרכים מבוקרות לשינויים בתנאים הפנימיים והחיצוניים כאחד.
עיכוב של אנזימים ספציפיים על ידי תרופות יכול גם להיות שימושי מבחינה רפואית. הבנת המנגנונים השולטים בפעילות האנזים היא אפוא בעלת חשיבות רבה.
עיכוב
תחילה נדון בארבעה סוגים של עיכוב אנזימים-תחרותי, לא תחרותי, לא תחרותי ועיכוב התאבדות. מבין אלה, שלושת הסוגים הראשונים הם הפיכים. האחרון, עיכוב התאבדות, הוא לא.
עיכוב תחרותי
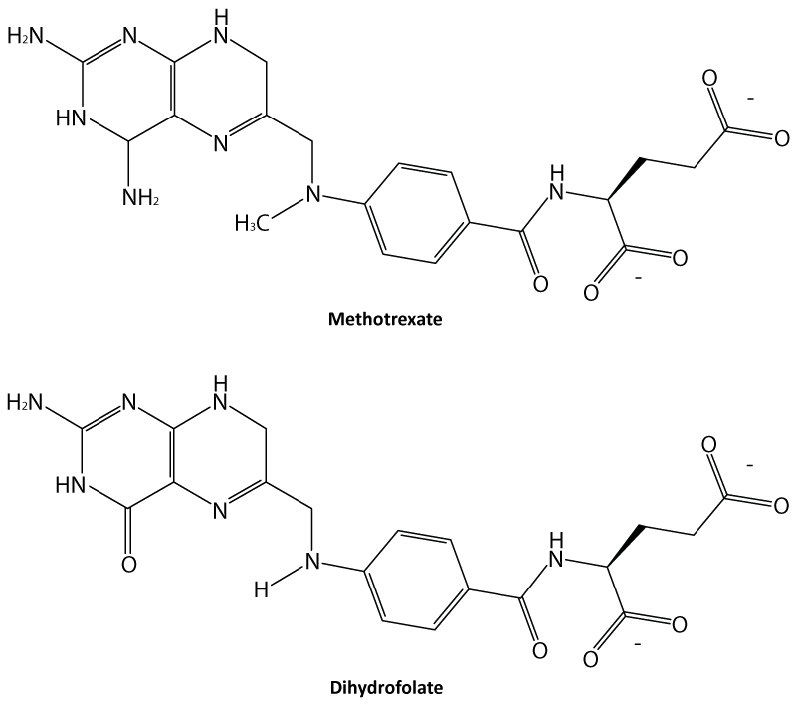
כנראה שהסוג הקל ביותר של עיכוב אנזים להבנה הוא עיכוב תחרותי והוא זה המנוצל ביותר מבחינה פרמצבטית. מולקולות שהן מעכבות תחרותיות של אנזימים דומות לאחד המצעים הנורמליים של אנזים. דוגמה לכך היא מטוטרקסט, הדומה למצע הפולאט של האנזים דיהידרופולט רדוקטאז (DHFR). אנזים זה בדרך כלל מזרז את הפחתת חומצה פולית, תגובה חשובה בחילוף החומרים של נוקליאוטידים.
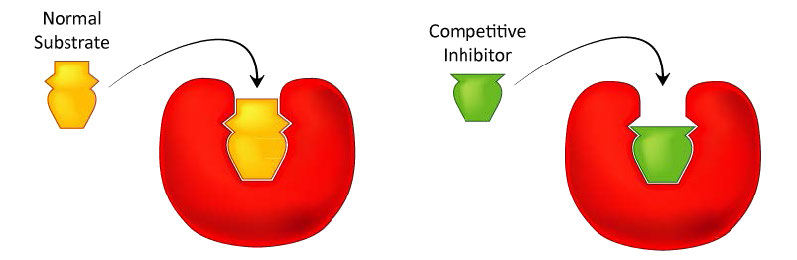
איור 4.33 - מעכבים תחרותיים דומים למצע הרגיל ומתחרים על הקישור באתר הפעיל. תמונה על ידי אליה קים
כריכת מעכב
כאשר התרופה מתוטרקסט קיימת, חלק מהאנזים DHFR נקשר אליו, במקום לפולאט, ובזמן שמטוטרקסט נקשר, האנזים אינו פעיל ואינו מסוגל לקשור חומצה פולית. לפיכך, האנזים מעוכב. יש לציין כי אתר הקישור ב- DHFR עבור methotrexate הוא האתר הפעיל, אותו מקום שחומצה פולית בדרך כלל נקשרת. כתוצאה מכך, methotrexate 'מתחרה' עם חומצה פולית על הקישור לאנזים. ככל שיש יותר מטוטרקסט, כך הוא מתחרה בצורה יעילה יותר עם חומצה פולית על האתר הפעיל של האנזים. לעומת זאת, ככל שיש יותר חומצה פולית, כך יש פחות השפעה של מטוטרקסט על האנזים מכיוון שחומצה פולית עולה עליו.
אין השפעה על Vmax
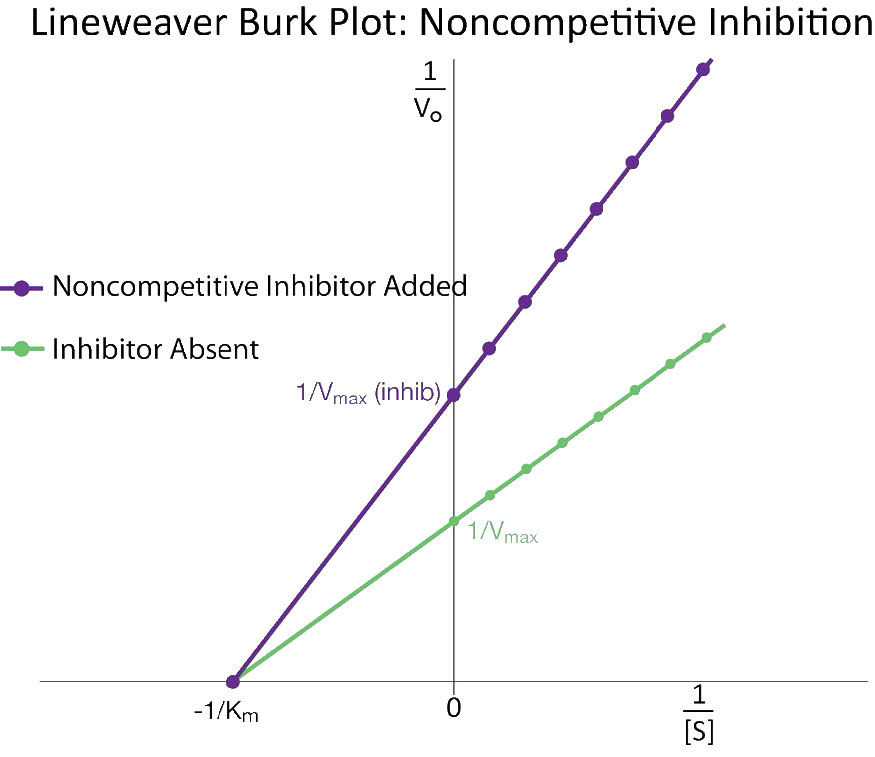
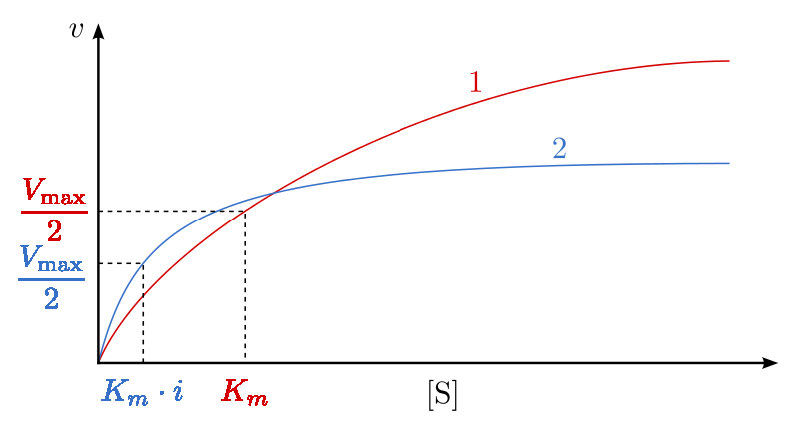
כיצד אנו לומדים עיכוב תחרותי? זה נעשה בדרך כלל כדלקמן. ראשית, מבצעים קבוצה של תגובות V0 לעומת [S] ללא מעכב (20 צינורות בערך, עם חיץ וכמויות קבועות של אנזים, כמויות משתנות של מצע, זמני תגובה שווים). V0 לעומת [S] משורטט (איור 4.35 קו אדום), כמו גם 1/V0 לעומת 1/ [S] (איור 4.36 קו ירוק). לאחר מכן, קבוצה שנייה של תגובות מבוצעת באותו אופן כמו קודם, אלא כי כמות קבועה של מעכב methotrexate מתווסף לכל צינור. בריכוזים נמוכים של סובסטרט, המטוטרקסט מתחרה על האנזים ביעילות, אך בריכוזים גבוהים של סובסטרט, למעכב תהיה השפעה מופחתת בהרבה, מכיוון שהמצע מתחרה עליו, בשל ריכוזו הגבוה יותר (זכרו שהמעכב נמצא בריכוז קבוע).
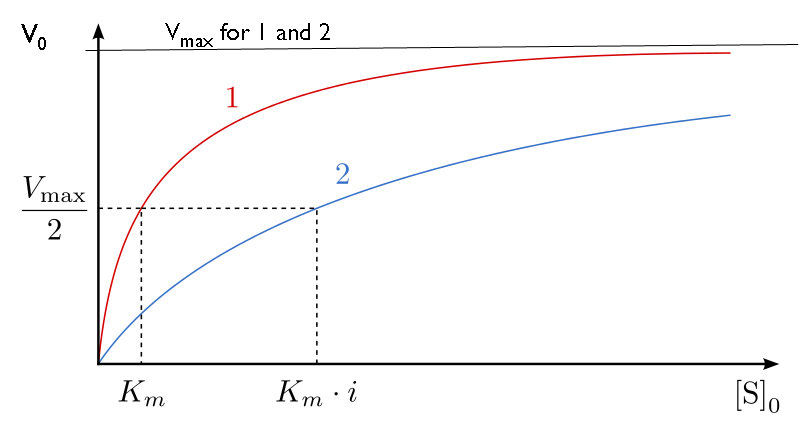
מבחינה גרפית, התוצאות של ניסויי מעכבים אלה מוצגות באיור 4.35 (קו כחול) ובאיור 4.36 (קו כתום). שימו לב שבריכוזי מצע גבוהים, למעכב התחרותי אין למעשה השפעה, מה שגורם לאנזים להישאר ללא שינוי. \(V_{max}\) כדי לחזור ולהדגיש, זה נובע מהעובדה שבריכוזי מצע גבוהים, המעכב אינו מתחרה היטב. עם זאת, בריכוזי מצע נמוכים יותר, זה כן.
מוגבר \(K_m\)
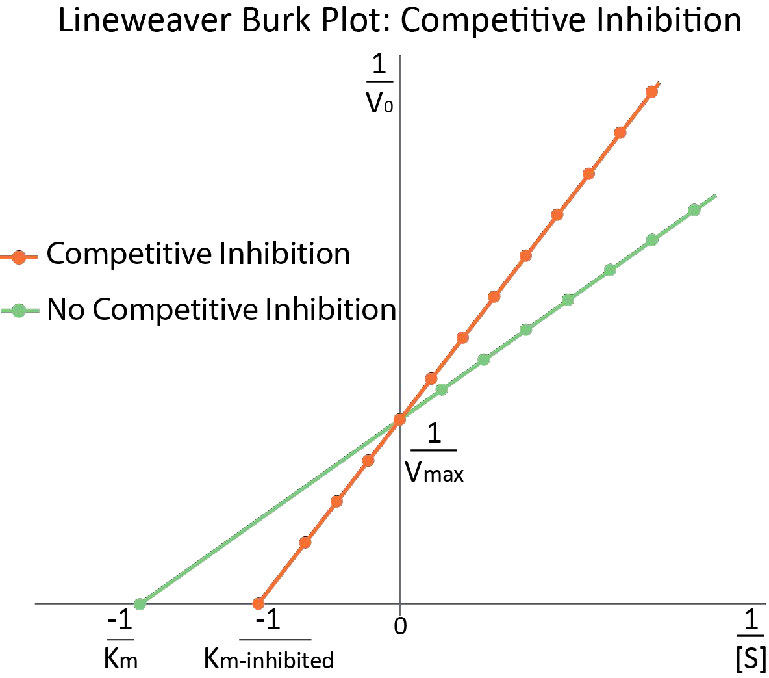
בתגובות מעוכבות תחרותיות, ה-Km לכאורה של האנזים עבור המצע גדל (\(-1/K_m\)מתקרב לאפס - קו אדום באיור 4.36) כאשר המעכב קיים בהשוואה למועד שבו המעכב נעדר, ובכך ממחיש את התחרות הטובה יותר של המעכב בריכוזי מצע נמוכים יותר. אולי לא ברור מדוע אנו מכנים את ה-Km המשתנה ה-Km לכאורה של האנזים. הסיבה היא שהמעכב לא ממש משנה את הזיקה של האנזים למצע הפולאט. נראה שזה רק עושה זאת. הסיבה לכך היא הדרך בה פועלת עיכוב תחרותי. כאשר המעכב התחרותי קושר את האנזים, הוא למעשה 'יוצא מפעולה'. לאנזימים לא פעילים אין זיקה למצע וגם אין פעילות. אנחנו לא יכולים למדוד Km לאנזים לא פעיל.
מולקולות האנזים שאינן קשורות על ידי מטוטרקסט יכולות, למעשה, לקשור חומצה פולית והן פעילות. למתוטרקסט אין כל השפעה עליהם וערכי ה- Km שלהם אינם משתנים. מדוע אם כן, האם Km נראה גבוה יותר בנוכחות מעכב תחרותי? הסיבה היא שלמעכב התחרותי יש השפעה גדולה יותר של הפחתת כמות האנזים הפעיל בריכוזים נמוכים יותר של מצע מאשר בריכוזים גבוהים יותר של מצע. כאשר כמות האנזים מופחתת, חייב להיות יותר מצע כדי לספק את כמות האנזים המופחתת מספיק כדי להגיע ל-Vmax/2.
ראוי לציין כי בעיכוב תחרותי, אחוז האנזים הלא פעיל משתנה באופן דרסטי בטווח הערכים [S] המשמשים. כדי להתחיל, בערכי [S] נמוכים, האחוז הגדול ביותר של האנזים מעוכב. ב- [S] גבוה, אין אחוז משמעותי מהאנזים מעוכב. זה לא תמיד המקרה, כפי שנראה בעיכוב לא תחרותי.
עיכוב לא תחרותי
סוג שני של עיכוב משתמש במעכבים שאינם דומים למצע ונקשרים לא לאתר הפעיל, אלא לאתר נפרד באנזים (איור 4.37). ההשפעה של קשירת מעכב לא תחרותי שונה באופן משמעותי מקשירת מעכב תחרותי מכיוון שאין תחרות. במקרה של עיכוב תחרותי, ניתן להפחית את השפעת המעכב ובסופו של דבר להציף בכמויות הולכות וגדלות של מצע. הסיבה לכך הייתה שהגדלת המצע גרמה לאחוזים הולכים וגדלים של האנזים לפעילים. עם עיכוב לא תחרותי, להגדלת כמות המצע אין השפעה על אחוז האנזים הפעיל. ואכן, בעיכוב לא תחרותי, אחוז האנזים המעוכב נשאר זהה בכל הטווחים של [S].
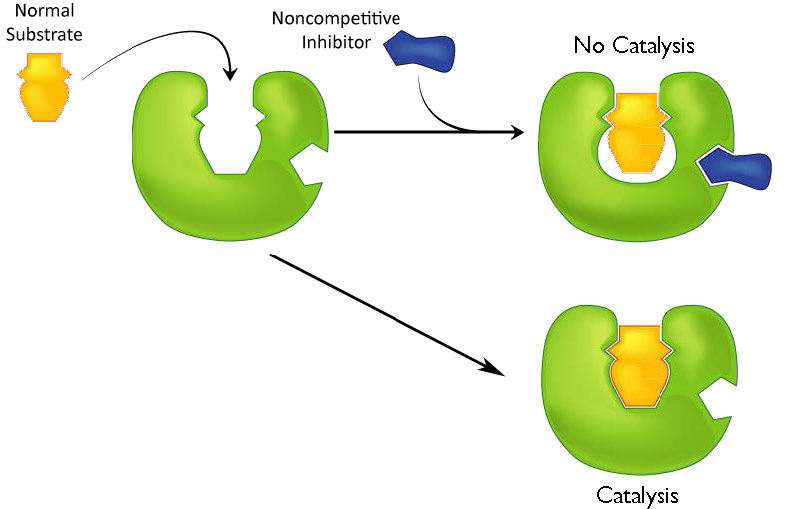
משמעות הדבר היא, אם כן, שעיכוב לא תחרותי מפחית ביעילות את כמות האנזים באותה כמות קבועה בניסוי טיפוסי בכל ריכוז מצע המשמש. ההשפעה של עיכוב זה מוצגת באיור 4.38 & 4.39. כפי שאתה יכול לראות, \(V_{max}\) מצטמצם בעיכוב לא תחרותי בהשוואה לתגובות חסרות עכבות.
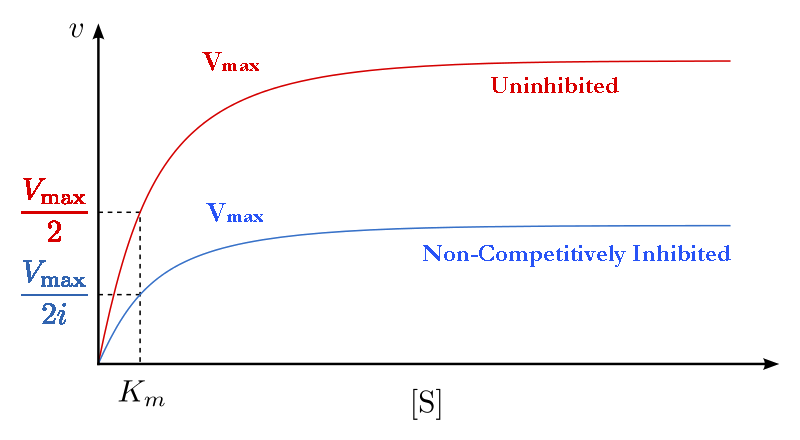
זה הגיוני אם נזכור ש-Vmax תלוי בכמות האנזים הקיימת. צמצום כמות האנזים הנוכחי מפחית\(V_{max}\). בעיכוב תחרותי, זה לא מתרחש באופן ניתן לזיהוי, מכיוון שבריכוזי מצע גבוהים, יש בעצם 100% מהאנזים פעיל \(V_{max}\) ונראה שהוא לא משתנה. בנוסף, קM לתגובות לא מעוכבות באופן תחרותי אינו משתנה מזה של תגובות ללא עכבות. הסיבה לכך היא שכפי שצוין קודם לכן, ניתן למדוד רק את \(K_m\) האנזימים הפעילים \(K_m\) והוא קבוע לאנזים נתון.
עיכוב לא תחרותי
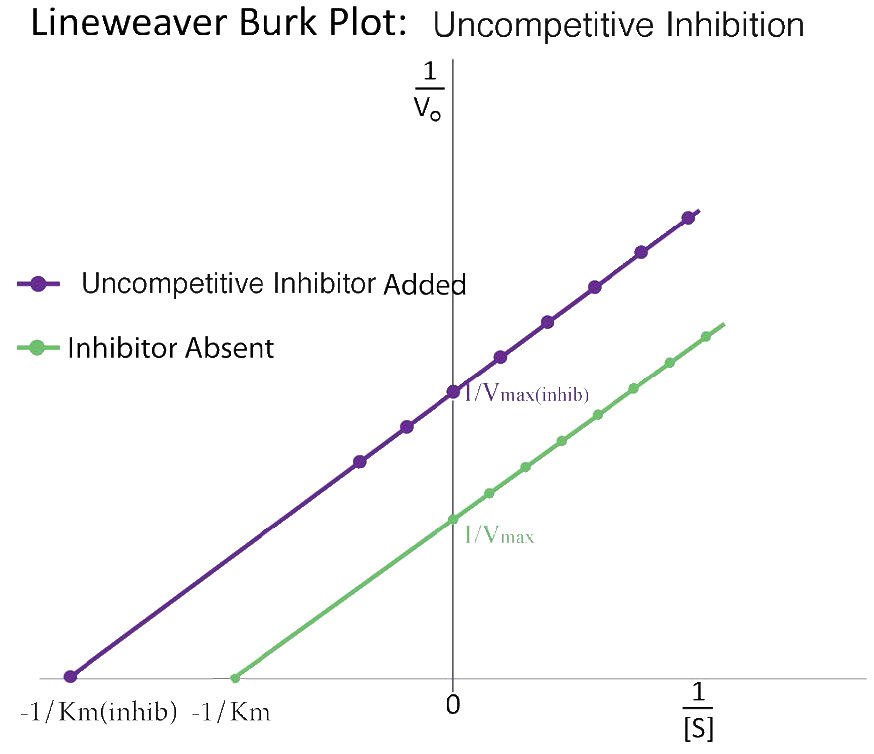
סוג שלישי של עיכוב אנזימטי הוא של עיכוב לא תחרותי, שיש לו את המאפיין המוזר של Vmax מופחת כמו גם Km מופחת. ההסבר לתוצאות לכאורה מוזרות אלה נעוץ בעובדה שהמעכב הלא תחרותי נקשר רק לקומפלקס האנזים-סובסטרט (ES) (איור 4.40). הקומפלקס הקשור למעכבים נוצר בעיקר בריכוזים של מצע גבוה וקומפלקס ES-I אינו יכול לשחרר מוצר בזמן שהמעכב קשור, ובכך מסביר את המופחת. \(V_{max}\)
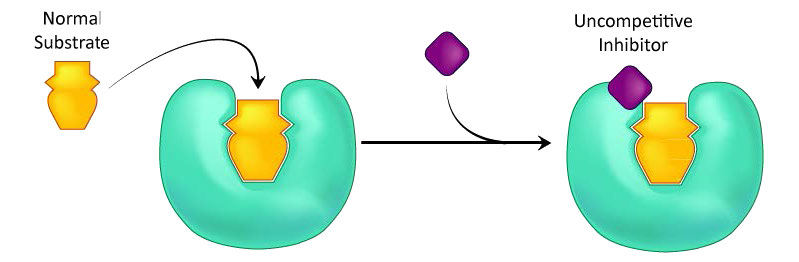
קצת יותר קשה להמשיג את ה- Km המופחת. הסיבה היא שהמתחם הקשור למעכבים מפחית ביעילות את ריכוז מתחם ה- ES. לפי העיקרון של Le Chatelier, מתרחש שינוי ליצירת קומפלקס ES נוסף, וכתוצאה מכך פחות אנזים חופשי ויותר אנזים בצורות ES ו- ESI (ES עם מעכב). ירידות באנזים החופשי תואמות לאנזים בעל זיקה גדולה יותר למצע שלו. לפיכך, באופן פרדוקסלי, עיכוב לא תחרותי גם פוחת \(V_{max}\) וגם מגביר את הזיקה של האנזים למצע שלו (\(K_m\)- איורים 4.41 & 4.42).
עיכוב התאבדות
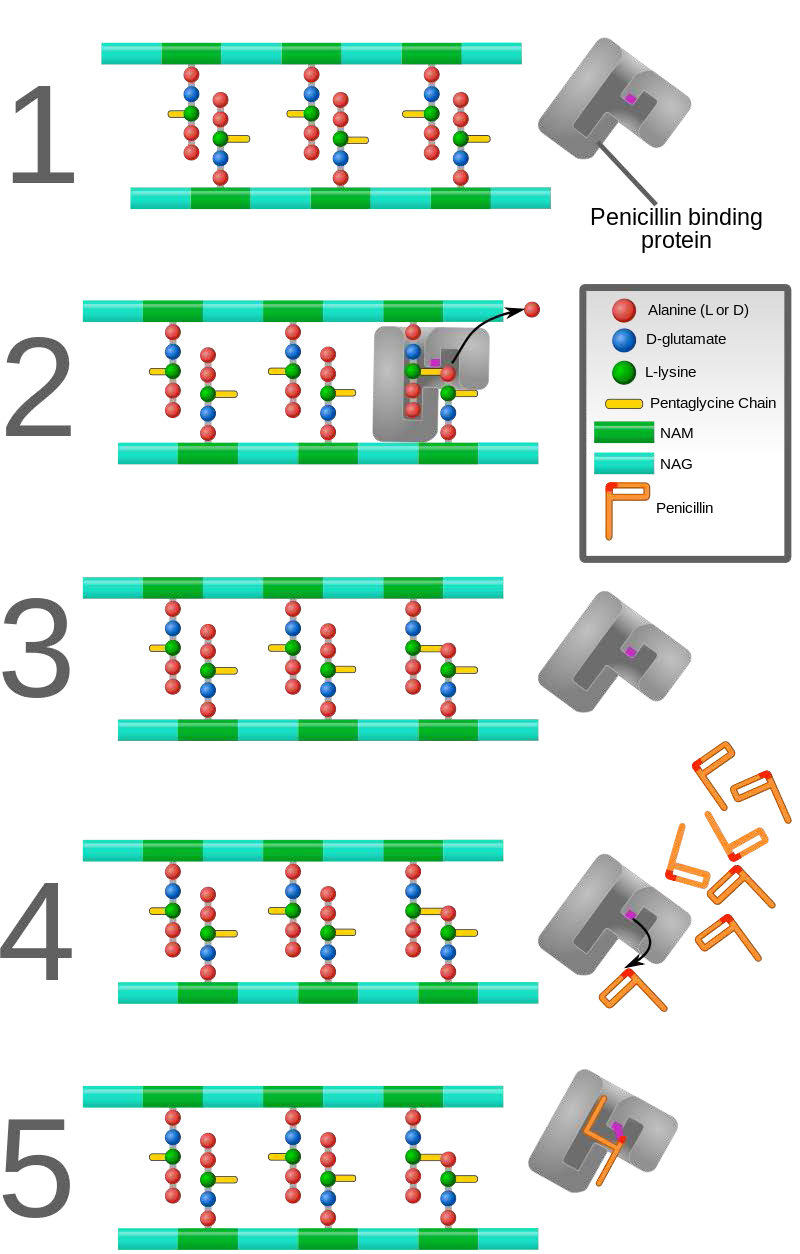
בניגוד לשלושת סוגי העיכוב הראשונים, הכוללים קישור הפיך של המעכב לאנזים, עיכוב ההתאבדות הוא בלתי הפיך, מכיוון שהמעכב נקשר באופן קוולנטי לאנזים במהלך העיכוב. עיכוב התאבדות דומה למדי לעיכוב תחרותי מכיוון שהמעכב דומה בדרך כלל למצע ונקשר לאתר הפעיל של האנזים. ההבדל העיקרי הוא שמעכב ההתאבדות מגיב כימית באתר הפעיל ויוצר איתו קשר המונע את הסרתו. מנגנון כזה הוא זה המופעל על ידי פניצילין (איור 4.43), המקשר באופן קוולנטי לאנזים החיידקי, DD transpeptidase ומונע ממנו לתפקד. מכיוון שתפקידו התקין של האנזים הוא ליצור קשר הכרחי למתחם הפפטידוגליקן של דופן התא החיידקי, דופן התא אינה יכולה להיווצר כראוי וחיידקים אינם יכולים להתרבות.
שליטה באנזימים
ראוי לדבר בשלב זה על מנגנונים שתאים משתמשים בהם כדי לשלוט באנזימים. ישנן ארבע שיטות כלליות המופעלות:
- אלוסטריזם,
- שינוי קוולנטי,
- גישה למצע, ו
- שליטה בסינתזה/פירוק האנזים.
אנזימים מסוימים נשלטים על ידי יותר מאחת משיטות אלה.
אלוסטריזם
המונח אלוסטריזם מתייחס לעובדה שפעילותם של אנזימים מסוימים יכולה להיות מושפעת מקשירת מולקולות קטנות. מולקולות הגורמות להשפעות אלוסטריות מגיעות בשני סיווגים. אלה שהם מצעים לאנזימים שהם משפיעים עליהם נקראים אפקטורים הומוטרופיים ואלו שאינם מצעים נקראים אפקטורים הטרוטרופיים.
האפקטורים ההומוטרופיים הם בדרך כלל מפעילים של האנזימים אליהם הם נקשרים וניתן לראות את תוצאות פעולתם בהמרה של העקומה ההיפרבולית האופיינית לעלילה V0 לעומת [S] לאנזים (איור 4.18), כשהם מומרים לעלילה סיגמואידית (איור 4.44). זה נובע מההמרה של האנזים ממצב T למצב R על קשירת המצע/אפקט ההומוטרופי.
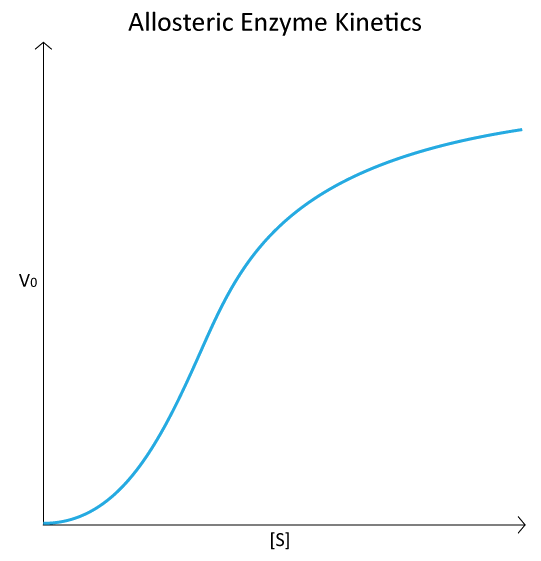
עלילת V0 לעומת [S] של תגובות אנזים אלוסטריות דומה לעקומת קשירת החמצן של המוגלובין (ראה איור 2.83). למרות שהמוגלובין אינו אנזים ולכן אינו מזרז תגובה, הדמיון בין החלקות אינו מקרי. בשני המקרים, הקישור של מולקולה חיצונית נמדד - ישירות, בחלקת ההמוגלובין, ובעקיפין על ידי עלילת V0 לעומת [S], שכן קישור המצע הוא גורם למהירות תגובת האנזים.
עיכוב אלוסטרי
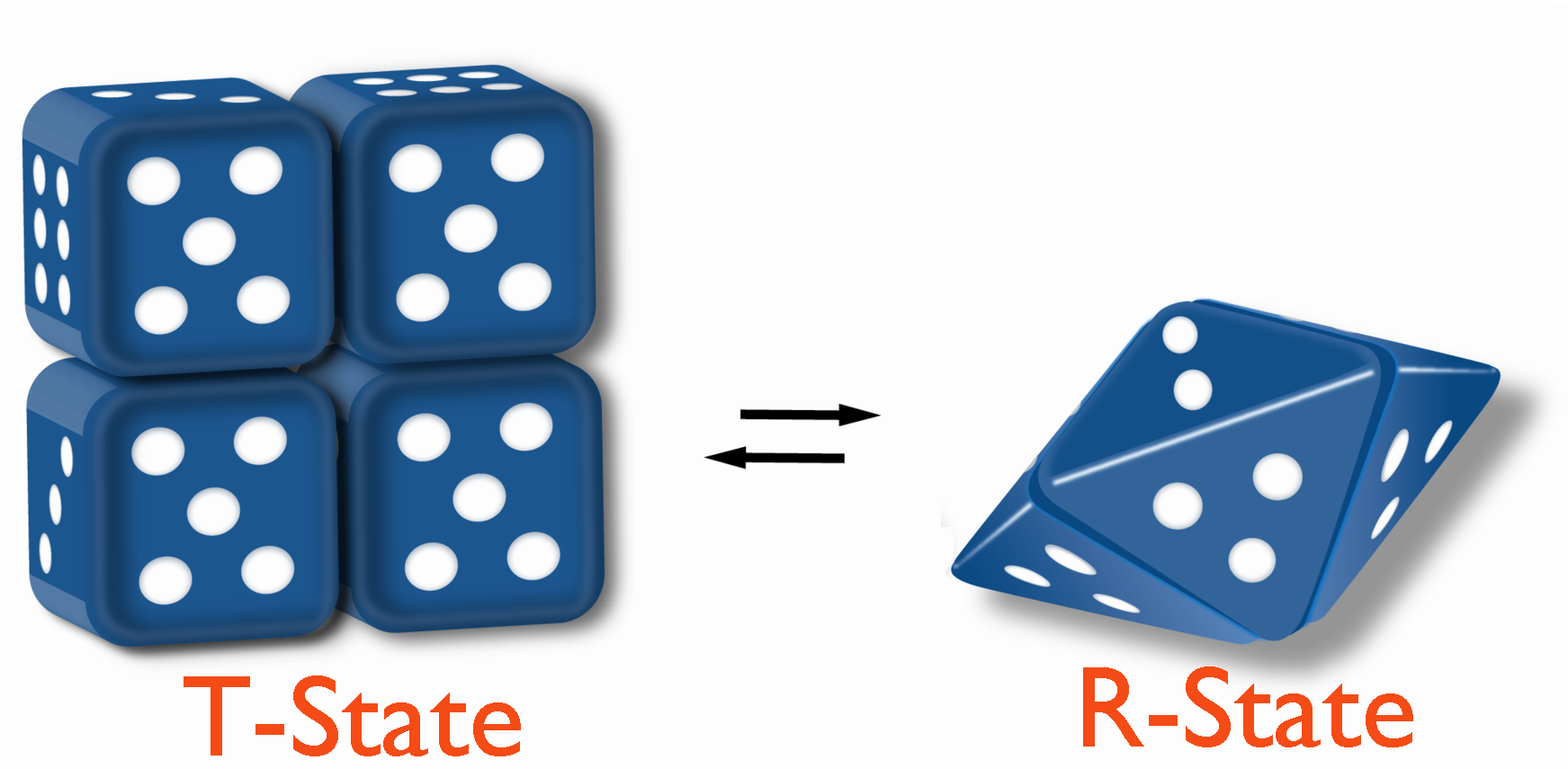
באופן אלוסטרי, ויסות האנזימים הללו פועל על ידי גרימת מצבים פיזיקליים שונים (צורות, כביכול) המשפיעים על יכולתם להיקשר למצע. כאשר אנזים מעוכב על ידי קשירת אפקטור, הוא מומר למצב T (T = הדוק), יש לו זיקה מופחתת למצע ובאמצעות זה התגובה מואטת.
הפעלה אלוסטרית
מצד שני, כאשר אנזים מופעל על ידי קישור אפקטור, הוא הופך למצב R (R = רגוע) וקושר את המצע הרבה יותר בקלות. כאשר אין אפקטור, האנזים עשוי להיות בתערובת של מצבי T ו- R.
עיכוב משוב
סוג מעניין של בקרה אלוסטרית מוצג על ידי רדוקטאז HMG-CoA, המזרז תגובה חשובה במסלול המוביל לסינתזה של כולסטרול. קשירת הכולסטרול לאנזים מפחיתה את פעילות האנזים באופן משמעותי. כולסטרול אינו מצע לאנזים, ולכן הוא גורם הטרוטרופי.
עם זאת, יש לציין כי כולסטרול הוא התוצר הסופי של המסלול בו HMG-CoA רדוקטאז מזרז תגובה. כאשר אנזימים מעוכבים על ידי תוצר סופי של המסלול בו הם משתתפים, אומרים שהם מפגינים עיכוב משוב.
עיכוב משוב פועל תמיד על ידי אלוסטריזם ובהמשך, מספק שליטה חשובה ויעילה במסלול שלם. על ידי עיכוב אנזים מוקדם במסלול, זרימת החומרים (והידרוליזה של ATP הנדרשת לעיבודם) לכל המסלול נעצרת או מופחתת, בהנחה שאין שיטות אספקה חלופיות.
בקרת מסלול
במסלול הביוסינתזה של הכולסטרול, עצירת האנזים האחד הזה משפיעה על כיבוי (או לפחות האטה) של המסלול כולו. זה משמעותי מכיוון שאחרי קטליזה על ידי רדוקטאז HMG-CoA, יש למעלה מ-20 תגובות נוספות הדרושות לייצור כולסטרול, רבות מהן דורשות אנרגיית ATP. כיבוי תגובה אחת עוצר את כולן. דוגמה מצוינת נוספת לבקרה אלוסטרית ועיכוב משוב היא האנזים ATCase, שנדון להלן.
ATCase
דוגמה מעניינת נוספת לבקרה אלוסטרית ועיכוב משוב קשורה לאנזים אספרטט טרנסקרבמוילאז (ATCase). לאנזים זה, המזרז שלב בסינתזה של נוקלאוטידים פירמידין, יש 12 יחידות משנה. אלה כוללים שש יחידות משנה קטליטיות זהות ושש יחידות משנה רגולטוריות זהות. יחידות המשנה הקטליטיות נקשרות למצע ומזרזות תגובה. יחידות המשנה הרגולטוריות נקשרות ל-ATP או ל-CTP. אם הם נקשרים ל- ATP, יחידות המשנה של האנזים מסדרות את עצמן במצב R.
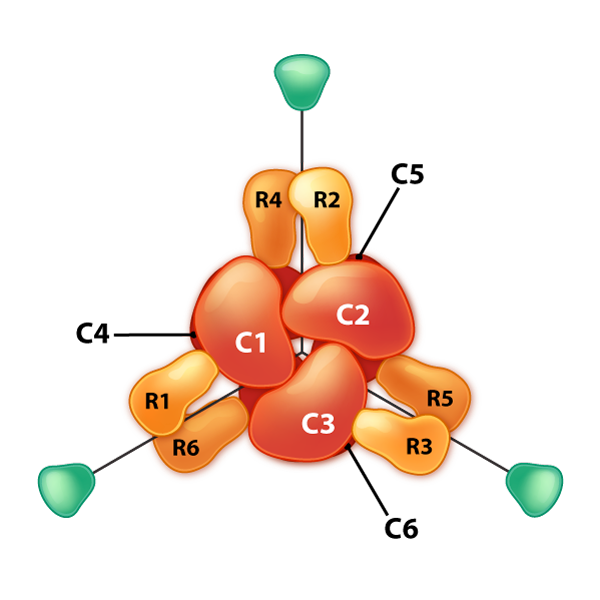
מדינת R
מצב R של ATCase מאפשר למצע גישה קלה יותר לששת האתרים הפעילים והתגובה מתרחשת מהר יותר. עבור אותה כמות מצע, לאנזים במצב R תהיה מהירות גבוהה יותר מאותו אנזים שאינו במצב R. לעומת זאת, אם האנזים נקשר ל- CTP באחת מיחידות המשנה הרגולטוריות שלו, יחידות המשנה יסדרו במצב T ובצורה זו, למצע לא תהיה גישה קלה לאתרים הפעילים, וכתוצאה מכך מהירות איטית יותר עבור אותו ריכוז של מצע בהשוואה למצב R. ATCase מעניין בכך שהוא יכול גם להתהפך למצב R כאשר אחד המצעים (אספרטט) נקשר לאתר פעיל בתוך אחת מיחידות המשנה הקטליטיות.
לאספרטאט יש השפעה של הפעלת הפעולה הקטליטית של האנזים על ידי העדפת מצב R. לפיכך, אספרטט, שהוא מצע של האנזים הוא אפקטור הומוטרופי ו-ATP ו-CTP, שאינם מצעים של האנזים הם אפקטורים הטרוטרופיים של ATCase.
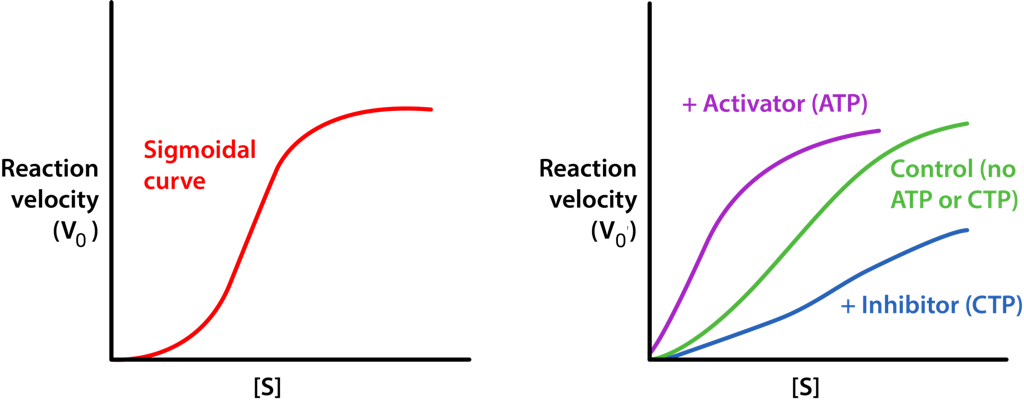
מודלים אלוסטריים
ישנם שלושה מודלים המשמשים בדרך כלל כדי להסביר כיצד אלוסטריזם מווסת את פעילות האנזים הרב-תת-יחידות. הם ידועים בשם
- דגם מונוד-ווימן-צ'אנגו (MWC) (המכונה גם הדגם המתואם),
- המודל הרציף (המכונה גם KNF),
- ומודל המורפיון.
כל המודלים מתארים מצב מתוח (T) שהוא פחות פעיל קטליטית ומצב רגוע (R) פעיל יותר קטליטית. המודלים נבדלים באופן שבו המדינות משתנות.
מודל רציף
במודל הרצף, קישור של אפקטור אלוסטרי על ידי יחידת משנה אחת גורם לו להשתנות ממצב T ל- R (או להיפך) ושינוי זה מקל על יחידות משנה סמוכות לשנות מצב דומה. במודל זה, קיים קשר סיבה/תוצאה בין קישור של אפקטור ביחידת משנה אחת לבין שינוי מצב על ידי יחידת משנה סמוכה.
בהמוגלובין, למשל, קישור של חמצן אחד ביחידה אחת של המתחם עשוי לגרום ליחידה זו להתהפך למצב R, ובאמצעות אינטראקציות עם יחידות משנה אחרות, לגרום להם להעדיף אימוץ תצורת R לפני שהם נקשרים לחמצן. באופן זה, קישור של יחידת משנה אחת מעדיף קישור של אחרים וניתן להסביר את שיתוף הפעולה על ידי השינוי בזיקה המחייבת כאשר ריכוז החמצן משתנה.
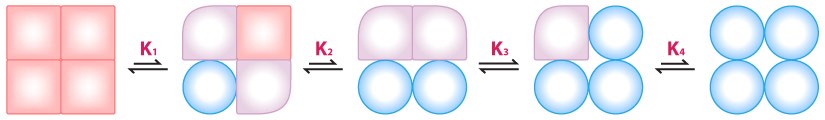
דגם MWC
דגם ה- MWC פחות אינטואיטיבי. בתוכו, המתחם כולו משנה את המצב מ- T ל- R (או להיפך) ללא תלות בקשירת האפקטורים. התהפכות בין מצבי T למצבי R מוצגת בשיווי משקל של מצבים בהיעדר אפקטור (לדוגמה, יחס של 50 עד 1 של T/R יחס זה מכונה L, אז L = T/R). לקשירת האפקטור על ידי קומפלקס האנזים יש נטייה "לנעול" את המתחם במצב. קישור מעכבים יגדיל את היחס בין T/R ואילו קישור של מפעילים יגדיל את R ובכך יקטין את הקצבה של T/R.
מודל מורפיון
מודל המורפאין דומה למודל MWC, אך עם שלב נוסף של דיסוציאציה של יחידות המשנה. מודל MWC מציע כי התהפכות בין מצבי R ו- T מתרחשת על ידי המתחם בכללותו ומתרחשת בכל היחידות בו זמנית. מודל המורפאין מציע במקום זאת שהאנזים הרב-יחידות יתפרק ליחידות בודדות שיכולות לאחר מכן להתהפך במבנה וליצור מחדש את הקומפלקס. במודל המורפאין, רק יחידות בעלות צורה זהה (כולן R, למשל) יכולות להתכנס במתחם, ובכך להסביר את מצב "All-R-" או "all-T-" שנמצא במודל MWC.
למספר רב של אנזימים, כולל בולטים כמו סינתאז ציטראט, אצטיל-CoA קרבוקסילאז, גלוטמט דהידרוגנאז, ריבונוקלאוטיד רדוקטאז ולקטט דהידרוגנאז יש התנהגות התואמת את מודל המורפאין.

שליטה קוולנטית באנזימים
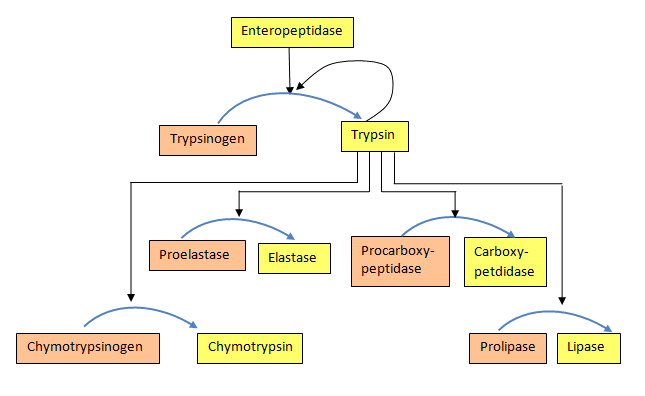
חלק מהאנזימים מסונתזים בצורה לא פעילה לחלוטין והפעלתם מחייבת ביקוע קשרים קוולנטיים בהם. צורות לא פעילות כאלה של אנזימים נקראות זימוגנים. דוגמאות כוללות את החלבונים המעורבים בקרישת דם ואנזימים פרוטאוליטיים של מערכת העיכול, כגון טריפסין, כימוטריפסין, פפסין ואחרים.
סינתזה של כמה אנזימים בצורה לא פעילה הגיונית מאוד כאשר פעילות האנזים עלולה להזיק לרקמה שבה הוא נוצר. לדוגמא, המצב הכואב המכונה דלקת הלבלב מתעורר כאשר אנזימי עיכול המיוצרים בלבלב מופעלים מוקדם מדי ובסופו של דבר תוקפים את הלבלב.
מפלים
הן לאנזימי קרישת הדם והן לאנזימי העיכול, הזימוגנים מופעלים במפל פרוטאז. זה קורה כאשר הפעלה של אנזים אחד מפעילה אחרים במעין תגובת שרשרת. בתכנית כזו האנזים הראשון המופעל פרוטאוליטית מבקע את הזימוגן השני, וגורם להפעלתו, אשר בתורו מפעיל שליש וזה עשוי להתקדם במספר רמות של פעולה אנזימטית (איור 4.50).
היתרון במפלים הוא בכך שהם מאפשרים לכמות גדולה של זימוגנים להיות מופעלים די מהר, מכיוון שיש הגברה של האות בכל רמה של קטליזה.
זימוגנים נמצאים גם בשפע בדם. קרישת דם כוללת פילמור של חלבון המכונה פיברין. מכיוון שהיווצרות אקראית של פיברין מסוכנת ביותר מכיוון שהיא יכולה לחסום את זרימת הדם, ועלולה לגרום להתקף לב/שבץ מוחי, הגוף מסנתז את הפיברין כזימוגן (פיברינוגן) והפעלתו נובעת מ"מפל "של הפעלות של פרוטאזות המתעוררות כאשר מתקבל אות מפצע. באופן דומה, האנזים המזרז הסרה של קרישי פיברין (פלסמין) מסונתז גם כזימוגן (פלסמינוגן), שכן הסרת קריש אקראית תהיה גם מסוכנת (ראה להלן גם).
זרחון/דה-פוספורילציה
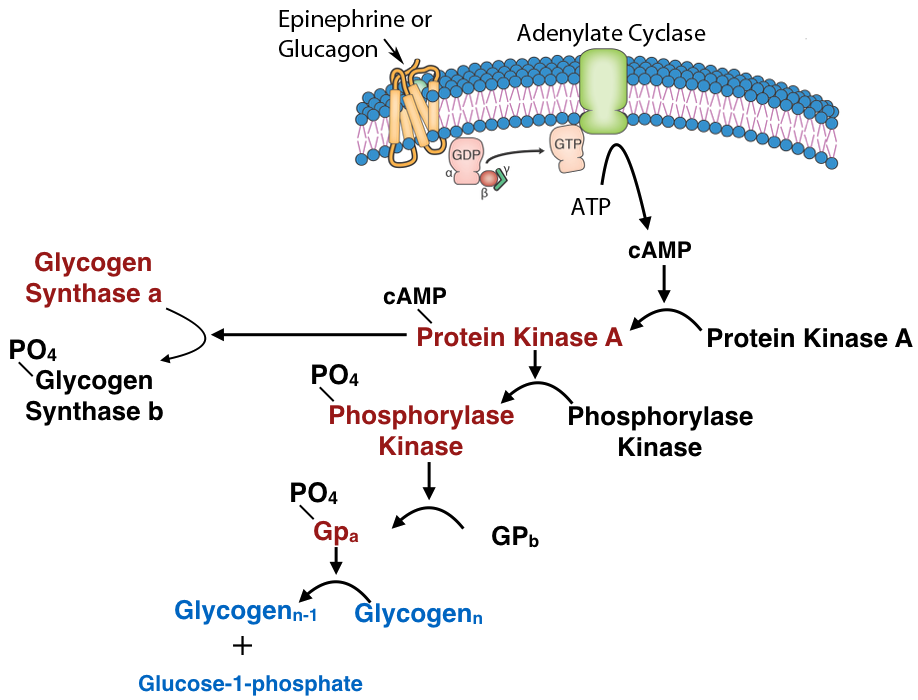
מנגנון נפוץ נוסף לשליטה בפעילות האנזים על ידי שינוי קוולנטי הוא זרחון. הזרחון של אנזימים (על שרשראות הצד של שאריות סרין, תראונין או טירוסין) מתבצע על ידי קינאזות חלבון. אנזימים המופעלים על ידי זרחון יכולים להיות מווסתים על ידי הוספת קבוצות פוספט על ידי קינאזות או הסרתם על ידי פוספטאזות. לפיכך, סוג זה של שינוי קוולנטי הפיך בקלות, בניגוד למחשוף פרוטאוליטי.
הפחתה/חמצון
בקרה קוולנטית מעניינת של אנזימים באמצעות הפחתה/חמצון מוצגת בצמחים פוטוסינתטיים. בשלב האור של הפוטוסינתזה, האלקטרונים נרגשים מאור וזורמים דרך נשאים ל- NADP+ ויוצרים NADPH. לפיכך, באור, ריכוז ה- NADPH גבוה. כאשר ריכוז NADPH גבוה, גם ריכוז הפרדוקסין המופחת (מולקולה התורמת אלקטרונים ל- NADP+) גבוה.
פרדוקסין מופחת יכול להעביר אלקטרונים לתיורדוקסין, ולהפחית אותו. thioredoxin מופחת יכול, בתורו, להעביר אלקטרונים לחלבונים כדי להפחית את קשרי הדיסולפיד שלהם. ארבעה אנזימים הקשורים למחזור קלווין יכולים לקבל אלקטרונים מתיורדוקסין ולהיות מופעלים כתוצאה מכך.
אלה כוללים סדוהפטולוז 1,7-ביספוספטאז, ריבולוז-5-פוספט קינאז, פרוקטוז 1,6-ביספוספטאז וגליצראלדהיד 3-פוספט דהידרוגנאז. כך, באור, אלקטרונים זורמים, מה שגורם ל- NADPH להצטבר ולפרדוקסין לדחוף אלקטרונים לכיוון האנזימים הללו למעלה, להפעיל אותם ולהעדיף את מחזור קלווין. בחושך, ריכוז ה- NADPH המופחת, הפחתת הפרדוקסין והפחתת נפילת התיורדוקסין, וכתוצאה מכך אובדן אלקטרונים על ידי אנזימי מחזור קלווין (חמצון היוצרים מחדש קשרי דיסולפיד) ומחזור קלווין אינו פעיל.
מנגנוני בקרת אנזים אחרים
אמצעים אחרים לשליטה באנזימים מתייחסים לגישה למצע (שליטה ברמת המצע) ושליטה בסינתזת האנזים. הקסוקינאז הוא אנזים המווסת במידה רבה על ידי זמינות המצע שלו, גלוקוז. כאשר ריכוז הגלוקוז נמוך, תוצר הקטליזה של האנזים, גלוקוז-6-פוספט, מעכב את תפקוד האנזים.
ויסות האנזימים על ידי שליטה בסינתזה שלהם מכוסה בהמשך הספר בדיון הנוגע לשליטה בביטוי הגנים.


