6.3: Sheria za Thermodynamics
- Page ID
- 175960
Ujuzi wa Kuendeleza
- Jadili dhana ya entropy
- Eleza sheria ya kwanza na ya pili ya thermodynamics
Thermodynamics inahusu utafiti wa uhamisho wa nishati na nishati inayohusisha suala la kimwili. Suala hilo na mazingira yake yanayohusiana na kesi fulani ya uhamisho wa nishati huwekwa kama mfumo, na kila kitu nje ya mfumo huo kinaitwa mazingira. Kwa mfano, wakati inapokanzwa sufuria ya maji kwenye jiko, mfumo unajumuisha jiko, sufuria, na maji. Nishati huhamishwa ndani ya mfumo (kati ya jiko, sufuria, na maji). Kuna aina mbili za mifumo: kufunguliwa na kufungwa. Mfumo wa wazi ni moja ambayo nishati inaweza kuhamishwa kati ya mfumo na mazingira yake. Mfumo wa stovetop unafunguliwa kwa sababu joto linaweza kupotea ndani ya hewa. Mfumo uliofungwa ni ule ambao hauwezi kuhamisha nishati kwenye mazingira yake.
Viumbe vya kibaiolojia ni mifumo ya wazi. Nishati hubadilishana kati yao na mazingira yao, kwani hutumia molekuli za kuhifadhi nishati na kutolewa nishati kwa mazingira kwa kufanya kazi. Kama vitu vyote katika ulimwengu wa kimwili, nishati inakabiliwa na sheria za fizikia. Sheria za thermodynamics zinatawala uhamisho wa nishati ndani na kati ya mifumo yote ulimwenguni.
Sheria ya Kwanza ya Thermodynamics
Sheria ya kwanza ya thermodynamics inahusika na jumla ya nishati katika ulimwengu. Inasema kwamba kiasi hiki cha nishati ni mara kwa mara. Kwa maneno mengine, daima kumekuwa, na daima itakuwa, kiasi sawa cha nishati katika ulimwengu. Nishati ipo katika aina nyingi tofauti. Kwa mujibu wa sheria ya kwanza ya thermodynamics, nishati inaweza kuhamishwa kutoka sehemu kwa mahali au kubadilishwa kuwa aina tofauti, lakini haiwezi kuundwa au kuharibiwa. Uhamisho na mabadiliko ya nishati hufanyika karibu nasi wakati wote. Mababu ya mwanga hubadilisha nishati ya umeme katika nishati ya mwanga. Miiko ya gesi hubadilisha nishati ya kemikali kutoka gesi asilia kuwa nishati ya joto. Mimea hufanya mojawapo ya mabadiliko ya nishati yenye manufaa zaidi duniani: ile ya kubadili nishati ya jua ndani ya nishati ya kemikali iliyohifadhiwa ndani ya molekuli za kikaboni (Mchoro 2.3.b.1). Baadhi ya mifano ya mabadiliko ya nishati ni inavyoonekana katika Kielelezo\(\PageIndex{1}\).
Changamoto kwa viumbe hai vyote ni kupata nishati kutoka kwa mazingira yao katika fomu ambazo zinaweza kuhamisha au kubadilisha kuwa nishati inayoweza kutumika kufanya kazi. Seli hai zimebadilika ili kukidhi changamoto hii vizuri sana. Nishati ya kemikali iliyohifadhiwa ndani ya molekuli za kikaboni kama vile sukari na mafuta hubadilishwa kupitia mfululizo wa athari za kemikali za mkononi kuwa nishati ndani ya molekuli za ATP. Nishati katika molekuli za ATP zinapatikana kwa urahisi kufanya kazi. Mifano ya aina za kazi ambazo seli zinahitaji kufanya ni pamoja na kujenga molekuli tata, kusafirisha vifaa, kuimarisha mwendo wa kumpiga wa cilia au flagella, kuambukizwa nyuzi za misuli ili kuunda harakati, na uzazi.

Sheria ya Pili ya Thermodynamics
Kazi ya msingi ya kiini hai ya kupata, kubadilisha, na kutumia nishati kufanya kazi inaweza kuonekana rahisi. Hata hivyo, sheria ya pili ya thermodynamics inaelezea kwa nini kazi hizi ni ngumu kuliko zinaonekana. Hakuna hata uhamisho wa nishati tuliyojadiliwa, pamoja na uhamisho wote wa nishati na mabadiliko katika ulimwengu, ni ufanisi kabisa. Katika kila uhamisho wa nishati, kiasi fulani cha nishati kinapotea kwa fomu ambayo haitumiki. Mara nyingi, fomu hii ni nishati ya joto. Thermodynamically, nishati ya joto hufafanuliwa kama nishati iliyohamishwa kutoka kwenye mfumo mmoja hadi mwingine ambayo haifanyi kazi. Kwa mfano, wakati ndege inapita kupitia hewa, baadhi ya nishati ya ndege ya kuruka inapotea kama nishati ya joto kutokana na msuguano na hewa inayozunguka. Msuguano huu kwa kweli huponya hewa kwa kuongeza kasi ya molekuli za hewa kwa muda mfupi. Vivyo hivyo, nishati fulani hupotea kama nishati ya joto wakati wa athari za metabolic za mkononi. Hii ni nzuri kwa viumbe vyenye joto kama sisi, kwa sababu nishati ya joto husaidia kudumisha joto la mwili wetu. Kwa kusema, hakuna uhamisho wa nishati ni ufanisi kabisa, kwa sababu baadhi ya nishati inapotea kwa fomu isiyoweza kutumika.
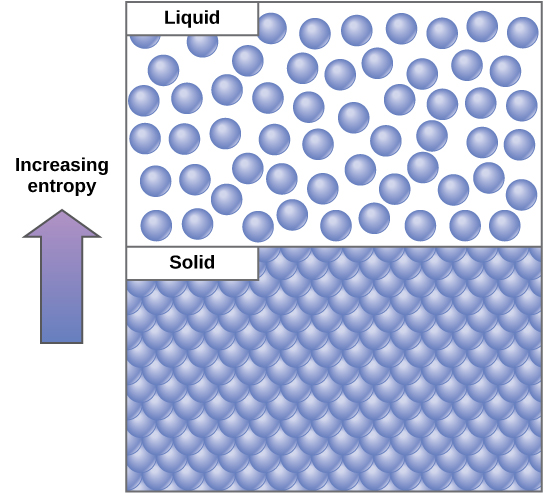
Dhana muhimu katika mifumo ya kimwili ni ile ya utaratibu na machafuko (pia inajulikana kama randomness). Nishati zaidi ambayo imepotea na mfumo kwa mazingira yake, chini ya kuamuru na zaidi random mfumo ni. Wanasayansi wanataja kipimo cha randomness au machafuko ndani ya mfumo kama entropy. Entropy ya juu ina maana ugonjwa wa juu na nishati ya chini (Kielelezo\(\PageIndex{2}\)). Ili kuelewa vizuri entropy, fikiria chumba cha kulala cha mwanafunzi. Kama hakuna nishati au kazi walikuwa kuweka ndani yake, chumba itakuwa haraka kuwa messy. Itakuwa kuwepo katika hali ya shida sana, moja ya entropy ya juu. Nishati lazima iingizwe kwenye mfumo, kwa namna ya mwanafunzi anayefanya kazi na kuweka kila kitu mbali, ili kuleta chumba kwenye hali ya usafi na utaratibu. Hali hii ni moja ya entropy ya chini. Vile vile, gari au nyumba lazima ihifadhiwe daima na kazi ili kuiweka katika hali iliyoamriwa. Kushoto peke yake, entropy ya nyumba au gari huongezeka kwa kasi kupitia kutu na uharibifu. Molekuli na athari za kemikali zina kiasi tofauti cha entropy pia. Kwa mfano, kama athari za kemikali zinafikia hali ya usawa, entropy huongezeka, na kama molekuli kwenye mkusanyiko wa juu katika sehemu moja huenea na kuenea, entropy pia huongezeka.
Uunganisho wa kisayansi: Uhamisho wa Nishati na Entropy inayosababisha
Weka jaribio rahisi kuelewa jinsi nishati huhamishwa na jinsi mabadiliko katika matokeo ya entropy.
- Chukua kizuizi cha barafu. Hii ni maji katika fomu imara, kwa hiyo ina utaratibu wa juu wa miundo. Hii inamaanisha kwamba molekuli haziwezi kusonga sana na ziko katika nafasi ya kudumu. Halijoto ya barafu ni 0°C Matokeo yake entropy ya mfumo ni ya chini.
- Ruhusu barafu kuyeyuka kwenye joto la kawaida. Hali gani ya molekuli katika maji ya kioevu sasa? Uhamisho wa nishati ulifanyikaje? Je, entropy ya mfumo wa juu au chini? Kwa nini?
- Joto maji kwa kiwango chake cha kuchemsha. Ni nini kinachotokea kwa entropy ya mfumo wakati maji yanapokanzwa?
Mifumo yote ya kimwili inaweza kufikiriwa kwa njia hii: Mambo ya uhai yanaamuru sana, yanahitaji pembejeo ya nishati ya mara kwa mara kuhifadhiwa katika hali ya entropy ya chini. Kama mifumo hai inachukua molekuli za kuhifadhi nishati na kuzibadilisha kupitia athari za kemikali, zinapoteza kiasi fulani cha nishati inayoweza kutumika katika mchakato, kwa sababu hakuna majibu yenye ufanisi kabisa. Pia huzalisha taka na bidhaa ambazo si vyanzo vya nishati muhimu. Utaratibu huu huongeza entropy ya mazingira ya mfumo. Kwa kuwa uhamisho wote wa nishati husababisha kupoteza nishati inayoweza kutumika, sheria ya pili ya thermodynamics inasema kwamba kila uhamisho wa nishati au mabadiliko huongeza entropy ya ulimwengu. Japokuwa vitu vilivyo hai vinatakiwa sana na kudumisha hali ya entropy ya chini, entropy ya ulimwengu kwa jumla inaongezeka mara kwa mara kutokana na upotevu wa nishati inayoweza kutumika na kila uhamisho wa nishati unaotokea. Kimsingi, vitu vilivyo hai viko katika vita vinavyoendelea kupanda dhidi ya ongezeko hili la mara kwa mara katika entropy ya ulimwengu wote.
Muhtasari
Katika kusoma nishati, wanasayansi hutumia neno “mfumo” kutaja suala hilo na mazingira yake yanayohusika katika uhamisho wa nishati. Kila kitu nje ya mfumo kinaitwa mazingira. Seli moja ni mifumo ya kibiolojia. Mifumo inaweza kufikiriwa kama kuwa na kiasi fulani cha utaratibu. Inachukua nishati ya kufanya mfumo zaidi kuamuru. Mfumo ulioamuru zaidi ni, chini ya entropy yake. Entropy ni kipimo cha ugonjwa wa mfumo. Kama mfumo unakuwa mbaya zaidi, chini ya nishati yake na juu ya entropy yake inakuwa.
Mfululizo wa sheria, inayoitwa sheria za thermodynamics, kuelezea mali na taratibu za uhamisho wa nishati. Sheria ya kwanza inasema kwamba jumla ya nishati katika ulimwengu ni mara kwa mara. Hii ina maana kwamba nishati haiwezi kuundwa au kuharibiwa, tu kuhamishwa au kubadilishwa. Sheria ya pili ya thermodynamics inasema kwamba kila uhamisho wa nishati unahusisha kupoteza kwa nishati kwa fomu isiyoweza kutumika, kama vile nishati ya joto, na kusababisha mfumo usio na matatizo zaidi. Kwa maneno mengine, hakuna uhamisho wa nishati ni ufanisi kabisa na huelekea kuelekea ugonjwa.
faharasa
- entropy (S)
- kipimo cha randomness au machafuko ndani ya mfumo
- joto
- nishati ya nishati kuhamishwa kutoka mfumo mmoja hadi mwingine ambayo si kazi (nishati ya mwendo wa molekuli au chembe)
- thermodynamics
- utafiti wa nishati na uhamisho wa nishati kuwashirikisha jambo kimwili


