14.1: Brønsted-Lowry Acids na Msingi
- Page ID
- 182526
- Kutambua asidi, besi, na conjugate jozi asidi-msingi kulingana na ufafanuzi wa Brønsted-Lowry
- Andika equations kwa athari za asidi na msingi wa ionization
- Tumia mara kwa mara ya bidhaa ya ioni kwa maji kuhesabu viwango vya hidroniamu na hidroksidi ion
- Eleza tabia ya asidi-msingi ya vitu vya amphiprotic
Acids na besi zimejulikana kwa muda mrefu. Wakati Robert Boyle sifa yao katika 1680, alibainisha kuwa asidi kufuta vitu vingi, kubadilisha rangi ya dyes fulani ya asili (kwa mfano, mabadiliko ya litmus kutoka bluu na nyekundu), na kupoteza tabia hizi baada ya kuwasiliana na alkali (besi). Katika karne ya kumi na nane, ilitambuliwa kuwa asidi na ladha ya siki, huguswa na chokaa ili kukomboa dutu la gesi (sasa linajulikana kuwa CO 2), na kuingiliana na alkali kuunda vitu vya neutral. Mwaka 1815, Humphry Davy alichangia sana maendeleo ya dhana ya kisasa ya asidi-msingi kwa kuonyesha kwamba hidrojeni ni sehemu muhimu ya asidi. Karibu wakati huo huo, Joseph Louis Gay-Lussac alihitimisha kuwa asidi ni vitu vinavyoweza kuondokana na besi na kwamba madarasa haya mawili ya vitu yanaweza kuelezwa tu kwa suala la kila mmoja. Umuhimu wa hidrojeni ulisisitizwa tena mwaka 1884 wakati Svante Arrhenius alifafanua asidi kama kiwanja kinachopasuka ndani ya maji ili kuzalisha cations hidrojeni (sasa inatambuliwa kuwa ioni za hidroniamu) na msingi kama kiwanja kinachopasuka ndani ya maji ili kuzalisha anioni hidroksidi.
Katika sura ya awali juu ya athari za kemikali, tulifafanua asidi na besi kama Arrhenius alivyofanya: Tulitambua asidi kama kiwanja kinachopasuka ndani ya maji ili kuzalisha ioni za hidronium (H 3 O +) na msingi kama kiwanja kinachopasuka ndani ya maji ili kuzalisha ioni za hidroksidi (\(\ce{OH-}\)). Ufafanuzi huu sio sahihi; ni mdogo tu.
Baadaye, tulipanua ufafanuzi wa asidi au msingi kwa kutumia ufafanuzi wa jumla zaidi uliopendekezwa mwaka 1923 na mwanakemia wa Denmark Johannes Brønsted na mwanakemia wa Kiingereza Thomas Lowry. Ufafanuzi wao vituo juu ya proton,\(\ce{H^+}\). protoni ni nini bado wakati kawaida atomi hidrojeni,\(\ce{^1_1H}\), hupoteza elektroni. Kiwanja kinachochangia protoni kwa kiwanja kingine kinaitwa asidi ya Brønsted-Lowry, na kiwanja kinachopokea protoni kinaitwa msingi wa Brønsted-Lowry. Mmenyuko wa asidi-msingi ni uhamisho wa proton kutoka kwa wafadhili wa proton (asidi) kwa mpokeaji wa proton (msingi). Katika sura inayofuata ya maandishi haya tutaanzisha mfano wa jumla wa tabia ya asidi-msingi iliyoletwa na mwanakemia wa Marekani G.
Acids inaweza kuwa misombo kama vile HCl au H 2 SO 4, asidi kikaboni kama asidi asetiki (\(\ce{CH_3COOH}\)) au asidi ascorbic (vitamini C), au H 2 O. Anions (kama vile\(\ce{HSO_4^-}\)\(\ce{H_2PO_4^-}\)\(\ce{HS^-}\),, na\(\ce{HCO_3^-}\)) na cations (kama vile\(\ce{H_3O^+}\)\(\ce{NH_4^+}\),, na\(\ce{[Al(H_2O)_6]^{3+}}\)) inaweza pia kutenda kama asidi. Misingi huanguka katika makundi matatu sawa. Misingi inaweza kuwa molekuli zisizo na upande wowote (kama\(\ce{H_2O}\) vile,, na\(\ce{CH_3NH_2}\))\(\ce{OH^-}\), anions (kama vile\(\ce{HS^-}\)\(\ce{HCO_3^-}\)\(\ce{CO_3^{2−}}\),\(\ce{F^-}\),,, na\(\ce{PO_4^{3−}}\)), au cations (kama vile\(\ce{[Al(H_2O)_5OH]^{2+}}\)).\(\ce{NH_3}\) Msingi unaojulikana zaidi ni misombo ya ionic kama\(\ce{NaOH}\) vile\(\ce{Ca(OH)_2}\), ambayo ina ion ya hidroksidi,\(\ce{OH^-}\). Ioni ya hidroksidi katika misombo hii inakubali proton kutoka asidi ili kuunda maji:
\[\ce{H^+ + OH^- \rightarrow H_2O} \label{14.11} \]
Tunaita bidhaa iliyobaki baada ya asidi hutoa proton msingi wa conjugate wa asidi. Spishi hii ni msingi kwa sababu inaweza kukubali protoni (kuunda tena asidi):
\[\text{acid} \rightleftharpoons \text{proton} + \text{conjugate base}\label{14.12a} \]
\[\ce{HF \rightleftharpoons H^+ + F^-} \label{14.12b} \]
\[\ce{H_2SO_4 \rightleftharpoons H^+ + HSO_4^{−}}\label{14.12c} \]
\[\ce{H_2O \rightleftharpoons H^+ + OH^-}\label{14.12d} \]
\[\ce{HSO_4^- \rightleftharpoons H^+ + SO_4^{2−}}\label{14.12e} \]
\[\ce{NH_4^+ \rightleftharpoons H^+ + NH_3} \label{14.12f} \]
Sisi wito bidhaa kwamba matokeo wakati msingi anapokea proton msingi wa conjugate asidi. Spishi hii ni asidi kwa sababu inaweza kutoa protoni (na hivyo kuunda tena msingi):
\[\text{base} + \text{proton} \rightleftharpoons \text{conjugate acid} \label{14.13a} \]
\[\ce{OH^- +H^+ \rightleftharpoons H2O}\label{14.13b} \]
\[\ce{H_2O + H^+ \rightleftharpoons H3O+}\label{14.13c} \]
\[\ce{NH_3 +H^+ \rightleftharpoons NH4+}\label{14.13d} \]
\[\ce{S^{2-} +H^+ \rightleftharpoons HS-}\label{14.13e} \]
\[\ce{CO_3^{2-} +H^+ \rightleftharpoons HCO3-}\label{14.13f} \]
\[\ce{F^- +H^+ \rightleftharpoons HF} \label{14.13g} \]
Katika seti hizi mbili za milinganyo, tabia za asidi kama wafadhili wa protoni na besi kama vibali vya protoni vinawakilishwa katika kutengwa. Kwa kweli, athari zote za asidi-msingi zinahusisha uhamisho wa protoni kati ya asidi na besi. Kwa mfano, fikiria mmenyuko wa asidi-msingi unaofanyika wakati amonia inapasuka katika maji. Molekuli ya maji (inayofanya kazi kama asidi) huhamisha protoni kwa molekuli ya amonia (inayofanya kazi kama msingi), hutoa msingi wa maji\(\ce{OH^-}\), na asidi ya conjugate ya amonia,\(\ce{NH4+}\):
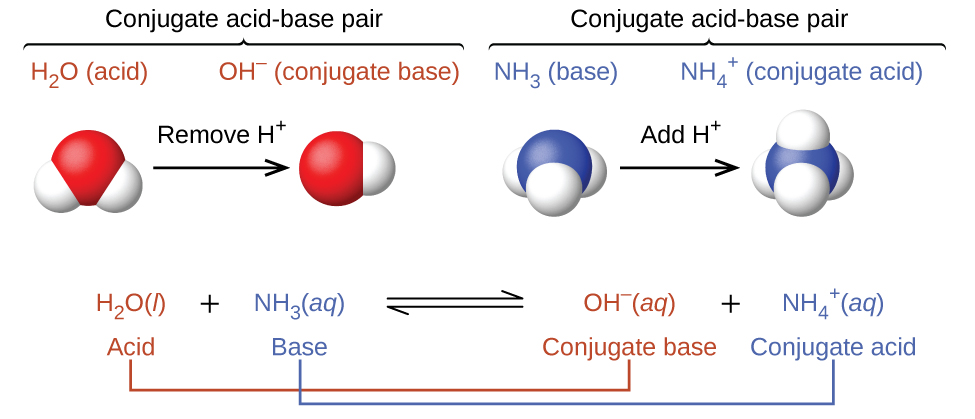
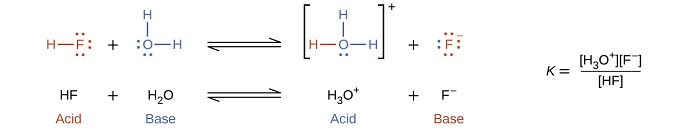
Mmenyuko kati ya asidi ya Brønsted-Lowry na maji huitwa ionization ya asidi. Kwa mfano, wakati fluoride ya hidrojeni hupasuka katika maji na ionizes, protoni huhamishwa kutoka molekuli ya fluoride ya hidrojeni hadi molekuli za maji, hutoa ioni za hidroniamu na ioni za fluoride
Tunapoongeza msingi kwa maji, mmenyuko wa msingi wa ionization hutokea ambapo protoni huhamishwa kutoka kwa molekuli za maji hadi molekuli za msingi. Kwa mfano, kuongeza pyridine kwa maji huzaa ions hidroksidi na ions pyridinium:
Angalia kwamba athari hizi zote za ionization zinawakilishwa kama michakato ya usawa. Kiwango cha jamaa ambacho athari hizi za asidi na msingi wa ionization zinaendelea ni mada muhimu inayotibiwa katika sehemu ya baadaye ya sura hii. Katika aya zilizotangulia tuliona ya kwamba maji yanaweza kufanya kazi kama asidi au msingi, kulingana na asili ya solute kufutwa ndani yake. Kwa kweli, katika maji safi au katika suluhisho lolote la maji, maji hufanya wote kama asidi na msingi. Sehemu ndogo sana ya molekuli za maji huchangia protoni kwa molekuli nyingine za maji ili kuunda ioni za hidroniamu na ioni za hidroksidi:
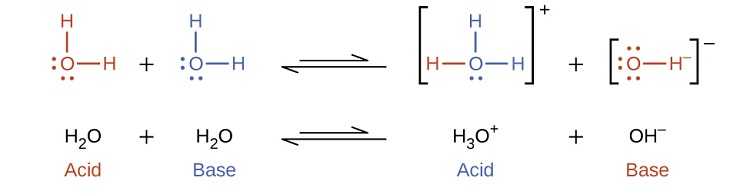
Aina hii ya mmenyuko, ambayo dutu ionizes wakati molekuli moja ya dutu humenyuka na molekuli nyingine ya dutu hiyo, inajulikana kama autoionization. Maji safi hupata autoionization kwa kiwango kidogo sana. Tu takriban mbili kati ya kila\(10^9\) molekuli katika sampuli ya maji safi ni ionized saa 25 °C Msawazo mara kwa mara kwa ajili ya ionization ya maji inaitwa ion-bidhaa mara kwa mara kwa ajili ya maji (K w):
\[\ce{H_2O}_{(l)}+\ce{H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)}+\ce{OH^-}_{(aq)}\;\;\; K_\ce{w}=\ce{[H_3O^+][OH^- ]} \label{14.14} \]
Ionization kidogo ya maji safi inaonekana katika thamani ndogo ya mara kwa mara ya usawa; saa 25 °C, Kw ina thamani ya\(1.0 \times 10^{−14}\). Mchakato huu ni endothermic, na hivyo kiwango cha ionization na viwango vinavyotokana na ioni ya hidroniamu na hidroksidi ion huongezeka kwa joto. Kwa mfano, katika 100 °C, thamani ya\(K_\ce{w}\) ni takriban\(5.1 \times 10^{−13}\), takriban mara 50 kubwa kuliko thamani ya 25 °C.
Je, ni mkusanyiko wa ioni ya hidroniamu na mkusanyiko wa ioni ya hidroksidi katika maji safi katika 25 °C?
Suluhisho
Autoionization ya maji hutoa idadi sawa ya ions hidroniamu na hidroksidi. Kwa hiyo, katika maji safi,\(\ce{[H_3O^+]} = \ce{[OH^- ]}\). Saa 25 °C:
\[K_\ce{w}=\ce{[H_3O^+][OH^- ]}=\ce{[H_3O^+]^2}=\ce{[OH^- ]^2}=1.0 \times 10^{−14} \nonumber \]
Hivyo:
\[\ce{[H_3O^+]}=\ce{[OH^- ]}=\sqrt{1.0 \times 10^{−14}} =1.0 \times 10^{−7}\; M \nonumber \]
Mkusanyiko wa ioni ya hidroniamu na mkusanyiko wa ioni ya hidroksidi ni sawa, na tunaona kwamba wote wawili ni sawa\(1.0 \times 10^{−7}\; M\).
Bidhaa ya ioni ya maji kwenye 80 °C ni\(2.4 \times 10^{−13}\). Je, ni viwango gani vya hidroniamu na ioni hidroksidi katika maji safi kwenye 80 °C?
- Jibu
-
\(\ce{[H_3O^+]} = \ce{[OH^- ]} = 4.9 \times 10^{−7}\; M\)
Ni muhimu kutambua kwamba usawa wa autoionization kwa maji umeanzishwa katika ufumbuzi wote wa maji. Kuongeza asidi au msingi kwa maji hautabadili nafasi ya usawa. Mfano 14.12 unaonyesha mambo ya upimaji wa uhusiano huu kati ya viwango vya hidroniamu na hidroksidi ioni.
Inverse uwiano wa [H 3 O +] na [OH -] ufumbuzi wa dioksidi kaboni katika maji ina hydronium ion mkusanyiko wa\(2.0 \times 10^{−6}\; M\). Je, ni mkusanyiko wa ioni ya hidroksidi saa 25 °C?
Suluhisho
Tunajua thamani ya mara kwa mara ya bidhaa ya ioni kwa maji kwenye 25 °C:
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)} + \ce{OH^-}_{(aq)} \nonumber \]
\[K_\ce{w}=\ce{[H3O+][OH^- ]}=1.0 \times 10^{−14} \nonumber \]
Hivyo, tunaweza kuhesabu mkusanyiko wa usawa wa kukosa.
Rearrangement ya K w kujieleza mavuno ambayo\([\ce{OH^- }]\) ni moja kwa moja sawia na inverse ya [H 3 O +]:
\[[\ce{OH^- }]=\dfrac{K_{\ce w}}{[\ce{H_3O^+}]}=\dfrac{1.0 \times 10^{−14}}{2.0 \times 10^{−6}}=5.0 \times 10^{−9} \nonumber \]
Hidroksidi ioni mkusanyiko katika maji ni kupunguzwa kwa\(5.0 \times 10^{−9}\: M\) kama mkusanyiko ioni hidrojeni kuongezeka kwa\(2.0 \times 10^{−6}\; M\). Hii inatarajiwa kutoka kanuni ya Le Chatelier; mmenyuko wa autoionization hubadilika upande wa kushoto ili kupunguza mkazo wa kuongezeka kwa mkusanyiko wa ioni ya hidronium na kupunguzwa ikilinganishwa na ile katika maji safi.\(\ce{[OH^- ]}\)
Cheti cha viwango hivi kinathibitisha kwamba hesabu yetu ni sahihi:
\[\begin{align*} K_\ce{w} &=\ce{[H_3O^+][OH^- ]} \\[4pt] &=(2.0 \times 10^{−6})(5.0 \times 10^{−9})\\[4pt] &=1.0 \times 10^{−14} \end{align*} \nonumber \]
Je, ni mkusanyiko wa ioni ya hidroniamu katika suluhisho la maji yenye mkusanyiko wa ioni ya hidroksidi ya 0.001 M saa 25 °C?
- Jibu
-
\[\ce{[H3O+]} = 1 \times 10^{−11} M \nonumber \]
Aina ya Amphiprotic
Kama maji, molekuli nyingi na ioni zinaweza ama kupata au kupoteza protoni chini ya hali zinazofaa. Spishi hizo zinasemekana kuwa amphiprotic. Neno lingine linalotumika kuelezea spishi hizo ni amphoteriki, ambalo ni neno la jumla zaidi kwa spishi ambazo zinaweza kutenda ama kama asidi au msingi kwa ufafanuzi wowote (sio tu moja ya Brønsted-Lowry). Fikiria kwa mfano ion ya bicarbonate, ambayo inaweza ama kuchangia au kukubali proton kama inavyoonekana hapa:
\[\ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{CO^{2-}}_{3(aq)} + \ce{H_3O^+}_{(aq)} \label{14.15a} \]
\[ \ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{H_2CO}_{3(aq)} + \ce{OH^-}_{(aq)} \label{14.15b} \]
Andika equations tofauti anayewakilisha majibu ya\(\ce{HSO3-}\)
- kama asidi na\(\ce{OH^-}\)
- kama msingi na HI
Suluhisho
- \(\ce{HSO3-}(aq)+ \ce{OH^-}(aq)\rightleftharpoons \ce{SO3^2-}(aq)+ \ce{H_2O}_{(l)} \)
- \(\ce{HSO3-}(aq)+\ce{HI}(aq)\rightleftharpoons \ce{H2SO3}(aq)+\ce{I-}(aq)\)
Andika equations tofauti anayewakilisha majibu ya\(\ce{H2PO4-}\)
- kama msingi na HbR
- kama asidi na\(\ce{OH^-}\)
- Jibu
-
\(\ce{H2PO4-}(aq)+\ce{HBr}(aq)\rightleftharpoons \ce{H3PO4}(aq)+\ce{Br-}(aq)\)
- Jibu b
-
\(\ce{H2PO4-}(aq)+\ce{OH^-} (aq)\rightleftharpoons \ce{HPO4^2-}(aq)+ \ce{H_2O}_{(l)} \)
Muhtasari
Kiwanja kinachoweza kuchangia protoni (ioni ya hidrojeni) kwenye kiwanja kingine kinaitwa asidi ya Brønsted-Lowry. Kiwanja kinachopokea protoni kinaitwa msingi wa Brønsted-Lowry. Spishi zilizobaki baada ya asidi ya Brønsted-Lowry imepoteza protoni ni msingi wa conjugate wa asidi. Aina zilizotengenezwa wakati msingi wa Brønsted-Lowry unapata protoni ni asidi ya conjugate ya msingi. Kwa hiyo, mmenyuko wa asidi-msingi hutokea wakati protoni inapohamishwa kutoka asidi hadi msingi, na kuundwa kwa msingi wa conjugate wa asidi ya reactant na kuunda asidi conjugate ya msingi wa reactant. Spishi za Amphiprotic zinaweza kutenda kama wafadhili wa protoni na wakubali protoni. Maji ni aina muhimu zaidi ya amphiprotic. Inaweza kuunda ioni ya hidroniamu, H 3 O +, na ioni ya hidroksidi,\(\ce{OH^-}\) wakati inakabiliwa na autoionization:
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}(aq)+\ce{OH^-} (aq) \nonumber \]
Bidhaa ya ion ya maji, K w ni mara kwa mara ya usawa kwa mmenyuko wa autoionization:
\[K_\ce{w}=\mathrm{[H_3O^+][OH^- ]=1.0 \times 10^{−14} \; at\; 25°C} \nonumber \]
Mlinganyo muhimu
- \[K_{\ce w} = \ce{[H3O+][OH^- ]} = 1.0 \times 10^{−14}\textrm{ (at 25 °C)} \nonumber \]
faharasa
- ionization asidi
- mmenyuko unaohusisha uhamisho wa proton kutoka asidi hadi maji, kutoa ions hydronium na msingi wa conjugate wa asidi
- amphiprotic
- aina ambayo inaweza ama kupata au kupoteza proton katika mmenyuko
- amphoteric
- aina ambayo inaweza kutenda kama asidi au msingi
- autoionization
- mmenyuko kati ya aina zinazofanana hutoa bidhaa za ionic; kwa maji, mmenyuko huu unahusisha uhamisho wa protoni ili kuzalisha ioni za hidroniamu na hidroksidi
- ionization ya msingi
- majibu yanayohusisha uhamisho wa proton kutoka maji hadi msingi, kutoa ions hidroksidi na asidi conjugate ya msingi
- Asidi ya Brønsted-Lowry
- proton wafadhili
- Msingi wa Brønsted-Lowry
- mpokeaji wa protoni
- asidi conjugate
- Dutu sumu wakati msingi faida proton
- msingi wa conjugate
- Dutu sumu wakati asidi hupoteza proton
- ion-bidhaa mara kwa mara kwa ajili ya maji (K w)
- mara kwa mara ya usawa kwa autoionization ya maji


