9.3: Enthalpy
- Page ID
- 182419
- Hali ya sheria ya kwanza ya thermodynamics
- Eleza enthalpy na kuelezea uainishaji wake kama kazi ya serikali
- Andika na usawa usawa wa thermochemical
- Tumia mabadiliko ya enthalpy kwa athari mbalimbali za kemikali
- Eleza sheria ya Hess na kuitumia kukokotoa enthalpies mmenyuko
Thermochemistry ni tawi la thermodynamics ya kemikali, sayansi inayohusika na uhusiano kati ya joto, kazi, na aina nyingine za nishati katika mazingira ya michakato ya kemikali na kimwili. Tunapozingatia thermochemistry katika sura hii, tunahitaji kufikiria dhana fulani za kutumika sana za thermodynamics.
Vitu hufanya kama hifadhi za nishati, maana yake ni kwamba nishati inaweza kuongezwa kwao au kuondolewa kutoka kwao. Nishati huhifadhiwa katika dutu wakati nishati ya kinetic ya atomi zake au molekuli zinafufuliwa. Nishati kubwa ya kinetic inaweza kuwa katika mfumo wa tafsiri zilizoongezeka (usafiri au mwendo wa mstari wa moja kwa moja), vibrations, au mzunguko wa atomi au molekuli. Wakati nishati ya joto inapotea, ukubwa wa mwendo huu hupungua na nishati ya kinetic huanguka. Jumla ya aina zote zinazowezekana za nishati zilizopo katika dutu huitwa nishati ya ndani (U), wakati mwingine inaashiria kama E.
Kama mfumo unavyobadilika, nishati yake ya ndani inaweza kubadilika, na nishati inaweza kuhamishwa kutoka kwenye mfumo hadi kwenye mazingira, au kutoka kwa mazingira hadi kwenye mfumo. Nishati huhamishiwa kwenye mfumo wakati inachukua joto (q) kutoka kwa mazingira au wakati mazingira yanafanya kazi (w) kwenye mfumo. Kwa mfano, nishati ni kuhamishiwa katika chumba joto chuma waya kama ni kuzama katika maji ya moto (waya inachukua joto kutoka maji), au kama haraka bend waya na kurudi (waya inakuwa joto kwa sababu ya kazi kufanyika juu yake). Michakato yote huongeza nishati ya ndani ya waya, ambayo inaonekana katika ongezeko la joto la waya. Kinyume chake, nishati huhamishwa nje ya mfumo wakati joto linapotea kutoka kwenye mfumo, au wakati mfumo unafanya kazi kwenye mazingira.
Uhusiano kati ya nishati ya ndani, joto, na kazi inaweza kuwakilishwa na equation:
\[ΔU=q+w \label{5.4.1} \]
kama inavyoonekana katika Kielelezo\(\PageIndex{1}\). Hii ni toleo moja la sheria ya kwanza ya thermodynamics, na inaonyesha kwamba nishati ya ndani ya mfumo hubadilika kupitia mtiririko wa joto ndani au nje ya mfumo (chanya q ni mtiririko wa joto ndani; hasi q ni joto hutoka nje) au kazi iliyofanywa au kwa mfumo. Kazi, w, ni chanya ikiwa imefanywa kwenye mfumo na hasi ikiwa imefanywa na mfumo.
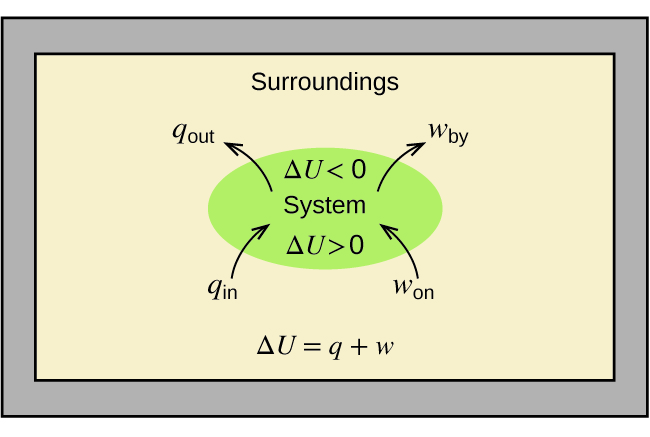
Aina ya kazi inayoitwa kazi ya upanuzi (au kazi ya shinikizo la kiasi) hutokea wakati mfumo unasuja nyuma mazingira dhidi ya shinikizo la kuzuia, au wakati mazingira yanapunguza mfumo. Mfano wa hii hutokea wakati wa operesheni ya inji ya mwako ndani. Majibu ya petroli na oksijeni ni exothermic. Baadhi ya nishati hii hutolewa kama joto, na baadhi hufanya kazi kusuuza pistoni katika silinda. Dutu zinazohusika katika mmenyuko ni mfumo, na inji na ulimwengu wote ni mazingira. Mfumo hupoteza nishati kwa kupokanzwa na kufanya kazi kwenye mazingira, na nishati yake ya ndani hupungua. (Injini ina uwezo wa kushika gari kusonga kwa sababu mchakato huu unarudiwa mara nyingi kwa sekunde ilhali injini inaendesha.) Tutazingatia jinsi ya kuamua kiasi cha kazi inayohusika katika mabadiliko ya kemikali au kimwili katika sura ya thermodynamics.
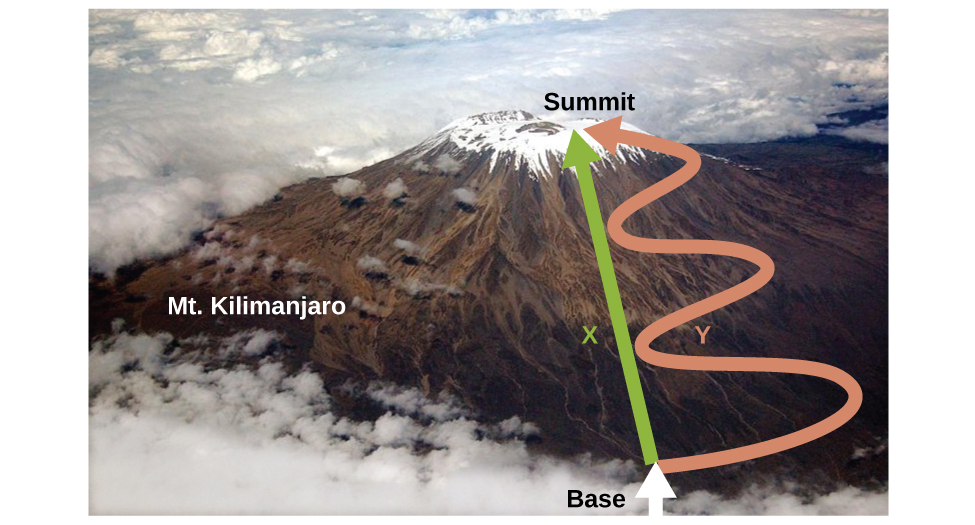
Kama ilivyojadiliwa, uhusiano kati ya nishati ya ndani, joto, na kazi inaweza kuwakilishwa kama Δ U = q + w. Nishati ya ndani ni aina ya wingi inayojulikana kama kazi ya hali (au hali ya kutofautiana), ilhali joto na kazi si kazi za serikali. Thamani ya kazi ya serikali inategemea tu hali ambayo mfumo unaingia, na sio jinsi hali hiyo inavyofikiwa. Ikiwa wingi sio kazi ya serikali, basi thamani yake inategemea jinsi hali inavyofikia. Mfano wa kazi ya hali ni urefu au mwinuko. Kama kusimama juu ya mkutano wa Mt. Kilimanjaro, wewe ni katika urefu wa 5895 m, na haijalishi kama wewe hiked huko au parachuted huko. Umbali uliosafiri hadi juu ya Kilimanjaro, hata hivyo, si kazi ya serikali. Unaweza kupanda kwenye mkutano huo kwa njia ya moja kwa moja au kwa njia ya mzunguko zaidi, njia ya mzunguko (Kielelezo\(\PageIndex{2}\)). Umbali uliosafiri ungetofautiana (umbali si kazi ya serikali) lakini mwinuko uliofikiwa ungekuwa sawa (urefu ni kazi ya serikali).
Wataalamu wa dawa hutumia mali inayojulikana kama enthalpy (\(H\)) kuelezea thermodynamics ya michakato ya kemikali na kimwili. Enthalpy hufafanuliwa kama jumla ya nishati ya ndani ya mfumo (\(U\)) na bidhaa ya hisabati ya shinikizo lake (\(P\)) na kiasi (\(V\)):
\[H=U+PV \label{5.4.2} \]
Kwa kuwa inatokana na kazi tatu za serikali (\(U\),\(P\), na\(V\)), enthalpy pia ni kazi ya serikali. Maadili ya Enthalpy kwa vitu maalum hayawezi kupimwa moja kwa moja; tu mabadiliko ya enthalpy kwa michakato ya kemikali au ya kimwili yanaweza kuamua. Kwa michakato inayofanyika kwa shinikizo la mara kwa mara (hali ya kawaida kwa mabadiliko mengi ya kemikali na kimwili), mabadiliko ya enthalpy (\(ΔH\)) ni:
\[ΔH=ΔU+PΔV\label{5.4.3} \]
Bidhaa ya hisabati\(PΔV\) inawakilisha kazi (\(w\)), yaani, upanuzi au kazi ya kiasi cha shinikizo kama ilivyoelezwa. Kwa ufafanuzi wao, ishara za hesabu za ΔV na w zitakuwa kinyume:
\[PΔV=−w \label{5.4.4} \]
Kubadilisha Equation\ ref {5.4.4} na ufafanuzi wa nishati ya ndani (Equation\ ref {5.4.1}) katika Equation\ ref {5.4.3} mavuno:
\[ \begin{align} ΔH&=ΔU+PΔV \\[4pt] &=q_\ce{p}+\cancel{w}−\cancel{w} \\[4pt] &=q_\ce{p} \label{5.4.5} \end{align} \]
ambapo\(q_p\) ni joto la mmenyuko chini ya hali ya shinikizo la mara kwa mara.
Na hivyo, ikiwa mchakato wa kemikali au kimwili unafanywa kwa shinikizo la mara kwa mara na kazi pekee iliyofanywa na upanuzi au kupinga, basi mtiririko wa joto (\(q_\ce{p}\)) na mabadiliko ya enthalpy (\(ΔH\)) kwa mchakato huo ni sawa.
Joto lililotolewa unapofanya kazi ya burner ya Bunsen ni sawa na mabadiliko ya enthalpy ya mmenyuko wa mwako wa methane ambayo hufanyika, kwani hutokea kwa shinikizo la kawaida la anga. Kwa upande mwingine, joto zinazozalishwa na mmenyuko kipimo katika calorimeter bomu si sawa na kwa\(ΔH\) sababu imefungwa, mara kwa mara kiasi chuma chombo kuzuia kazi upanuzi kutokea. Wataalamu wa dawa hufanya majaribio chini ya hali ya kawaida ya anga, kwa shinikizo la nje la mara kwa mara na\(q = ΔH\), ambayo inafanya enthalpy chaguo rahisi zaidi kwa kuamua joto.
Makusanyiko yafuatayo yanatumika wakati tunatumia\(ΔH\):
- Wanakemia hutumia equation ya thermochemical kuwakilisha mabadiliko katika suala na nishati zote mbili. Katika equation thermochemical, mabadiliko ya enthalpy ya mmenyuko yanaonyeshwa kama thamani Δ H kufuatia equation kwa mmenyuko. \(ΔH\)Thamani hii inaonyesha kiasi cha joto kinachohusishwa na mmenyuko unaohusisha idadi ya moles ya reactants na bidhaa kama inavyoonekana katika equation ya kemikali. Kwa mfano, fikiria equation\[\ce{H2(g) + 1/2 O2(g) ⟶ H2O (l)} \;\; ΔH=\mathrm{−286\:kJ} \label{5.4.6} \] hii: Equation hii inaonyesha kwamba wakati 1 mole ya gesi ya hidrojeni na mole 12 ya gesi ya oksijeni katika joto fulani na shinikizo mabadiliko kwa 1 mole ya maji kioevu katika joto sawa na shinikizo, 286 kJ ya joto hutolewa kwa mazingira. Ikiwa coefficients ya equation ya kemikali huongezeka kwa sababu fulani, mabadiliko ya enthalpy yanapaswa kuongezeka kwa sababu hiyo (ΔH ni mali kubwa).
\[\begin {align*} &\textrm{(two-fold increase in amounts)}\label{5.4.7}\\ &\ce{2H2}(g)+\ce{O2}(g)⟶\ce{2H2O}(l)\hspace{20px}ΔH=\mathrm{2×(−286\:kJ)=−572\:kJ}\\ &\textrm{(two-fold decrease in amounts)}\\ &\frac{1}{2}\ce{H2}(g)+\dfrac{1}{4}\ce{O2}(g)⟶\frac{1}{2}\ce{H2O}(l)\hspace{20px}ΔH=\mathrm{\frac{1}{2}×(−286\:kJ)=−143\:kJ} \end {align*} \label{5.4.6B} \]
- Mabadiliko ya enthalpy ya mmenyuko hutegemea hali ya kimwili ya majibu na bidhaa za mmenyuko (ikiwa tuna gesi, majimaji, yabisi, au ufumbuzi wa maji), hivyo hizi lazima zionyeshe. Kwa mfano, wakati 1 mole ya gesi ya hidrojeni na mole 12 ya gesi ya oksijeni hubadilika kwa mole 1 ya maji ya kioevu kwa joto sawa na shinikizo, 286 kJ ya joto hutolewa. Ikiwa maji ya gesi yanaunda, tu 242 kJ ya joto hutolewa.
\[\ce{ H2(g) + 1/2 O2(g) ⟶ H2O(g)} \;\;\; ΔH=\ce{−242\:kJ} \label{5.4.7B} \]
- Thamani hasi ya mabadiliko ya enthalpy, Δ H, inaonyesha mmenyuko wa exothermic; thamani nzuri ya Δ H inaonyesha mmenyuko wa mwisho. Ikiwa mwelekeo wa equation ya kemikali hubadilishwa, ishara ya hesabu ya Δ H yake inabadilishwa (mchakato ambao ni endothermic katika mwelekeo mmoja ni exothermic katika mwelekeo kinyume).
Wakati 0.0500 mol ya HCl (aq) humenyuka na 0.0500 mol ya NaOH (aq) kuunda 0.0500 mol ya NaCl (aq), 2.9 kJ ya joto huzalishwa. Nini ΔH, mabadiliko ya enthalpy, kwa mole ya asidi hujibu, kwa majibu ya asidi-msingi yanayotumika chini ya masharti yaliyoelezwa?
\[\ce{HCl (aq) + NaOH(aq) \rightarrow NaCl (aq) + H2O(l)} \nonumber \]
Suluhisho
Kwa mmenyuko wa asidi 0.0500 mol (HCl), q = -2.9 kJ. Uwiano huu
\[\mathrm{\dfrac{−2.9 \; kJ}{0.0500\; mol\; HCl}} \nonumber \]
inaweza kutumika kama sababu ya uongofu ili kupata joto zinazozalishwa wakati 1 mole ya HCl humenyuka:
\[ΔH =\mathrm{1\; \cancel{mol\; HCl} \times \dfrac{ −2.9\; kJ}{0.0500 \;\cancel{ mol\; HCl}} =−58\; kJ} \nonumber \]
Mabadiliko ya enthalpy wakati 1 mole ya HCl humenyuka ni -58 kJ. Kwa kuwa hiyo ni idadi ya moles katika equation ya kemikali, tunaandika equation thermochemical kama:
\[\ce{HCl}_{(aq)}+\ce{NaOH}_{(aq)}⟶\ce{NaCl}_{(aq)}+\ce{H_2O}_{(l)} \;\;\; ΔH=\mathrm{−58\;kJ} \nonumber \]
Wakati 1.34 g Zn (s) humenyuka na 60.0 ml ya 0.750 M HCl (aq), 3.14 kJ ya joto huzalishwa. Kuamua mabadiliko ya enthalpy kwa mole ya zinki akijibu kwa majibu:
\[ \ce{Zn}_{(s)}+\ce{2HCl}_{(aq)}⟶\ce{ZnCl}_{(aq)}+\ce{H}_{2(g)} \nonumber \]
- Jibu
-
ΔH = -153 kJ
Hakikisha kuchukua stoichiometry zote mbili na kuzuia reactants katika akaunti wakati wa kuamua Δ H kwa mmenyuko wa kemikali.
Bonde la gummy lina 2.67 g sucrose, C 12 H 22 O 11. Wakati humenyuka na 7.19 g kloreti ya potasiamu, kClO 3, 43.7 kJ ya joto huzalishwa. Kuamua mabadiliko ya enthalpy kwa mmenyuko
\[\ce{C12H22O11}(aq)+\ce{8KClO3}(aq)⟶\ce{12CO2}(g)+\ce{11H2O}(l)+\ce{8KCl}(aq) \nonumber \]
Suluhisho la Marekani
Sisi\(\mathrm{2.67\:\cancel{g}×\dfrac{1\:mol}{342.3\:\cancel{g}}=0.00780\:mol\:C_{12}H_{22}O_{11}}\) inapatikana, na
\(\mathrm{7.19\:\cancel{g}×\dfrac{1\:mol}{122.5\:\cancel{g}}=0.0587\:mol\:KClO_3}\)inapatikana.
Tangu
\(\mathrm{0.0587\:mol\:KClO_3×\dfrac{1\:mol\:\ce{C12H22O11}}{8\:mol\:KClO_3}=0.00734\:mol\:\ce{C12H22O11}}\)
inahitajika, C 12 H 22 O 11 ni reactant ziada na kClO 3 ni reactant kikwazo.
majibu inatumia 8 mol kClo 3, na sababu ya uongofu ni\(\mathrm{\dfrac{−43.7\:kJ}{0.0587\:mol\:KClO_3}}\), hivyo tuna\(ΔH=\mathrm{8\:mol×\dfrac{−43.7\:kJ}{0.0587\:mol\:KClO_3}=−5960\:kJ}\). Mabadiliko ya enthalpy kwa mmenyuko huu ni -5960 kJ, na equation thermochemical ni:
\[\ce{C12H22O11 + 8KClO3⟶12CO2 + 11H2O + 8KCl}\hspace{20px}ΔH=\ce{−5960\:kJ} \nonumber \]
Wakati 1.42 g ya chuma humenyuka na 1.80 g ya klorini, 3.22 g ya\(\ce{FeCl}_{2(s)}\) na 8.60 kJ ya joto huzalishwa. Ni mabadiliko gani ya enthalpy kwa mmenyuko wakati 1 mole ya\(\ce{FeCl2(s)}\) huzalishwa?
- Jibu
-
ΔH = -338 kJ
Mabadiliko ya Enthalpy ni kawaida kuorodheshwa kwa athari ambayo wote reactants na bidhaa ni katika hali sawa. Hali ya kawaida ni seti ya kawaida ya hali inayotumiwa kama hatua ya kumbukumbu ya uamuzi wa mali chini ya hali nyingine tofauti. Kwa maduka ya dawa, hali ya kiwango cha IUPAC inahusu vifaa chini ya shinikizo la bar 1 na ufumbuzi saa 1 M, na haitaja joto (lilitumiwa pia). Majedwali mengi ya thermochemical yanaorodhesha maadili na hali ya kawaida ya atm 1. Kwa sababu Δ H ya mmenyuko hubadilika kidogo sana na mabadiliko madogo kama hayo katika shinikizo (1 bar = 0.987 atm), Δ H maadili (isipokuwa kwa maadili ya kipimo zaidi) ni sawa chini ya seti zote mbili za hali ya kawaida. Tutajumuisha “o” iliyochapishwa katika ishara ya mabadiliko ya enthalpy ili kuteua hali ya kawaida. Kwa kuwa joto la kawaida (lakini si la kitaalam) ni 298.15 K, tutatumia “298” iliyosajiliwa ili kutaja joto hili. Hivyo, ishara (\(ΔH^\circ_{298}\)) hutumiwa kuonyesha mabadiliko ya enthalpy kwa mchakato unaotokea chini ya hali hizi. (Ishara Δ H hutumiwa kuonyesha mabadiliko ya enthalpy kwa mmenyuko unaotokea chini ya hali isiyo ya kawaida.)
Mabadiliko ya enthalpy kwa aina nyingi za michakato ya kemikali na kimwili zinapatikana katika maandiko ya kumbukumbu, ikiwa ni pamoja na yale ya athari za mwako, mabadiliko ya awamu, na athari za malezi. Tunapozungumzia kiasi hiki, ni muhimu kuzingatia hali ya kina ya mabadiliko ya enthalpy na enthalpy. Kwa kuwa mabadiliko ya enthalpy kwa mmenyuko uliotolewa ni sawia na kiasi cha vitu vinavyohusika, inaweza kuripotiwa kwa msingi huo (yaani, kama Δ H kwa kiasi maalum cha reactants). Hata hivyo, mara nyingi tunaona ni muhimu zaidi kugawanya mali moja ya kina (Δ H) na mwingine (kiasi cha dutu), na kuripoti thamani kubwa ya kiasi cha Δ H, mara nyingi “kawaida” kwa msingi wa mole. (Kumbuka kuwa hii ni sawa na kuamua mali kubwa joto maalum kutokana na uwezo mkubwa wa joto mali, kama inavyoonekana hapo awali.)
Enthalpy ya Mwako
Standard enthalpy ya mwako n (\(ΔH_C^\circ\)) ni mabadiliko ya enthalpy wakati mole 1 ya dutu inawaka (inachanganya kwa nguvu na oksijeni) chini ya hali ya kawaida ya hali; wakati mwingine huitwa “joto la mwako.” Kwa mfano, enthalpy ya mwako wa ethanol, -1366.8 kJ/mol, ni kiasi cha joto zinazozalishwa wakati mole moja ya ethanol inakabiliwa na mwako kamili kwenye 25 °C na shinikizo la angahewa 1, huzaa bidhaa pia kwenye 25 °C na atm 1.
\[\ce{C2H5OH}(l)+\ce{3O2}(g)⟶\ce{2CO2}+\ce{3H2O}(l)\hspace{20px}ΔH_{298}^\circ=\mathrm{−1366.8\: kJ} \label{5.4.8} \]
Enthalpies ya mwako kwa vitu vingi vimepimwa; chache kati ya hizi zimeorodheshwa katika Jedwali\(\PageIndex{1}\). Dutu nyingi zinazopatikana kwa urahisi zenye enthalpi kubwa za mwako hutumika kama fueli, ikiwa ni pamoja na hidrojeni, kaboni (kama makaa ya mawe au makaa), na hidrokaboni (misombo yenye hidrojeni na kaboni tu), kama vile methane, propane, na sehemu kubwa za petroli.
| Dutu | Mmwako mmenyuko | Enthalpy ya Mwako\(ΔH_c^\circ \left(\mathrm{\dfrac{kJ}{mol} \:at\:25°C}\right)\) |
|---|---|---|
| kaboni | \(\ce{C}(s)+\ce{O2}(g)⟶\ce{CO2}(g)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">-393.5 |
| haidrojeni | \(\ce{H2}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{H2O}(l)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">18-285.8 |
| magnesiamu | \(\ce{Mg}(s)+\frac{1}{2}\ce{O2}(g)⟶\ce{MgO}(s)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">18-601.6 |
| salfa | \(\ce{S}(s)+\ce{O2}(g)⟶\ce{SO2}(g)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; "> -296.8 |
| monoksidi kaboni | \(\ce{CO}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{CO2}(g)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">18-283.0 |
| methani | \(\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(l)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">18-890.8 |
| asetilini | \(\ce{C2H2}(g)+\dfrac{5}{2}\ce{O2}(g)⟶\ce{2CO2}(g)+\ce{H2O}(l)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">-1301.1 |
| ethanoli | \(\ce{C2H5OH}(l)+\ce{3O2}(g)⟶\ce{CO2}(g)+\ce{3H2O}(l)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">18-1366.8 |
| methanoli | \(\ce{CH3OH}(l)+\dfrac{3}{2}\ce{O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(l)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">18-726.1 |
| isoktane | \(\ce{C8H18}(l)+\dfrac{25}{2}\ce{O2}(g)⟶\ce{8CO2}(g)+\ce{9H2O}(l)\) | \ (ΔH_C^\ circ\ kushoto (\ mathrm {\ dfrac {kJ} {mol}\ :at\:}\ haki)\)” style="Nakala-align:center; ">-5461 |
Kama Kielelezo\(\PageIndex{3}\) kinapendekeza, mwako wa petroli ni mchakato wa exothermic sana. Hebu tueleze kiasi cha takriban cha joto kilichozalishwa na kuchomwa 1.00 L ya petroli, kwa kuzingatia enthalpy ya mwako wa petroli ni sawa na ile ya isooctane, sehemu ya kawaida ya petroli. Uzito wa isooctane ni 0.692 g/ml.

Suluhisho
Kuanzia na kiasi kinachojulikana (1.00 L ya isooctane), tunaweza kufanya mabadiliko kati ya vitengo mpaka tufikia kiasi kinachohitajika cha joto au nishati. Enthalpy ya mwako wa isooctane hutoa moja ya mabadiliko muhimu. Jedwali\(\PageIndex{1}\) linatoa thamani hii kama -5460 kJ kwa 1 mole ya isooctane (C 8 H 18).
Kutumia data hizi,
\[\mathrm{1.00\:\cancel{L\:\ce{C8H18}}×\dfrac{1000\:\cancel{mL\:\ce{C8H18}}}{1\:\cancel{L\:\ce{C8H18}}}×\dfrac{0.692\:\cancel{g\:\ce{C8H18}}}{1\:\cancel{mL\:\ce{C8H18}}}×\dfrac{1\:\cancel{mol\:\ce{C8H18}}}{114\:\cancel{g\:\ce{C8H18}}}×\dfrac{−5460\:kJ}{1\:\cancel{mol\:\ce{C8H18}}}=−3.31×10^4\:kJ} \nonumber \]
Mwako wa 1.00 L ya isooctane hutoa 33,100 kJ ya joto. (Kiasi hiki cha nishati kinatosha kuyeyuka kilo 99.2, au takriban 218 lbs, ya barafu.)
Kumbuka: Ikiwa unafanya hesabu hii hatua moja kwa wakati, ungepata:
\ (\ kuanza {align*}
&\ hesabu {1.00\ :L\:\ ce {C8H18} 1.00×10 ^ 3\ :ml\:\ ce {C8H18}}}\\
&\ hesabu {1.00×10 ^ 3\ :ml\:\ ce {C8H18} 692\:\ g\:\ ce {C8H18}}}\\
&\ hesabu {692\:\ g\:\ ce {C8H18} 6.07\: mol\:\ ce {C8H18}}\\
&\ hesabu {692\:\ g\:\ ce {C8H18} -3.31×10 ^ 4\ :KJ}
\ mwisho {align*}\)
Ni joto gani linalozalishwa na mwako wa 125 g ya acetylene?
- Jibu
-
6.25 × 10 3 kJ
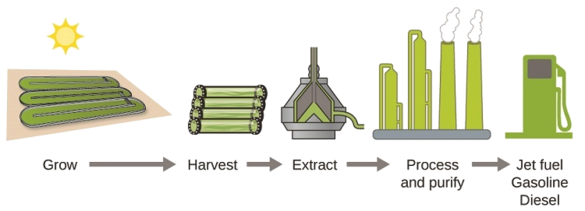
Kama akiba ya mafuta ya mafuta inapungua na kuwa na gharama kubwa zaidi kutoa, utafutaji unaendelea kwa ajili ya vyanzo vya mafuta badala ya siku zijazo. Miongoni mwa biofueli zinazoahidi zaidi ni wale wanaotokana na mwani (Kielelezo\(\PageIndex{4}\)). Aina za mwani zinazotumiwa ni zisizo na sumu, zinazobadilika, na kati ya viumbe vinavyokua kwa kasi zaidi duniani. Kuhusu 50% ya uzito wa algal ni mafuta, ambayo yanaweza kubadilishwa kwa urahisi kuwa mafuta kama vile biodiesel. Algae inaweza kuzalisha galoni 26,000 za biofueli kwa hekta—nishati nyingi zaidi kwa ekari kuliko mazao mengine. Matatizo mengine ya mwani yanaweza kustawi katika maji ya chumvi ambayo hayatumiki kwa kukua mazao mengine. Algae inaweza kuzalisha biodiesel, biopetroli, ethanol, butanol, methane, na hata mafuta ya ndege.

Kwa mujibu wa Idara ya Nishati ya Marekani, kilomita za mraba 39,000 tu (takriban 0.4% ya masi ya ardhi ya Marekani au chini\(\dfrac{1}{7}\) ya eneo linalotumiwa kukua mahindi) zinaweza kuzalisha mafuta ya algali ya kutosha kuchukua nafasi ya mafuta yote ya petroli inayotumiwa Marekani. Gharama ya mafuta ya algal inakuwa ya ushindani zaidi-kwa mfano, Jeshi la Anga la Marekani linazalisha mafuta ya ndege kutoka kwa mwani kwa gharama ya jumla ya chini ya dola 5 kwa kila lita. Mchakato unaotumiwa kuzalisha mafuta ya algali ni kama ifuatavyo: kukua mwani (ambao hutumia jua kama chanzo chao cha nishati na CO 2 kama malighafi); kuvuna mwani; dondoo misombo ya mafuta (au misombo ya mtangulizi); mchakato kama inavyohitajika (kwa mfano, fanya mmenyuko wa transesterification kufanya biodiesel); kusafisha; na kusambaza (Kielelezo\(\PageIndex{5}\)).
Standard Enthalpy ya Mafunzo
Enthalpy ya kawaida ya malezi\(ΔH^\circ_\ce{f}\) ni mabadiliko ya enthalpy kwa mmenyuko ambapo hasa mole 1 ya dutu safi hutengenezwa kutoka kwa vipengele vya bure katika majimbo yao imara zaidi chini ya hali ya hali ya kawaida. Maadili haya ni muhimu hasa kwa kompyuta au kutabiri mabadiliko ya enthalpy kwa athari za kemikali ambazo haziwezekani au hatari kutekeleza, au kwa michakato ambayo ni vigumu kufanya vipimo. Ikiwa tuna maadili ya enthalpies ya kawaida ya malezi, tunaweza kuamua mabadiliko ya enthalpy kwa majibu yoyote, ambayo tutafanya mazoezi katika sehemu inayofuata juu ya sheria ya Hess.
Enthalpy ya kawaida ya malezi ya CO 2 (g) ni -393.5 kJ/mol. Hii ni mabadiliko ya enthalpy kwa mmenyuko wa exothermic:
\[\ce{C}(s)+\ce{O2}(g)⟶\ce{CO2}(g)\hspace{20px}ΔH^\circ_\ce{f}=ΔH^\circ_{298}=−393.5\:\ce{kJ} \label{5.4.9} \]
kuanzia na reactants kwa shinikizo la atm 1 na 25 °C (pamoja na kaboni iliyopo kama grafiti, aina imara zaidi ya kaboni chini ya hali hizi) na kuishia na mole moja ya CO 2, pia kwa atm 1 na 25 °C Kwa dioksidi nitrojeni\(\ce{NO}_{2(g)}\),,\(ΔH^\circ_\ce{f}\) ni 33.2 kJ/mol. Hii ni mabadiliko ya enthalpy kwa mmenyuko:
\[\frac{1}{2}\ce{N2}(g)+\ce{O2}(g)⟶\ce{NO2}(g)\hspace{20px}ΔH^\circ_\ce{f}=ΔH^\circ_{298}=+33.2\: \ce{kJ} \label{5.4.10} \]
Equation ya mmenyuko na\(\frac{1}{2}\) mole ya N 2 na 1 mole ya O 2 ni sahihi katika kesi hii kwa sababu enthalpy ya kawaida ya malezi daima inahusu 1 mole ya bidhaa, NO 2 (g).
Utapata meza ya enthalpies ya kawaida ya malezi ya vitu vingi vya kawaida katika Majedwali T1 na T2. Maadili haya yanaonyesha kwamba athari za malezi zinatofautiana kutoka kwa exothermic sana (kama vile -2984 KJ/mol kwa ajili ya malezi ya P 4 O 10) hadi kwa nguvu endothermic (kama vile +226.7 kJ/mol kwa ajili ya malezi ya asetilini, C 2 H 2). Kwa ufafanuzi, enthalpy ya kawaida ya malezi ya kipengele katika fomu yake imara ni sawa na sifuri chini ya hali ya kawaida, ambayo ni 1 atm kwa gesi na 1 M kwa ufumbuzi.
Ozone, O 3 (g), aina kutoka oksijeni, O 2 (g), kwa mchakato wa mwisho. Mionzi ya ultraviolet ni chanzo cha nishati inayoongoza mmenyuko huu katika anga ya juu. Kwa kuzingatia kwamba majibu yote na bidhaa za mmenyuko ziko katika majimbo yao ya kawaida, kuamua enthalpy ya kawaida ya malezi,\(ΔH^\circ_\ce{f}\) ya ozoni kutoka kwa habari zifuatazo:
\[\ce{3O2}(g)⟶\ce{2O3}(g)\hspace{20px}ΔH^\circ_{298}=+286\: \ce{kJ} \nonumber \]
S Solutio n\(ΔH^\circ_\ce{f}\) ni mabadiliko ya enthalpy kwa ajili ya malezi ya mole moja ya dutu katika hali yake ya kawaida kutoka kwa vipengele katika majimbo yao ya kawaida. Hivyo,\(ΔH^\circ_\ce{f}\) kwa O 3 (g) ni mabadiliko ya enthalpy kwa mmenyuko:
\[\dfrac{3}{2}\ce{O2}(g)⟶\ce{O3}(g) \nonumber \]
Kwa ajili ya malezi ya 2 mol ya O 3 (g),\(ΔH^\circ_{298}=+286\: \ce{kJ}\). Uwiano huu\(\mathrm{\left(\dfrac{286\:kJ}{2\:mol\:O_3}\right)}\), unaweza kutumika kama sababu ya uongofu ili kupata joto zinazozalishwa wakati 1 mole ya O 3 (g) inapangwa, ambayo ni enthalpy ya malezi kwa O 3 (g):
\[ΔH^\circ \ce{\:for\:1\:mole\: of\:O_3}(g)=\mathrm{1\:\cancel{mol\:O_3}×\dfrac{286\:kJ}{2\:\cancel{mol\:O_3}}=143\:kJ} \nonumber \]
Kwa hiyo,\(ΔH^\circ_\ce{f}[\ce{O3}(g)]=\ce{+143\: kJ/mol}\).
Gesi ya hidrojeni, H 2, humenyuka kwa ukali na klorini ya gesi, Cl 2, ili kuunda kloridi hidrojeni, HCl (g). Je, ni mabadiliko ya enthalpy kwa mmenyuko wa 1 mole ya H 2 (g) na 1 mole ya Cl 2 (g) ikiwa majibu na bidhaa zote zina hali ya hali ya kawaida? Enthalpy ya kawaida ya malezi ya HCl (g) ni -92.3 kJ/mol.
- Jibu
-
Kwa majibu
\[\ce{H2}(g)+\ce{Cl2}(g)⟶\ce{2HCl}(g)\hspace{20px}ΔH^\circ_{298}=\mathrm{−184.6\:kJ} \nonumber \]
Andika joto la equations ya mmenyuko wa malezi kwa:
- \(\ce{C2H_5OH}_{(l)}\)
- \(\ce{Ca_3(PO_4)}_{2(s)}\)
Suluhisho
Kumbuka kwamba equations ya\(ΔH^\circ_\ce{f}\) majibu ni kwa ajili ya kutengeneza mole 1 ya kiwanja kutoka kwa vipengele vyake vya chini ya hali ya kawaida, tuna:
- \(\ce{2C}(s,\:\ce{graphite})+\ce{3H2}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{C2H5OH}(l)\)
- \(\ce{3Ca}(s)+\frac{1}{2}\ce{P4}(s)+\ce{4O2}(g)⟶\ce{Ca3(PO4)2}(s)\)
Kumbuka: Hali ya kiwango cha kaboni ni grafiti, na fosforasi ipo kama\(P_4\).
Andika joto la equations ya mmenyuko wa malezi kwa:
- \(\ce{C_2H_5OC_2H}_{5(l)}\)
- \(\ce{Na_2CO}_{3(s)}\)
- Jibu
-
\(\ce{4C}(s,\:\ce{graphite})+\ce{5H2}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{C2H5OC2H5}(l)\);
- Jibu b
-
\(\ce{2Na}(s)+\ce{C}(s,\:\ce{graphite})+\dfrac{3}{2}\ce{O2}(g)⟶\ce{Na2CO3}(s)\)
Sheria ya Hess
Kuna njia mbili za kuamua kiasi cha joto kinachohusika na mabadiliko ya kemikali: kupima kwa majaribio, au uhesabu kutoka kwa mabadiliko mengine ya enthalpy yaliyopangwa kwa majaribio. Baadhi ya athari ni vigumu, ikiwa haiwezekani, kuchunguza na kufanya vipimo sahihi kwa majaribio. Na hata wakati mmenyuko si vigumu kufanya au kupima, ni rahisi kuwa na uwezo wa kuamua joto linalohusika katika mmenyuko bila ya kufanya jaribio.
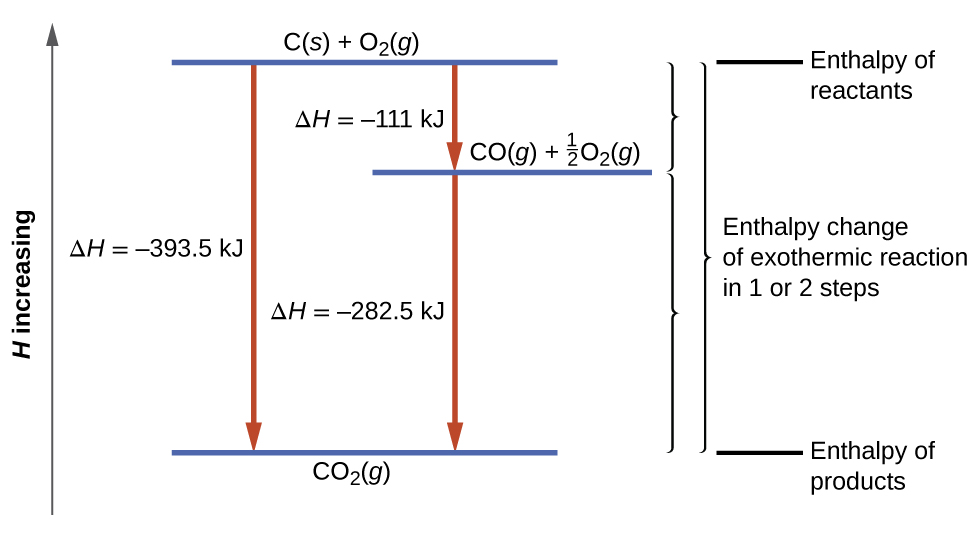
Aina hii ya hesabu kwa kawaida inahusisha matumizi ya sheria ya Hess, ambayo inasema: Ikiwa mchakato unaweza kuandikwa kama jumla ya michakato kadhaa ya hatua kwa hatua, mabadiliko ya enthalpy ya mchakato wa jumla yanafanana na jumla ya mabadiliko ya enthalpy ya hatua mbalimbali. Sheria ya Hess ni halali kwa sababu enthalpy ni kazi ya serikali: Mabadiliko ya Enthalpy hutegemea tu mahali ambapo mchakato wa kemikali unaanza na kuishia, lakini si kwenye njia inachukua kuanzia mwanzo hadi mwisho. Kwa mfano, tunaweza kufikiria mmenyuko wa kaboni na oksijeni kuunda dioksidi kaboni kama inatokea ama moja kwa moja au kwa mchakato wa hatua mbili. Mchakato wa moja kwa moja umeandikwa:
\[\ce{C}_{(s)}+\ce{O}_{2(g)}⟶\ce{CO}_{2(g)}\;\;\;ΔH^∘_{298}=\mathrm{−394\;kJ} \label{ 5.4.11} \]
Katika mchakato wa hatua mbili, monoxide ya kwanza ya kaboni huundwa:
\[\ce{C}_{(s)}+\dfrac{1}{2}\ce{O}_{2(g)}⟶\ce{CO}_{(g)}\;\;\;ΔH^∘_{298}=\mathrm{−111\;kJ} \label{ 5.4.12} \]
Kisha, monoxide ya kaboni humenyuka zaidi ili kuunda dioksidi kaboni:
\[\ce{CO} {(g)}+\dfrac{1}{2}\ce{O2}(g)⟶\ce{CO}_2 {(g)}\;\;\;ΔH^∘_{298}=\mathrm{−283\;kJ} \label{ 5.4.13} \]
Ulinganisho unaoelezea mmenyuko wa jumla ni jumla ya mabadiliko haya mawili ya kemikali:
\[\begin {align*} &\textrm{Step 1:} \:\ce{C}(s)+\frac{1}{2}\ce{O2}(g)⟶\ce{CO}(g)\\ &\underline{\textrm{Step 2:} \:\ce{CO}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{CO2}(g)}\\ &\textrm{Sum:} \:\ce{C}(s)+\frac{1}{2}\ce{O2}(g)+\ce{CO}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{CO}(g)+\ce{CO2}(g) \end {align*} \label{5.4.14} \]
Kwa sababu CO zinazozalishwa katika Hatua ya 1 inatumiwa katika Hatua ya 2, mabadiliko halisi ni:
\[\ce{C}_{(s)}+\ce{O}_{2(g)}⟶\ce{CO}_{2(g)} \label{5.4.15} \]
Kwa mujibu wa sheria ya Hess, mabadiliko ya enthalpy ya mmenyuko yatafanana na jumla ya mabadiliko ya enthalpy ya hatua. Tunaweza kutumia data kutoka kwa enthalpies ya majaribio ya mwako katika Jedwali\(\PageIndex{1}\) ili kupata mabadiliko ya enthalpy ya mmenyuko mzima kutoka hatua zake mbili:
\ [kuanza {align*}
&\ ce {C} (s) +\ Frac {1} {2}\ ce {O2} (g)\ ce {CO} (g) &ΔH^\ circ_ {298} =\ hesabu {-111\ :KJ}\\
&\ ce {CO} (g) +\ Frac 1} {2}\ {O2} (g)\ ce {CO2} (g) &ΔH ^\ circ_ {298} =\ hesabu {-283\ :KJ}\\
&\ overline {\ ce {C} (s) +\ ce {O2} (g)\ ce {CO2} (g)\\ hnafasi {25px}}} & ; &\ overline {ΔH ^\ circ_ {298} =\ mathrm {-394\ :KJ}}
\ mwisho {align*}\ studio {5.4.16}\]
Matokeo huonyeshwa kwenye Kielelezo\(\PageIndex{6}\). Tunaona kwamba ΔH ya mmenyuko wa jumla ni sawa kama inatokea kwa hatua moja au mbili. Utafutaji huu (jumla ΔH kwa mmenyuko = jumla ya Δ H maadili kwa majibu “hatua” katika mmenyuko wa jumla) ni kweli kwa ujumla kwa michakato ya kemikali na kimwili.
Kabla ya kufanya mazoezi zaidi kutumia sheria ya Hess, hebu tukumbuke vipengele viwili muhimu vya Δ H.
- Δ H ni sawa sawa na kiasi cha reactants au bidhaa. Kwa mfano, mabadiliko ya enthalpy kwa mmenyuko kutengeneza 1 mole ya NO 2 (g) ni +33.2 kJ:\[\frac{1}{2}\ce{N2}(g)+\ce{O2}(g)⟶\ce{NO2}(g)\hspace{20px}ΔH=\mathrm{+33.2\: kJ} \label{5.4.17} \]
Wakati moles 2 ya NO 2 (mara mbili zaidi) hutengenezwa, Δ H itakuwa mara mbili kubwa:\[\ce{N2}(g)+\ce{2O2}(g)⟶\ce{2NO2}(g)\hspace{20px}ΔH=\mathrm{+66.4\: kJ} \label{5.4.18} \]
Kwa ujumla, ikiwa tunazidisha au kugawanya equation kwa namba, basi mabadiliko ya enthalpy yanapaswa pia kuzidishwa au kugawanywa na idadi sawa.
- Δ H kwa mmenyuko katika mwelekeo mmoja ni sawa na ukubwa na kinyume na ishara kwa Δ H kwa mmenyuko katika mwelekeo wa nyuma. Kwa mfano, kutokana na kwamba:\[\ce{H2}(g)+\ce{Cl2}(g)⟶\ce{2HCl}(g)\hspace{20px}ΔH=\mathrm{−184.6\:kJ} \label{5.4.19} \]
Kisha, kwa mmenyuko wa “reverse”, mabadiliko ya enthalpy pia “yanabadilishwa”:\[\ce{2HCl}(g)⟶\ce{H2}(g)+\ce{Cl2}(g)\hspace{20px}ΔH=\mathrm{+184.6\: kJ} \label{5.4.20} \]
Kwa kutumia Sheria ya Hess Kuamua enthalpy ya malezi\(ΔH^\circ_\ce{f}\), ya FeCl 3 (s) kutoka kwa mabadiliko ya enthalpy ya mchakato wa hatua mbili zifuatazo ambayo hutokea chini ya hali ya hali ya kawaida:
\[\ce{Fe}(s)+\ce{Cl2}(g)⟶\ce{FeCl2}(s)\hspace{20px}ΔH°=\mathrm{−341.8\:kJ} \nonumber \]
\[\ce{FeCl2}(s)+\frac{1}{2}\ce{Cl2}(g)⟶\ce{FeCl3}(s)\hspace{20px}ΔH°=\mathrm \nonumber{−57.7\:kJ} \nonumber \]
Suluhisho
Tunajaribu kupata enthalpy ya kawaida ya malezi ya FeCl3 (s), ambayo ni sawa na ΔH° kwa majibu:
\[\ce{Fe}(s)+\frac{3}{2}\ce{Cl2}(g)⟶\ce{FeCl3}(s)\hspace{20px}ΔH^\circ_\ce{f}=\:? \nonumber \]
Kuangalia athari, tunaona kwamba majibu ambayo tunataka kupata Δ H° ni jumla ya athari mbili na maadili yaliyojulikana Δ H, kwa hiyo tunapaswa kuhesabu Δ H s yao:
\[\ce{Fe}(s)+\ce{Cl2}(g)⟶\ce{FeCl2}(s)\hspace{59px}ΔH°=\mathrm{−341.8\:kJ}\\ \underline{\ce{FeCl2}(s)+\frac{1}{2}\ce{Cl2}(g)⟶\ce{FeCl3}(s)\hspace{20px}ΔH°=\mathrm{−57.7\:kJ}}\\ \ce{Fe}(s)+\frac{1}{2}\ce{Cl2}(g)⟶\ce{FeCl3}(s)\hspace{43px}ΔH°=\mathrm{−399.5\:kJ} \nonumber \]
Enthalpy ya malezi,\(ΔH^\circ_\ce{f}\), ya FeCl 3 (s) ni -399.5 kJ/mol.
Tumia ΔH kwa mchakato:
\[\ce{N2}(g)+\ce{2O2}(g)⟶\ce{2NO2}(g) \nonumber \]
kutoka kwa maelezo yafuatayo:
\[\ce{N2}(g)+\ce{O2}(g)⟶\ce{2NO}(g)\hspace{20px}ΔH=\mathrm{180.5\:kJ} \nonumber \]
\[\ce{NO}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{NO2}(g)\hspace{20px}ΔH=\mathrm{−57.06\:kJ} \nonumber \]
- Jibu
-
66.4 kJ
Hapa ni mfano usio na moja kwa moja unaoonyesha mchakato wa mawazo unaohusika katika kutatua matatizo mengi ya sheria ya Hess. Inaonyesha jinsi tunaweza kupata enthalpies nyingi za kawaida za malezi (na maadili mengine ya Δ H) ikiwa ni vigumu kuamua majaribio.
Kutumia Sheria ya Hess Chlorini monofluoride inaweza kuguswa na fluorine kuunda trifluoride ya klorini:
(i)\(\ce{ClF}(g)+\ce{F2}(g)⟶\ce{ClF3}(g)\hspace{20px}ΔH°=\:?\)
Tumia athari hapa kuamua ΔH° kwa majibu (i):
(ii)\(\ce{2OF2}(g)⟶\ce{O2}(g)+\ce{2F2}(g)\hspace{20px}ΔH^\circ_{(ii)}=\mathrm{−49.4\:kJ}\)
(iii)\(\ce{2ClF}(g)+\ce{O2}(g)⟶\ce{Cl2O}(g)+\ce{OF2}(g)\hspace{20px}ΔH^\circ_{(iii)}=\mathrm{+205.6\: kJ}\)
(iv)\(\ce{ClF3}(g)+\ce{O2}(g)⟶\frac{1}{2}\ce{Cl2O}(g)+\dfrac{3}{2}\ce{OF2}(g)\hspace{20px}ΔH^\circ_{(iv)}=\mathrm{+266.7\: kJ}\)
Suluhisho
Lengo letu ni kuendesha na kuchanganya athari (ii), (iii), na (iv) kama kwamba wao kuongeza hadi majibu (i). Kwenda kutoka kushoto kwenda kulia katika (i), sisi kwanza kuona kwamba\(\ce{ClF}_{(g)}\) inahitajika kama reactant. Hii inaweza kupatikana kwa kuzidisha mmenyuko (iii) na\(\frac{1}{2}\), ambayo ina maana kwamba mabadiliko ΔH° pia yanaongezeka kwa\(\frac{1}{2}\):
\[\ce{ClF}(g)+\frac{1}{2}\ce{O2}(g)⟶\frac{1}{2}\ce{Cl2O}(g)+\frac{1}{2}\ce{OF2}(g)\hspace{20px} ΔH°=\frac{1}{2}(205.6)=+102.8\: \ce{kJ} \nonumber \]
Kisha, tunaona kwamba pia\(\ce{F_2}\) inahitajika kama reactant. Ili kupata hii, reverse na nusu mmenyuko (ii), ambayo ina maana kwamba ΔH° mabadiliko ishara na ni nusu:
\[\frac{1}{2}\ce{O2}(g)+\ce{F2}(g)⟶\ce{OF2}(g)\hspace{20px}ΔH°=+24.7\: \ce{kJ} \nonumber \]
Ili kupata ClF 3 kama bidhaa, reverse (iv), kubadilisha ishara ya ΔH°:
\[\frac{1}{2}\ce{Cl2O}(g)+\dfrac{3}{2}\ce{OF2}(g)⟶\ce{ClF3}(g)+\ce{O2}(g)\hspace{20px}ΔH°=\mathrm{−266.7\: kJ} \nonumber \]
Sasa angalia ili uhakikishe kwamba athari hizi zinaongeza hadi majibu tunayotaka:
\ [kuanza {align*}
&\ ce {CLF} (g) +\ Frac {1} {2}\ ce {O2} (g)\ frac {1} {2}\ ce {Cl2O} (g) +\ frac {1} {2}\ ce {OF2} (g) &ΔH =\ hesabu {+102.8\: KJ}\\
&\ frac {1} {2}\ ce {O2} (g) +\ ce {F2} (g)\ ce {OF2} (g) &ΔH =\ hesabu {+24.7\: KJ}\\
&\ frac {1} {2}\ ce {Cl2O} (g) +\ dfrac {2}\ ce {OF2} (g)\ ce {cLF3} (g) +\ ce {O2} (g) &&ΔH =\ hesabu {-266.7\: KJ}\\ &\ overline {\ ce {cLF} (g) +\ ce {F2}\ ce {ClF3} (g)\ nafasi {130px}}
&\ overline {F2}\ ce {ClF3} (g)\\ nafasi {130px}} &\ overline {F2}\ ce {ClF3} (g)\\ hnafasi {130px}} &\ overline {F2}\ ce {ΔH°=\ mathrm {-139.2
\ :KJ}}\ mwisho {align*}\ hakuna idadi\]
Reactants\(\frac{1}{2}\ce{O2}\) na\(\frac{1}{2}\ce{O2}\) kufuta bidhaa O 2; bidhaa\(\frac{1}{2}\ce{Cl2O}\) cancels reactant\(\frac{1}{2}\ce{Cl2O}\); na reactant\(\dfrac{3}{2}\ce{OF2}\) ni kufutwa na bidhaa\(\frac{1}{2}\ce{OF2}\) na YA 2. Hii majani reactants tu ClF (g) na F 2 (g) na bidhaa ClF 3 (g), ambayo ni nini tunataka. Kwa kuwa summing hizi athari tatu iliyopita mavuno majibu ya riba, summing tatu iliyopita ΔH° maadili kutoa taka ΔH°:
Kloridi ya alumini inaweza kuundwa kutoka kwa vipengele vyake:
(i)\(\ce{2Al}(s)+\ce{3Cl2}(g)⟶\ce{2AlCl3}(s)\hspace{20px}ΔH°=\:?\)
Tumia athari hapa kuamua ΔH° kwa majibu (i):
(ii)\(\ce{HCl}(g)⟶\ce{HCl}(aq)\hspace{20px}ΔH^\circ_{(ii)}=\mathrm{−74.8\:kJ}\)
(iii)\(\ce{H2}(g)+\ce{Cl2}(g)⟶\ce{2HCl}(g)\hspace{20px}ΔH^\circ_{(iii)}=\mathrm{−185\:kJ}\)
(iv)\(\ce{AlCl3}(aq)⟶\ce{AlCl3}(s)\hspace{20px}ΔH^\circ_{(iv)}=\mathrm{+323\:kJ/mol}\)
(v)\(\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3H2}(g)\hspace{20px}ΔH^\circ_{(v)}=\mathrm{−1049\:kJ}\)
- Jibu
-
-1407 kJ
Pia tunaweza kutumia sheria ya Hess kuamua mabadiliko ya enthalpy ya mmenyuko wowote ikiwa enthalpies sambamba ya malezi ya reactants na bidhaa zinapatikana. Athari stepwise tunaona ni: (i) kuharibika kwa reactants katika vipengele vyao vya sehemu (ambayo mabadiliko ya enthalpy ni sawia na hasi ya enthalpies ya malezi ya reactants), ikifuatiwa na (ii) mchanganyiko wa vipengele vya kutoa bidhaa (pamoja na enthalpy mabadiliko sawia na enthalpies ya malezi ya bidhaa). Mabadiliko ya kiwango cha enthalpy ya mmenyuko wa jumla ni sawa na: (ii) jumla ya enthalpies ya kawaida ya malezi ya bidhaa zote pamoja na (i) jumla ya hasi ya enthalpies ya kawaida ya malezi ya reactants. Hii ni kawaida upya kidogo kuandikwa kama ifuatavyo, na\(\sum\) kuwakilisha “jumla ya” na n kusimama kwa coefficients stoichiometric:
\[ΔH^\circ_\ce{reaction}=\sum n×ΔH^\circ_\ce{f}\ce{(products)}−\sum n×ΔH^\circ_\ce{f}\ce{(reactants)} \label{5.4.20B} \]
Mfano unaofuata unaonyesha kwa undani kwa nini equation hii ni halali, na jinsi ya kuitumia kuhesabu mabadiliko ya enthalpy kwa mmenyuko wa riba.
Je, ni mabadiliko ya kawaida ya enthalpy kwa mmenyuko:
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(aq)+\ce{NO}(g)\hspace{20px}ΔH°=\:? \nonumber \]
Suluhisho 1: Kutumia Equation
Vinginevyo, tunaweza kutumia fomu maalum ya sheria ya Hess iliyotolewa hapo awali:
\[ΔH^\circ_\ce{reaction}=∑n×ΔH^\circ_\ce{f}\ce{(products)}−∑n×ΔH^\circ_\ce{f}\ce{(reactants)} \nonumber \]
\[\begin {align*} &=\mathrm{\left[2\:\cancel{mol\:HNO_3}×\dfrac{−207.4\:kJ}{\cancel{mol\:HNO_3\:(\mathit{aq})}}+1\:\cancel{mol\: NO\:(\mathit{g})}×\dfrac{+90.2\: kJ}{\cancel{mol\: NO\:(\mathit{g})}}\right]}\\ &\mathrm{\:−\,\left[3\:\cancel{mol\:NO_2(\mathit{g})}×\dfrac{+33.2\: kJ}{\cancel{mol\:NO_2\:(\mathit{g})}}+1\:\cancel{mol\:H_2O\:(\mathit{l})}×\dfrac{−285.8\:kJ}{\cancel{mol\:H_2O\:(\mathit{l})}}\right]}\\ &=\mathrm{2(−207.4\:kJ)+1(+90.2\: kJ)−3(+33.2\: kJ)−1(−285.8\:kJ)}\\ &=\mathrm{−138.4\:kJ}\end {align*} \nonumber \]
S Solution 2: Kusaidia Kwa nini Equation General Halali
Tunaweza kuandika majibu haya kama jumla ya uharibifu wa 3NO 2 (g) na 1H 2 O (l) katika mambo yao ya msingi, na kuundwa kwa 2 HNO 3 (aq) na 1 NO (g) kutoka vipengele vyao vya msingi. Kuandika athari hizi, na kuzingatia uhusiano wao na\(ΔH^\circ_\ce{f}\) maadili ya misombo hii (kutoka Majedwali T1 na T2), tuna:
\[\ce{3NO2}(g)⟶ \dfrac{3}{2} \ce{N2}(g)+ 3 \ce{O2}(g)\hspace{20px}ΔH^\circ_{1}=\mathrm{−99.6\:kJ} \nonumber \]
\[\ce{H2O}(l)⟶\ce{H2}(g)+\frac{1}{2}\ce{O2}(g)\hspace{20px}ΔH^\circ_{2}=+285.8\: \ce{kJ}\:[−1×ΔH^\circ_\ce{f}(\ce{H2O})] \nonumber \]
\[\ce{H2}(g)+\ce{N2}(g)+ 3 \ce{O2}(g)⟶\ce{2HNO3}(aq)\hspace{20px}ΔH^\circ_{3}=−414.8\:kJ\:[2×ΔH^\circ_\ce{f}(\ce{HNO3 \nonumber})] \nonumber \]
\[\frac{1}{2}\ce{N2}(g)+\frac{1}{2}\ce{O2}(g)⟶\ce{NO}(g)\hspace{20px}ΔH^\circ \nonumber_{4}=+90.2\: \ce{kJ}\:[1×(\ce{NO})] \nonumber \]
Kuhitimisha equations hizi za majibu hutoa majibu tunayopenda:
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(aq)+\ce{NO}(g) \nonumber \]
Kuhitimisha mabadiliko yao ya enthalpy hutoa thamani tunayotaka kuamua:
\[\begin {align*} ΔH^\circ_\ce{rxn}&=ΔH^\circ_1+ΔH^\circ_2+ΔH^\circ_3+ΔH^\circ_4=\mathrm{(−99.6\:kJ)+(+285.8\: kJ)+(−414.8\:kJ)+(+90.2\: kJ)}\\ &=\mathrm{−138.4\:kJ} \end {align*} \nonumber \]
Hivyo mabadiliko ya kawaida ya enthalpy kwa mmenyuko huu ni Δ H° = -138.4 kJ.
Kumbuka kuwa matokeo haya yalipatikana na:
- kuzidisha\(ΔH^\circ_\ce{f}\) kila bidhaa kwa mgawo wake wa stoichiometric na kuhesabu maadili hayo,
- kuzidisha\(ΔH^\circ_\ce{f}\) ya kila reactant kwa mgawo wake stoichiometric na summing maadili hayo, na kisha
- kuondoa matokeo yaliyopatikana katika hatua ya 2 kutoka kwa matokeo yaliyopatikana katika hatua ya 1.
Hii pia ni utaratibu wa kutumia equation ya jumla, kama inavyoonekana.
Tumia joto la mwako wa mole 1 ya ethanol, C 2 H 5 OH (l), wakati H 2 O (l) na CO 2 (g) huundwa. Tumia enthalpies zifuatazo za malezi: C 2 H 5 OH (l), -278 KJ/mol; H 2 O (l), -286 KJ/mol; na CO 2 (g), -394 KJ/mol.
- Jibu
-
-1368 KJ/mol
Muhtasari
Ikiwa mabadiliko ya kemikali yanafanywa kwa shinikizo la mara kwa mara na kazi pekee iliyofanywa inasababishwa na upanuzi au kupinga, q kwa mabadiliko huitwa mabadiliko ya enthalpy na ishara Δ H, au\(ΔH^\circ_{298}\) kwa athari zinazotokea chini ya hali ya hali ya kawaida. Thamani ya Δ H kwa mmenyuko katika mwelekeo mmoja ni sawa na ukubwa, lakini kinyume na ishara, kwa Δ H kwa mmenyuko katika mwelekeo kinyume, na Δ H ni sawa sawa na wingi wa reactants na bidhaa. Mifano ya mabadiliko ya enthalpy ni pamoja na enthalpy ya mwako, enthalpy ya fusion, enthalpy ya uvukizi, na enthalpy ya kawaida ya malezi. Enthalpy ya kawaida ya malezi\(ΔH^\circ_\ce{f}\), ni mabadiliko ya enthalpy yanayoambatana na malezi ya mole 1 ya dutu kutoka kwa vipengele katika majimbo yao imara katika bar 1 (hali ya kawaida). Wengi wa michakato unafanywa katika 298.15 K. kama enthalpies malezi inapatikana kwa reactants na bidhaa za mmenyuko, mabadiliko enthalpy inaweza kuhesabiwa kwa kutumia sheria ya Hess: Kama mchakato inaweza kuandikwa kama jumla ya michakato kadhaa hatua, mabadiliko ya enthalpy ya mchakato wa jumla sawa na jumla ya mabadiliko ya enthalpy ya hatua mbalimbali.
Mlinganyo muhimu
- \(ΔU=q+w\)
- \(ΔH^\circ_\ce{reaction}=∑n×ΔH^\circ_\ce{f}\ce{(products)}−∑n×ΔH^\circ_\ce{f}\ce{(reactants)}\)
maelezo ya chini
- 1 Kwa zaidi juu ya mafuta ya algal, angalia www.theguardian.com/environme... n-mafuta-tatizo.
faharasa
- thermodynamics ya kemikali
- eneo la sayansi ambayo inahusika na uhusiano kati ya joto, kazi, na aina zote za nishati zinazohusiana na michakato ya kemikali na kimwili
- enthalpy (H)
- jumla ya nishati ya mfumo wa ndani na bidhaa hisabati ya shinikizo lake na kiasi
- mabadiliko ya enthalpy (Δ H)
- joto iliyotolewa au kufyonzwa na mfumo chini ya shinikizo la mara kwa mara wakati wa mchakato wa kemikali au kimwili
- kazi ya upanuzi (kazi ya shinikizo la kiasi)
- kazi kufanyika kama mfumo expands au mikataba dhidi ya shinikizo la nje
- sheria ya kwanza ya thermodynamics
- nishati ya ndani ya mabadiliko ya mfumo kutokana na mtiririko wa joto ndani au nje ya mfumo au kazi iliyofanywa au kwa mfumo
- Sheria ya Hess
- ikiwa mchakato unaweza kuwakilishwa kama jumla ya hatua kadhaa, mabadiliko ya enthalpy ya mchakato yanafanana na jumla ya mabadiliko ya enthalpy ya hatua
- haidrokaboni
- kiwanja linajumuisha tu ya hidrojeni na kaboni; sehemu kubwa ya mafuta
- nishati ya ndani (U)
- jumla ya kila aina inawezekana ya nishati ya sasa katika dutu au dutu
- enthalpy ya kawaida ya mwako (\(ΔH^\circ_\ce{c}\))
- joto iliyotolewa wakati mole moja ya kiwanja inakabiliwa na mwako kamili chini ya hali ya kawaida
- enthalpy ya kawaida ya malezi (\(ΔH^\circ_\ce{f}\))
- mabadiliko ya enthalpy ya mmenyuko wa kemikali ambayo 1 mole ya dutu safi hutengenezwa kutoka kwa vipengele vyake katika majimbo yao imara zaidi chini ya hali ya hali ya kawaida
- hali ya kawaida
- seti ya hali ya kimwili kama kukubalika kama hali ya kawaida ya kumbukumbu ya kuripoti mali ya thermodynamic; 1 bar ya shinikizo, na ufumbuzi katika viwango vya molar 1, kwa kawaida kwa joto la 298.15 K
- kazi ya serikali
- mali kutegemea tu juu ya hali ya mfumo, na si njia kuchukuliwa kufikia hali


