9.1: Misingi ya Nishati
- Page ID
- 182415
- Eleza nishati, kutofautisha aina za nishati, na kuelezea hali ya mabadiliko ya nishati ambayo yanaongozana na mabadiliko ya kemikali na kimwili
- Kutofautisha mali kuhusiana na joto, nishati ya joto, na joto
- Kufafanua na kutofautisha joto maalum na uwezo wa joto, na kuelezea matokeo ya kimwili ya wote
- Kufanya mahesabu kuwashirikisha joto, joto maalum, na mabadiliko ya joto
Mabadiliko ya kemikali na mabadiliko yao yanayoambatana na nishati ni sehemu muhimu za ulimwengu wetu wa kila siku (Kielelezo\(\PageIndex{1}\)). Macronutrients katika chakula (protini, mafuta, na wanga) hupata athari za kimetaboliki ambazo hutoa nishati ya kuweka miili yetu kufanya kazi. Sisi kuchoma aina ya nishati (petroli, gesi asilia, makaa ya mawe) kuzalisha nishati kwa ajili ya usafiri, inapokanzwa, na kizazi cha umeme. Athari za kemikali za viwanda hutumia kiasi kikubwa cha nishati kuzalisha malighafi (kama vile chuma na alumini). Nishati hutumiwa kutengeneza malighafi hayo kuwa bidhaa muhimu, kama vile magari, skyscrapers, na madaraja.

Zaidi ya 90% ya nishati tunayotumia huja awali kutoka jua. Kila siku, jua linatoa dunia kwa karibu mara 10,000 kiasi cha nishati muhimu ili kukidhi mahitaji yote ya nishati duniani kwa siku hiyo. Changamoto yetu ni kutafuta njia za kubadilisha na kuhifadhi nishati ya jua inayoingia ili iweze kutumika katika athari au michakato ya kemikali ambayo ni rahisi na isiyo na uchafu. Mimea na bakteria nyingi huchukua nishati ya jua kwa njia ya usanisinuru. Sisi kutolewa nishati kuhifadhiwa katika mimea wakati sisi kuchoma mbao au kupanda bidhaa kama vile ethanol. Pia tunatumia nishati hii kuimarisha miili yetu kwa kula chakula kinachotoka moja kwa moja kutoka kwa mimea au kutoka kwa wanyama waliopata nishati yao kwa kula mimea. Kuungua makaa ya mawe na mafuta ya petroli pia hutoa nishati ya jua iliyohifadhiwa: Nishati hizi ni mmea wa fossilized na
Sura hii itaanzisha mawazo ya msingi ya eneo muhimu la sayansi inayohusika na kiasi cha joto kufyonzwa au kutolewa wakati wa mabadiliko ya kemikali na kimwili—eneo linaloitwa thermochemistry. Dhana zilizoletwa katika sura hii zinatumika sana katika karibu nyanja zote za kisayansi na kiufundi. Wanasayansi wa chakula hutumia kuamua maudhui ya nishati ya vyakula. Wanabiolojia hujifunza energetics ya viumbe hai, kama mwako wa kimetaboliki wa sukari ndani ya dioksidi kaboni na maji. Viwanda vya mafuta, gesi, na usafiri, watoa nishati mbadala, na wengine wengi wanajitahidi kutafuta njia bora za kuzalisha nishati kwa mahitaji yetu ya kibiashara na ya kibinafsi. Wahandisi wanajitahidi kuboresha ufanisi wa nishati, kutafuta njia bora za joto na baridi nyumba zetu, friji chakula na vinywaji vyetu, na kukidhi mahitaji ya nishati na baridi ya kompyuta na umeme, miongoni mwa maombi mengine. Kuelewa kanuni za thermochemical ni muhimu kwa wanakemia, fizikia, wanabiolojia, wanajiolojia, kila aina ya mhandisi, na tu kuhusu yeyote anayejifunza au anafanya aina yoyote ya sayansi.
Nishati
Nishati inaweza kuelezwa kama uwezo wa kusambaza joto au kufanya kazi. Aina moja ya kazi (w) ni mchakato wa kusababisha jambo kusonga dhidi ya nguvu ya kupinga. Kwa mfano, tunafanya kazi tunapopiga tairi la baiskeli—tunahamisha jambo (hewa ndani ya pampu) dhidi ya nguvu ya kupinga ya hewa inayozunguka tairi.
Kama jambo, nishati inakuja kwa aina tofauti. Mpango mmoja huainisha nishati katika aina mbili: nishati inayoweza, nishati ambayo kitu kina kwa sababu ya nafasi yake ya jamaa, muundo, au hali, na nishati ya kinetic, nishati ambayo kitu kinacho kwa sababu ya mwendo wake. Maji juu ya maporomoko ya maji au bwawa ina nishati uwezo kwa sababu ya nafasi yake; wakati inapita chini kupitia jenereta, ina nishati kinetic ambayo inaweza kutumika kufanya kazi na kuzalisha umeme katika mmea wa umeme (Kielelezo\(\PageIndex{2}\)). Betri ina uwezo wa nishati kwa sababu kemikali ndani yake zinaweza kuzalisha umeme zinazoweza kufanya kazi.

Nishati inaweza kubadilishwa kutoka fomu moja hadi nyingine, lakini nishati zote zilizopo kabla ya mabadiliko hutokea daima zipo katika fomu fulani baada ya mabadiliko kukamilika. Uchunguzi huu unaonyeshwa katika sheria ya uhifadhi wa nishati: wakati wa mabadiliko ya kemikali au kimwili, nishati haiwezi kuundwa wala kuharibiwa, ingawa inaweza kubadilishwa kwa fomu. (Hii pia ni toleo moja la sheria ya kwanza ya thermodynamics, kama utakavyojifunza baadaye.)
Wakati dutu moja inabadilishwa kuwa nyingine, daima kuna uongofu unaohusishwa wa aina moja ya nishati hadi nyingine. Joto hutolewa au kufyonzwa, lakini wakati mwingine uongofu unahusisha mwanga, nishati ya umeme, au aina nyingine ya nishati. Kwa mfano, nishati ya kemikali (aina ya nishati inayoweza) huhifadhiwa katika molekuli zinazounda petroli. Wakati petroli inapowaka ndani ya mitungi ya inji ya gari, bidhaa za gesi zinazopanua haraka za mmenyuko huu wa kemikali huzalisha nishati ya mitambo (aina ya nishati ya kinetic) wakati wa kusonga pistoni za silinda.
Kwa mujibu wa sheria ya uhifadhi wa suala (inayoonekana katika sura ya awali), hakuna mabadiliko yanayoonekana katika jumla ya suala wakati wa mabadiliko ya kemikali. Wakati athari za kemikali zinatokea, mabadiliko ya nishati ni ya kawaida na mabadiliko ya wingi ni ndogo sana kupima, hivyo sheria za uhifadhi wa suala na nishati zinashikilia vizuri. Hata hivyo, katika athari za nyuklia, mabadiliko ya nishati ni makubwa zaidi (kwa sababu za milioni au hivyo), mabadiliko ya wingi yanapimika, na mabadiliko ya juu-nishati ni muhimu. Hii itachunguzwa kwa undani zaidi katika sura ya baadaye juu ya kemia ya nyuklia. Ili kuhusisha mabadiliko ya kemikali na nyuklia, tunachanganya sheria hizi katika taarifa moja: Jumla ya kiasi cha suala na nishati katika ulimwengu ni fasta.
Thermal Nishati, Joto, na Joto
Nishati ya joto ni nishati ya kinetic inayohusishwa na mwendo wa random wa atomi na molekuli. Joto ni kipimo cha kiasi cha “moto” au “baridi.” Wakati atomi na molekuli katika kitu ni kusonga au vibrating haraka, wana juu ya wastani kinetic nishati (KE), na tunasema kwamba kitu ni “moto.” Wakati atomi na molekuli zinahamia polepole, zina KE chini, na tunasema kwamba kitu ni “baridi” (Kielelezo\(\PageIndex{3}\)). Kutokana kwamba hakuna mmenyuko wa kemikali au mabadiliko ya awamu (kama vile kuyeyuka au kuvukiza) hutokea, kuongeza kiasi cha nishati ya joto katika sampuli ya suala itasababisha joto lake kuongezeka. Na, kwa kuzingatia kwamba hakuna mmenyuko wa kemikali au mabadiliko ya awamu (kama vile condensation au kufungia) hutokea, kupungua kwa kiasi cha nishati ya joto katika sampuli ya suala itasababisha joto lake kupungua.

Dutu nyingi hupanua kadiri joto lao linavyoongezeka na mkataba kadiri joto lao linapungua. Mali hii inaweza kutumika kupima mabadiliko ya joto, kama inavyoonekana katika Kielelezo\(\PageIndex{4}\). Uendeshaji wa thermometers nyingi hutegemea upanuzi na contraction ya vitu kwa kukabiliana na mabadiliko ya joto.


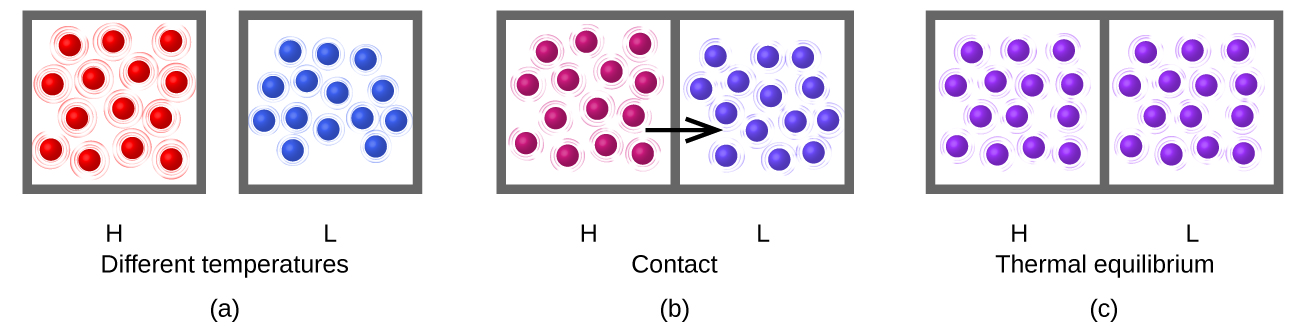
Joto (q) ni uhamisho wa nishati ya joto kati ya miili miwili kwa joto tofauti. Mzunguko wa joto (neno la redundant, lakini moja hutumiwa kawaida) huongeza nishati ya joto ya mwili mmoja na hupungua nishati ya joto ya nyingine. Tuseme sisi awali tuna joto la juu (na nishati ya juu ya mafuta) dutu (H) na joto la chini (na chini ya nishati ya joto) dutu (L). Atomi na molekuli katika H zina wastani wa KE kuliko wale walio katika L. ikiwa tunaweka dutu H katika kuwasiliana na dutu L, nishati ya joto itapita katikati ya dutu H hadi Dutu L. joto la Dutu H itapungua, kama itakuwa KE wastani wa molekuli zake; joto la Dutu L itaongeza, pamoja na KE wastani wa molekuli yake. Joto kati yake itaendelea mpaka dutu mbili ni katika joto sawa (Kielelezo\(\PageIndex{5}\)).
Suala linaloathiriwa na kemikali na mabadiliko ya kimwili yanaweza kutolewa au kunyonya joto. Mabadiliko ambayo hutoa joto huitwa mchakato wa exothermic. Kwa mfano, mmenyuko wa mwako ambao hutokea wakati wa kutumia tochi ya oksiasetilini ni mchakato wa exothermic - mchakato huu pia hutoa nishati kwa namna ya mwanga kama inavyothibitishwa na moto wa tochi (Kielelezo\(\PageIndex{6a}\)). Tabia au mabadiliko ambayo inachukua joto ni mchakato wa mwisho. Pakiti ya baridi inayotumiwa kutibu matatizo ya misuli hutoa mfano wa mchakato wa mwisho. Wakati vitu katika pakiti ya baridi (maji na chumvi kama nitrati ya amonia) huletwa pamoja, mchakato unaosababishwa unachukua joto, na kusababisha hisia za baridi.

Kupima Nishati na Uwezo wa joto
Kihistoria, nishati ilipimwa katika vitengo vya kalori (cal). Kalori ni kiasi cha nishati kinachohitajika kuongeza gramu moja ya maji kwa shahada 1 C (1 kelvin). Hata hivyo, kiasi hiki kinategemea shinikizo la anga na joto la kuanzia la maji. Urahisi wa kipimo cha mabadiliko ya nishati katika kalori umemaanisha kuwa kalori bado hutumiwa mara nyingi. Calorie (yenye mji mkuu C), au kalori kubwa, ambayo hutumiwa kwa kupima maudhui ya nishati ya chakula, ni kilocalorie. Kitengo cha SI cha joto, kazi, na nishati ni joule. Joule (J) hufafanuliwa kama kiasi cha nishati kinachotumiwa wakati nguvu ya newton 1 inasonga kitu mita 1. Ni jina kwa heshima ya mwanafizikia wa Kiingereza James Prescott Joule. Joule moja ni sawa na kilo 1 m 2 /s 2, ambayo pia huitwa 1 newton—meter. Kilojoule (kJ) ni 1000 joules. Ili kusanifisha ufafanuzi wake, kalori 1 imewekwa kuwa sawa na 4.184 joules.
Sasa tunaanzisha dhana mbili muhimu katika kuelezea mtiririko wa joto na mabadiliko ya joto. Uwezo wa joto (C) wa mwili wa suala ni wingi wa joto (q) inachukua au hutoa wakati unapata mabadiliko ya joto (Δ T) ya shahada 1 Celsius (au sawa, 1 kelvin)
\[C=\dfrac{q}{ΔT} \label{5.2.1} \]
Uwezo wa joto hutegemea aina na kiasi cha dutu ambayo inachukua au hutoa joto. Kwa hiyo ni mali ya kina - thamani yake ni sawia na kiasi cha dutu.
Kwa mfano, fikiria uwezo wa joto wa sufuria mbili za chuma za kukata. Uwezo wa joto wa sufuria kubwa ni mara tano zaidi kuliko ile ya sufuria ndogo kwa sababu, ingawa wote wawili hufanywa kwa nyenzo sawa, umati wa sufuria kubwa ni mara tano zaidi kuliko umati wa sufuria ndogo. Masi zaidi inamaanisha kuwa atomi zaidi zipo katika sufuria kubwa, hivyo inachukua nishati zaidi kufanya atomi hizo zote zitikisike kwa kasi zaidi. Uwezo wa joto wa sufuria ndogo ya chuma cha kutupwa hupatikana kwa kuchunguza kwamba inachukua 18,150 J ya nishati ili kuongeza halijoto ya sufuria kwa 50.0 °C
\[C_{\text{small pan}}=\mathrm{\dfrac{18,140\; J}{50.0\; °C} =363\; J/°C} \label{5.2.2} \]
Sufuria kubwa ya chuma ya kukata, huku ikifanywa kwa dutu moja, inahitaji 90,700 J ya nishati ili kuongeza joto lake kwa 50.0 °C. sufuria kubwa ina (proportionally) uwezo mkubwa wa joto kwa sababu kiasi kikubwa cha nyenzo inahitaji (proportionally) kiasi kikubwa cha nishati ili kuzalisha joto sawa mabadiliko:
\[C_{\text{large pan}}=\mathrm{\dfrac{90,700\; J}{50.0\;°C}=1814\; J/°C} \label{5.2.3} \]
Uwezo maalum wa joto (c) wa dutu, kwa kawaida huitwa “joto maalum,” ni kiasi cha joto kinachohitajika ili kuongeza joto la gramu 1 ya dutu kwa shahada 1 Celsius (au 1 kelvin):
\[c = \dfrac{q}{\mathrm{m\Delta T}} \label{5.2.4} \]
Uwezo maalum wa joto unategemea tu aina ya dutu inayotumia au ikitoa joto. Ni mali kubwa-aina, lakini si kiasi, ya dutu ni mambo yote. Kwa mfano, sufuria ndogo ya chuma ya kukata ina wingi wa 808 g. joto maalum la chuma (nyenzo zinazotumiwa kufanya sufuria) ni kwa hiyo:
\[c_\ce{iron}=\mathrm{\dfrac{18,140\; J}{(808\; g)(50.0\;°C)} = 0.449\; J/g\; °C} \label{5.2.5} \]
Pani kubwa ya kukata ina wingi wa 40-40 g Kutumia data kwa sufuria hii, tunaweza pia kuhesabu joto maalum la chuma:
\[c_\ce{iron}=\mathrm{\dfrac{90,700\; J}{(4,040\; g)(50.0\;°C)}=0.449\; J/g\; °C} \label{5.2.6} \]
Ingawa sufuria kubwa ni kubwa zaidi kuliko sufuria ndogo, kwa kuwa wote hufanywa kwa nyenzo sawa, wote hutoa thamani sawa kwa joto maalum (kwa ajili ya vifaa vya ujenzi, chuma). Kumbuka kuwa joto maalum hupimwa katika vitengo vya nishati kwa joto kwa wingi na ni mali kubwa, inayotokana na uwiano wa mali mbili za kina (joto na wingi). Uwezo wa joto la molar, pia mali kubwa, ni uwezo wa joto kwa mole ya dutu fulani na ina vitengo vya J/mol °C (Kielelezo\(\PageIndex{7}\)).

Maji ya kiowevu yana joto maalumu kiasi (takriban 4.2 J/g °C); metali nyingi zina mionzi mahususi ya chini sana (kwa kawaida chini ya 1 J/g °C). Joto maalum la dutu hutofautiana kiasi fulani na joto. Hata hivyo, tofauti hii ni kawaida ndogo ya kutosha kwamba tutachukua joto maalum kama mara kwa mara juu ya joto mbalimbali ambayo yatazingatiwa katika sura hii. Vipu maalum vya vitu vingine vya kawaida vimeorodheshwa kwenye Jedwali\(\PageIndex{1}\).
| Dutu | Ishara (hali) | Joto maalum (J/g °C) |
|---|---|---|
| heliamu | Yeye (g) | 5.193 |
| maji | H 2 O (l) | 4.184 |
| ethanoli | C 2 H 6 O (l) | 2.376 |
| barafu | H 2 O | 2.093 (saa -10 °C) |
| mvuke wa maji | H 2 O (g) | 1.864 |
| naitrojeni | N 2 (g) | 1.040 |
| hewa | 1.007 | |
| oksijeni | O 2 (g) | 0.918 |
| alumini | Yote | 0.897 |
| dioksidi kaboni | CO 2 (g) | 0.853 |
| agoni | Ar (g) | 0.522 |
| chuma | Fe (s) | 0.449 |
| shaba | Cu (s) | 0.385 |
| risasi | Pb (s) | 0.130 |
| dhahabu | Au (s) | 0.129 |
| silikoni | Sita (s) | 0.712 |
Ikiwa tunajua wingi wa dutu na joto lake maalum, tunaweza kuamua kiasi cha joto, q, kuingia au kuacha dutu kwa kupima mabadiliko ya joto kabla na baada ya joto kupata au kupotea:
\[\begin{align*} q &= \ce{(specific\: heat)×(mass\: of\: substance)×(temperature\: change)}\label{5.2.7}\\q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial})\end{align*} \]
Katika equation hii,\(c\) ni joto maalum ya dutu, m ni masi yake, na Δ T (ambayo inasomwa “delta T”) ni mabadiliko ya joto, T mwisho - T awali. Ikiwa dutu inapata nishati ya joto, joto lake linaongezeka, joto lake la mwisho ni kubwa kuliko joto lake la awali, T mwisho - T awali ina thamani nzuri, na thamani ya q ni chanya. Ikiwa dutu hupoteza nishati ya joto, joto lake hupungua, joto la mwisho ni la chini kuliko joto la awali, T mwisho - T awali ina thamani hasi, na thamani ya q ni hasi.
Flaski iliyo\(\mathrm{8.0 \times 10^2\; g}\) na maji huchomwa moto, na halijoto ya maji huongezeka kutoka 21 °C hadi 85 °C.
Suluhisho
Ili kujibu swali hili, fikiria mambo haya:
- joto maalum ya dutu kuwa joto (katika kesi hii, maji)
- kiasi cha dutu kuwa moto (katika kesi hii, 800 g)
- ukubwa wa mabadiliko ya joto (katika kesi hii, kutoka 21 °C hadi 85 °C).
Joto maalum la maji ni 4.184 J/g °C, hivyo kwa joto 1 g ya maji kwa 1 °C inahitaji 4.184 J. tunaona kuwa tangu 4.184 J inahitajika kuwaka 1 g ya maji kwa 1 °C, tutahitaji mara 800 kiasi cha joto 800 g ya maji kwa 1 °C Hatimaye, tunaona kuwa kwa kuwa 4.184 J inatakiwa kuwaka 1 g ya maji kwa 1 °C, sisi itahitaji mara 64 kiasi cha kuitisha kwa 64 °C (yaani kuanzia 21 °C hadi 85 °C).
Hii inaweza kufupishwa kwa kutumia equation:
\[\begin{align*} q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial}) \\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°C)×(800\:\cancel{g})×(85−21)°C}\\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°\cancel{C})×(800\:\cancel{g})×(64)°\cancel{C}}\\[4pt] &=\mathrm{210,000\: J(=210\: kJ)} \end{align*} \nonumber \]
Kwa sababu joto limeongezeka, maji yalifyonzwa joto na\(q\) ni chanya.
Kiasi gani cha joto, katika joules, lazima liongezwe kwenye skillet ya\(\mathrm{5.00 \times 10^2 \;g}\) chuma ili kuongeza joto lake kutoka 25 °C hadi 250 °C? Joto maalum la chuma ni 0.451 J/g °C.
Jibu-
\(\mathrm{5.05 \times 10^4\; J}\)
Kumbuka kuwa uhusiano kati ya joto, joto maalum, wingi, na mabadiliko ya joto yanaweza kutumika kuamua yoyote ya kiasi hiki (sio joto tu) ikiwa wengine watatu wanajulikana au yanaweza kutolewa.
Kipande cha chuma kisichojulikana kina uzito wa 348 g.Wakati kipande cha chuma kinachukua 6.64 kJ ya joto, halijoto yake huongezeka kutoka 22.4 °C hadi 43.6 °C Kuamua joto maalum la chuma hiki (ambacho kinaweza kutoa kidokezo cha utambulisho wake).
Suluhisho
Kwa kuwa molekuli, joto, na mabadiliko ya joto hujulikana kwa chuma hiki, tunaweza kuamua joto lake maalum kwa kutumia uhusiano:
\[\begin{align*} q&=c \times m \times \Delta T \\[4pt] &=c \times m \times (T_\ce{final}−T_\ce{initial}) \end{align*} \nonumber \]
Kubadilisha maadili inayojulikana:
\[6,640\; \ce J=c \times \mathrm{(348\; g) \times (43.6 − 22.4)\; °C} \nonumber \]
Kutatua:
\[c=\mathrm{\dfrac{6,640\; J}{(348\; g) \times (21.2°C)} =0.900\; J/g\; °C} \nonumber \]
Kulinganisha thamani hii na maadili katika Jedwali\(\PageIndex{1}\), thamani hii inafanana na joto maalum la alumini, ambalo linaonyesha kuwa chuma haijulikani inaweza kuwa alumini.
Kipande cha chuma kisichojulikana kina uzito wa 217 g Wakati kipande cha chuma kinachukua 1.43 kJ ya joto, halijoto yake huongezeka kutoka 24.5 °C hadi 39.1 °C Kuamua joto maalum la chuma hiki, na kutabiri utambulisho wake.
- Jibu
-
\(c = \mathrm{0.45 \;J/g \;°C}\); chuma ni uwezekano wa kuwa chuma kutoka kuangalia Jedwali\(\PageIndex{1}\).
Solar Thermal Nishati nguvu mimea
Jua linalofikia dunia lina nishati maelfu ya nyakati zaidi kuliko tunavyoshika sasa. Mifumo ya joto ya jua hutoa suluhisho moja linalowezekana kwa tatizo la kugeuza nishati kutoka jua kuwa nishati tunayoweza kutumia. Mimea ya joto ya jua kwa kiasi kikubwa ina maalum ya kubuni tofauti, lakini yote huzingatia jua ili joto la dutu fulani; joto “lililohifadhiwa” katika dutu hilo linabadilishwa kuwa umeme.
Kituo cha Kuzalisha Solana katika Jangwa la Sonora la Arizona hutoa megawati 280 za umeme. Inatumia vioo vya parabolic vinavyozingatia jua kwenye mabomba yaliyojaa maji ya uhamisho wa joto (HTF) (Kielelezo\(\PageIndex{8}\)). HTF kisha anafanya mambo mawili: Inageuka maji kuwa mvuke, ambayo huzunguka mitambo, ambayo kwa upande hutoa umeme, na huyeyuka na hupunguza mchanganyiko wa chumvi, ambayo inafanya kazi kama mfumo wa kuhifadhi nishati ya joto. Baada ya jua kushuka, mchanganyiko wa chumvi iliyoyeyushwa unaweza kisha kutolewa joto lake la kutosha kuhifadhiwa ili kuzalisha mvuke kuendesha mitambo kwa masaa 6. Chumvi zilizochombwa hutumiwa kwa sababu zina mali kadhaa za manufaa, ikiwa ni pamoja na uwezo wa juu wa joto na conductivities ya mafuta.

Mfumo wa kuzalisha jua wa Ivanpah wa Mojave, ulio katika Jangwa la Mojave huko California, ni mmea mkubwa zaidi wa nishati ya jua duniani (Kielelezo\(\PageIndex{9}\)). Vioo vyake 170,000 vinazingatia kiasi kikubwa cha jua kwenye minara mitatu inayojaa maji, huzalisha mvuke kwenye zaidi ya 538 °C inayoendesha mitambo inayozalisha umeme. Inazalisha nishati ya kutosha kwa nguvu nyumba 140,000. Maji hutumiwa kama maji ya kazi kwa sababu ya uwezo wake mkubwa wa joto na joto la uvukizi.

Muhtasari
Nishati ni uwezo wa kufanya kazi (kutumia nguvu ya kusonga jambo). Nishati ya Kinetic (KE) ni nishati ya mwendo; uwezo wa nishati ni nishati kutokana na nafasi ya jamaa, muundo, au hali. Wakati nishati inabadilishwa kutoka kwa fomu moja hadi nyingine, nishati haijaundwa wala kuharibiwa (sheria ya uhifadhi wa nishati au sheria ya kwanza ya thermodynamics). Matter ina nishati ya joto kutokana na KE ya molekuli zake na halijoto inayofanana na KE wastani wa molekuli zake. Joto ni nishati inayohamishwa kati ya vitu kwa joto tofauti; inapita kutoka juu hadi joto la chini. Michakato ya kemikali na kimwili inaweza kunyonya joto (endothermic) au kutolewa joto (exothermic). Kitengo cha SI cha nishati, joto, na kazi ni joule (J). Uwezo maalum wa joto na joto ni hatua za nishati zinazohitajika kubadili joto la dutu au kitu. Kiasi cha joto kinachotumiwa au kilichotolewa na dutu hutegemea moja kwa moja aina ya dutu, umati wake, na mabadiliko ya joto yanayotokana.
Mlinganyo muhimu
- \(q=c×m×ΔT=c×m×(T_\ce{final}−T_\ce{initial})\)
faharasa
- kalori (kalori)
- kitengo cha joto au nishati nyingine; kiasi cha nishati kinachohitajika kuongeza gramu 1 ya maji kwa shahada 1 Celsius; 1 cal inaelezwa kama 4.184 J
- mchakato wa endothermic
- kemikali mmenyuko au mabadiliko ya kimwili ambayo inachukua joto
- nishati
- uwezo wa kusambaza joto au kufanya kazi
- mchakato wa exothermic
- kemikali mmenyuko au mabadiliko ya kimwili kwamba releases joto
- joto (q)
- uhamisho wa nishati ya joto kati ya miili miwili
- uwezo wa joto (C)
- mali kubwa ya mwili wa suala ambalo linawakilisha kiasi cha joto kinachohitajika kuongeza joto lake kwa shahada 1 Celsius (au 1 kelvin)
- Joule (J)
- SI kitengo cha nishati; Joule 1 ni nishati ya kinetic ya kitu kilicho na uzito wa kilo 2 zinazohamia kwa kasi ya mita 1 kwa pili, 1 J = 1 kg m 2 /s na 4.184 J = 1 cal
- nishati kinetic
- nishati ya mwili wa kusonga, katika joules, sawa na\(\dfrac{1}{2}mv^2\) (ambapo m = molekuli na v = kasi)
- uwezo wa nishati
- nishati ya chembe au mfumo wa chembe inayotokana na nafasi ya jamaa, muundo, au hali
- uwezo maalum wa joto (c)
- mali kubwa ya dutu ambayo inawakilisha kiasi cha joto kinachohitajika kuongeza joto la gramu 1 ya dutu kwa shahada 1 Celsius (au 1 kelvin)
- joto
- kubwa mali ya jambo hilo ni kipimo upimaji wa “hotness” na “baridi”
- nishati ya joto
- kinetic nishati ya kuhusishwa na mwendo random ya atomi na molekuli
- thermochemistry
- utafiti wa kupima kiasi cha joto kufyonzwa au iliyotolewa wakati wa mmenyuko wa kemikali au mabadiliko ya kimwili
- kazi (w)
- uhamisho wa nishati kutokana na mabadiliko katika vigezo vya nje, macroscopic kama vile shinikizo na kiasi; au kusababisha jambo kuhamia dhidi ya nguvu ya kupinga


