7.5: Uchambuzi wa Kemikali Kiasi
- Page ID
- 182500
- Eleza mambo ya msingi ya titrations na uchambuzi wa gravimetric.
- Fanya mahesabu ya stoichiometric kwa kutumia titration ya kawaida na data ya gravimetric.
Katika karne ya 18, nguvu (kwa kweli mkusanyiko) ya sampuli za siki iliamua kwa kuzingatia kiasi cha carbonate ya potasiamu, K 2 CO 3, ambayo ilibidi kuongezwa, kidogo kwa wakati, kabla ya kuvuta pumzi. Uzito mkubwa wa carbonate ya potasiamu uliongezwa kufikia hatua ambapo kupumua kumalizika, zaidi ya kujilimbikizia siki.
Sasa tunajua kwamba ufanisi uliofanyika wakati wa mchakato huu ulitokana na mmenyuko na asidi ya asidi, CH 3 CO 2 H, kiwanja kimsingi kinachohusika na harufu na ladha ya siki. Asidi ya Acetic inachukua na carbonate ya potasiamu kulingana na usawa wafuatayo:
\[\ce{2CH3CO2H}(aq)+\ce{K2CO3}(s)\rightarrow 2 \ce{KCH3CO3}(aq)+\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Bubbling ilikuwa kutokana na uzalishaji wa CO 2.
Mtihani wa siki na carbonate ya potasiamu ni aina moja ya uchambuzi wa upimaji -uamuzi wa kiasi au mkusanyiko wa dutu katika sampuli. Katika uchambuzi wa siki, mkusanyiko wa solute (asidi asetiki) uliamua kutoka kwa kiasi cha reactant ambacho kinajumuishwa na sasa ya solute katika kiasi kinachojulikana cha suluhisho. Katika aina nyingine za uchambuzi wa kemikali, kiasi cha dutu kilichopo katika sampuli kinatambuliwa kwa kupima kiasi cha bidhaa kinachosababisha.
Titration
Njia iliyoelezwa ya kupima nguvu ya siki ilikuwa toleo la awali la mbinu ya uchambuzi inayojulikana kama uchambuzi wa titration. Uchambuzi wa kawaida wa titration unahusisha matumizi ya buret (Kielelezo\(\PageIndex{1}\)) kufanya nyongeza ya ziada ya suluhisho iliyo na mkusanyiko unaojulikana wa dutu fulani (titrant) kwa suluhisho la sampuli iliyo na dutu ambayo ukolezi unapaswa kupimwa ( analyte). Titrant na analyte hupata mmenyuko wa kemikali wa stoichiometry inayojulikana, na hivyo kupima kiasi cha suluhisho la titrant kinachohitajika kwa mmenyuko kamili na analyte (hatua ya ulinganifu wa titration) inaruhusu hesabu ya mkusanyiko wa analyte. Hatua ya ulinganifu wa titration inaweza kuonekana kuibua ikiwa mabadiliko tofauti katika kuonekana kwa suluhisho la sampuli huambatana na kukamilika kwa majibu. Msimamo wa malezi ya Bubble katika uchambuzi wa siki ya classic ni mfano mmoja, ingawa, kwa kawaida, dyes maalum inayoitwa viashiria vinaongezwa kwenye ufumbuzi wa sampuli ili kutoa mabadiliko katika rangi au karibu na kiwango cha ulinganifu wa titration. Vipengele vya ulinganifu vinaweza pia kugunduliwa kwa kupima mali fulani ya suluhisho ambayo inabadilika kwa njia inayoweza kutabirika wakati wa titration. Bila kujali mbinu iliyochukuliwa ili kuchunguza hatua ya usawa wa titration, kiasi cha titrant kinachopimwa kinaitwa hatua ya mwisho. Mbinu za titration zilizoundwa vizuri zinahakikisha kuwa tofauti kati ya ulinganifu na pointi za mwisho ni duni. Ingawa aina yoyote ya mmenyuko wa kemikali inaweza kutumika kama msingi wa uchambuzi wa titration, tatu zilizoelezwa katika sura hii (mvua, asidi-msingi, na redox) ni ya kawaida. Maelezo ya ziada kuhusu uchambuzi wa titration hutolewa katika sura ya usawa wa asidi-msingi.

Mwisho wa mwisho katika titration ya sampuli ya 50.00-ml ya HCl yenye maji yalifikia kwa kuongeza 35.23 ml ya 0.250 M NaOH titrant. Mmenyuko wa titration ni:
\[\ce{HCl}(aq)+\ce{NaOH}(aq)\rightarrow \ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
Je, ni molarity ya HCl?
Suluhisho
Kama kwa mahesabu yote majibu stoichiometry, suala muhimu ni uhusiano kati ya kiasi molar ya aina ya kemikali ya riba kama taswira katika uwiano kemikali equation. Mbinu ilivyoainishwa katika modules ya awali ya sura hii inafuatiwa, na masuala ya ziada yanahitajika, kwa kuwa kiasi cha reactants zinazotolewa na ombi zinaelezwa kama viwango vya ufumbuzi.
Kwa zoezi hili, hesabu itafuata hatua zifuatazo zilizoelezwa:
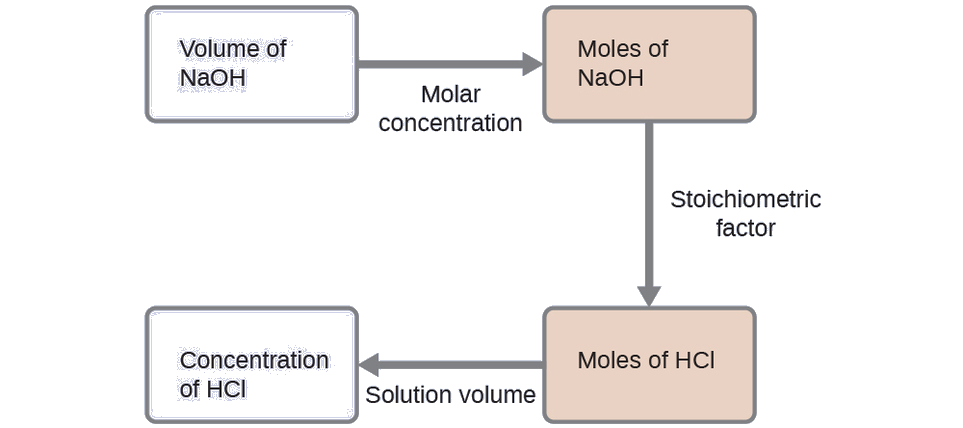
Kiasi cha molar cha HCl kinahesabiwa kuwa:
\[\mathrm{35.23\:\cancel{mL\: NaOH}\times \dfrac{1\:\cancel{L}}{1000\:\cancel{mL}}\times \dfrac{0.250\:\cancel{mol\: NaOH}}{1\:\cancel{L}}\times \dfrac{1\: mol\: HCl}{1\:\cancel{mol\: NaOH}}=8.81\times 10^{-3}\:mol\: HCl} \nonumber \]
Kutumia kiasi kilichotolewa cha ufumbuzi wa HCl na ufafanuzi wa molarity, ukolezi wa HCl ni:
\ [kuanza {align*}
M&=\ mathrm {\ dfrac {mol\: HCl} {L\: ufumbuzi}}\\
M&=\ hesabu {\ dfrac {8.81\ mara 10^ {-3}\ :mol\: HCl} {50.00\: ml\ mara\ dfrac {1\: L} {1000\: ml}}}\\
M&=0.176\ :M
\ mwisho {align*}\ nonumber\]
Kumbuka: Kwa aina hizi za mahesabu ya titration, ni rahisi kutambua kwamba molarity ya suluhisho pia ni sawa na idadi ya moles milli ya solute kwa lita moja ya suluhisho:
\[M=\mathrm{\dfrac{mol\: solute}{L\: solution}\times \dfrac{\dfrac{10^3\:mmol}{mol}}{\dfrac{10^3\:mL}{L}}=\dfrac{mmol\: solute}{mL\: solution}} \nonumber \]
Kutumia toleo hili la kitengo cha molarity kitapunguza hesabu kwa kuondoa mambo mawili ya uongofu:
\[\mathrm{\dfrac{35.23\:mL\: NaOH\times \dfrac{0.250\:mmol\: NaOH}{mL\: NaOH}\times \dfrac{1\:mmol\: HCl}{1\:mmol\: NaOH}}{50.00\:mL\: solution}=0.176\: \mathit M\: HCl} \nonumber \]
Sampuli ya 20.00-ml ya asidi oxalic yenye maji, H 2 C 2 O 4, ilikuwa titrated na ufumbuzi wa 0.09113- M ya permanganate ya potasiamu, KMNo 4.
\[\ce{2MnO4-}(aq)+\ce{5H2C2O4}(aq)+\ce{6H+}(aq)\rightarrow \ce{10CO2}(g)+\ce{2Mn^2+}(aq)+\ce{8H2O}(l) \nonumber \]
Kiasi cha 23.24 ml kilihitajika kufikia hatua ya mwisho. Je, ni asidi ya oxalic molarity?
- Jibu
-
0.2648 M
Uchambuzi wa Gravimetric
Uchunguzi wa gravimetric ni moja ambayo sampuli inakabiliwa na matibabu ambayo husababisha mabadiliko katika hali ya kimwili ya analyte ambayo inaruhusu kujitenga kwake kutoka kwa vipengele vingine vya sampuli. Misa vipimo ya sampuli, analyte pekee, au sehemu nyingine ya mfumo wa uchambuzi, kutumika pamoja na stoichiometry inayojulikana ya misombo kushiriki, kibali hesabu ya mkusanyiko analyte. Mbinu za gravimetric zilikuwa mbinu za kwanza zilizotumiwa kwa uchambuzi wa kemikali za kiasi, na zinabaki zana muhimu katika maabara ya kemia ya kisasa.
Mabadiliko yanayotakiwa ya hali katika uchambuzi wa gravimetric yanaweza kupatikana kwa michakato mbalimbali ya kimwili na kemikali. Kwa mfano, maudhui ya unyevu (maji) ya sampuli mara kwa mara huamua kwa kupima wingi wa sampuli kabla na baada ya kufanyiwa mchakato wa kupokanzwa unaodhibitiwa ambao huvukiza maji. Pia kawaida ni mbinu za gravimetric ambazo analyte inakabiliwa na mmenyuko wa mvua ya aina iliyoelezwa hapo awali katika sura hii. Precipitate ni kawaida pekee kutoka mchanganyiko majibu na filtration, kavu kwa makini, na kisha uzito (Kielelezo\(\PageIndex{2}\)). Uzito wa usahihi unaweza kutumika, pamoja na mahusiano muhimu ya stoichiometric, kuhesabu mkusanyiko wa analyte.

Mchanganyiko imara wa 0.4550-g iliyo na MgSO 4 hupasuka ndani ya maji na kutibiwa na ziada ya Ba (NO 3) 2, na kusababisha mvua ya 0.6168 g ya BaSO 4.
\[\ce{MgSO4}(aq)+\ce{Ba(NO3)2}(aq)\rightarrow \ce{BaSO4}(s)+\ce{Mg(NO3)2}(aq) \nonumber \]
Mkusanyiko (asilimia) ya MgSO 4 katika mchanganyiko ni nini?
Suluhisho
Mpango wa hesabu hii ni sawa na wengine kutumika katika mahesabu ya stoichiometric, hatua kuu kuwa uhusiano kati ya moles ya BaSO 4 na MgSO 4 kupitia sababu yao ya stoichiometric. Mara baada ya molekuli ya MgSO 4 inakadiriwa, inaweza kutumika pamoja na wingi wa mchanganyiko wa sampuli ili kuhesabu mkusanyiko wa asilimia iliyoombwa.
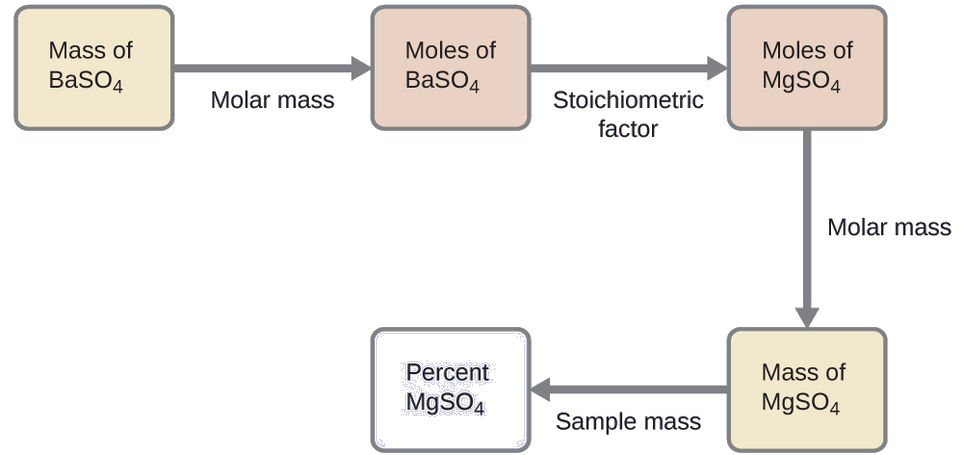
Masi ya MgSO 4 ambayo itazaa molekuli zinazotolewa precipitate ni
\[\mathrm{0.6168\:\cancel{g\: BaSO_4}\times \dfrac{1\:\cancel{mol\: BaSO_4}}{233.43\:\cancel{g\: BaSO_4}}\times \dfrac{1\:\cancel{mol\: MgSO_4}}{1\:\cancel{mol\: BaSO_4}}\times \dfrac{120.37\:g\: MgSO_4}{1\:\cancel{mol\: MgSO_4}}=0.3181\:g\: MgSO_4} \nonumber \]
Mkusanyiko wa MgSO 4 katika mchanganyiko wa sampuli ni kisha mahesabu kuwa
\ [kuanza {align*}
\ ce {asilimia\: MgSO4} &=\ ce {\ dfrac {Misa\: MgSO4} {molekuli\: sampuli}}\ mara 100\\%
\\ mathrm {\ dfrac {0.3181\: g} {0.4550\: g}}\ times100\ %&= 69.91\%
\ mwisho {align*\} hakuna nambari\]
Ni asilimia gani ya ioni ya kloridi katika sampuli ikiwa 1.1324 g ya sampuli hutoa 1.0881 g ya AgCl wakati wa kutibiwa na Ag ziada +?
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
- Jibu
-
23.76%
Uchambuzi wa mwako
Utungaji wa msingi wa hidrokaboni na misombo inayohusiana inaweza kuamua kupitia njia ya gravimetric inayojulikana kama uchambuzi wa mwako. Katika uchambuzi wa mwako, sampuli iliyopimwa ya kiwanja huwaka kwa joto la juu chini ya mkondo wa gesi ya oksijeni, na kusababisha mwako wake kamili kutoa bidhaa za gesi za utambulisho unaojulikana. Mwako kamili wa hidrokaboni, kwa mfano, utazalisha dioksidi kaboni na maji kama bidhaa pekee. Bidhaa za mwako wa gesi zinatengenezwa kwa njia ya vifaa vya ukusanyaji tofauti, vilivyotangulia vyenye misombo ambayo huchagua kila bidhaa (Kielelezo\(\PageIndex{3}\)). Ongezeko la wingi wa kila kifaa linalingana na wingi wa bidhaa iliyoingizwa na inaweza kutumika katika hesabu sahihi ya stoichiometric ili kupata umati wa kipengele husika.
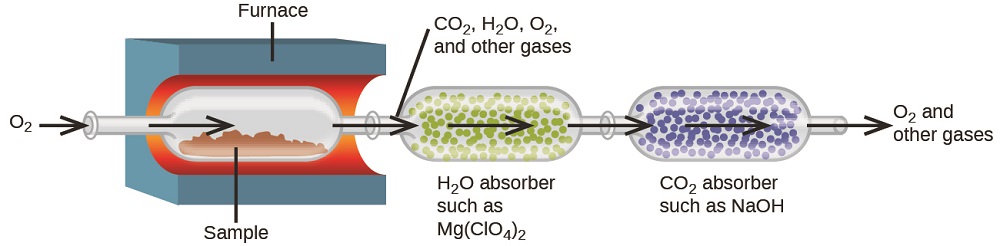
Polyethilini ni polymer ya hydrocarbon inayotumiwa kuzalisha mifuko ya kuhifadhi chakula na vitu vingine vingi vya plastiki rahisi. uchambuzi mwako wa 0.00126-g polyethilini sampuli mavuno 0.00394 g CO 2 na 0.00161 g H 2 O. ni empirical formula ya polyethilini nini?
Suluhisho
Dhana ya msingi katika zoezi hili ni kwamba kaboni yote katika sampuli iliyowaka inabadilishwa kuwa dioksidi kaboni, na hidrojeni yote katika sampuli inabadilishwa kuwa maji:
\[\mathrm{C_xH_y}(s)+\ce{excess\: O2}(g)\rightarrow x\ce{CO2}(g)+ \dfrac{y}{2} \ce{H2O}(g) \nonumber \]
Kumbuka kuwa equation uwiano si lazima kwa ajili ya kazi ya mkono. Ili kupata formula ya maandishi ya kiwanja, tu scripts x na y zinahitajika.
Kwanza, hesabu kiasi cha molar cha kaboni na hidrojeni katika sampuli, kwa kutumia raia iliyotolewa ya dioksidi kaboni na maji, kwa mtiririko huo. Kwa kiasi hiki cha molar, formula ya kimapenzi ya kiwanja inaweza kuandikwa kama ilivyoelezwa katika sura ya awali ya maandishi haya. Muhtasari wa njia hii hutolewa katika chati ya mtiririko ifuatayo:
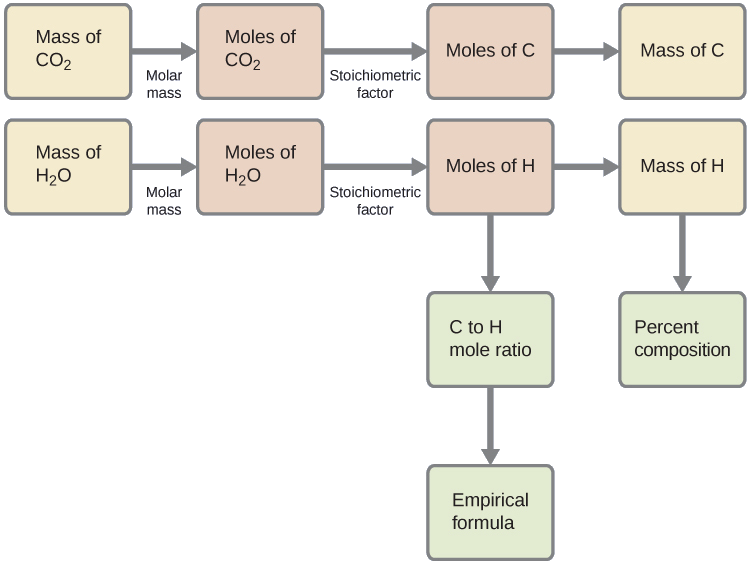
\[\mathrm{mol\: C=0.00394\:g\: CO_2\times\dfrac{1\:mol\: CO_2}{44.01\: g/mol}\times\dfrac{1\:mol\: C}{1\:mol\: CO_2}=8.95\times10^{-5}\:mol\: C} \nonumber \]
\[\mathrm{mol\: H=0.00161\:g\: H_2O\times\dfrac{1\:mol\: H_2O}{18.02\:g/mol}\times\dfrac{2\:mol\: H}{1\:mol\: H_2O}=1.79\times10^{-4}\:mol\: H} \nonumber \]
Fomu ya upimaji kwa kiwanja ni kisha inayotokana na kutambua ndogo nzima-nambari nyingi kwa kiasi hiki cha molar. Uwiano wa H hadi C molar ni
\[\mathrm{\dfrac{mol\: H}{mol\: C}=\dfrac{1.79\times10^{-4}\:mol\: H}{8.95\times10^{-5}\:mol\: C}=\dfrac{2\:mol\: H}{1\:mol\: C}} \nonumber \]
na formula ya maandishi ya polyethilini ni CH 2.
Sampuli 0.00215-g ya polystyrene, polymer linajumuisha kaboni na hidrojeni, zinazozalishwa 0.00726 g ya CO 2 na 0.00148 g ya H 2 O katika uchambuzi wa mwako. Nini formula ya empirical ya polystyrene?
- Jibu
-
CH
Muhtasari
Stoichiometry ya athari za kemikali inaweza kutumika kama msingi wa mbinu za uchambuzi wa kemikali za kiasi. Titrations kuhusisha kupima kiasi cha ufumbuzi titrant required kabisa kuguswa na ufumbuzi sampuli. Kiasi hiki kinatumiwa kuhesabu mkusanyiko wa analyte katika sampuli kwa kutumia stoichiometry ya mmenyuko wa titration. Uchunguzi wa gravimetric unahusisha kutenganisha analyte kutoka sampuli kwa mchakato wa kimwili au kemikali, kuamua wingi wake, na kisha kuhesabu mkusanyiko wake katika sampuli kulingana na stoichiometry ya mchakato husika. Uchunguzi wa mwako ni njia ya gravimetric inayotumiwa kuamua muundo wa msingi wa kiwanja kwa kukusanya na kupima bidhaa za gesi za mwako wake.
faharasa
- analyte
- aina ya kemikali ya riba
- buret
- kifaa kutumika kwa ajili ya utoaji sahihi wa kiasi variable kioevu, kama vile katika uchambuzi titration
- uchambuzi wa mwako
- mbinu ya gravimetric kutumika kuamua muundo wa msingi wa kiwanja kupitia ukusanyaji na uzito wa bidhaa zake za mwako wa gesi
- hatua ya mwisho
- kipimo kiasi cha titrant ufumbuzi kwamba mavuno mabadiliko katika sampuli ufumbuzi muonekano au mali nyingine inatarajiwa kwa ajili ya ulinganifu stoichiometric (tazama ulinganifu uhakika)
- uhakika wa ulinganifu
- kiasi cha ufumbuzi wa titrant inahitajika kuitikia kabisa na analyte katika uchambuzi wa titration; hutoa kiasi cha stoichiometric cha titrant kwa analyte ya sampuli kulingana na mmenyuko wa titration
- uchambuzi wa gravimetric
- upimaji kemikali uchambuzi mbinu kuwashirikisha mgawanyo wa analyte kutoka sampuli na mchakato wa kimwili au kemikali na baadae vipimo molekuli ya analyte, mmenyuko bidhaa, na/au sampuli
- kiashiria
- Dutu aliongeza kwa sampuli katika uchambuzi wa titration kuruhusu kugundua Visual ya hatua ya mwisho
- uchambuzi wa kiasi
- uamuzi wa kiasi au mkusanyiko wa dutu katika sampuli
- titrant
- suluhisho iliyo na mkusanyiko unaojulikana wa dutu ambayo itaitikia na analyte katika uchambuzi wa titration
- uchambuzi wa titration
- njia ya uchambuzi wa kemikali ya kiasi ambayo inahusisha kupima kiasi cha suluhisho la reactant linalotakiwa kuitikia kabisa na analyte katika sampuli


