2.4: Uwezo wa joto na Uwezo wa Nishati
- Page ID
- 176491
Mwishoni mwa sehemu hii, utaweza:
- Tatua matatizo yanayohusiana na uhamisho wa joto na kutoka kwa gesi bora za monatomiki ambazo kiasi chake kinafanyika mara kwa mara
- Tatua matatizo sawa kwa gesi zisizo za monatomic bora kulingana na idadi ya digrii za uhuru wa molekuli
- Tathmini uwezo wa joto wa metali kwa kutumia mfano kulingana na digrii za uhuru
Katika sura ya joto na joto, tulifafanua uwezo maalum wa joto na equation\(Q = mc\Delta T\), au\(c = (1/m)Q/\Delta T\). Hata hivyo, mali ya gesi bora hutegemea moja kwa moja na idadi ya moles katika sampuli, kwa hiyo hapa tunafafanua uwezo maalum wa joto kulingana na idadi ya moles, sio wingi. Zaidi ya hayo, wakati wa kuzungumza juu ya yabisi na vinywaji, tulipuuza mabadiliko yoyote katika kiasi na shinikizo na mabadiliko ya joto-makadirio mazuri kwa yabisi na vinywaji, lakini kwa gesi, tunapaswa kufanya baadhi ya hali juu ya mabadiliko ya kiasi au shinikizo. Hapa, tunazingatia uwezo wa joto na kiasi kilichofanyika mara kwa mara. Tunaweza kuhesabu kwa gesi bora.
Uwezo wa joto wa Gesi bora ya Monatomic kwa Volume ya Mara kwa mara
Tunafafanua uwezo wa joto la molar kwa kiasi cha mara kwa mara \(C_V\)kama
\[\underbrace{C_V = \dfrac{1}{n} \dfrac{Q}{\Delta T}}_{\text{with constant V}}\nonumber \]
Hii ni mara nyingi walionyesha katika fomu
\[Q = nC_V\Delta T\nonumber \]
Ikiwa kiasi hakibadilika, hakuna uhamisho wa jumla, kwa hiyo hakuna kazi iliyofanywa, na mabadiliko tu katika nishati ya ndani ni kutokana na mtiririko wa joto\(\Delta E_{int} = Q\). (Taarifa hii inajadiliwa zaidi katika sura inayofuata.) Tunatumia equation\(E_{int} = 3nRT/2\) kuandika\(\Delta E_{int} = 3nR\Delta T/2\) na mbadala\(\Delta E\) ya Q kupata\(Q = 3nR\Delta T/2\), ambayo inatoa matokeo yafuatayo rahisi kwa gesi bora ya monatomic:
\[C_V = \dfrac{3}{2}R.\nonumber \]
Ni huru ya joto, ambayo inathibitisha matumizi yetu ya tofauti za mwisho badala ya derivative. Fomula hii inakubaliana vizuri na matokeo ya majaribio.
Katika sura inayofuata tunazungumzia joto maalum la molar kwa shinikizo la mara kwa mara\(C_p\), ambalo daima ni kubwa kuliko\(C_V\).
Sampuli ya kilo 0.125 ya xenon iko katika silinda ya chuma kali, kubwa ya kutosha kwamba xenon inaweza kuonyeshwa kama gesi bora, kwa joto la\(20.0^oC\). Silinda huhamishwa nje siku ya joto ya majira ya joto. Kama xenon inakuja katika usawa kwa kufikia joto la mazingira yake, 180 J ya joto hufanyika kwa njia ya kuta za silinda. Joto la usawa ni nini? Puuza upanuzi wa silinda ya chuma.
Suluhisho
- Tambua ujuzi: Tunajua joto la awali\(T_1\) ni\(20.0^oC\), joto Q ni 180 J, na molekuli m ya xenon ni 0.125 kg.
- Tambua haijulikani. Tunahitaji joto la mwisho, hivyo tutahitaji\(\Delta T\).
- Tambua ni equations gani zinazohitajika. Kwa sababu gesi ya xenon ni monatomic, tunaweza kutumia\(Q = 3nR\Delta T/2\). Kisha tunahitaji idadi ya moles\(n = m/M\).
- Badilisha maadili inayojulikana katika equations na kutatua kwa haijulikani.
Masi ya molar ya xenon ni 131.3 g, hivyo tunapata
\[n = \dfrac{125 \, g}{131.3 \, g/mol} = 0.952 \, mol, \nonumber\nonumber \]
\[\Delta T = \dfrac{2Q}{3nR} = \dfrac{2(180 \, J)}{3(0.952 \, mol)(8.31 \, J/mol \cdot \, ^oC)} = 15.2^oC. \nonumber\nonumber \]
Kwa hiyo, joto la mwisho ni\(35.2^oC \). Tatizo linaweza kutatuliwa sawa katika kelvin; kama kelvin ni ukubwa sawa na kiwango cha Celsius cha mabadiliko ya joto, ungepata\(\Delta T = 15.2 \, K \).
Umuhimu
Kupokanzwa kwa gesi bora au karibu kabisa kwa kiasi cha mara kwa mara ni muhimu katika inji za gari na mifumo mingine mingi ya vitendo.
Tuseme moles 2 ya gesi ya heliamu saa 200 K huchanganywa na moles 2 ya gesi ya kryptoni saa 400 K katika calorimeter. Joto la mwisho ni nini?
- Jibu
-
Kama idadi ya moles ni sawa na tunajua uwezo wa joto la molar wa gesi mbili ni sawa, joto ni nusu kati ya joto la awali, 300 K.
Tungependa kuzalisha matokeo yetu kwa gesi bora na atomi zaidi ya moja kwa molekuli. Katika mifumo hiyo, molekuli inaweza kuwa na aina nyingine za nishati kando ya nishati ya kutafsiri kinetic, kama vile nishati ya mzunguko kinetic na vibrational kinetic na uwezo nguvu. Tutaona kwamba utawala rahisi unatuwezesha kuamua nguvu za wastani zilizopo katika fomu hizi na kutatua matatizo kwa njia sawa sawa na tulivyo na gesi za monatomic.
Degrees ya Uhuru
Katika sehemu iliyopita, tumegundua hiyo\(\frac{1}{2}mv^2 = \frac{3}{2}k_BT\) na\(v^2 = 3v_x^2\), ambayo inafuata hiyo\(\frac{1}{2}mv_x^2 = \frac{1}{2}k_BT\). equation hiyo inashikilia kwa\(\frac{3}{2}k_BT\) kama jumla ya michango ya\(\frac{1}{2}k_BT\) kutoka kila moja ya vipimo vitatu vya mwendo translational. Kuhamia gesi kwa ujumla, tunaona kwamba 3 katika formula\(C_V = \frac{3}{2}R\) pia inaonyesha vipimo hivi vitatu. Tunafafanua kiwango cha uhuru kama mwendo wa kujitegemea unaowezekana wa molekuli, kama vile kila moja ya vipimo vitatu vya tafsiri. Kisha, kuruhusu d kuwakilisha idadi ya digrii za uhuru, uwezo wa joto la molar kwa kiasi cha mara kwa mara cha gesi bora ya monatomic ni\(C_V = \frac{d}{2}R\) wapi\(d = 3\).
Tawi la fizikia inayoitwa mechanics ya takwimu inatuambia, na majaribio inathibitisha, ile\(C_V\) ya gesi yoyote bora hutolewa na equation hii, bila kujali idadi ya digrii za uhuru. Ukweli huu unafuata kutokana na matokeo ya jumla zaidi, theorem ya equipartition, ambayo inashikilia thermodynamics ya kawaida (isiyo ya quantum) kwa mifumo ya usawa wa mafuta chini ya hali ya kiufundi ambayo ni zaidi ya upeo wetu. Hapa, tunasema tu kwamba katika mfumo, nishati inashirikiwa kati ya digrii za uhuru kwa migongano.
Nishati ya mfumo wa thermodynamic katika usawa imegawanyika sawa kati ya digrii zake za uhuru. Kwa hiyo, uwezo wa joto la molar wa gesi bora ni sawa na idadi yake ya digrii za uhuru, d:\[C_V = \dfrac{d}{2}R.\nonumber \]
Matokeo haya yanatokana na mwanafizikia wa Scotland James Clerk Maxwell (1831-1871), ambaye jina lake litaonekana mara kadhaa zaidi katika kitabu hiki.
Kwa mfano, fikiria gesi bora ya diatomic (mfano mzuri wa nitrojeni,\(N_2\), na oksijeni,\(O_2\)). Gesi hiyo ina digrii zaidi ya uhuru kuliko gesi ya monatomiki. Mbali na digrii tatu za uhuru wa kutafsiri, ina digrii mbili za uhuru wa mzunguko perpendicular kwa mhimili wake. Zaidi ya hayo, molekuli inaweza vibrate pamoja mhimili wake. Mwendo huu mara nyingi inatokana na kufikiria spring kuunganisha atomi mbili, na tunajua kutokana na mwendo rahisi harmonic kwamba mwendo kama ina wote kinetic na uwezo wa nishati. Kila moja ya aina hizi za nishati inalingana na kiwango cha uhuru, kutoa mbili zaidi.
Tunaweza kutarajia kwamba kwa gesi diatomiki, tunapaswa kutumia 7 kama idadi ya digrii za uhuru; kwa kawaida, kama molekuli ya gesi ilikuwa na nishati tu ya kutafsiri kinetic, migongano kati ya molekuli hivi karibuni itawafanya kuzunguka na kuzunguka. Hata hivyo, kama ilivyoelezwa katika moduli ya awali, quantum mechanics udhibiti ambayo digrii ya uhuru ni kazi. Matokeo huonyeshwa kwenye Kielelezo\(\PageIndex{1}\). Nguvu zote za mzunguko na vibrational ni mdogo kwa maadili ya kipekee. Kwa joto chini ya 60 K, nguvu za molekuli hidrojeni ni ndogo sana kwa mgongano kuleta hali ya mzunguko au hali ya vibrational ya molekuli kutoka nishati ya chini kabisa kwa pili chini, hivyo aina pekee ya nishati ni translational kinetic nishati, na\(d = 3\) au\(C_V = 3R/2\) kama katika gesi ya monatomiki. Zaidi ya joto hilo, digrii mbili za mzunguko wa uhuru huanza kuchangia, yaani, baadhi ya molekuli hufurahia hali ya mzunguko na nishati ya pili ya chini kabisa. (Joto hili ni la chini sana kuliko ile ambapo mzunguko wa gesi za monatomiki huchangia, kwa sababu molekuli za diatomiki zina hali ya juu sana ya mzunguko na hivyo nguvu za chini za mzunguko.) Kutoka juu ya joto la kawaida (kidogo chini ya 300 K) hadi 600 K, digrii za mzunguko wa uhuru zinatumika kikamilifu, lakini vibrational sio, na\(d = 5\). Kisha, hatimaye, juu ya 3000 K, digrii za uhuru wa vibrational zinafanya kazi kikamilifu, na\(d = 7\) kama nadharia ya classical ilivyotabiriwa.
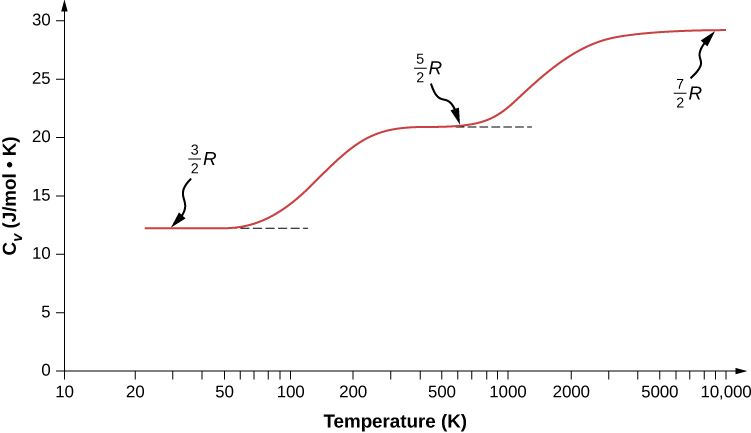
Molekuli za polyatomiki huwa na kiwango cha ziada cha mzunguko wa uhuru kwenye joto la kawaida, kwa kuwa zina wakati unaofanana wa hali karibu na mhimili wowote. Hivyo, kwa joto la kawaida, wana\(d = 6\) na kwa joto la juu,\(d = 8\). Kwa kawaida tunadhani kwamba gesi zina maadili ya chumba cha joto cha d.
Kama inavyoonekana katika Jedwali\(\PageIndex{1}\), matokeo yanakubaliana vizuri na majaribio ya gesi nyingi za monatomiki na diatomiki, lakini makubaliano ya gesi ya triatomiki ni ya haki tu. Tofauti zinatokea kutokana na mwingiliano ambao tumepuuza kati na ndani ya molekuli.
| Gesi | \(C_V/R\)saa\(25^oC\) na 1 atm |
|---|---|
| Ar | \ (C_V/R\) saa\(25^oC\) na 1 atm">1.50 |
| Yeye | \ (C_V/R\) saa\(25^oC\) na 1 atm">1.50 |
| Ne | \ (C_V/R\) saa\(25^oC\) na 1 atm">1.50 |
| USHIRIKIANO | \ (C_V/R\) saa\(25^oC\) na 1 atm">2.50 |
| \(H_2\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">2.47 |
| \(N_2\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">2.50 |
| \(O_2\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">2.53 |
| \(F_2\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">2.8 |
| \(CO_2\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">3.48 |
| \(H_2S\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">3.13 |
| \(N_2O\) | \ (C_V/R\) saa\(25^oC\) na 1 atm">3.66 |
Nini kuhusu nishati ya ndani kwa gesi diatomic na polyatomic? Kwa gesi hizo,\(C_V\) ni kazi ya joto (Kielelezo\(\PageIndex{1}\)), kwa hiyo hatuna aina ya matokeo rahisi tunayo kwa gesi bora za monatomic.
Uwezo wa joto la Molar wa Mambo Imara
Wazo la equipartition inaongoza kwa makadirio ya uwezo wa joto la molar wa mambo imara katika joto la kawaida. Tunaweza mfano wa atomi za imara kama masharti ya atomi jirani na chemchemi (Kielelezo\(\PageIndex{2}\)).
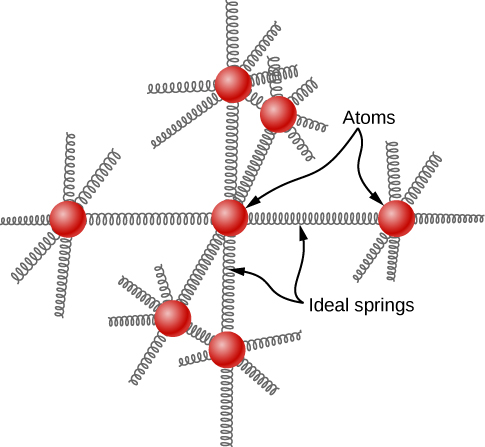
Sawa na majadiliano ya vibration katika moduli ya awali, kila atomi ina digrii sita za uhuru: kinetic moja na uwezo mmoja kwa kila moja ya x -, y -, na z -maelekezo. Kwa hiyo, joto maalum la chuma linapaswa kuwa 3 R. Matokeo haya, inayojulikana kama Sheria ya Dulong na Petit, inafanya kazi vizuri kwa majaribio kwa joto la kawaida. (Kwa kila kipengele, inashindwa kwa joto la chini kwa sababu za quantum-mitambo. Kwa kuwa athari za quantum ni muhimu hasa kwa chembe za chini, Sheria ya Dulong na Petit tayari inashindwa kwa joto la kawaida kwa vipengele vingine vya mwanga, kama vile beryllium na kaboni. Pia inashindwa kwa baadhi ya vipengele nzito kwa sababu mbalimbali zaidi ya kile tunaweza kufunika.)
Mkakati wa kutatua matatizo haya ni sawa na moja katika Mabadiliko ya Awamu kwa madhara ya uhamisho wa joto. Kipengele kipya tu ni kwamba unapaswa kuamua kama kesi tu iliyotolewa-gesi bora kwa kiasi mara kwa mara-inatumika kwa tatizo. (Kwa mambo imara, kuangalia juu ya uwezo maalum wa joto kwa ujumla ni bora kuliko kukadiria kutoka Sheria ya Dulong na Petit.) Katika kesi ya gesi bora, onyesha idadi d ya digrii za uhuru kutoka kwa idadi ya atomi katika molekuli ya gesi na uitumie kuhesabu\(C_V\) (au kutumia\(C_V\) kutatua kwa d).
Kipande 300g cha gallium imara (chuma kilichotumiwa katika vifaa vya semiconductor) katika kiwango chake cha kiwango cha pekee\(30.0^oC\) kinawasiliana na moles 12.0 za hewa (kudhani diatomic)\(95.0^oC\) kwenye chombo cha maboksi. Wakati hewa inafikia usawa na galliamu, 202 g ya galliamu imeyeyuka. Kulingana na data hizo, ni joto gani la fusion ya gallium? Fikiria kiasi cha hewa haibadilika na hakuna uhamisho mwingine wa joto.
Mkakati
Tutaweza kutumia equation\(Q_{hot} + Q_{cold} = 0\). Kama baadhi ya galliamu haina kuyeyuka, tunajua joto la mwisho bado ni kiwango cha kuyeyuka. Kisha tu\(Q_{hot}\) ni joto kupotea kama hewa cools,\(Q_{hot} = n_{air}C_V\Delta T\), wapi\(C_V = 5R/2\). Ya pekee\(Q_{cold}\) ni joto la latent la fusion ya gallium,\(Q_{cold} = m_{Ga}L_f\). Ni chanya kwa sababu joto inapita ndani ya gallium.
Suluhisho
- Weka equation:\[n_{air}C_V\Delta T + m_{Ga}L_f = 0.\nonumber \]
- Badilisha maadili inayojulikana na kutatua:\[(12.0 \, mol) \left(\dfrac{5}{2}\right) \left(8.31 \dfrac{J}{mol \cdot \, ^oC}\right)(30.0^oC - 95.0^oC) + (0.202 \, kg)L_f = 0.\nonumber \]
Tunatatua kupata kwamba joto la fusion ya gallium ni 80.2 kJ/kg.


