2.2: Mfano wa Masi ya Gesi Bora
- Page ID
- 176511
Mwishoni mwa sehemu hii, utaweza:
- Tumia sheria bora ya gesi kwa hali zinazohusisha shinikizo, kiasi, joto, na idadi ya molekuli ya gesi
- Tumia kitengo cha moles kuhusiana na idadi ya molekuli, na raia wa Masi na macroscopic
- Eleza sheria bora ya gesi katika suala la moles badala ya idadi ya molekuli
- Tumia sheria ya gesi ya van der Waals kwa hali ambapo sheria bora ya gesi haitoshi
Katika sehemu hii, tunachunguza tabia ya mafuta ya gesi. Neno letu “gesi” linatokana na neno la Flemish linalomaanisha “machafuko,” lilitumiwa kwanza kwa mvuke na mwanakemia wa karne ya kumi na saba J. B. van Helmont. Neno hilo lilikuwa sahihi zaidi kuliko alivyojua, kwa sababu gesi zinajumuisha molekuli zinazohamia na kugongana kwa kila mmoja kwa random. Randomness hii inafanya uhusiano kati ya vikoa microscopic na macroscopic rahisi kwa gesi kuliko kwa vinywaji au yabisi.
Je! Gesi hutofautiana na solids na vinywaji? Katika hali ya kawaida, kama zile za hewa inayozunguka nasi, tofauti ni kwamba molekuli za gesi ziko mbali sana kuliko zile za yabisi na viowevu. Kwa sababu umbali wa kawaida kati ya molekuli ni kubwa ikilinganishwa na ukubwa wa molekuli\(\PageIndex{1}\), kama ilivyoonyeshwa kwenye Kielelezo, majeshi kati yao yanachukuliwa kuwa duni, isipokuwa wakati wanawasiliana wakati wa migongano. Pia, katika joto la juu ya joto la moto, mwendo wa molekuli ni wa haraka, na gesi hupanua haraka ili kuchukua kiasi chochote kilichopatikana. Kinyume chake, katika majimaji na yabisi, molekuli ni karibu pamoja, na tabia ya molekuli katika majimaji na yabisi inakabiliwa sana na mwingiliano wa molekuli na kila mmoja. Mali ya macroscopic ya vitu vile hutegemea sana nguvu kati ya molekuli, na kwa kuwa molekuli nyingi zinaingiliana, kusababisha “matatizo mengi ya mwili” yanaweza kuwa ngumu sana (tazama sehemu ya Fizikia ya Matukio ya Fizikia).
Sheria ya gesi
Katika sura iliyotangulia, tuliona matokeo moja ya nafasi kubwa ya intermolecular katika gesi: Gesi zinaweza kusisitizwa kwa urahisi. Jedwali 1.4.1 linaonyesha kwamba gesi zina coefficients kubwa za upanuzi wa kiasi kuliko aidha yabisi au vinywaji. Coefficients hizi kubwa zinamaanisha kwamba gesi hupanua na mkataba haraka sana na mabadiliko ya joto. Pia tuliona (katika sehemu ya upanuzi wa joto) kwamba gesi nyingi hupanua kwa kiwango sawa au kuwa na mgawo sawa wa upanuzi wa kiasi,\(\beta\). Hii inaleta swali: Kwa nini gesi zote hufanya kwa karibu njia sawa, wakati vinywaji mbalimbali na yabisi vina viwango vya upanuzi tofauti sana?
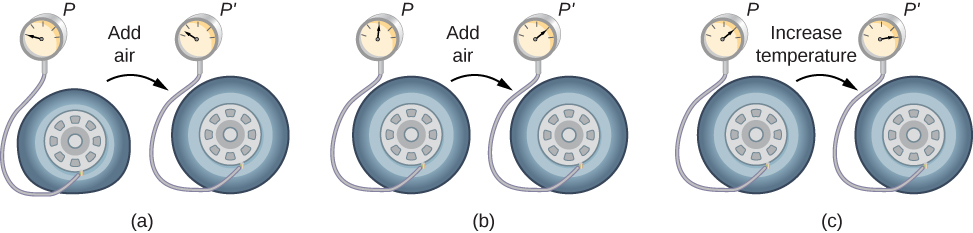
Ili kujifunza jinsi shinikizo, joto, na kiasi cha gesi vinahusiana na kila mmoja, fikiria kinachotokea unapopiga hewa ndani ya tairi ya gari iliyopunguzwa. Kiwango cha tairi huongezeka kwanza kwa uwiano wa moja kwa moja na kiasi cha hewa kinachojitokeza, bila ongezeko kubwa la shinikizo la tairi. Mara baada ya tairi kupanua hadi karibu ukubwa wake kamili, kuta za tairi hupunguza upanuzi wake wa kiasi. Ikiwa tunaendelea kupiga hewa ndani ya tairi, shinikizo huongezeka. Wakati gari inaendeshwa na matairi yanapungua, joto lao huongezeka, na hivyo shinikizo huongezeka hata zaidi (Kielelezo\(\PageIndex{2}\)).
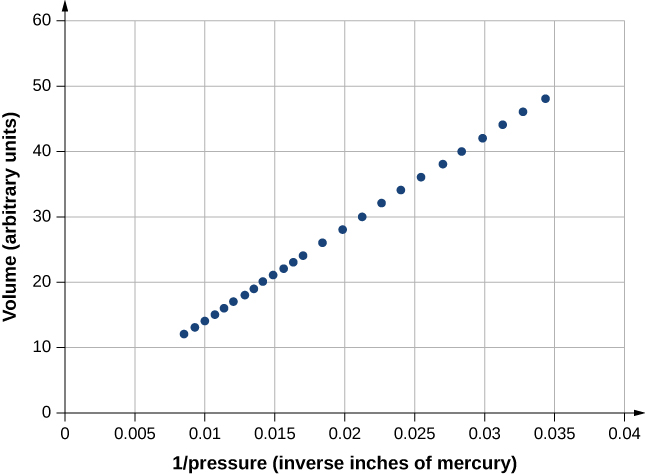
Kielelezo\(\PageIndex{3}\) kinaonyesha data kutoka kwa majaribio ya Robert Boyle (1627—1691), kuonyesha nini sasa inaitwa sheria ya Boyle: Katika joto la mara kwa mara na idadi ya molekuli, shinikizo kamili ya gesi na kiasi chake ni inversely sawia. (Kumbuka kutoka sehemu ya Fluid Mechanics kwamba shinikizo kamili ni shinikizo kweli na shinikizo kupima ni shinikizo kabisa bala shinikizo iliyoko, kawaida shinikizo anga.) Grafu katika Kielelezo\(\PageIndex{3}\) inaonyesha uhusiano huu kama uwiano wa inverse wa kiasi na shinikizo.
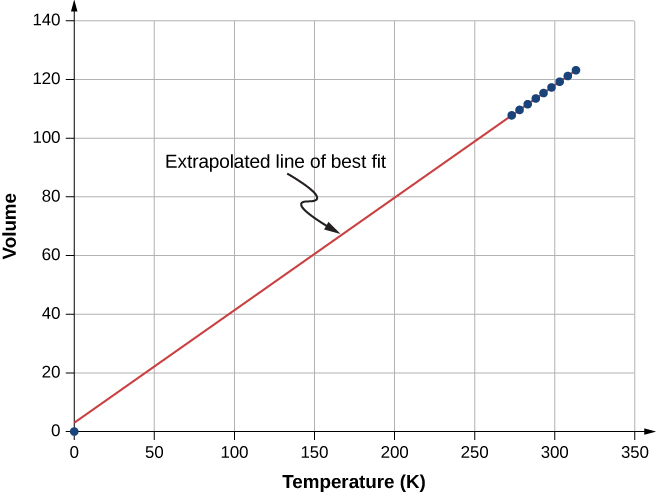
Kielelezo\(\PageIndex{4}\) kinaonyesha data ya majaribio kuonyesha kile kinachoitwa sheria ya Charles, baada ya Jacques Charles (1746—1823). Sheria ya Charles inasema kuwa kwa shinikizo la mara kwa mara na idadi ya molekuli, kiasi cha gesi ni sawia na joto lake kabisa.
Sawa ni sheria ya Amonton au Gay-Lussac, ambayo inasema kuwa kwa kiasi cha mara kwa mara na idadi ya molekuli, shinikizo ni sawia na halijoto. Sheria hiyo ni msingi wa thermometer ya gesi ya mara kwa mara, iliyojadiliwa katika sura iliyopita. (Historia ya sheria hizi na mikopo sahihi kwa ajili yao ni ngumu zaidi kuliko inaweza kujadiliwa hapa.)
Inajulikana kwa majaribio kwamba kwa gesi katika wiani mdogo (kama vile molekuli zao zinachukua sehemu ndogo ya kiasi cha jumla) na katika joto la juu ya kiwango cha kuchemsha, uwiano huu unashikilia makadirio mazuri. Haishangazi, na kiasi kingine uliofanyika mara kwa mara, ama shinikizo au kiasi ni sawia na idadi ya molekuli. Zaidi ya kushangaza, wakati uwiano umeunganishwa katika equation moja, mara kwa mara ya uwiano ni huru na muundo wa gesi. Equation inayosababisha kwa gesi zote inatumika katika kikomo cha wiani mdogo na joto la juu; ni sawa kwa oksijeni kama kwa heliamu au uranium hexafluoride. Gesi katika kikomo hicho inaitwa gesi bora; inatii sheria bora ya gesi, ambayo pia huitwa equation ya hali ya gesi bora.
Sheria bora ya gesi inasema kwamba\[pV = Nk_BT,\] ambapo p ni shinikizo kamili la gesi, V ni kiasi kinachochukua, N ni idadi ya molekuli katika gesi, na T ni joto lake kabisa.
Mara kwa mara\(k_B\) huitwa mara kwa mara ya Boltzmann kwa heshima ya mwanafizikia wa Austria Ludwig Boltzmann (1844—1906) na ana thamani
\[k_B = 1.38 \times 10^{-23} \, J/K.\]
Sheria bora ya gesi inaelezea tabia ya gesi yoyote halisi wakati wiani wake ni mdogo wa kutosha au joto lake juu ya kutosha kuwa iko mbali na liquefaction. Hii inajumuisha hali nyingi za vitendo. Katika sehemu inayofuata, tutaona kwa nini ni huru ya aina ya gesi.
Katika hali nyingi, sheria bora ya gesi inatumika kwa sampuli ya gesi yenye idadi ya mara kwa mara ya molekuli; kwa mfano, gesi inaweza kuwa katika chombo kilichofunikwa. Ikiwa N ni mara kwa mara, basi kutatua kwa N inaonyesha kwamba PV/T ni mara kwa mara. Tunaweza kuandika ukweli huo kwa fomu rahisi:
\[\dfrac{p_1V_1}{T_1} = \dfrac{p_2V_2}{T_2},\]
ambapo subscripts 1 na 2 rejea majimbo yoyote mawili ya gesi kwa nyakati tofauti. Tena, joto lazima lielezwe katika kelvin na shinikizo lazima liwe shinikizo kabisa, ambayo ni jumla ya shinikizo la kupima na shinikizo la anga.
Tuseme baiskeli yako tairi kikamilifu umechangiwa, na shinikizo kamili ya\(7.00 \times 10^5 \, Pa\) (shinikizo kupima ya tu chini\(90.0 \, lb/in^2\).) katika joto la\(18.0^oC\). Je! Shinikizo ni nini baada ya joto lake limeongezeka kwa\(35.0^oC\) siku ya moto? Fikiria hakuna uvujaji wa thamani au mabadiliko kwa kiasi.
Mkakati
Shinikizo katika tairi linabadilika tu kwa sababu ya mabadiliko ya joto. Tunajua shinikizo la awali\(p_0 = 7.00 \times 10^5 \, Pa\), joto la awali\(T_0 = 18.0^oC\), na joto la mwisho\(T_f = 35.0^oC\). Lazima tupate shinikizo la mwisho\(p_f\). Kwa kuwa idadi ya molekuli ni mara kwa mara, tunaweza kutumia equation
\[\dfrac{p_fV_f}{T_f} = \dfrac{p_0V_0}{T_0}.\]
Kwa kuwa kiasi ni mara kwa mara,\(V_f\) na\(V_0\) ni sawa na hugawanyika. Kwa hiyo,
\[\dfrac{p_f}{T_f} = \dfrac{p_0}{T_0}.\]
Tunaweza kisha upya hii kutatua kwa\(p_f\):
\[p_f = p_0 \dfrac{T_f}{T_0},\]
ambapo joto lazima liwe katika kelvin.
Suluhisho
- Badilisha joto kutoka digrii Celsius hadi kelvin\[T_0 = (18.0 + 273)K = 291 \, K,\]\[T_f = (35.0 + 273)K = 308 \, K.\]
- Badilisha maadili inayojulikana katika equation,\[p_f = p_0\dfrac{T_f}{T_0} = 7.00 \times 10^5 \, Pa \left(\dfrac{308 \, K}{291 \, K}\right) = 7.41 \times 10^5 \, Pa.\]
Umuhimu
Joto la mwisho ni karibu zaidi\(6\%\) kuliko joto la awali, hivyo shinikizo la mwisho ni karibu\(6\%\) zaidi pia. Kumbuka kuwa shinikizo kamili (angalia Fluid Mechanics) na joto kabisa (tazama Joto na Joto) lazima kutumika katika sheria bora ya gesi.
Ni molekuli ngapi zilizo katika kitu cha kawaida, kama vile gesi kwenye tairi au maji kwenye kioo? Hesabu hii inaweza kutupa wazo la jinsi kubwa N kawaida ni. Hebu tuhesabu idadi ya molekuli katika hewa ambayo kawaida ya afya ya vijana wazima inhales katika pumzi moja, na kiasi cha 500 ml, kwa joto la kawaida na shinikizo (STP), ambayo hufafanuliwa kama\(0^oC\) na shinikizo la anga. (Vijana wetu wazima ni inaonekana nje katika majira ya baridi.)
Mkakati
Kwa sababu shinikizo, kiasi, na joto ni wote maalum, tunaweza kutumia sheria bora ya gesi,\ (pV = k_bt\}, ili kupata N.
Suluhisho
- Tambua maarifa. \[T = 0^oC = 273 \, K, \, p = 1.01 \times 10^5 \, Pa, \, V = 500 \, mL = 5 \times 10^{-4} \, m^3, \, k_B = 1.38 \times 10^{-23} \, J/K\]
- Badilisha maadili inayojulikana katika equation na kutatua kwa N. \[N = \dfrac{pV}{k_BT} = \dfrac{(1.01 \times 10^5 \, Pa)(5 \times 10^{-4} \, m^3)}{(1.38 \times 10^{-23} \, J/K)(273 \, K)} = 1.34 \times 10^{22} \, molecules\]
Umuhimu N ni kubwa, hata kwa kiasi kidogo. Kwa mfano,\(1 \, cm^3\) ya gesi katika STP ina\(2.68 \times 10^{19} \) molekuli. Mara nyingine tena, kumbuka kuwa matokeo yetu ya N ni sawa kwa aina zote za gesi, ikiwa ni pamoja na mchanganyiko.
Kama tulivyoona katika sura ya mitambo ya maji, pascals ni\(N/m^2\), hivyo\(Pa \cdot m^3 = N \cdot m = J\). Hivyo, matokeo yetu kwa N ni dimensionless, idadi safi ambayo inaweza kupatikana kwa kuhesabu (kwa kanuni) badala ya kupima. Kama ni idadi ya molekuli, tunaweka “molekuli” baada ya namba, tukikumbuka kuwa ni misaada kwa mawasiliano badala ya kitengo.
Idadi ya moles na Avogadro
Mara nyingi ni rahisi kupima kiasi cha dutu na kitengo kwa kiwango cha binadamu zaidi kuliko molekuli. Kitengo cha SI kwa kusudi hili kilianzishwa na mwanasayansi wa Italia Amedeo Avogadro (1776—1856). (Alifanya kazi kutoka kwa hypothesis kwamba kiasi sawa cha gesi katika shinikizo sawa na joto zina idadi sawa ya molekuli, bila kujitegemea aina ya gesi. Kama ilivyoelezwa hapo juu, hypothesis hii imethibitishwa wakati makadirio bora ya gesi inatumika.) Mole (kifupi mol) hufafanuliwa kama kiasi cha dutu yoyote ambayo ina molekuli nyingi kama kuna atomi katika hasa gramu 12 (0.012 kg) ya kaboni-12. (Kitaalam, tunapaswa kusema “vitengo vya formula,” si “molekuli,” lakini tofauti hii haina maana kwa madhumuni yetu.) Idadi ya molekuli katika mole moja inaitwa namba ya Avogadro (\(N_A\)) na thamani ya namba ya Avogadro sasa inajulikana kuwa\[N_A = 6.02 \times 10^{-23} \, mol^{-1}\]. Sasa tunaweza kuandika\(N = N_An\), ambapo n inawakilisha idadi ya moles ya dutu.
Nambari ya Avogadro inahusiana na masi ya kiasi cha dutu katika gramu na idadi ya protoni na nyutroni katika atomu au molekuli (12 kwa atomi kaboni-12), ambayo takribani huamua masi yake. Ni asili kufafanua kitengo cha masi kama kwamba masi ya atomu ni takriban sawa na idadi yake ya nyutroni na protoni. Kitengo cha aina hiyo kinachokubaliwa kwa matumizi na SI ni kitengo cha umati atomia kilichounganishwa (u), kinachoitwa pia dalton. Hasa, chembe kaboni-12 ina wingi wa hasa 12 u, ili molekuli yake molar M katika gramu kwa mole ni numerically sawa na wingi wa atomi moja kaboni-12 katika u Hiyo usawa ana kwa dutu yoyote Kwa maneno mengine,\(N_A\) si tu uongofu kutoka idadi ya molekuli kwa moles, lakini pia ni uongofu kutoka u kwa gramu:\(6.02 \times 10^{23} \, u = 1 \, g\). Angalia Kielelezo\(\PageIndex{5}\).
Kiwango cha kila siku kilichopendekezwa cha vitamini\(B_3\) au niasini\(C_6NH_5O_2\), kwa wanawake ambao hawana mjamzito au wauguzi, ni 14 mg. Pata idadi ya molekuli ya niasini kwa kiasi hicho.
- Jibu
-
Sisi kwanza tunahitaji kuhesabu molekuli ya molar (wingi wa mole moja) ya niacin. Ili kufanya hivyo, tunapaswa kuzidisha idadi ya atomi za kila elementi katika molekuli kwa molekuli ya molar ya elementi.
(6 mol ya kaboni) (12.0 g/mol) + (5 mol hidrojeni) (1.0 g/mol) + (1 mol ya nitrojeni) (14 g/mol) + (2 mol oksijeni) (16.0 g/mol) = 123 g/mol
Kisha tunahitaji kuhesabu idadi ya moles katika 14 mg.
\(\left(\dfrac{14 \, mg}{123 \, g/mol}\right)\left(\dfrac{1 \, g}{1000 \, mg}\right) = 1.14 \times 10^{-4} \, mol.\)
Kisha, tunatumia nambari ya Avogadro kuhesabu idadi ya molekuli:
\(N = nN_A = (1.14 \times 10^{-4} \, mol)(6.02 \times 10^{23} \, molecules/mol) = 6.85 \times 10^{19} molecules\)
Uzito wa hewa katika darasani\((p = 1.00 \, atm\) na\(T = 20^oC\)) ni\(1.28 \, kg/m^3\). Je! Shinikizo gani ni wiani\(0.600 \, kg/m^3\) ikiwa joto linahifadhiwa mara kwa mara?
- Jibu
-
Uzito wa gesi ni sawa na mara kwa mara, wastani wa molekuli ya molekuli, mara wiani wa idadi N/V. Kutokana na sheria bora ya gesi\(pV = Nk_BT\), tunaona kwamba\(N/V = p/k_BT\). Kwa hiyo, kwa joto la kawaida, ikiwa wiani na, kwa hiyo, wiani wa idadi hupunguzwa kwa nusu, shinikizo lazima pia lipunguzwe kwa nusu, na\(p_f = 0.500 \, atm\).
Sheria bora ya gesi imerejeshwa kwa kutumia moles
Maneno ya kawaida ya sheria bora ya gesi hutumia idadi ya moles katika sampuli, n, badala ya idadi ya molekuli, N. Tunaanza kutoka sheria bora ya gesi,
\[pV = Nk_BT,\]
na kuzidisha na kugawanya upande wa kulia wa equation na idadi ya Avogadro\(N_A\) ya.Hii inatupa\[pV = \dfrac{N}{N_A}N_A k_BT.\]
Kumbuka kwamba\(n = N/N_A\) ni idadi ya moles. Sisi kufafanua zima gesi mara kwa mara kama\(R = N_Ak_B\), na kupata bora gesi sheria katika suala la moles.
Kwa upande wa idadi ya moles n, sheria bora ya gesi imeandikwa kama\[pV = nRT.\]
Katika vitengo vya SI,
\[R = N_Ak_B = (6.02 \times 10^{23} \, mol^{-1}) (1.38 \times 10^{-23} J/K) = 8.31 \, J/mol \cdot K\]
Katika vitengo vingine,
\[R = 1.99 \dfrac{cal}{mol \cdot K} = 0.0821 \dfrac{L \cdot atm}{mol \cdot K}.\]
Unaweza kutumia thamani yoyote ya R ni rahisi zaidi kwa tatizo fulani.
Tumia wiani wa hewa kavu (a) chini ya hali ya kawaida na (b) katika puto ya hewa ya moto kwenye joto la\(120^oC\). Air kavu ni takriban\(78\% N_2, \, 21\% O_2,\) na\(1\% \, Ar\).
Mkakati na ufumbuzi
- Tunaulizwa kupata wiani, au molekuli kwa kila mita ya ujazo. Tunaweza kuanza kwa kutafuta molekuli ya molar. Ikiwa tuna molekuli mia, ambayo 78 ni nitrojeni, 21 ni oksijeni, na 1 ni argon, wastani wa molekuli ya Masi ni\(frac{78 \, m_{N_2} + 21 \, m_{O_2} + m_{Ar}}{100}\), au wingi wa kila sehemu huongezeka kwa asilimia yake. Hali hiyo inatumika kwa molekuli ya molar, ambayo kwa hiyo ni\[M = 0.78 \, M_{N_2} + 0,21 \, M_{O_2} + 0.01 \, M_{Ar} = 29.0 \, g/mol.\] Sasa tunaweza kupata idadi ya moles kwa mita za ujazo. Tunatumia sheria bora ya gesi kwa suala la moles\(pV = nRT\),\(p = 1.00 \, atm\), na\(T = 273 \, K\),\(V = 1 \, m^3\), na\(R = 8.31 \, J/mol \cdot K\). Chaguo rahisi zaidi kwa R katika kesi hii ni\(R = 8.31 \, J/mol \cdot K\) kwa sababu kiasi kinachojulikana ni katika vitengo SI:\[n = \dfrac{pV}{RT} = \dfrac{(1.01 \times 10^5 \, Pa)(1 \, m^3)}{(8.31 \, J/mol \cdot K)(273 \, K)} = 44.5 \, mol.\] Kisha, wingi\(m_s\) wa hewa hiyo ni\[m_s = nM = (44.5 \, mol)(29.0 \, g/mol) = 1290 \, g = 1.29 \, kg.\] Hatimaye wiani wa hewa katika STP ni\[\rho = \dfrac{m_s}{V} = \dfrac{1.29 \, kg}{1 \, m^3} = 1.29 \, kg/m^3.\]
- Shinikizo la hewa ndani ya puto bado ni atm 1 kwa sababu chini ya puto iko wazi kwa angahewa. Hesabu ni sawa isipokuwa kwamba sisi kutumia joto la\(120^oC\), ambayo ni 393 K. tunaweza kurudia hesabu katika (a), au tu kuchunguza kwamba wiani ni sawia na idadi ya moles, ambayo ni inversely sawia na joto. Kisha kutumia subscripts 1 kwa hewa katika STP na 2 kwa hewa ya moto, tuna\[\rho_2 = \dfrac{T_1}{T_2}\rho_1 = \dfrac{273 \, K}{393 \, K}(1.29 \, kg/m^3) = 0.896 \, kg/m^3.\]
Umuhimu
Kutumia mbinu za Kanuni ya Archimedes na Buoyancy, tunaweza kupata kwamba nguvu\(2200 \, m^3\) ya wavu juu ya hewa\(120^oC\) ni\(F_b - F_g = \rho_{atmosphere}V_g - \rho_{hot \, air}V_g = 8.49 \times 10^3 \, N\), au kutosha kuinua kuhusu kilo 867. Uzito wa wingi na wiani wa molar wa hewa katika STP, unaopatikana hapo juu, mara nyingi ni namba muhimu. Kutoka wiani wa molar, tunaweza kuamua kwa urahisi nambari nyingine muhimu, kiasi cha mole ya gesi yoyote bora katika STP, ambayo ni 22.4 L.
Liquids na yabisi huwa na densiti kwa utaratibu wa mara 1000 zaidi kuliko gesi. Eleza jinsi hii ina maana kwamba umbali kati ya molekuli katika gesi ni juu ya utaratibu wa mara 10 zaidi kuliko ukubwa wa molekuli zao.
- Jibu
-
Uzito wiani ni wingi kwa kiasi cha kitengo, na kiasi ni sawia na ukubwa wa mwili (kama vile radius ya nyanja) cubed. Kwa hiyo ikiwa umbali kati ya molekuli huongezeka kwa sababu ya 10, basi kiasi kinachukua huongezeka kwa sababu ya 1000, na wiani hupungua kwa sababu ya 1000. Kwa kuwa tunadhani molekuli zinawasiliana na vinywaji na vilivyo, umbali kati ya vituo vyao ni kwa utaratibu wa ukubwa wao wa kawaida, hivyo umbali wa gesi ni juu ya utaratibu wa mara 10 kubwa.
Sheria bora ya gesi inahusiana kwa karibu na nishati: vitengo vya pande zote mbili za equation ni joules. upande wa kulia wa bora gesi sheria equation ni\(Nk_BT\). Neno hili ni takribani jumla translational kinetic nishati (ambayo, wakati wa kujadili gesi, inahusu nishati ya tafsiri ya molekuli, si ya vibration ya atomi yake au mzunguko) ya N molekuli katika joto kamili T, kama tutaona rasmi katika sehemu inayofuata. Upande wa kushoto wa usawa bora wa sheria ya gesi ni pV. Kama ilivyoelezwa katika mfano juu ya idadi ya molekuli katika gesi bora, shinikizo lililoongezeka kwa kiasi lina vitengo vya nishati. Nishati ya gesi inaweza kubadilishwa wakati gesi inafanya kazi kama inavyoongezeka kwa kiasi, kitu ambacho tulichunguza katika sura iliyotangulia, na kiasi cha kazi kinahusiana na shinikizo. Huu ndio mchakato unaotokea katika inji za petroli au mvuke na turbines, kama tutakavyoona katika sura inayofuata.
- Hatua ya 1. Kuchunguza hali ya kuamua kwamba gesi bora ni kushiriki. Gesi nyingi ni karibu bora isipokuwa zipo karibu na kiwango cha kuchemsha au kwa shinikizo mbali zaidi ya shinikizo la anga.
- Hatua ya 2. Fanya orodha ya kiasi gani kinachopewa au kinaweza kuhitimishwa kutokana na tatizo kama ilivyoelezwa (kutambua kiasi kinachojulikana).
- Hatua ya 3. Tambua hasa kile kinachohitajika kuamua katika tatizo (kutambua kiasi haijulikani). Orodha iliyoandikwa ni muhimu.
- Hatua ya 4. Kuamua kama idadi ya molekuli au idadi ya moles inajulikana au kuombwa kuamua kama kutumia sheria bora ya gesi kama\( pV = Nk_BT\), ambapo N ni idadi ya molekuli, au\(pV = nRT\), ambapo n ni idadi ya moles.
- Hatua ya 5. Badilisha maadili inayojulikana katika vitengo sahihi vya SI (K kwa joto, Pa kwa shinikizo,\(m^3\) kwa kiasi, molekuli kwa N, na moles kwa n). Ikiwa vitengo vya maarifa vinalingana na moja ya maadili yasiyo ya SI ya R, unaweza kuwaacha katika vitengo hivyo. Hakikisha kutumia joto kamili na shinikizo kabisa.
- Hatua ya 6. Tatua sheria bora ya gesi kwa kiasi cha kuamua (kiasi haijulikani). Unaweza haja ya kuchukua uwiano wa majimbo ya mwisho kwa majimbo ya awali ili kuondoa kiasi haijulikani kwamba ni agizo fasta.
- Hatua ya 7. Badilisha kiasi kinachojulikana, pamoja na vitengo vyao, katika equation sahihi na kupata ufumbuzi wa namba kamili na vitengo.
- Hatua ya 8. Angalia jibu ili uone ikiwa ni busara: Je, ina maana?
Mlinganyo wa Nchi ya Van der Waals
Sisi kurudia alibainisha kuwa bora gesi sheria ni makadirio. Jinsi gani inaweza kuboreshwa juu ya? Ulinganisho wa hali ya van der Waals (ulioitwa baada ya mwanafizikia wa Uholanzi Johannes van der Waals, 1837-1923) huiboresha kwa kuzingatia mambo mawili. Kwanza, nguvu za kuvutia kati ya molekuli, ambazo zina nguvu katika wiani wa juu na kupunguza shinikizo, huzingatiwa kwa kuongeza shinikizo neno sawa na mraba wa wiani wa molar unaoongezeka kwa mgawo mzuri a. Pili, kiasi cha molekuli kinawakilishwa na mara kwa mara b, ambayo inaweza kufikiriwa kama kiasi cha mole ya molekuli. Hii imeondolewa kutoka kwa kiasi cha jumla ili kutoa kiasi kilichobaki ambacho molekuli zinaweza kuingia. Vipindi vya a na b vinatambuliwa majaribio kwa kila gesi. Equation kusababisha ni
\[ \left[p + a\left(\dfrac{n}{V}\right)^2\right] (V - nb) = nRT.\]
Katika kikomo cha wiani mdogo (ndogo n), maneno ya a na b ni duni, na tuna sheria bora ya gesi, kama tunapaswa kwa wiani mdogo. Kwa upande mwingine, ikiwa\(V - nb\) ni ndogo, maana yake ni kwamba molekuli ni karibu sana pamoja, shinikizo lazima liwe kubwa zaidi ili kutoa NRT sawa, kama tunavyotarajia katika hali ya gesi yenye ushindani. Hata hivyo, ongezeko la shinikizo ni chini ya hoja hiyo ingeweza kupendekeza, kwa sababu kwa wiani\((n/V)^2\) mrefu mrefu ni muhimu. Kwa kuwa ni chanya, husababisha shinikizo la chini kutoa NRT sawa.
Van der Waals equation ya hali kazi vizuri kwa ajili ya gesi nyingi chini ya aina mbalimbali ya hali. Kama tutaona katika moduli inayofuata, hata inabiri mabadiliko ya gesi-kioevu.
PV michoro
Tunaweza kuchunguza mambo ya tabia ya dutu kwa kupanga mchoro wa PV, ambayo ni grafu ya shinikizo dhidi ya kiasi. Wakati dutu hii inafanya kama gesi bora, sheria bora ya gesi\(pV = nRT\) inaelezea uhusiano kati ya shinikizo na kiasi chake. Katika mchoro wa PV, ni kawaida kupanga njama ya isotherm, ambayo ni safu inayoonyesha p kama kazi ya V na idadi ya molekuli na joto lililowekwa. Kisha, kwa gesi bora,\(pV = constant.\) Kwa mfano, kiasi cha gesi hupungua kama shinikizo linaongezeka. Grafu inayosababisha ni hyperbola.
Hata hivyo, kama sisi kudhani van der Waals equation ya hali, isotherms kuwa ya kuvutia zaidi, kama inavyoonekana katika Kielelezo\(\PageIndex{6}\). Kwa joto la juu, curves ni takriban hyperbolas, inayowakilisha tabia takriban bora katika joto mbalimbali za kudumu. Katika joto la chini, curves inaonekana chini na chini kama hyperbolas-yaani, gesi haifanyi kazi vizuri. Kuna \(T_c\)joto kali ambalo curve ina uhakika na mteremko wa sifuri. Chini ya joto hilo, curves hazipungua monotonically; badala yake, kila mmoja ana “hump,” maana kwamba kwa kiasi fulani cha kiasi, kuongeza kiasi huongeza shinikizo.
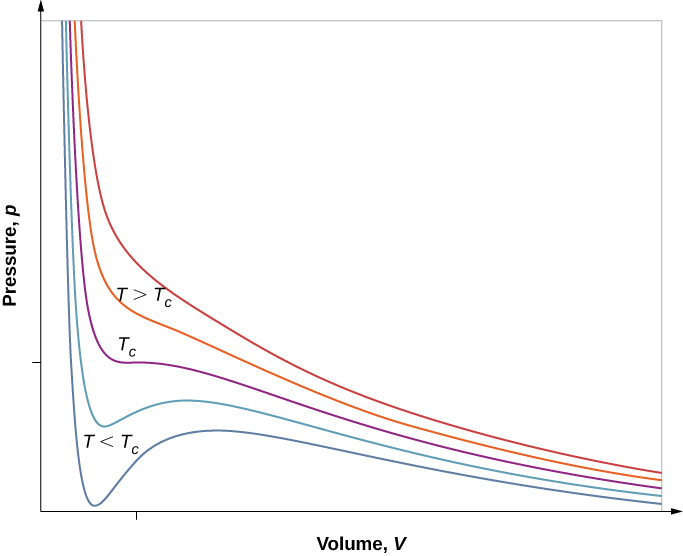
Tabia kama hiyo itakuwa kabisa unphysical. Badala yake, curves ni kueleweka kama kuelezea mabadiliko ya awamu ya kioevu-gesi. Sehemu ya kusonga ya curve inabadilishwa na mstari usio na usawa, kuonyesha kwamba kama kiasi kinachoongezeka kwa joto la kawaida, shinikizo linakaa mara kwa mara. Tabia hiyo inafanana na kuchemsha na condensation; wakati dutu iko kwenye joto lake la kuchemsha kwa shinikizo fulani, linaweza kuongezeka kwa kiasi kama baadhi ya kiowevu hugeuka kuwa gesi, au kupungua kadiri baadhi ya gesi inavyogeuka kuwa kiowevu, bila mabadiliko yoyote ya halijoto au shinikizo.
Kielelezo\(\PageIndex{7}\) inaonyesha isotherms sawa kwamba ni kweli zaidi kuliko wale kulingana na van der Waals equation. Sehemu za mwinuko wa curves upande wa kushoto wa mkoa wa mpito zinaonyesha awamu ya kiowevu, ambayo inakaribia incompressible-kupungua kidogo kwa kiasi kunahitaji ongezeko kubwa la shinikizo. Sehemu za gorofa zinaonyesha mpito wa kioevu-gesi; mikoa ya bluu ambayo hufafanua inawakilisha mchanganyiko wa shinikizo na kiasi ambapo kioevu na gesi vinaweza kushirikiana.
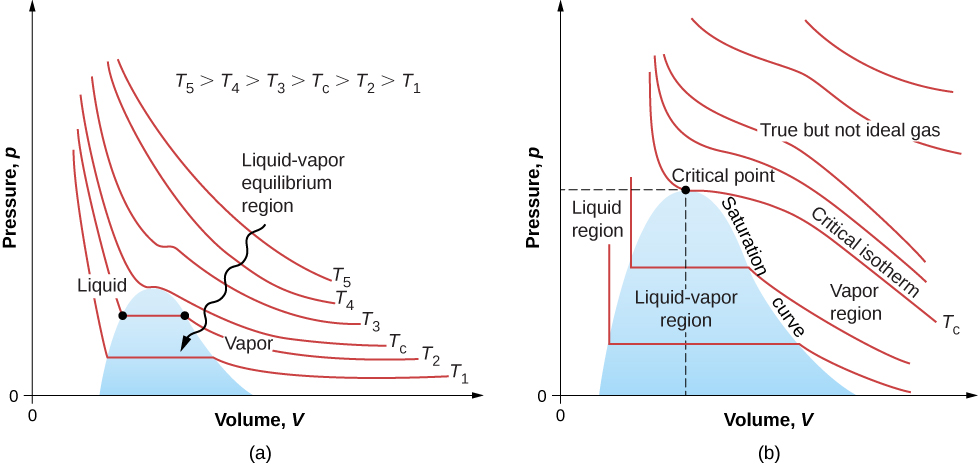
Isotherms hapo juu\(T_c\) haipiti kupitia mabadiliko ya kioevu-gesi. Kwa hiyo, kiowevu hakiwezi kuwepo juu ya joto hilo, ambalo ni joto kali (lililoelezwa katika sura ya halijoto na joto). Kwa shinikizo la kutosha chini juu ya joto hilo, gesi ina wiani wa kiowevu lakini haitapungua; gesi inasemekana kuwa supercritical. Kwa shinikizo la juu, ni imara. Dioksidi kaboni, kwa mfano, haina awamu ya kioevu kwenye joto la juu\(31.0^oC\). Shinikizo muhimu ni shinikizo la juu ambalo kioevu kinaweza kuwepo. Hatua kwenye mchoro wa PV kwenye shinikizo muhimu na joto ni hatua muhimu (ambayo umejifunza kuhusu sura ya joto na joto). Orodha ya meza inawakilisha joto muhimu na shinikizo.
| Dutu | Joto muhimu | \(T_c\) | Shinikizo muhimu | |
|---|---|---|---|---|
| K | \ (T_c\) ">\(^oC\) | Pa | atm | |
| Maji | 647.4 | \ (T_c\) "> 374.3 | \(22.12 \times 10^6\) | 219.0 |
| Dioksidi ya sul | 430.7 | \ (T_c\) "> 157.6 | \(7.88\times 10^6\) | 78.0 |
| Amonia | 405.5 | \ (T_c\) ">132.4 | \(11.28\times 10^6\) | 111.7 |
| Dioksidi kaboni | 304.2 | \ (T_c\) ">31.1 | \(7.39\times 10^6\) | 73.2 |
| Oksijeni | 154.8 | \ (T_c\) ">—118.4 | \(5.08\times 10^6\) | 50.3 |
| Nitrojeni | 126.2 | \ (T_c\) "> - 146.9 | \(3.39\times 10^6\) | 33.6 |
| Hidrojeni | 33.3 | \ (T_c\) ">—239.9 | \(1.30\times 10^6\) | 12.9 |
| Heliamu | 5.3 | \ (T_c\) "> - 267.9 | \(0.229\times 10^6\) | 2.27 |


