21.3: Decaimento radioativo
- Page ID
- 185337
- Reconheça os modos comuns de decaimento radioativo
- Identifique partículas e energias comuns envolvidas nas reações de decaimento nuclear
- Escreva e equilibre equações de decaimento nuclear
- Calcule parâmetros cinéticos para processos de decaimento, incluindo meia-vida
- Descreva técnicas comuns de datação radiométrica
Após a descoberta um tanto fortuita da radioatividade por Becquerel, muitos cientistas proeminentes começaram a investigar esse fenômeno novo e intrigante. Entre eles estavam Marie Curie (a primeira mulher a ganhar um Prêmio Nobel e a única pessoa a ganhar dois prêmios Nobel em ciências diferentes - química e física), que foi a primeira a cunhar o termo “radioatividade”, e Ernest Rutherford (famoso por experimentos de folha de ouro), que investigou e nomeou três dos mais comuns tipos de radiação. Durante o início do século XX, muitas substâncias radioativas foram descobertas, as propriedades da radiação foram investigadas e quantificadas e uma sólida compreensão da radiação e do decaimento nuclear foi desenvolvida.
A mudança espontânea de um nuclídeo instável em outro é o decaimento radioativo. O nuclídeo instável é chamado de nuclídeo pai; o nuclídeo que resulta da decomposição é conhecido como nuclídeo filho. O nuclídeo filho pode ser estável ou pode se decompor sozinho. A radiação produzida durante o decaimento radioativo é tal que o nuclídeo filho fica mais próximo da faixa de estabilidade do que o nuclídeo original, portanto, a localização de um nuclídeo em relação à faixa de estabilidade pode servir como um guia para o tipo de decaimento que ele sofrerá (Figura\(\PageIndex{1}\)).
Embora o decaimento radioativo de um núcleo seja muito pequeno para ser visto a olho nu, podemos ver indiretamente o decaimento radioativo em um ambiente chamado câmara de nuvem. Clique aqui para saber mais sobre câmaras de nuvem e ver uma interessante demonstração da câmara de nuvem do Jefferson Lab.
Tipos de decaimento radioativo
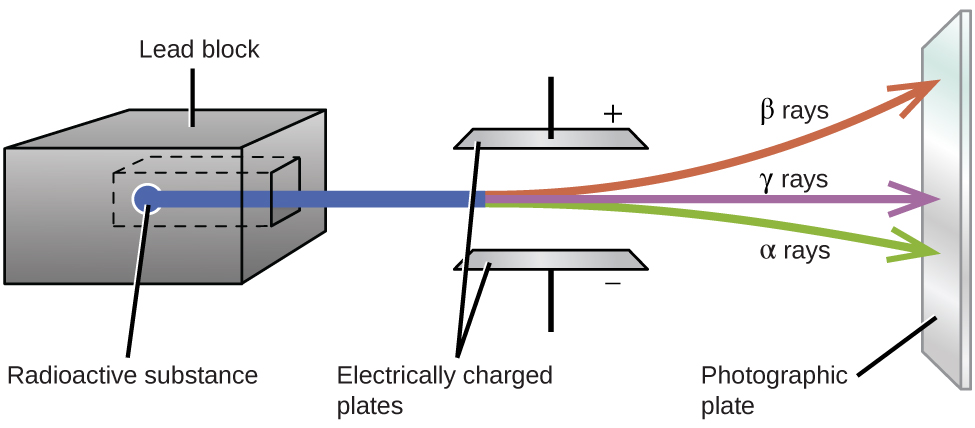
Os experimentos de Ernest Rutherford envolvendo a interação da radiação com um campo magnético ou elétrico (Figura\(\PageIndex{2}\)) o ajudaram a determinar que um tipo de radiação consistia em\(α\) partículas carregadas positivamente e relativamente massivas; um segundo tipo era composto de carga negativa e muito menos \(β\)partículas massivas; e uma terceira eram ondas eletromagnéticas não carregadas,\(γ\) raios. Agora sabemos que\(α\) as partículas são núcleos de hélio de alta energia,\(β\) as partículas são elétrons de alta energia e a\(γ\) radiação compõe radiação eletromagnética de alta energia. Classificamos diferentes tipos de decaimento radioativo pela radiação produzida.
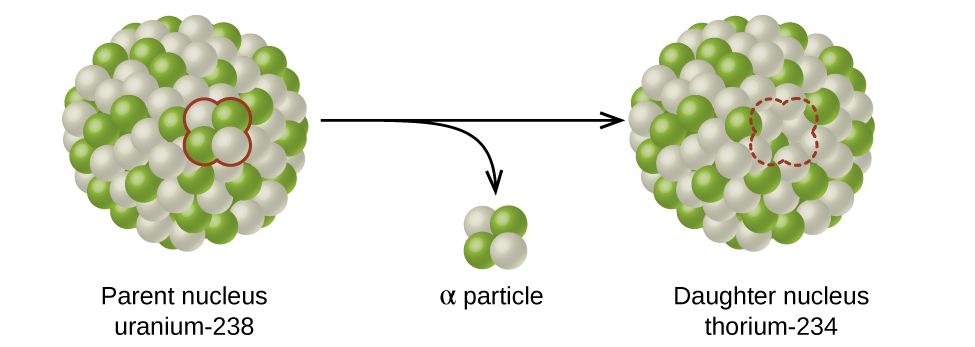
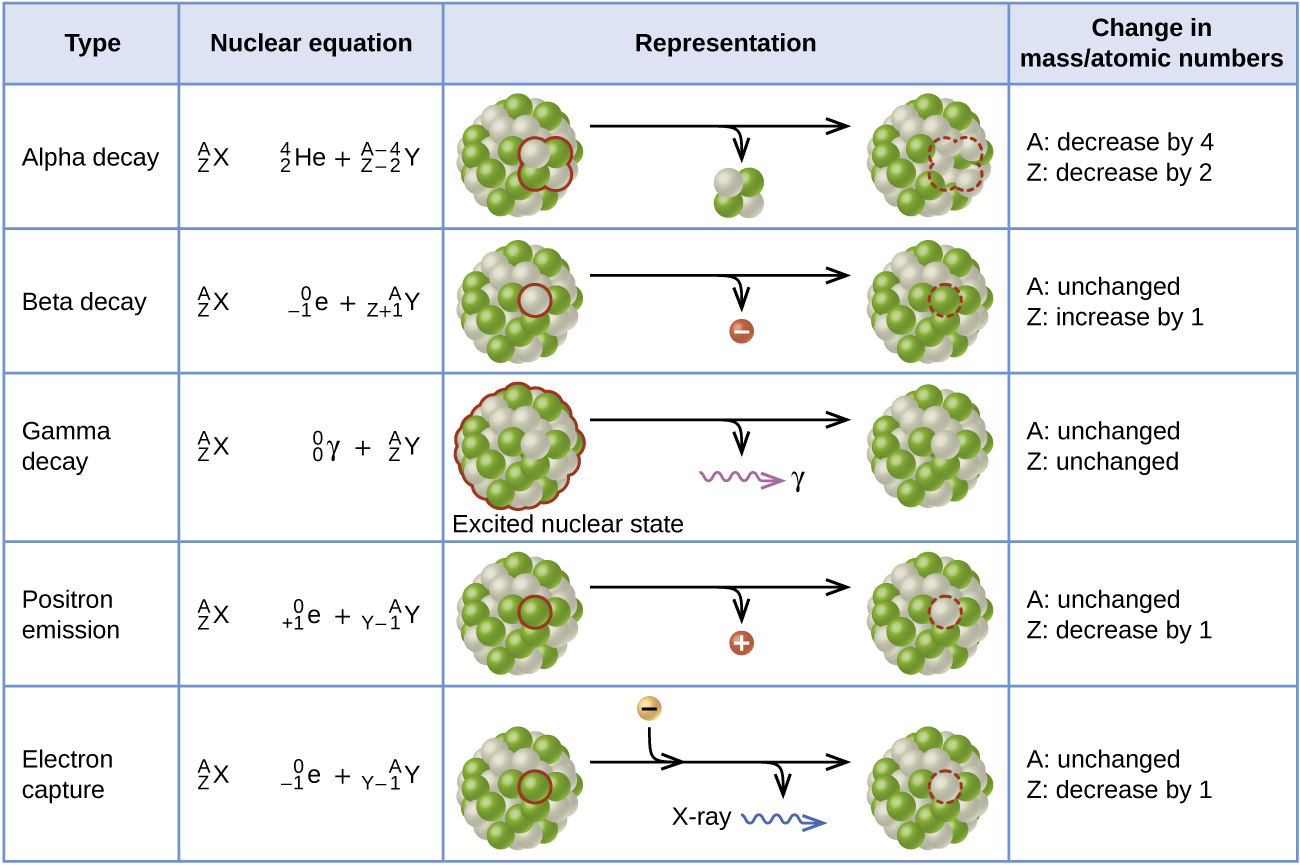
Alfa (\(α\)) decayé a emissão de uma partícula α do núcleo. Por exemplo, o polônio-210 sofre decaimento α:
\[\ce{^{210}_{84}Po⟶ ^4_2He + ^{206}_{82}Pb} \hspace{40px}\ce{or}\hspace{40px} \ce{^{210}_{84}Po ⟶ ^4_2α + ^{206}_{82}Pb}\nonumber \]
O decaimento alfa ocorre principalmente em núcleos pesados (A > 200, Z > 83). Como a perda de uma partícula α dá a um nuclídeo filho com um número de massa quatro unidades menor e um número atômico duas unidades menor que o do nuclídeo pai, o nuclídeo filho tem uma razão n:p maior do que o nuclídeo pai. Se o nuclídeo pai que sofre decaimento α estiver abaixo da faixa de estabilidade, o nuclídeo filho ficará mais próximo da banda.
O decaimento beta (β) é a emissão de um elétron de um núcleo. O iodo-131 é um exemplo de um nuclídeo que sofre decaimento β:
\[\ce{^{131}_{53}I ⟶ ^0_{-1}e + ^{131}_{54}X} \hspace{40px}\ce{or}\hspace{40px} \ce{^{131}_{53}I ⟶ ^0_{-1}β + ^{131}_{54}Xe}\nonumber \]
O decaimento beta, que pode ser considerado como a conversão de um nêutron em um próton e uma partícula β, é observado em nuclídeos com uma grande proporção n:p. A partícula beta (elétron) emitida é do núcleo atômico e não é um dos elétrons ao redor do núcleo. Esses núcleos estão acima da faixa de estabilidade. A emissão de um elétron não altera o número de massa do nuclídeo, mas aumenta o número de seus prótons e diminui o número de seus nêutrons. Consequentemente, a relação n:p é reduzida e o nuclídeo filho fica mais próximo da faixa de estabilidade do que o nuclídeo original.
A emissão gama (emissão γ) é observada quando um nuclídeo é formado em um estado excitado e depois decai para seu estado fundamental com a emissão de um raio γ, um quantum de radiação eletromagnética de alta energia. A presença de um núcleo em estado excitado geralmente é indicada por um asterisco (*). O cobalto-60 emite radiação γ e é usado em muitas aplicações, incluindo tratamento de câncer:
\[\mathrm{^{60}_{27}Co^* ⟶\, ^0_0γ +\, ^{60}_{27}Co}\nonumber \]
Não há mudança no número de massa ou no número atômico durante a emissão de um raio γ, a menos que a emissão γ acompanhe um dos outros modos de decaimento.
O íon emissor de pósitrons (\(β^+\)decaimento) é a emissão de um pósitron do núcleo. O oxigênio-15 é um exemplo de nuclídeo que sofre emissão de pósitrons:
\[\ce{^{15}_8O ⟶ ^0_{+1}e + ^{15}_7N} \hspace{40px}\ce{or}\hspace{40px} \ce{^{15}_8O ⟶ ^0_{+1}β + ^{15}_7N}\nonumber \]
A emissão de pósitrons é observada para nuclídeos nos quais a relação n:p é baixa. Esses nuclídeos estão abaixo da faixa de estabilidade. O decaimento do pósitron é a conversão de um próton em nêutron com a emissão de um pósitron. A relação n:p aumenta e o nuclídeo filho fica mais próximo da faixa de estabilidade do que o nuclídeo original.
A captura de elétrons ocorre quando um dos elétrons internos de um átomo é capturado pelo núcleo do átomo. Por exemplo, o potássio-40 sofre captura de elétrons:
\[\ce{^{40}_{19}K + ^0_{-1}e ⟶ ^{40}_{18}Ar}\nonumber \]
A captura de elétrons ocorre quando um elétron da camada interna se combina com um próton e é convertido em um nêutron. A perda de um elétron da camada interna deixa uma vaga que será preenchida por um dos elétrons externos. Quando o elétron externo cair na vaga, ele emitirá energia. Na maioria dos casos, a energia emitida será na forma de um raio-X. Assim como a emissão de pósitrons, a captura de elétrons ocorre para núcleos “ricos em prótons” que estão abaixo da faixa de estabilidade. A captura de elétrons tem o mesmo efeito no núcleo que a emissão de pósitrons: o número atômico é reduzido em um e o número de massa não muda. Isso aumenta a relação n:p, e o nuclídeo filho fica mais próximo da faixa de estabilidade do que o nuclídeo original. É difícil prever se a captura de elétrons ou a emissão de pósitrons ocorrem. A escolha se deve principalmente a fatores cinéticos, com aquele que requer menor energia de ativação sendo o mais provável de ocorrer. A figura\(\PageIndex{3}\) resume esses tipos de decaimento, junto com suas equações e mudanças nos números atômicos e de massa.
Os exames de tomografia por emissão de pósitrons (PET) usam radiação para diagnosticar e rastrear condições de saúde e monitorar tratamentos médicos, revelando como partes do corpo de um paciente funcionam (Figura\(\PageIndex{4}\)). Para realizar uma tomografia computadorizada, um radioisótopo emissor de pósitrons é produzido em um ciclotron e, em seguida, ligado a uma substância usada pela parte do corpo que está sendo investigada. Esse composto “marcado”, ou radiotraçador, é então colocado no paciente (injetado via intravenosa ou respirado como um gás) e, como é usado pelo tecido, revela como esse órgão ou outra área do corpo funciona.
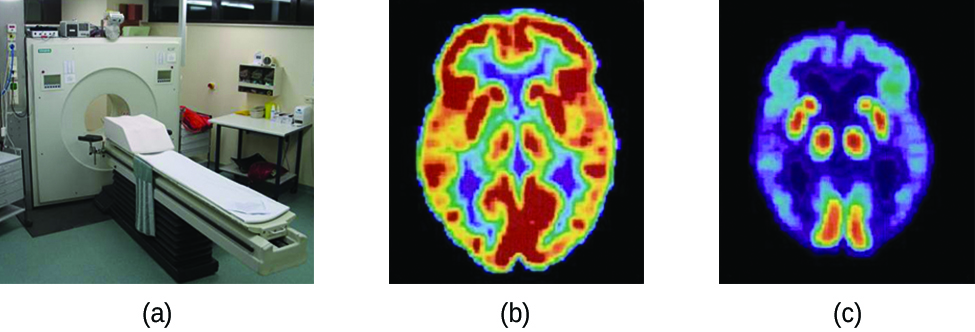
Por exemplo, o F-18 é produzido por bombardeio de prótons de 18 O\( (\ce{^{18}_8O + ^1_1p⟶ ^{18}_9F + ^1_0n})\) e incorporado a um análogo da glicose chamado fludeoxiglicose (FDG). A forma como o FDG é usado pelo corpo fornece informações diagnósticas críticas; por exemplo, como os cânceres usam glicose de forma diferente dos tecidos normais, o FDG pode revelar cânceres. O 18 F emite pósitrons que interagem com elétrons próximos, produzindo uma explosão de radiação gama. Essa energia é detectada pelo scanner e convertida em uma imagem colorida tridimensional detalhada que mostra como essa parte do corpo do paciente funciona. Níveis diferentes de radiação gama produzem diferentes quantidades de brilho e cores na imagem, que podem então ser interpretadas por um radiologista para revelar o que está acontecendo. Os exames PET podem detectar danos cardíacos e doenças cardíacas, ajudar a diagnosticar a doença de Alzheimer, indicar a parte do cérebro que é afetada pela epilepsia, revelar o câncer, mostrar em que estágio ele está e o quanto ele se espalhou e se os tratamentos são eficazes. Ao contrário da ressonância magnética e dos raios-X, que mostram apenas a aparência de algo, a grande vantagem dos exames de PET é que eles mostram como algo funciona. Agora, os exames de PET geralmente são realizados em conjunto com uma tomografia computadorizada.
Série Radioactive Decay
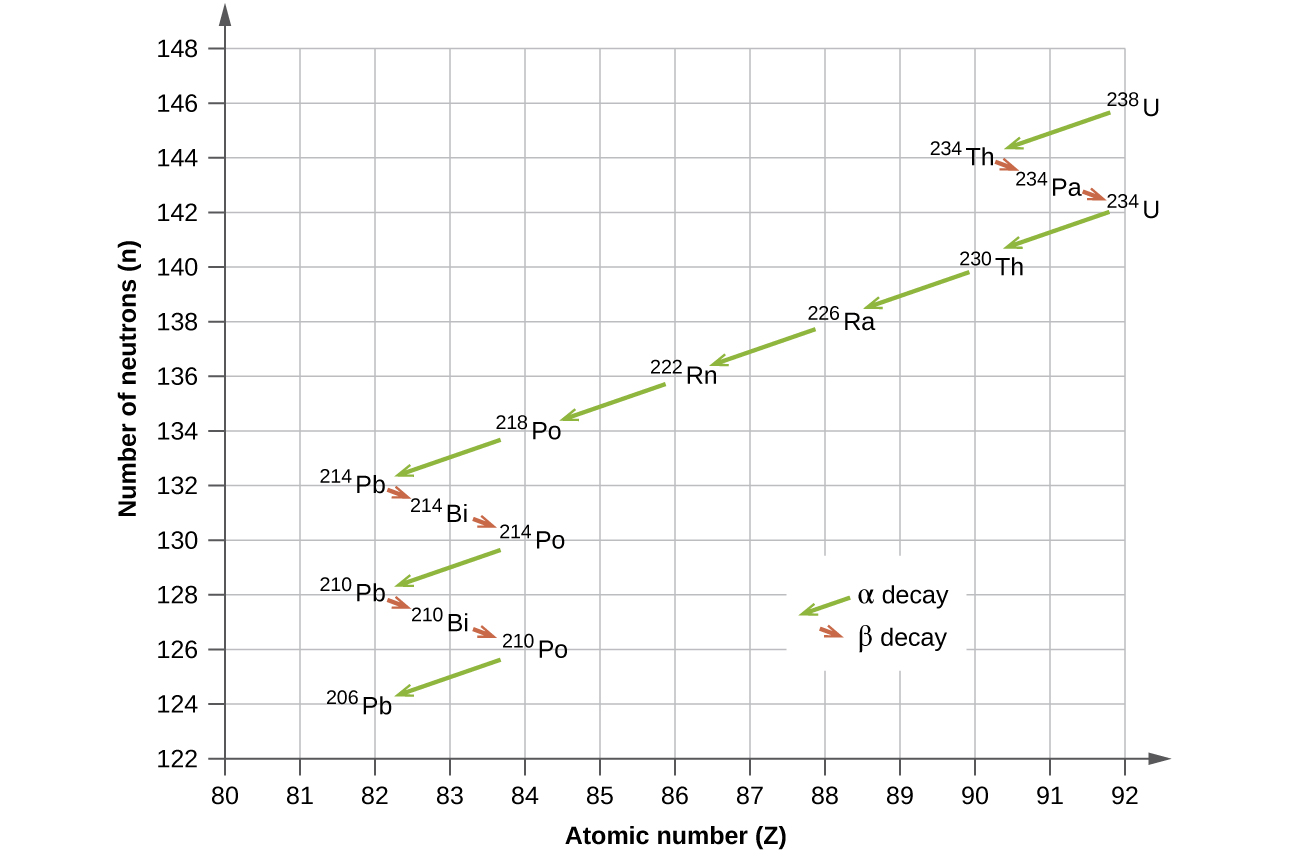
Os isótopos radioativos que ocorrem naturalmente dos elementos mais pesados se enquadram em cadeias de sucessivas desintegrações, ou decaimentos, e todas as espécies em uma cadeia constituem uma família radioativa, ou série de decaimento radioativo. Três dessas séries incluem a maioria dos elementos naturalmente radioativos da tabela periódica. Eles são a série do urânio, a série dos actinídeos e a série do tório. A série neptúnio é uma quarta série, que não é mais significativa na Terra devido à curta meia-vida das espécies envolvidas. Cada série é caracterizada por um pai (primeiro membro) que tem uma meia-vida longa e uma série de nuclídeos filhos que, em última análise, levam a um produto final estável - ou seja, um nuclídeo na faixa de estabilidade (Figura\(\PageIndex{5}\)). Em todas as três séries, o produto final é um isótopo estável de chumbo. A série neptúnio, anteriormente pensada para terminar com bismuto-209, termina com tálio-205.
Meias-vidas radioativas
O decaimento radioativo segue a cinética de primeira ordem. Como as reações de primeira ordem já foram abordadas em detalhes no capítulo de cinética, agora aplicaremos esses conceitos às reações de decaimento nuclear. Cada nuclídeo radioativo tem uma meia-vida característica e constante (t 1/2), o tempo necessário para que metade dos átomos em uma amostra se decomponha. A meia-vida de um isótopo nos permite determinar por quanto tempo uma amostra de um isótopo útil estará disponível, e por quanto tempo uma amostra de um isótopo indesejável ou perigoso deve ser armazenada antes de decair para um nível de radiação baixo o suficiente que não seja mais um problema.
Por exemplo, o cobalto-60, um isótopo que emite raios gama usados para tratar o câncer, tem meia-vida de 5,27 anos (Figura\(\PageIndex{6}\)). Em uma determinada fonte de cobalto-60, como metade dos\(\ce{^{60}_{27}Co}\) núcleos se decompõe a cada 5,27 anos, tanto a quantidade de material quanto a intensidade da radiação emitida são reduzidas pela metade a cada 5,27 anos. (Observe que, para uma determinada substância, a intensidade da radiação que ela produz é diretamente proporcional à taxa de decaimento da substância e à quantidade da substância.) Isso é o esperado para um processo que segue uma cinética de primeira ordem. Portanto, uma fonte de cobalto-60 usada no tratamento do câncer deve ser substituída regularmente para continuar sendo eficaz.

Como o decaimento nuclear segue a cinética de primeira ordem, podemos adaptar as relações matemáticas usadas para reações químicas de primeira ordem. Geralmente substituímos o número de núcleos, N, pela concentração. Se a taxa for declarada em decaimentos nucleares por segundo, nos referimos a ela como a atividade da amostra radioativa. A taxa de decaimento radioativo é:
\[\text{decay rate} = \lambda N\nonumber \]
com\(\lambda\) é a constante de decaimento do radioisótopo específico.
A constante de decaimento,\(\lambda\), que é o mesmo que uma constante de taxa discutida no capítulo de cinética. É possível expressar a constante de decaimento em termos de meia-vida, t 1/2:
\[λ=\dfrac{\ln 2}{t_{1/2}}=\dfrac{0.693}{t_{1/2}} \hspace{40px}\ce{or}\hspace{40px} t_{1/2}=\dfrac{\ln 2}{λ}=\dfrac{0.693}{λ}\nonumber \]
As equações de primeira ordem que relacionam quantidade, N e tempo são:
\[N_t=N_0e^{−kt} \hspace{40px}\ce{or}\hspace{40px} t=−\dfrac{1}{λ}\ln\left(\dfrac{N_t}{N_0}\right)\nonumber \]
onde N 0 é o número inicial de núcleos ou moles do isótopo, e N t é o número de núcleos/moles restantes no tempo t. \(\PageIndex{1}\)O exemplo aplica esses cálculos para encontrar as taxas de decaimento radioativo para nuclídeos específicos.
\(\ce{^{60}_{27}Co}\)decai com meia-vida de 5,27 anos para produzir\(\ce{^{60}_{28}Ni}\).
- Qual é a constante de decaimento da desintegração radioativa do cobalto-60?
- Calcule a fração de uma amostra do\(\ce{^{60}_{27}Co}\) isótopo que permanecerá após 15 anos.
- Quanto tempo leva para uma amostra de\(\ce{^{60}_{27}Co}\) se desintegrar na medida em que restam apenas 2,0% da quantidade original?
Solução
(a) O valor da constante de taxa é dado por:
\[λ=\dfrac{\ln 2}{t_{1/2}}=\mathrm{\dfrac{0.693}{5.27\:y}=0.132\:y^{−1}} \nonumber \]
(b) A fração\(\ce{^{60}_{27}Co}\) disso é deixada após o tempo t ser dado por\(\dfrac{N_t}{N_0}\). Reorganizar a relação de primeira ordem N t = N 0 e — λt para resolver essa razão produz:
\[\dfrac{N_t}{N_0}=e^{-λt}=e^\mathrm{-(0.132/y)(15.0/y)}=0.138 \nonumber \]
A fração\(\ce{^{60}_{27}Co}\) disso permanecerá após 15,0 anos é 0,138. Ou dito de outra forma, 13,8% do presente\(\ce{^{60}_{27}Co}\) originalmente permanecerá após 15 anos.
(c) 2,00% da quantidade original de\(\ce{^{60}_{27}Co}\) é igual a 0,0200 × N 0. Substituindo isso na equação do tempo pela cinética de primeira ordem, temos:
\[t=−\dfrac{1}{λ}\ln\left(\dfrac{N_t}{N_0}\right)=−\dfrac{1}{0.132\:\ce y^{−1}}\ln\left(\dfrac{0.0200×N_0}{N_0}\right)=29.6\:\ce y \nonumber \]
Radon-222,\(\ce{^{222}_{86}Rn}\), tem meia-vida de 3.823 dias. Quanto tempo uma amostra de radônio-222 com uma massa de 0,750 g levará para se decompor em outros elementos, restando apenas 0,100 g de radônio-222?
- Resposta
-
11,1 dias
Como cada nuclídeo tem um número específico de nucleons, um equilíbrio particular de repulsão e atração e seu próprio grau de estabilidade, as meias-vidas dos nuclídeos radioativos variam amplamente. Por exemplo: a meia-vida de\(\ce{^{209}_{83}Bi}\) é 1,9 × 10 19 anos;\(\ce{^{239}_{94}Ra}\) é 24.000 anos;\(\ce{^{222}_{86}Rn}\) é 3,82 dias; e o elemento-111 (Rg para roentgenium) é 1,5 × 10 —3 segundos. As meias-vidas de vários isótopos radioativos importantes para a medicina são mostradas na Tabela\(\PageIndex{1}\), e outros estão listados no Apêndice N1.
| Tipo | Modo de decaimento | Meia-vida | Usos |
|---|---|---|---|
| F-18 | decaimento β + | 110. minutos | Exames PET |
| Co-60 | decaimento β, decaimento γ | 5,27 anos | tratamento do câncer |
| TC-99 m 1 | decaimento γ | 8,01 horas | exames de cérebro, pulmão, coração, osso |
| I-131 | decaimento β | 8,02 dias | exames e tratamento da tireoide |
| Tl-201 | captura de elétrons | 73 horas | exames de coração e artérias; testes de estresse cardíaco |
| O “m” em TC-99m significa “metaestável”, indicando que esse é um estado instável e de alta energia do Tc-99. Isótopos metaestáveis emitem\(γ\) radiação para se livrar do excesso de energia e se tornarem (mais) estáveis. | |||
Datação radiométrica
Vários radioisótopos têm meia-vida e outras propriedades que os tornam úteis para fins de “datação” da origem de objetos, como artefatos arqueológicos, organismos anteriormente vivos, ou formações geológicas. Esse processo é de datação radiométrica e tem sido responsável por muitas descobertas científicas inovadoras sobre a história geológica da Terra, a evolução da vida, e a história da civilização humana. Vamos explorar alguns dos tipos mais comuns de datação radioativa e como os isótopos específicos funcionam para cada tipo.
Datação radioativa usando carbono-14
A radioatividade do carbono-14 fornece um método para datar objetos que faziam parte de um organismo vivo. Esse método de datação radiométrica, também chamado de datação por radiocarbono ou datação por carbono-14, é preciso para datar substâncias que contêm carbono com até cerca de 30.000 anos e pode fornecer datas razoavelmente precisas até um máximo de cerca de 50.000 anos.
O carbono que ocorre naturalmente consiste em três isótopos:\(\ce{^{12}_6C}\), que constitui cerca de 99% do carbono na Terra;\(\ce{^{13}_6C}\), cerca de 1% do total; e vestígios de\(\ce{^{14}_6C}\). O carbono-14 se forma na alta atmosfera pela reação de átomos de nitrogênio com nêutrons dos raios cósmicos no espaço:
\[\ce{^{14}_7N + ^1_0n⟶ ^{14}_6C + ^1_1H}\nonumber \]
Todos os isótopos de carbono reagem com o oxigênio para produzir moléculas de CO 2. A proporção de\(\ce{^{14}_6CO2}\) para\(\ce{^{12}_6CO2}\) depende da proporção de\(\ce{^{14}_6CO}\) para\(\ce{^{12}_6CO}\) na atmosfera. A abundância natural de\(\ce{^{14}_6CO}\) na atmosfera é de aproximadamente 1 parte por trilhão; até recentemente, isso geralmente era constante ao longo do tempo, como visto em amostras de gás encontradas presas no gelo. A incorporação de\(\ce{^{14}_6C ^{14}_6CO2}\) e\(\ce{^{12}_6CO2}\) nas plantas é uma parte regular do processo de fotossíntese, o que significa que a\(\ce{^{14}_6C: ^{12}_6C}\) proporção encontrada em uma planta viva é a\(\ce{^{14}_6C: ^{12}_6C}\) mesma da atmosfera. Mas quando a planta morre, ela não retém mais carbono por meio da fotossíntese. \(\ce{^{12}_6C}\)Por ser um isótopo estável e não sofrer decaimento radioativo, sua concentração na planta não muda. No entanto, o carbono-14 decai por emissão β com meia-vida de 5730 anos:
\[\ce{^{14}_6C⟶ ^{14}_7N + ^0_{-1}e}\nonumber \]
Assim, a\(\ce{^{14}_6C: ^{12}_6C}\) proporção diminui gradualmente após a morte da planta. A diminuição da proporção com o tempo fornece uma medida do tempo decorrido desde a morte da planta (ou outro organismo que a comeu). A figura retrata\(\PageIndex{7}\) visualmente esse processo.
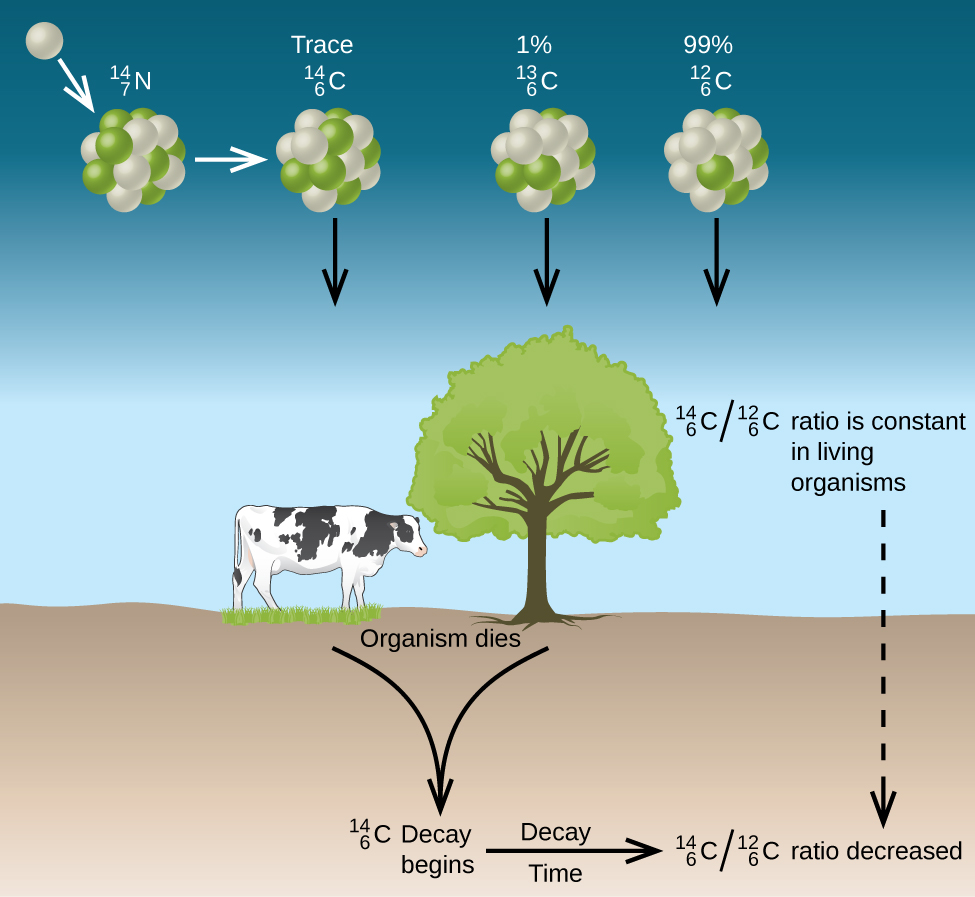
Por exemplo, com a meia-vida de\(\ce{^{14}_6C}\) 5730 anos, se a\(\ce{^{14}_6C : ^{12}_6C}\) proporção em um objeto de madeira encontrado em uma escavação arqueológica for metade da de uma árvore viva, isso indica que o objeto de madeira tem 5730 anos. Determinações de\(\ce{^{14}_6C : ^{12}_6C}\) proporções altamente precisas podem ser obtidas de amostras muito pequenas (tão pouco quanto um miligrama) com o uso de um espectrômetro de massa.
Um pequeno pedaço de papel (produzido a partir de matéria vegetal anteriormente viva) retirado dos Manuscritos do Mar Morto tem uma atividade de 10,8 desintegrações por minuto por grama de carbono. Se a atividade inicial do C-14 foi de 13,6 desintegrações/min/g de C, estime a idade dos Manuscritos do Mar Morto.
Solução
A taxa de decaimento (número de desintegrações/minuto/grama de carbono) é proporcional à quantidade de C-14 radioativo restante no papel, então podemos substituir as taxas pelas quantidades, N, na relação:
\[t=−\dfrac{1}{λ}\ln\left(\dfrac{N_t}{N_0}\right)⟶t=−\dfrac{1}{λ}\ln\left(\dfrac{\ce{Rate}_t}{\ce{Rate}_0}\right) \nonumber \]
onde o subscrito 0 representa a época em que as plantas foram cortadas para fazer o papel, e o subscrito t representa a hora atual.
A constante de decaimento pode ser determinada a partir da meia-vida de C-14, 5730 anos:
\[λ=\dfrac{\ln 2}{t_{1/2}}=\mathrm{\dfrac{0.693}{5730\: y}=1.21×10^{−4}\:y^{−1}} \nonumber \]
Substituindo e resolvendo, temos:
\[t=−\dfrac{1}{λ}\ln\left(\dfrac{\ce{Rate}_t}{\ce{Rate}_0}\right)=\mathrm{−\dfrac{1}{1.21×10^{−4}\:y^{−1}}\ln\left(\dfrac{10.8\:dis/min/g\: C}{13.6\:dis/min/g\: C}\right)=1910\: y}\nonumber \]
Portanto, os Manuscritos do Mar Morto têm aproximadamente 1900 anos (Figura\(\PageIndex{8}\)).

Datas mais precisas dos reinados dos antigos faraós egípcios foram determinadas recentemente usando plantas que foram preservadas em seus túmulos. Amostras de sementes e matéria vegetal do túmulo do rei Tutancâmon têm uma taxa de decaimento de C-14 de 9,07 desintegrações/min/g de C. Há quanto tempo o reinado do rei Tut chegou ao fim?
- Resposta
-
cerca de 3350 anos atrás, ou aproximadamente 1340 BC
Houve algumas mudanças significativas e bem documentadas na\(\ce{^{14}_6C : ^{12}_6C}\) proporção. A precisão de uma aplicação direta dessa técnica depende de a\(\ce{^{14}_6C : ^{12}_6C}\) proporção em uma planta viva ser a mesma agora de uma era anterior, mas isso nem sempre é válido. Devido ao crescente acúmulo de moléculas de CO 2 (em grande parte\(\ce{^{12}_6CO2}\)) na atmosfera causado pela combustão de combustíveis fósseis (nos quais essencialmente todas elas decaíram), a proporção de\(\ce{^{14}_6C : ^{12}_6C}\) na atmosfera pode estar mudando.\(\ce{^{14}_6C}\) Esse aumento causado pelo homem\(\ce{^{12}_6CO2}\) na atmosfera faz com que a\(\ce{^{14}_6C : ^{12}_6C}\) proporção diminua e, por sua vez, afeta a proporção de organismos atualmente vivos na Terra. Felizmente, no entanto, podemos usar outros dados, como datação de árvores por meio do exame de anéis de crescimento anuais, para calcular os fatores de correção. Com esses fatores de correção, datas precisas podem ser determinadas. Em geral, a datação radioativa só funciona por cerca de 10 meias-vidas; portanto, o limite para datação por carbono 14 é de cerca de 57.000 anos.
Datação radioativa usando nuclídeos que não sejam carbono-14
A datação radioativa também pode usar outros nuclídeos radioativos com meia-vida mais longa para datar eventos mais antigos. Por exemplo, o urânio-238 (que decai em uma série de etapas em chumbo-206) pode ser usado para estabelecer a idade das rochas (e a idade aproximada das rochas mais antigas da Terra). Como o U-238 tem meia-vida de 4,5 bilhões de anos, é preciso esse tempo para que metade do U-238 original se decomponha em Pb-206. Em uma amostra de rocha que não contém quantidades apreciáveis de Pb-208, o isótopo de chumbo mais abundante, podemos supor que o chumbo não estava presente quando a rocha foi formada. Portanto, medindo e analisando a proporção de U-238:Pb-206, podemos determinar a idade da rocha. Isso pressupõe que todo o chumbo-206 presente veio da decomposição do urânio-238. Se houver chumbo-206 adicional presente, o que é indicado pela presença de outros isótopos de chumbo na amostra, é necessário fazer um ajuste. A datação por potássio-argônio usa um método semelhante. O K-40 decai por emissão de pósitrons e captura de elétrons para formar o Ar-40 com meia-vida de 1,25 bilhão de anos. Se uma amostra de rocha for triturada e a quantidade de gás Ar-40 que escapa for medida, a determinação da razão Ar-40:K-40 produz a idade da rocha. Outros métodos, como a datação por rubídio-estrôncio (o Rb-87 decai em Sr-87 com meia-vida de 48,8 bilhões de anos), operam segundo o mesmo princípio. Para estimar o limite inferior da idade da Terra, os cientistas determinam a idade de várias rochas e minerais, assumindo que a Terra é mais velha do que as rochas e minerais mais antigos de sua crosta. Em 2014, as rochas mais antigas conhecidas na Terra são os zircões Jack Hills da Austrália, encontrados pela datação de urânio-chumbo com quase 4,4 bilhões de anos.
Uma rocha ígnea contém 9,58 × 10 —5 g de U-238 e 2,51 × 10 —5 g de Pb-206 e quantidades muito, muito menores de Pb-208. Determine o tempo aproximado em que a rocha se formou.
Solução
A amostra de rocha contém muito pouco Pb-208, o isótopo mais comum de chumbo, então podemos supor com segurança que todo o Pb-206 na rocha foi produzido pelo decaimento radioativo do U-238. Quando a rocha se formou, ela continha todo o U-238 atualmente nela, além de alguns U-238 que já sofreram decaimento radioativo.
A quantidade de U-238 atualmente na rocha é:
\[\mathrm{9.58×10^{−5}\cancel{g\: U}×\left( \dfrac{1\: mol\: U}{238\cancel{g\: U}}\right )=4.03×10^{−7}\:mol\: U}\nonumber \]
Porque quando um mol de U-238 decai, ele produz um mol de Pb-206, a quantidade de U-238 que sofreu decaimento radioativo desde que a rocha foi formada é:
\[\mathrm{2.51×10^{-5}\cancel{g\: Pb}×\left( \dfrac{1\cancel{mol\: Pb}}{206\cancel{g\: Pb}}\right )×\left(\dfrac{1\: mol\: U}{1\cancel{mol\: Pb}}\right)=1.22×10^{-7}\:mol\: U}\nonumber \]
A quantidade total de U-238 originalmente presente na rocha é, portanto:
\[\mathrm{4.03×10^{−7}\:mol+1.22×10^{−7}\:mol=5.25×10^{−7}\:mol\: U}\nonumber \]O tempo decorrido desde a formação da rocha é dado por:
\[t=−\dfrac{1}{λ}\ln\left(\dfrac{N_t}{N_0}\right)\nonumber \]com N 0 representando a quantidade original de U-238 e N t representando a quantidade atual de U-238.
O U-238 decai em Pb-206 com meia-vida de 4,5 × 10 9 y, então a constante de decaimento λ é:
\[t=\mathrm{−\dfrac{1}{1.54×10^{−10}\:y^{−1}}\ln\left(\dfrac{4.03×10^{−7}\cancel{mol\: U}}{5.25×10^{−7}\cancel{mol\: U}}\right)=1.7×10^9\:y}\nonumber \]
Portanto, a rocha tem aproximadamente 1,7 bilhão de anos.
Uma amostra de rocha contém 6,14 × 10 —4 g de Rb-87 e 3,51 × 10 —5 g de Sr-87. Calcule a idade da rocha. (A meia-vida do decaimento β do Rb-87 é 4,7 × 10 10 y.)
- Resposta
-
3,7 × 10 9 g
Resumo
Núcleos com relações n:p instáveis sofrem decaimento radioativo espontâneo. Os tipos mais comuns de radioatividade são decaimento α, decaimento β, emissão γ, emissão de pósitrons e captura de elétrons. As reações nucleares também costumam envolver raios γ, e alguns núcleos decaem por captura de elétrons. Cada um desses modos de decaimento leva à formação de um novo núcleo com uma relação n:p mais estável. Algumas substâncias passam por séries de decaimento radioativo, passando por vários decaimentos antes de terminar em um isótopo estável. Todos os processos de decaimento nuclear seguem uma cinética de primeira ordem, e cada radioisótopo tem sua própria meia-vida característica, o tempo necessário para a decomposição da metade de seus átomos. Devido às grandes diferenças de estabilidade entre os nuclídeos, há uma ampla gama de meias-vidas de substâncias radioativas. Muitas dessas substâncias encontraram aplicações úteis no diagnóstico e tratamento médico, determinando a idade de objetos arqueológicos e geológicos e muito mais.
Equações-chave
- taxa de decaimento = λN
- \(t_{1/2}=\dfrac{\ln 2}{λ}=\dfrac{0.693}{λ}\)
Glossário
- decaimento alfa (α)
- perda de uma partícula alfa durante o decaimento radioativo
- decaimento beta (β)
- quebra de um nêutron em um próton, que permanece no núcleo, e um elétron, que é emitido como uma partícula beta
- nuclídeo filha
- nuclídeo produzido pela decomposição radioativa de outro nuclídeo; pode ser estável ou pode decair ainda mais
- captura de elétrons
- combinação de um elétron central com um próton para produzir um nêutron dentro do núcleo
- emissão gama (γ)
- decaimento de um nuclídeo de estado excitado acompanhado pela emissão de um raio gama
- meia-vida (t 1/2)
- tempo necessário para que metade dos átomos em uma amostra radioativa se decomponha
- nuclídeo parental
- nuclídeo instável que se transforma espontaneamente em outro nuclídeo (filho)
- emissão de pósitrons
- (também, decaimento β +) conversão de um próton em um nêutron, que permanece no núcleo, e um pósitron, que é emitido
- decaimento radioativo
- decaimento espontâneo de um nuclídeo instável em outro nuclídeo
- série de decaimento radioativo
- cadeias de desintegrações sucessivas (decaimentos radioativos) que, em última análise, levam a um produto final estável
- datação por radiocarbono
- meios altamente precisos de datar objetos de 30.000 a 50.000 anos que foram derivados de matéria outrora viva; alcançado calculando a proporção de\(\ce{^{14}_6C : ^{12}_6C}\) no objeto versus a proporção de\(\ce{^{14}_6C : ^{12}_6C}\) na atmosfera atual
- datação radiométrica
- uso de radioisótopos e suas propriedades para datar a formação de objetos como artefatos arqueológicos, organismos anteriormente vivos ou formações geológicas


