20.3: Aldeídos, cetonas, ácidos carboxílicos e ésteres
- Page ID
- 184685
- Descreva a estrutura e as propriedades de aldeídos, cetonas, ácidos carboxílicos e ésteres
Outra classe de moléculas orgânicas contém um átomo de carbono conectado a um átomo de oxigênio por uma ligação dupla, comumente chamado de grupo carbonila. O carbono plano trigonal no grupo carbonil pode se ligar a dois outros substituintes, levando a várias subfamílias (aldeídos, cetonas, ácidos carboxílicos e ésteres) descritas nesta seção.
Aldeídos e cetonas
Tanto os aldeídos quanto as cetonas contêm um grupo carbonila, um grupo funcional com uma ligação dupla carbono-oxigênio. Os nomes dos compostos de aldeído e cetona são derivados usando regras de nomenclatura semelhantes às de alcanos e álcoois e incluem os sufixos de identificação de classe -al e -one, respectivamente.

Em um aldeído, o grupo carbonila está ligado a pelo menos um átomo de hidrogênio. Em uma cetona, o grupo carbonila está ligado a dois átomos de carbono. Como texto, um grupo aldeído é representado como —CHO; uma cetona é representada como —C (O) — ou —CO—.
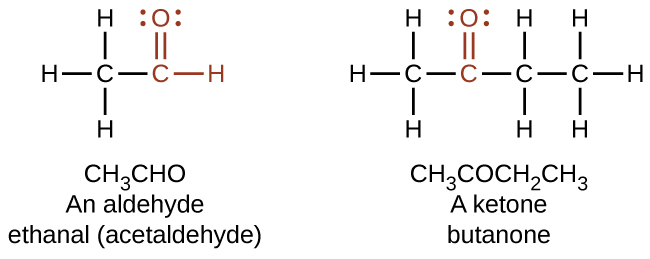
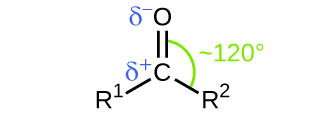
Tanto nos aldeídos quanto nas cetonas, a geometria em torno do átomo de carbono no grupo carbonila é trigonal plana; o átomo de carbono exibe hibridização sp 2. Dois dos orbitais sp 2 no átomo de carbono no grupo carbonila são usados para formar ligações σ com os outros átomos de carbono ou hidrogênio em uma molécula. O orbital híbrido sp 2 restante forma uma ligação σ ao átomo de oxigênio. O orbital p não hibridizado no átomo de carbono no grupo carbonila se sobrepõe a um orbital p no átomo de oxigênio para formar a ligação π na ligação dupla.
Como a\(\mathrm{C=O}\) ligação no dióxido de carbono, a\(\mathrm{C=O}\) ligação de um grupo carbonila é polar (lembre-se de que o oxigênio é significativamente mais eletronegativo do que o carbono, e os elétrons compartilhados são puxados em direção ao átomo de oxigênio e afastados do átomo de carbono). Muitas das reações de aldeídos e cetonas começam com a reação entre uma base de Lewis e o átomo de carbono na extremidade positiva da\(\mathrm{C=O}\) ligação polar para produzir um intermediário instável que posteriormente sofre um ou mais rearranjos estruturais para formar o produto final (Figura\(\PageIndex{1}\)).
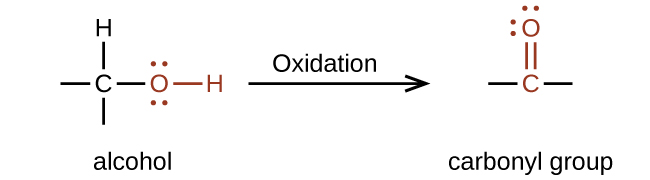
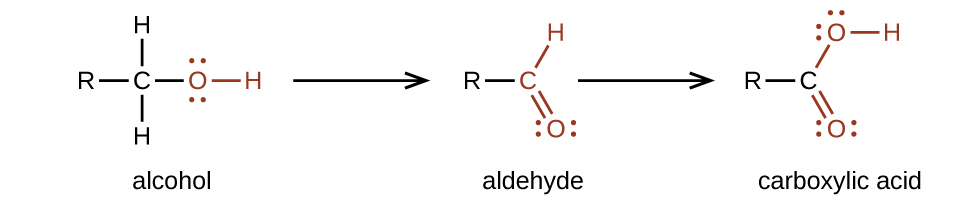
A importância da estrutura molecular na reatividade de compostos orgânicos é ilustrada pelas reações que produzem aldeídos e cetonas. Podemos preparar um grupo carbonila pela oxidação de um álcool - para moléculas orgânicas, diz-se que a oxidação de um átomo de carbono ocorre quando uma ligação carbono-hidrogênio é substituída por uma ligação carbono-oxigênio. A reação inversa - substituindo uma ligação carbono-oxigênio por uma ligação carbono-hidrogênio - é uma redução desse átomo de carbono. Lembre-se de que o oxigênio geralmente recebe um número de oxidação de —2, a menos que seja elementar ou ligado a um flúor. O hidrogênio geralmente recebe um número de oxidação de +1, a menos que esteja ligado a um metal. Como o carbono não tem uma regra específica, seu número de oxidação é determinado algebricamente fatorando os átomos aos quais está ligado e a carga geral da molécula ou íon. Em geral, um átomo de carbono ligado a um átomo de oxigênio terá um número de oxidação mais positivo e um átomo de carbono ligado a um átomo de hidrogênio terá um número de oxidação mais negativo. Isso deve se encaixar perfeitamente na sua compreensão da polaridade das ligações C—O e C—H. Os outros reagentes e possíveis produtos dessas reações estão além do escopo deste capítulo, então vamos nos concentrar apenas nas mudanças nos átomos de carbono:
O metano representa a forma completamente reduzida de uma molécula orgânica que contém um átomo de carbono. Substituir sequencialmente cada uma das ligações carbono-hidrogênio por uma ligação carbono-oxigênio levaria a um álcool, depois um aldeído, depois um ácido carboxílico (discutido posteriormente) e, finalmente, dióxido de carbono:
\[\ce{CH4⟶CH3OH⟶CH2O⟶HCO2H⟶CO2} \nonumber \]
Quais são os números de oxidação dos átomos de carbono nas moléculas mostradas aqui?
Solução
Neste exemplo, podemos calcular o número de oxidação (revise o capítulo sobre reações de redução de oxidação, se necessário) para o átomo de carbono em cada caso (observe como isso se tornaria difícil para moléculas maiores com átomos de carbono e átomos de hidrogênio adicionais, e é por isso que os químicos orgânicos usam a definição lidar com a substituição de títulos C—H por títulos C—O (descrito).
- Para CH 4, o átomo de carbono carrega um número de oxidação —4 (os átomos de hidrogênio recebem números de oxidação de +1 e o átomo de carbono equilibra isso por ter um número de oxidação de —4)
- Para o álcool (neste caso, metanol), o átomo de carbono tem um número de oxidação de —2 (o átomo de oxigênio é atribuído —2, cada um aos quatro átomos de hidrogênio é atribuído +1 e o átomo de carbono equilibra a soma por ter um número de oxidação de —2; observe que comparado ao átomo de carbono em CH 4, esse carbono o átomo perdeu dois elétrons, então foi oxidado)
- Para o aldeído, o número de oxidação do átomo de carbono é 0 (—2 para o átomo de oxigênio e +1 para cada átomo de hidrogênio já se equilibra em 0, então o número de oxidação para o átomo de carbono é 0)
- Para o ácido carboxílico, o número de oxidação do átomo de carbono é +2 (dois átomos de oxigênio cada em —2 e dois átomos de hidrogênio em +1)
- Para o dióxido de carbono, o número de oxidação do átomo de carbono é +4 (aqui, o átomo de carbono precisa equilibrar a soma —4 dos dois átomos de oxigênio).
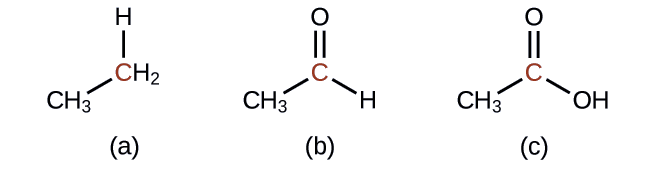
Indique se os átomos de carbono marcados nas três moléculas aqui estão oxidados ou reduzidos em relação ao átomo de carbono marcado no etanol:
Não há necessidade de calcular os estados de oxidação nesse caso; em vez disso, basta comparar os tipos de átomos ligados aos átomos de carbono marcados:
- Responda a
-
reduzido (ligação ao átomo de oxigênio substituída pela ligação ao átomo de hidrogênio);
- Resposta b
-
oxidado (uma ligação ao átomo de hidrogênio substituída por uma ligação ao átomo de oxigênio);
- Resposta c
-
oxidado (2 ligações a átomos de hidrogênio foram substituídas por ligações a um átomo de oxigênio)
Os aldeídos são comumente preparados pela oxidação de álcoois cujo grupo funcional —OH está localizado no átomo de carbono no final da cadeia de átomos de carbono no álcool:

Álcoois que têm seus grupos —OH no meio da cadeia são necessários para sintetizar uma cetona, o que requer que o grupo carbonila seja ligado a dois outros átomos de carbono:

Um álcool com seu grupo —OH ligado a um átomo de carbono ligado a nenhum ou a outro átomo de carbono formará um aldeído. Um álcool com seu grupo —OH ligado a dois outros átomos de carbono formará uma cetona. Se três carbonos estiverem ligados ao carbono ligado ao —OH, a molécula não terá uma ligação C-H para ser substituída, portanto, não será suscetível à oxidação.
O formaldeído, um aldeído com a fórmula HCHO, é um gás incolor com odor pungente e irritante. É vendido em uma solução aquosa chamada formalina, que contém cerca de 37% de formaldeído em peso. O formaldeído causa a coagulação das proteínas, por isso mata as bactérias (e qualquer outro organismo vivo) e interrompe muitos dos processos biológicos que causam a decomposição do tecido. Assim, o formaldeído é usado para preservar amostras de tecido e corpos de embalsamamento. Também é usado para esterilizar o solo ou outros materiais. O formaldeído é usado na fabricação de baquelite, um plástico rígido com alta resistência química e elétrica.
A dimetilcetona, CH 3 COCH 3, comumente chamada de acetona, é a cetona mais simples. É feito comercialmente pela fermentação de milho ou melaço, ou pela oxidação do 2-propanol. A acetona é um líquido incolor. Entre seus muitos usos estão como solvente para verniz (incluindo esmalte de unhas), acetato de celulose, nitrato de celulose, acetileno, plásticos e vernizes; como removedor de tintas e vernizes; e como solvente na fabricação de produtos farmacêuticos e químicos.
Ácidos carboxílicos e ésteres
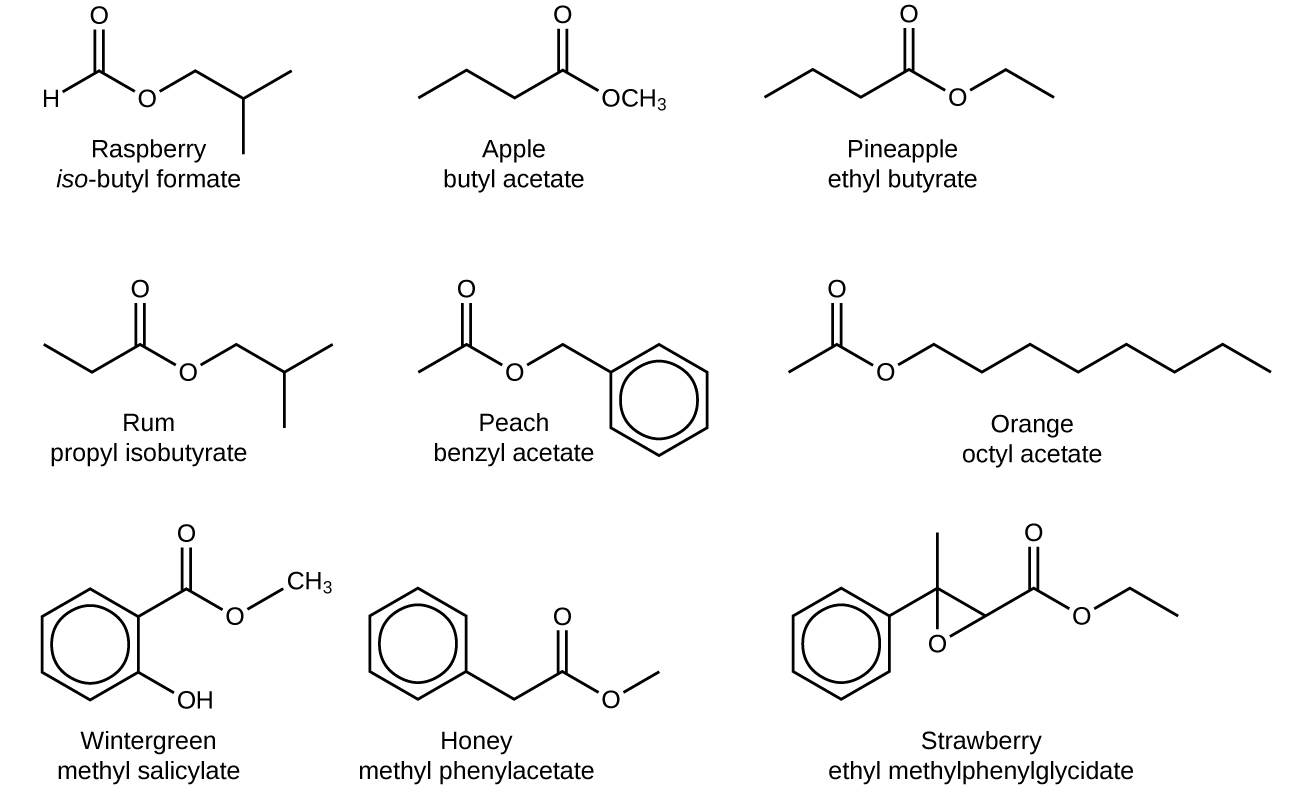
O odor do vinagre é causado pela presença de ácido acético, um ácido carboxílico, no vinagre. O odor de bananas maduras e de muitas outras frutas se deve à presença de ésteres, compostos que podem ser preparados pela reação de um ácido carboxílico com um álcool. Como os ésteres não têm ligações de hidrogênio entre as moléculas, eles têm pressões de vapor mais baixas do que os álcoois e ácidos carboxílicos dos quais são derivados (Figura\(\PageIndex{2}\)).
Tanto os ácidos carboxílicos quanto os ésteres contêm um grupo carbonila com um segundo átomo de oxigênio ligado ao átomo de carbono no grupo carbonila por uma única ligação. Em um ácido carboxílico, o segundo átomo de oxigênio também se liga a um átomo de hidrogênio. Em um éster, o segundo átomo de oxigênio se liga a outro átomo de carbono. Os nomes dos ácidos e ésteres carboxílicos incluem prefixos que denotam os comprimentos das cadeias de carbono nas moléculas e são derivados seguindo regras de nomenclatura semelhantes às dos ácidos e sais inorgânicos (veja estes exemplos):
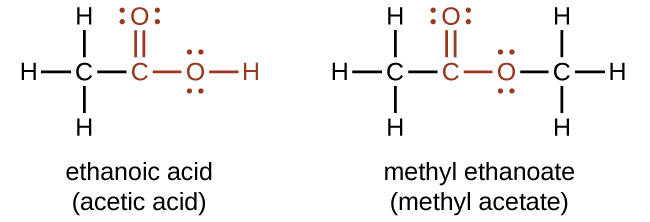
Os grupos funcionais para um ácido e para um éster são mostrados em vermelho nessas fórmulas.
O átomo de hidrogênio no grupo funcional de um ácido carboxílico reagirá com uma base para formar um sal iônico:
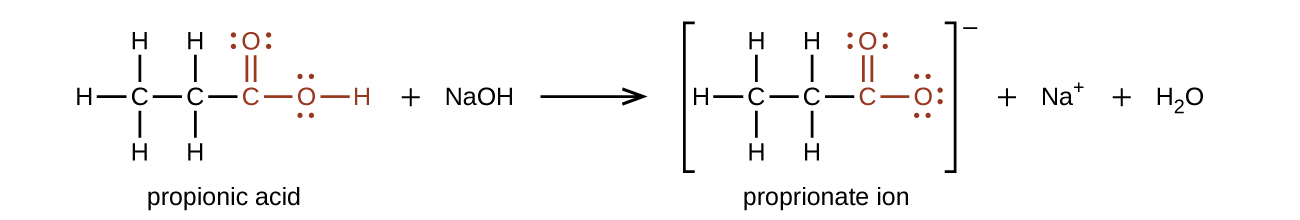
Os ácidos carboxílicos são ácidos fracos, o que significa que não são 100% ionizados em água. Geralmente, apenas cerca de 1% das moléculas de um ácido carboxílico dissolvido em água são ionizadas a qualquer momento. As moléculas restantes não estão dissociadas em solução.
Preparamos ácidos carboxílicos pela oxidação de aldeídos ou álcoois cujo grupo funcional —OH está localizado no átomo de carbono no final da cadeia de átomos de carbono no álcool:
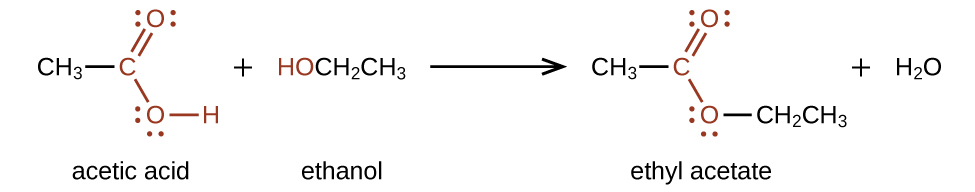
Os ésteres são produzidos pela reação de ácidos com álcoois. Por exemplo, o éster acetato de etila, CH 3 CO 2 CH 2 CH 3, é formado quando o ácido acético reage com o etanol:
O ácido carboxílico mais simples é o ácido fórmico, HCO 2 H, conhecido desde 1670. Seu nome vem da palavra latina formicus, que significa “formiga”; foi isolado pela primeira vez pela destilação de formigas vermelhas. É parcialmente responsável pela dor e irritação das picadas de formigas e vespas e é responsável por um odor característico das formigas que às vezes pode ser detectado em seus ninhos.
O ácido acético, CH 3 CO 2 H, constitui 3— 6% de vinagre. O vinagre de cidra é produzido permitindo que o suco de maçã fermente sem a presença de oxigênio. As células de levedura presentes no suco realizam as reações de fermentação. As reações de fermentação transformam o açúcar presente no suco em etanol e depois em ácido acético. O ácido acético puro tem um odor penetrante e produz queimaduras dolorosas. É um excelente solvente para muitos compostos orgânicos e alguns inorgânicos, e é essencial na produção de acetato de celulose, um componente de muitas fibras sintéticas, como o rayon.
Os odores e sabores distintos e atraentes de muitas flores, perfumes e frutas maduras são devidos à presença de um ou mais ésteres (Figura\(\PageIndex{3}\)). Entre os ésteres naturais mais importantes estão as gorduras (como banha, sebo e manteiga) e óleos (como linhaça, algodão e azeite de oliva), que são ésteres do álcool trihidroxílico glicerina, C 3 H 5 (OH) 3, com grandes ácidos carboxílicos, como o ácido palmítico, CH 3 (CH 2) 14 CO 2 H, ácido esteárico, CH 3 (CH 2) 16 CO 2 H e ácido oleico,\(\mathrm{CH_3(CH_2)_7CH=CH(CH_2)_7CO_2H}\). O ácido oleico é um ácido insaturado; contém uma ligação\(\mathrm{C=C}\) dupla. Os ácidos palmítico e esteárico são ácidos saturados que não contêm ligações duplas ou triplas.

Resumo
Os grupos funcionais relacionados ao grupo carbonil incluem o grupo —CHO de um aldeído, o grupo —CO— de uma cetona, o grupo —CO 2 H de um ácido carboxílico e o grupo —CO 2 R de um éster. O grupo carbonila, uma ligação dupla carbono-oxigênio, é a estrutura chave nessas classes de moléculas orgânicas: os aldeídos contêm pelo menos um átomo de hidrogênio ligado ao átomo de carbono carbonil, as cetonas contêm dois grupos de carbono ligados ao átomo de carbono carbonil, os ácidos carboxílicos contêm um grupo hidroxila ligado ao átomo de carbono carbonílico, e os ésteres contêm um átomo de oxigênio ligado a outro grupo de carbono conectado ao átomo de carbono carbonílico. Todos esses compostos contêm átomos de carbono oxidado em relação ao átomo de carbono de um grupo de álcool.
Glossário
- aldeído
- composto orgânico contendo um grupo carbonila ligado a dois átomos de hidrogênio ou um átomo de hidrogênio e um substituinte de carbono
- grupo carbonil
- átomo de carbono ligado duplamente a um átomo de oxigênio
- ácido carboxílico
- composto orgânico contendo um grupo carbonilo com um grupo hidroxila ligado
- éster
- composto orgânico contendo um grupo carbonila com um átomo de oxigênio ligado que está ligado a um substituinte de carbono
- cetona
- composto orgânico contendo um grupo carbonila com dois substituintes de carbono ligados a ele


