20.1: Hidrocarbonetos
- Page ID
- 184672
- Explicar a importância dos hidrocarbonetos e o motivo de sua diversidade
- Nomeie hidrocarbonetos saturados e insaturados e moléculas derivadas deles
- Descreva as reações características dos hidrocarbonetos saturados e insaturados
- Identificar isômeros estruturais e geométricos de hidrocarbonetos
O maior banco de dados 1 de compostos orgânicos lista cerca de 10 milhões de substâncias, que incluem compostos originários de organismos vivos e aqueles sintetizados por químicos. O número de compostos orgânicos em potencial foi estimado em 2 em 10 60 - um número astronomicamente alto. A existência de tantas moléculas orgânicas é uma consequência da capacidade dos átomos de carbono de formar até quatro ligações fortes com outros átomos de carbono, resultando em cadeias e anéis de diversos tamanhos, formas e complexidades.
Os compostos orgânicos mais simples contêm apenas os elementos carbono e hidrogênio e são chamados de hidrocarbonetos. Embora sejam compostos por apenas dois tipos de átomos, há uma grande variedade de hidrocarbonetos porque eles podem consistir em diferentes comprimentos de cadeias, cadeias ramificadas e anéis de átomos de carbono, ou combinações dessas estruturas. Além disso, os hidrocarbonetos podem diferir nos tipos de ligações carbono-carbono presentes em suas moléculas. Muitos hidrocarbonetos são encontrados em plantas, animais e seus fósseis; outros hidrocarbonetos foram preparados em laboratório. Usamos hidrocarbonetos todos os dias, principalmente como combustíveis, como gás natural, acetileno, propano, butano e os principais componentes da gasolina, diesel e óleo para aquecimento. Os conhecidos plásticos polietileno, polipropileno e poliestireno também são hidrocarbonetos. Podemos distinguir vários tipos de hidrocarbonetos por diferenças na ligação entre átomos de carbono. Isso leva a diferenças nas geometrias e na hibridização dos orbitais de carbono.
Alcanos
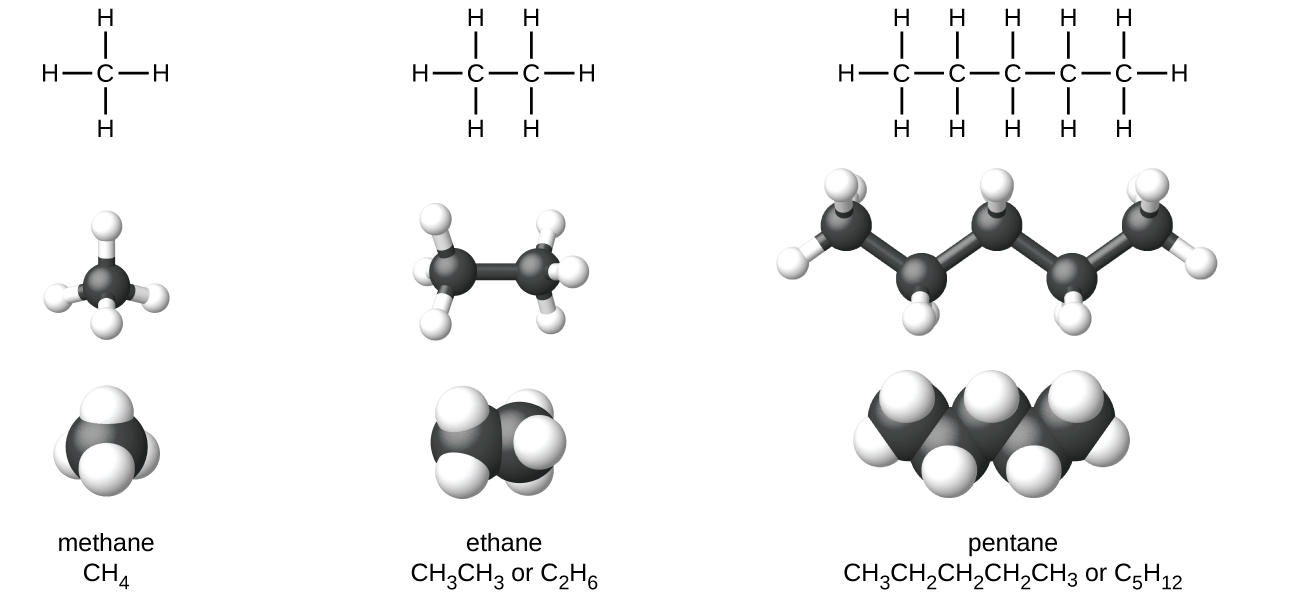
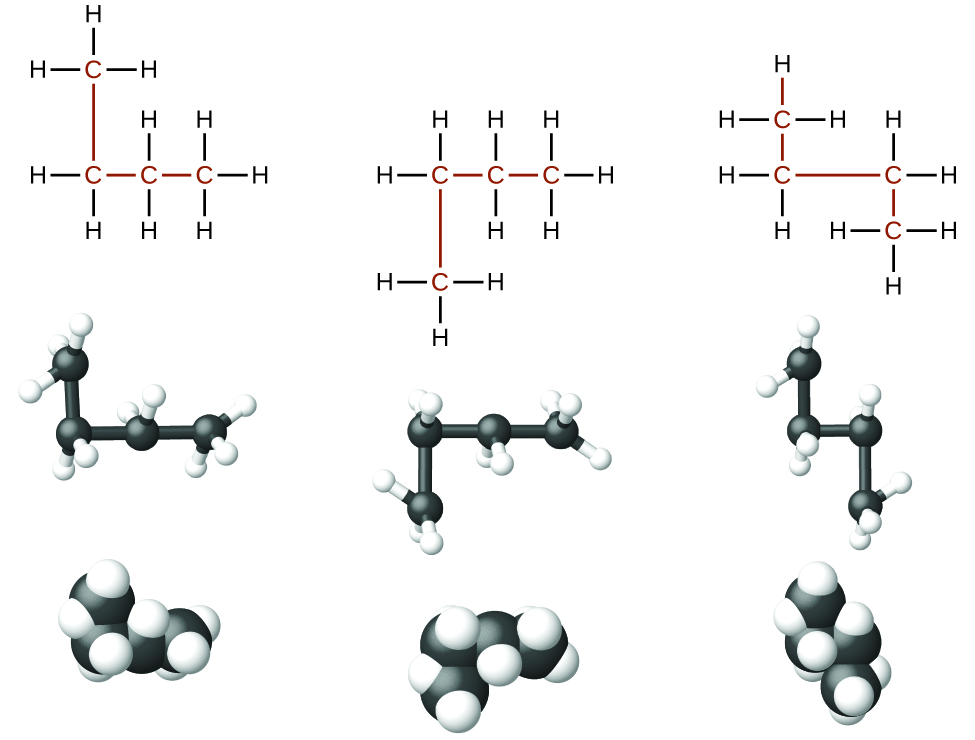
Os alcanos, ou hidrocarbonetos saturados, contêm apenas ligações covalentes simples entre átomos de carbono. Cada um dos átomos de carbono em um alcano tem orbitais híbridos sp 3 e está ligado a outros quatro átomos, cada um dos quais é carbono ou hidrogênio. As estruturas e modelos de Lewis de metano, etano e pentano são ilustrados na Figura\(\PageIndex{1}\). As cadeias de carbono geralmente são traçadas como linhas retas nas estruturas de Lewis, mas é preciso lembrar que as estruturas de Lewis não se destinam a indicar a geometria das moléculas. Observe que os átomos de carbono nos modelos estruturais (os modelos de bola e bastão e preenchimento de espaço) da molécula de pentano não estão em uma linha reta. Por causa da hibridização sp 3, os ângulos de ligação nas cadeias de carbono são próximos a 109,5°, dando a essas cadeias em um alcano uma forma de ziguezague.
As estruturas dos alcanos e outras moléculas orgânicas também podem ser representadas de forma menos detalhada por fórmulas estruturais condensadas (ou simplesmente fórmulas condensadas). Em vez do formato usual para fórmulas químicas em que cada símbolo de elemento aparece apenas uma vez, uma fórmula condensada é escrita para sugerir a ligação na molécula. Essas fórmulas têm a aparência de uma estrutura de Lewis da qual a maioria ou todos os símbolos de ligação foram removidos. As fórmulas estruturais condensadas para etano e pentano são mostradas na parte inferior da Figura\(\PageIndex{1}\), e vários exemplos adicionais são fornecidos nos exercícios no final deste capítulo.
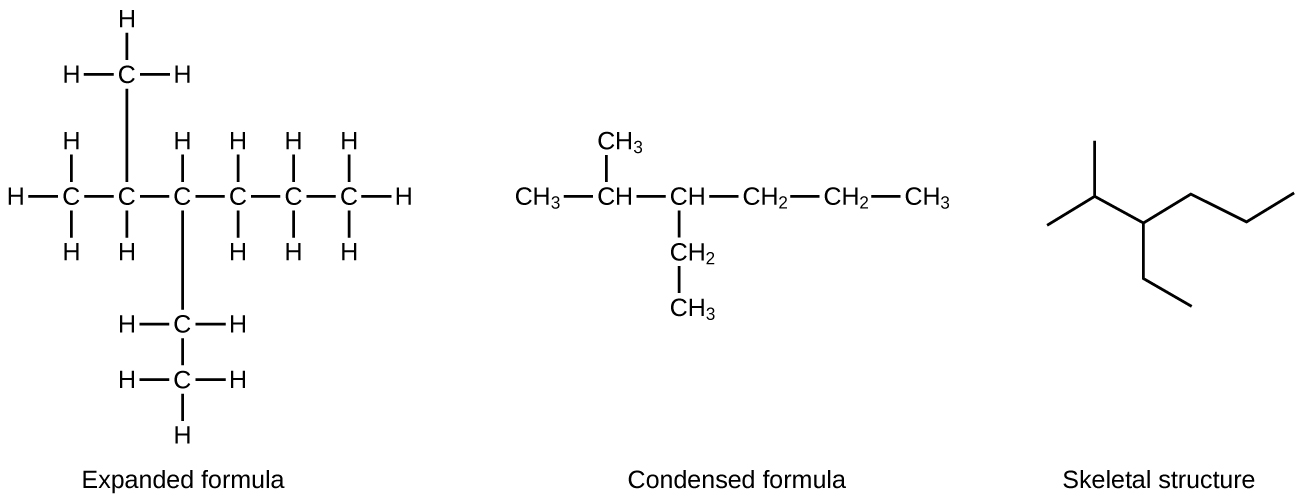
Um método comum usado por químicos orgânicos para simplificar os desenhos de moléculas maiores é usar uma estrutura esquelética (também chamada de estrutura de ângulo linear). Nesse tipo de estrutura, os átomos de carbono não são simbolizados com um C, mas representados por cada extremidade de uma linha ou curva em uma linha. Os átomos de hidrogênio não são extraídos se estiverem ligados a um carbono. Outros átomos além do carbono e do hidrogênio são representados por seus símbolos elementares. A figura\(\PageIndex{2}\) mostra três maneiras diferentes de desenhar a mesma estrutura.
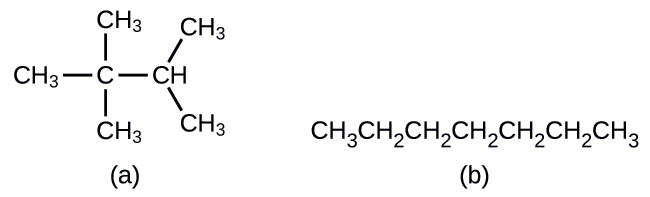
Desenhando estruturas esqueléticas Desenhe as estruturas esqueléticas para essas duas moléculas:
Solução
Cada átomo de carbono é convertido no final de uma linha ou no local onde as linhas se cruzam. Todos os átomos de hidrogênio ligados aos átomos de carbono são deixados de fora da estrutura (embora ainda precisemos reconhecer que eles estão lá):
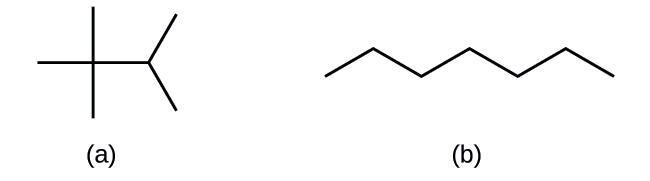
Desenhe as estruturas esqueléticas para essas duas moléculas:

- Resposta
-

Em a, um hexágono com um vértice na parte superior é mostrado. O vértice logo à direita tem um segmento de linha anexado que se estende para cima e para a direita. Em b, um padrão em zigue-zague é mostrado no qual os segmentos de linha sobem, descem, sobem, descem e sobem movendo-se da esquerda para a direita.
Interpretando estruturas esqueléticas Identifique a fórmula química da molécula representada aqui:
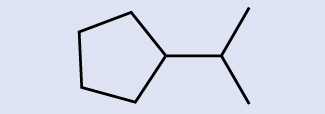
Solução
Há oito lugares onde as linhas se cruzam ou terminam, o que significa que há oito átomos de carbono na molécula. Como sabemos que os átomos de carbono tendem a fazer quatro ligações, cada átomo de carbono terá o número de átomos de hidrogênio necessários para quatro ligações. Este composto contém 16 átomos de hidrogênio para uma fórmula molecular de C 8 H 16.
Localização dos átomos de hidrogênio:
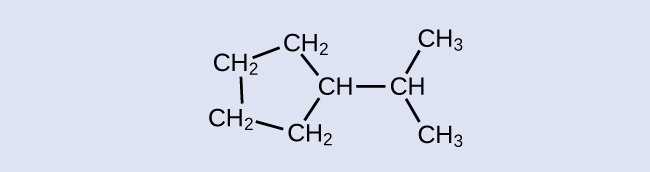
Identifique a fórmula química da molécula representada aqui:
- Resposta
-
C 9 H 20
Todos os alcanos são compostos de átomos de carbono e hidrogênio e têm ligações, estruturas e fórmulas semelhantes; todos os alcanos não cíclicos têm uma fórmula de C n H 2n +2. O número de átomos de carbono presentes em um alcano não tem limite. Um maior número de átomos nas moléculas levará a atrações intermoleculares mais fortes (forças de dispersão) e propriedades físicas correspondentemente diferentes das moléculas. Propriedades como ponto de fusão e ponto de ebulição (Tabela\(\PageIndex{1}\)) geralmente mudam de forma suave e previsível à medida que o número de átomos de carbono e hidrogênio nas moléculas muda.
| Alcano | Fórmula molecular | Ponto de fusão (° C) | Ponto de ebulição (°C) | Fase na STP 4 | Número de isômeros estruturais |
|---|---|---|---|---|---|
| metano | CH 4 | —182,5 | —161,5 | gás | 1 |
| etano | C 2 H 6 | —183,3 | —88,6 | gás | 1 |
| propano | C 3 H 8 | —187,7 | —42,1 | gás | 1 |
| butano | C 4 H 10 | —138,3 | —0,5 | gás | 2 |
| pentano | C 5 H 12 | —129,7 | 36,1 | líquido | 3 |
| hexano | C 6 H 14 | —95,3 | 68,7 | líquido | 5 |
| heptano | C 7 H 16 | —90,6 | 98,4 | líquido | 9 |
| octano | C 8 H 18 | —56,8 | 125,7 | líquido | 18 |
| nonane | C 9 H 20 | —53,6 | 150,8 | líquido | 35 |
| decano | C 10 H 22 | —29,7 | 174,0 | líquido | 75 |
| tetradecano | C 14 H 30 | 5.9 | 253,5 | sólido | 1858 |
| octadecano | C 18 H 38 | 28.2 | 316,1 | sólido | 60.523 |
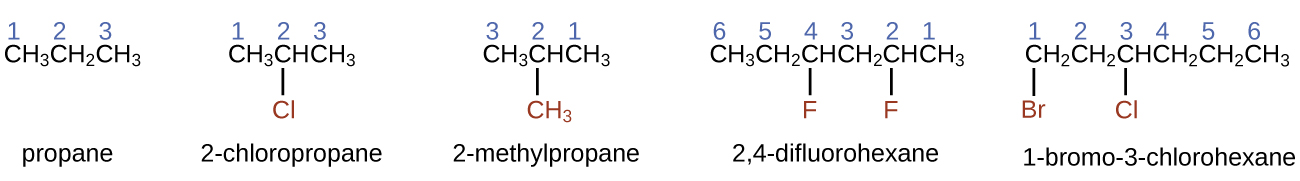
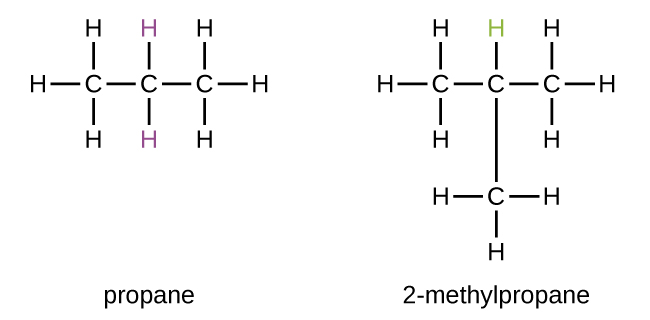
Hidrocarbonetos com a mesma fórmula, incluindo alcanos, podem ter estruturas diferentes. Por exemplo, dois alcanos têm a fórmula C 4 H 10: Eles são chamados de n-butano e 2-metilpropano (ou isobutano) e têm as seguintes estruturas de Lewis:
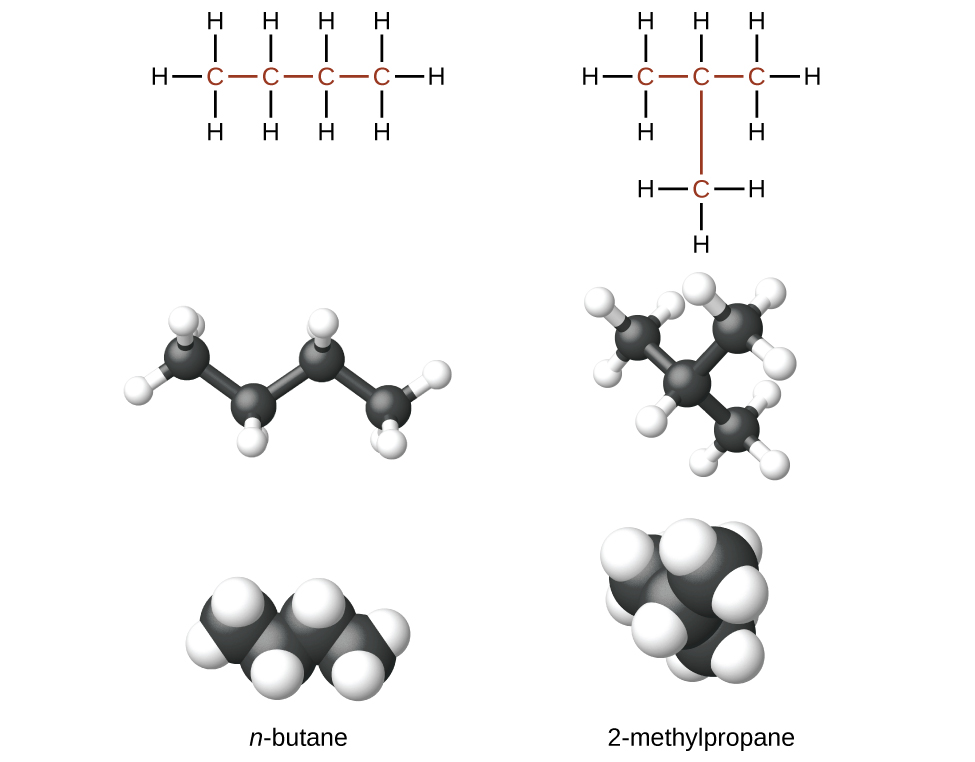
Os compostos n-butano e 2-metilpropano são isômeros estruturais (o termo isômeros constitucionais também é comumente usado). Os isômeros constitucionais têm a mesma fórmula molecular, mas diferentes arranjos espaciais dos átomos em suas moléculas. A molécula de n-butano contém uma cadeia não ramificada, o que significa que nenhum átomo de carbono está ligado a mais de dois outros átomos de carbono. Usamos o termo normal, ou o prefixo n, para nos referirmos a uma cadeia de átomos de carbono sem ramificação. O composto 2-metilpropano tem uma cadeia ramificada (o átomo de carbono no centro da estrutura de Lewis está ligado a três outros átomos de carbono)
Identificar isômeros das estruturas de Lewis não é tão fácil quanto parece. Estruturas de Lewis que parecem diferentes podem, na verdade, representar os mesmos isômeros. Por exemplo,\(\PageIndex{3}\) todas as três estruturas na Figura representam a mesma molécula, o n-butano, e, portanto, não são isômeros diferentes. Eles são idênticos porque cada um contém uma cadeia não ramificada de quatro átomos de carbono.
Noções básicas da nomenclatura orgânica: nomenclatura de alcanos
A União Internacional de Química Pura e Aplicada (IUPAC) criou um sistema de nomenclatura que começa com os nomes dos alcanos e pode ser ajustado a partir daí para dar conta de estruturas mais complicadas. A nomenclatura dos alcanos é baseada em duas regras:
- Para nomear um alcano, primeiro identifique a cadeia mais longa de átomos de carbono em sua estrutura. Uma cadeia de dois carbonos é chamada de etano; uma cadeia de três carbonos, propano; e uma cadeia de quatro carbonos, butano. Cadeias mais longas são denominadas da seguinte forma: pentano (cadeia de cinco carbonos), hexano (6), heptano (7), octano (8), nonano (9) e decano (10). Esses prefixos podem ser vistos nos nomes dos alcanos descritos na Tabela\(\PageIndex{1}\).
- Adicione prefixos ao nome da cadeia mais longa para indicar as posições e os nomes dos substituintes. Os substituintes são ramos ou grupos funcionais que substituem os átomos de hidrogênio em uma cadeia. A posição de um substituinte ou ramo é identificada pelo número do átomo de carbono ao qual ele está ligado na cadeia. Numeramos os átomos de carbono na cadeia contando a partir da extremidade da cadeia mais próxima dos substituintes. Vários substituintes são nomeados individualmente e colocados em ordem alfabética na frente do nome.
Quando mais de um substituinte está presente, seja no mesmo átomo de carbono ou em átomos de carbono diferentes, os substituintes são listados em ordem alfabética. Como a numeração dos átomos de carbono começa na extremidade mais próxima de um substituinte, a cadeia mais longa de átomos de carbono é numerada de forma a produzir o menor número para os substituintes. A terminação -o substitui -ide no final do nome de um substituinte eletronegativo (em compostos iônicos, o íon carregado negativamente termina com -ide como cloreto; em compostos orgânicos, esses átomos são tratados como substituintes e a terminação -o é usada). O número de substituintes do mesmo tipo é indicado pelos prefixos di- (dois), tri- (três), tetra- (quatro) e assim por diante (por exemplo, difluoro- indica dois substituintes de flúor).
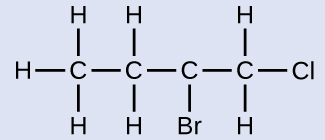
Nomeie a molécula cuja estrutura é mostrada aqui:
Solução
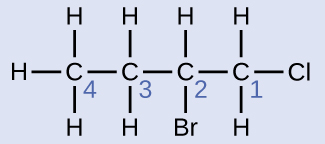
A cadeia de quatro carbonos é numerada do final com o átomo de cloro. Isso coloca os substituintes nas posições 1 e 2 (a numeração do outro lado colocaria os substituintes nas posições 3 e 4). Quatro átomos de carbono significam que o nome básico desse composto será butano. O bromo na posição 2 será descrito adicionando 2-bromo-; isso virá no início do nome, já que bromo- vem antes do cloro- em ordem alfabética. O cloro na posição 1 será descrito pela adição de 1-cloro-, resultando no nome da molécula sendo 2-bromo-1-clorobutano.
Nomeie a seguinte molécula:
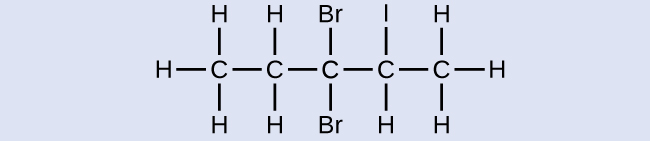
- Resposta
-
3,3-dibromo-2-iodopentano
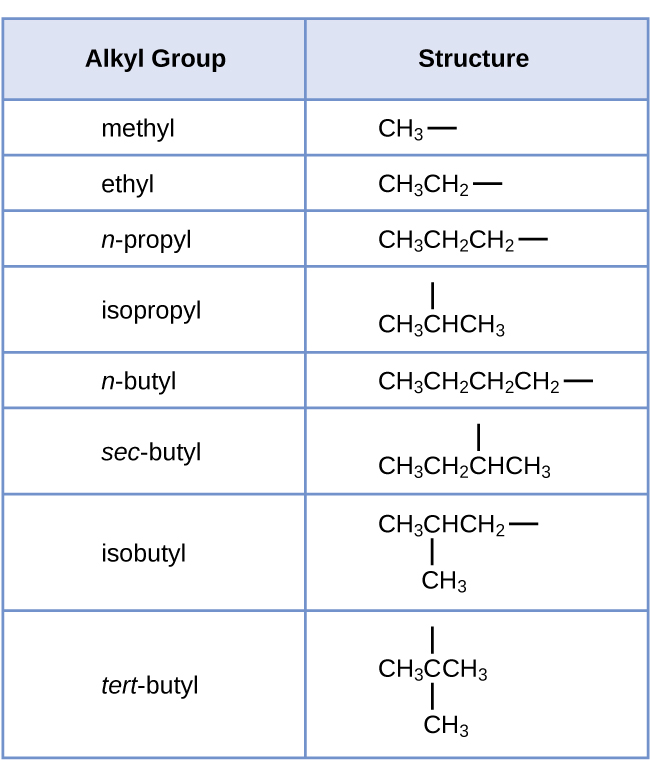
Chamamos um substituinte que contém um hidrogênio a menos que o alcano correspondente de grupo alquil. O nome de um grupo alquil é obtido eliminando o sufixo -ane do nome do alcano e adicionando -yl:
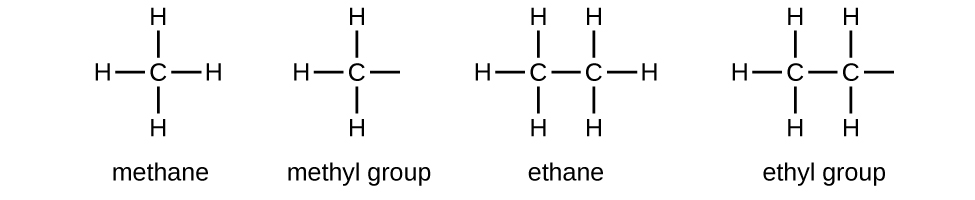
As ligações abertas nos grupos metil e etil indicam que esses grupos alquil estão ligados a outro átomo.
Nomeie a molécula cuja estrutura é mostrada aqui:
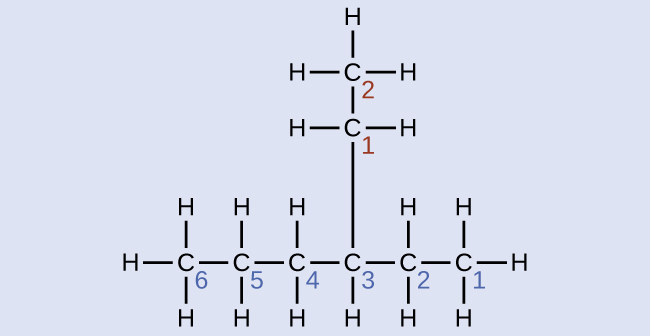
Solução
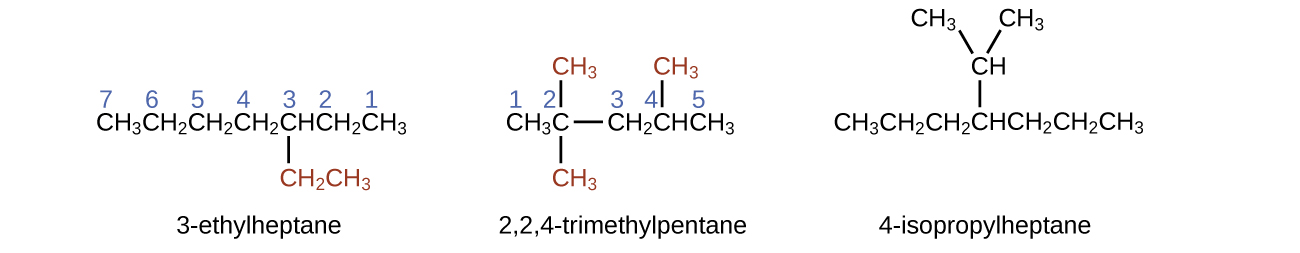
A cadeia de carbono mais longa percorre horizontalmente a página e contém seis átomos de carbono (isso torna a base do nome hexano, mas também precisaremos incorporar o nome do ramo). Nesse caso, queremos numerar da direita para a esquerda (conforme mostrado pelos números azuis) para que a ramificação seja conectada ao carbono 3 (imagine os números da esquerda para a direita — isso colocaria a ramificação no carbono 4, violando nossas regras). O ramo ligado à posição 3 de nossa cadeia contém dois átomos de carbono (numerados em vermelho) - então usamos nosso nome para dois carbonos eth- e anexamos -yl no final para significar que estamos descrevendo um ramo. Juntando todas as peças, essa molécula é 3-etil-hexano.
Nomeie a seguinte molécula:

- Resposta
-
4-propiloctano
Alguns hidrocarbonetos podem formar mais de um tipo de grupo alquil quando os átomos de hidrogênio que seriam removidos têm “ambientes” diferentes na molécula. Essa diversidade de possíveis grupos alquil pode ser identificada da seguinte maneira: Os quatro átomos de hidrogênio em uma molécula de metano são equivalentes; todos eles têm o mesmo ambiente. Eles são equivalentes porque cada um está ligado a um átomo de carbono (o mesmo átomo de carbono) que está ligado a três átomos de hidrogênio. (Pode ser mais fácil ver a equivalência nos modelos de bola e bastão na Figura\(\PageIndex{3}\). A remoção de qualquer um dos quatro átomos de hidrogênio do metano forma um grupo metil. Da mesma forma, os seis átomos de hidrogênio no etano são equivalentes e a remoção de qualquer um desses átomos de hidrogênio produz um grupo etil. Cada um dos seis átomos de hidrogênio está ligado a um átomo de carbono que está ligado a dois outros átomos de hidrogênio e a um átomo de carbono. No entanto, tanto no propano quanto no 2-metilpropano, existem átomos de hidrogênio em dois ambientes diferentes, diferenciados pelos átomos ou grupos de átomos adjacentes:
Observe que os grupos alquil não existem como entidades independentes estáveis. Eles sempre fazem parte de alguma molécula maior. A localização de um grupo alquil em uma cadeia de hidrocarbonetos é indicada da mesma forma que qualquer outro substituinte:
Os alcanos são moléculas relativamente estáveis, mas o calor ou a luz ativarão reações que envolvem a quebra de ligações simples C—H ou C—C. A combustão é uma dessas reações:
\[\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(g) \nonumber \]
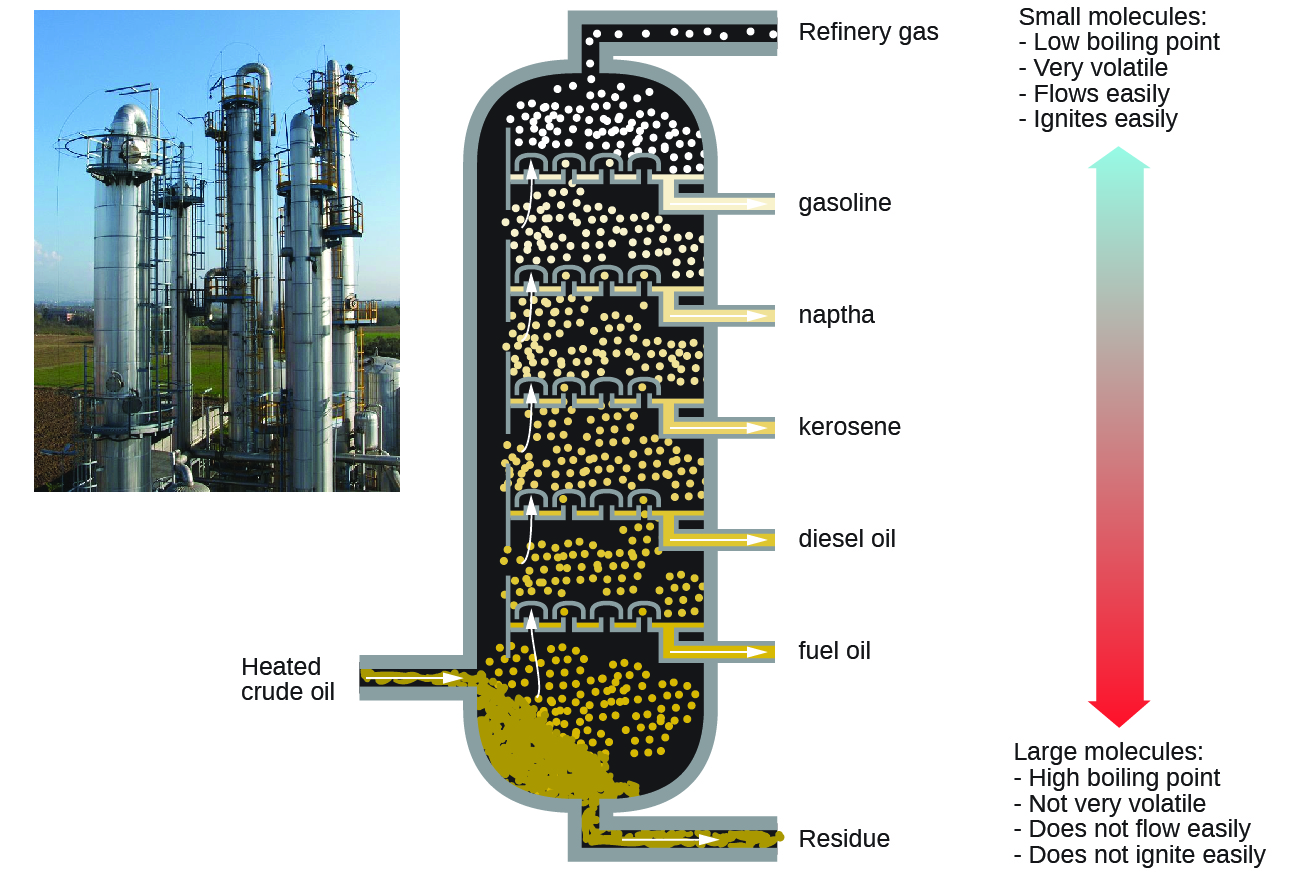
Os alcanos queimam na presença de oxigênio, uma reação de redução de oxidação altamente exotérmica que produz dióxido de carbono e água. Como consequência, os alcanos são excelentes combustíveis. Por exemplo, o metano, CH 4, é o principal componente do gás natural. O butano, C 4 H 10, usado em fogões e isqueiros de acampamento é um alcano. A gasolina é uma mistura líquida de alcanos de cadeia contínua e ramificada, cada um contendo de cinco a nove átomos de carbono, além de vários aditivos para melhorar seu desempenho como combustível. Querosene, óleo diesel e óleo combustível são principalmente misturas de alcanos com massas moleculares mais altas. A principal fonte desses combustíveis alcanos líquidos é o petróleo bruto, uma mistura complexa que é separada por destilação fracionada. A destilação fracionada aproveita as diferenças nos pontos de ebulição dos componentes da mistura (Figura\(\PageIndex{5}\)). Você deve se lembrar que o ponto de ebulição é uma função das interações intermoleculares, que foi discutida no capítulo sobre soluções e coloides.
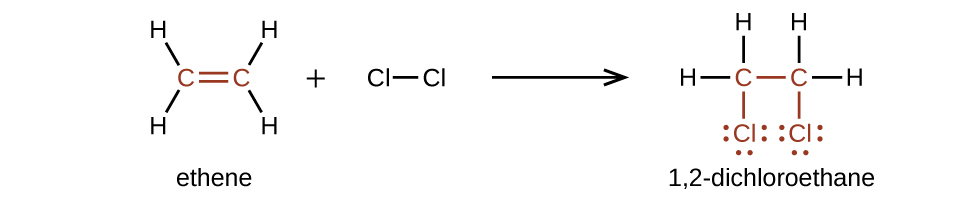
Em uma reação de substituição, outra reação típica de alcanos, um ou mais átomos de hidrogênio do alcano é substituído por um átomo ou grupo de átomos diferente. Nenhuma ligação carbono-carbono é quebrada nessas reações, e a hibridização dos átomos de carbono não muda. Por exemplo, a reação entre etano e cloro molecular descrita aqui é uma reação de substituição:
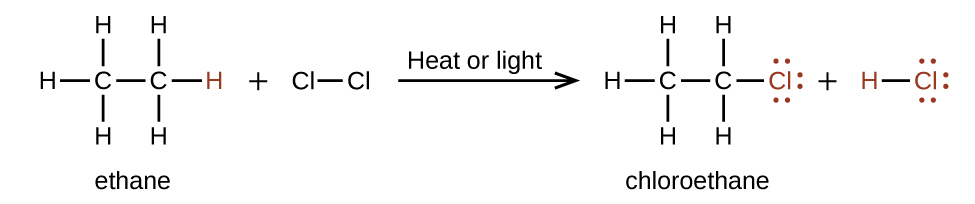
A porção C—Cl da molécula de cloroetano é um exemplo de um grupo funcional, a parte ou porção de uma molécula que transmite uma reatividade química específica. Os tipos de grupos funcionais presentes em uma molécula orgânica são os principais determinantes de suas propriedades químicas e são usados como um meio de classificar compostos orgânicos, conforme detalhado nas seções restantes deste capítulo.
Alcenos
Compostos orgânicos que contêm uma ou mais ligações duplas ou triplas entre átomos de carbono são descritos como insaturados. Você provavelmente já ouviu falar de gorduras insaturadas. São moléculas orgânicas complexas com longas cadeias de átomos de carbono, que contêm pelo menos uma ligação dupla entre átomos de carbono. As moléculas de hidrocarbonetos insaturados que contêm uma ou mais ligações duplas são chamadas de alcenos. Os átomos de carbono ligados por uma ligação dupla são unidos por duas ligações, uma ligação σ e uma ligação π. Ligações duplas e triplas dão origem a uma geometria diferente em torno do átomo de carbono que participa delas, levando a diferenças importantes na forma e propriedades moleculares. As diferentes geometrias são responsáveis pelas diferentes propriedades das gorduras insaturadas versus saturadas.
O eteno, C 2 H 4, é o alceno mais simples. Cada átomo de carbono no eteno, comumente chamado de etileno, tem uma estrutura plana trigonal. O segundo membro da série é propeno (propileno) (Figura\(\PageIndex{6}\)); os isômeros de buteno seguem na série. Quatro átomos de carbono na cadeia do buteno permitem a formação de isômeros com base na posição da ligação dupla, bem como em uma nova forma de isomerismo.
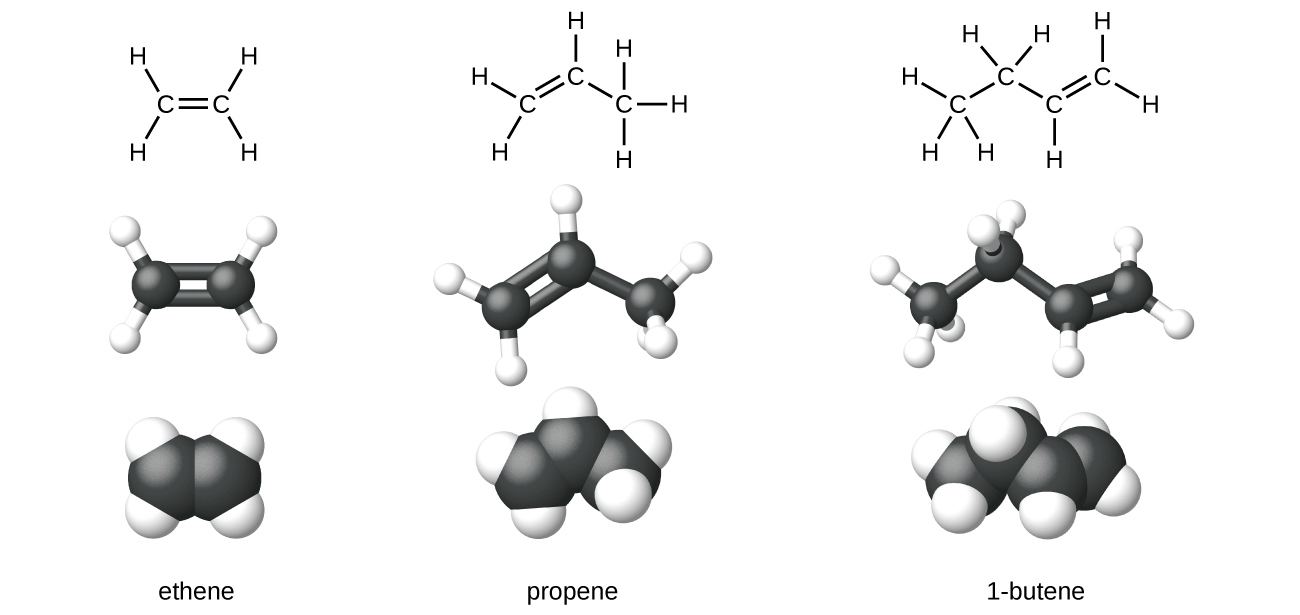
O etileno (o nome industrial comum para eteno) é uma matéria-prima básica na produção de polietileno e outros compostos importantes. Mais de 135 milhões de toneladas de etileno foram produzidas em todo o mundo em 2010 para uso nas indústrias de polímeros, petroquímicos e plásticos. O etileno é produzido industrialmente em um processo chamado craqueamento, no qual as longas cadeias de hidrocarbonetos em uma mistura de petróleo são divididas em moléculas menores.
Reciclagem de plásticos
Polímeros (das palavras gregas poli que significa “muitos” e mer significa “partes”) são moléculas grandes compostas por unidades repetidas, chamadas de monômeros. Os polímeros podem ser naturais (o amido é um polímero de resíduos de açúcar e as proteínas são polímeros de aminoácidos) ou sintéticos [como polietileno, cloreto de polivinil (PVC) e poliestireno]. A variedade de estruturas de polímeros se traduz em uma ampla gama de propriedades e usos que os tornam partes integrantes de nossas vidas diárias. Adicionar grupos funcionais à estrutura de um polímero pode resultar em propriedades significativamente diferentes (veja a discussão sobre o Kevlar mais adiante neste capítulo).
Um exemplo de reação de polimerização é mostrado na Figura\(\PageIndex{7}\). O monômero etileno (C 2 H 4) é um gás à temperatura ambiente, mas quando polimerizado, usando um catalisador de metal de transição, é transformado em um material sólido formado por longas cadeias de unidades —CH 2 chamadas polietileno. O polietileno é um plástico básico usado principalmente para embalagens (sacos e filmes).
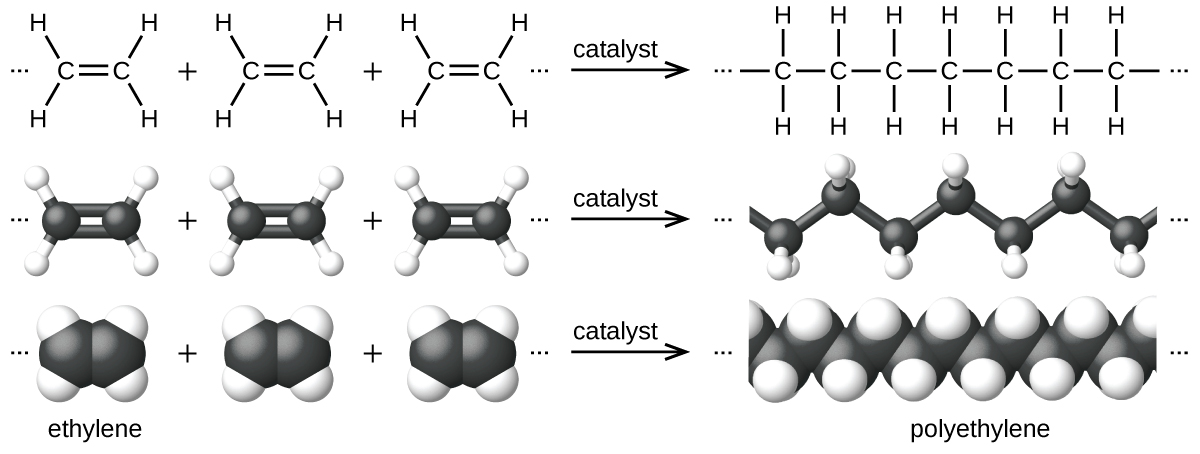
O polietileno é um membro de um subconjunto de polímeros sintéticos classificados como plásticos. Os plásticos são sólidos orgânicos sintéticos que podem ser moldados; eles são normalmente polímeros orgânicos com altas massas moleculares. A maioria dos monômeros que entram em plásticos comuns (etileno, propileno, cloreto de vinila, estireno e tereftalato de etileno) são derivados de produtos petroquímicos e não são muito biodegradáveis, tornando-os materiais candidatos à reciclagem. A reciclagem de plásticos ajuda a minimizar a necessidade de usar mais suprimentos petroquímicos e também minimiza os danos ambientais causados pelo descarte desses materiais não biodegradáveis.
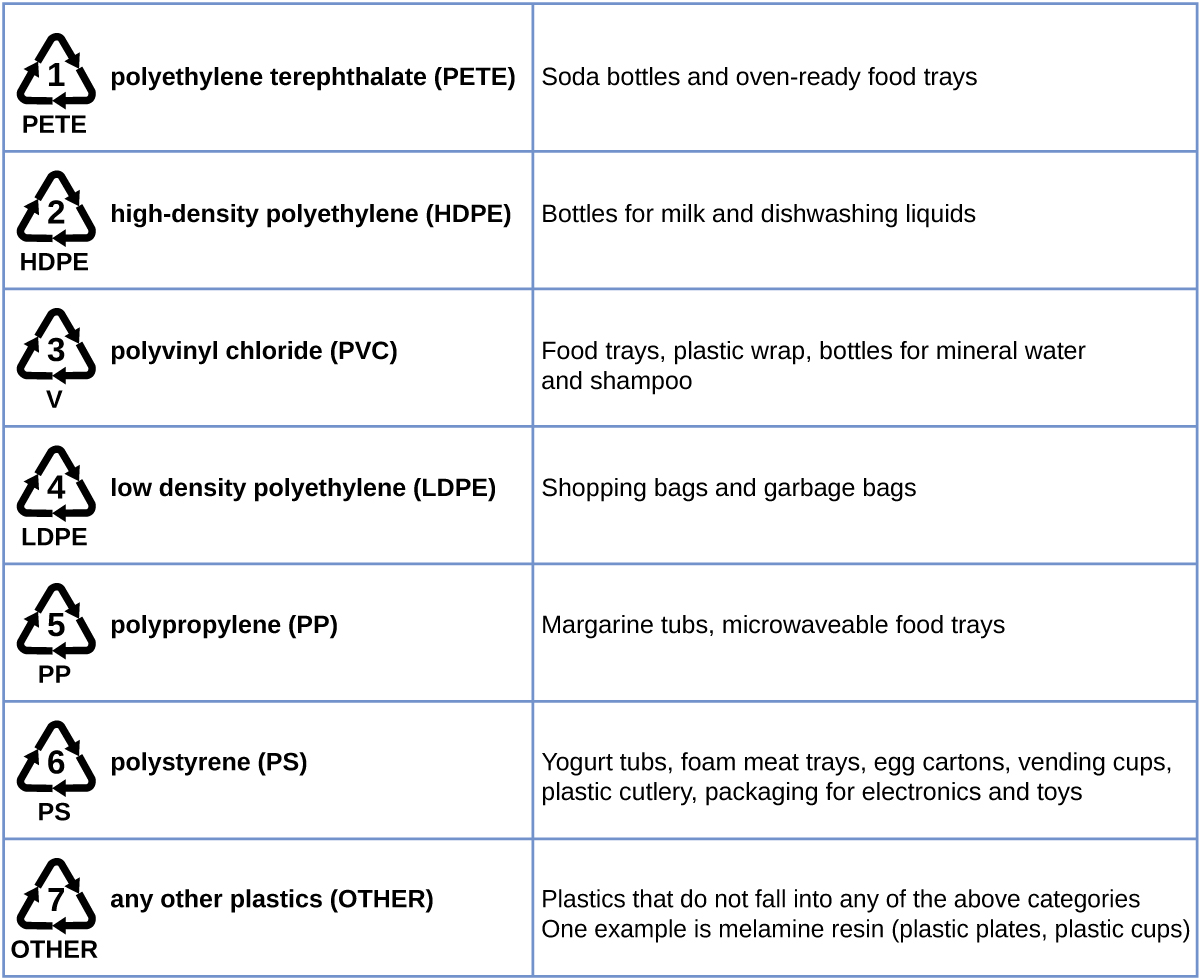
A reciclagem de plástico é o processo de recuperar resíduos, sucatas ou plásticos usados e reprocessar o material em produtos úteis. Por exemplo, o tereftalato de polietileno (garrafas de refrigerante) pode ser derretido e usado em móveis de plástico, tapetes ou outras aplicações. Outros plásticos, como polietileno (sacos) e polipropileno (copos, recipientes plásticos para alimentos), podem ser reciclados ou reprocessados para serem usados novamente. Muitas áreas do país têm programas de reciclagem que se concentram em um ou mais plásticos básicos aos quais foi atribuído um código de reciclagem (Figura\(\PageIndex{8}\)). Essas operações estão em vigor desde a década de 1970 e tornaram a produção de alguns plásticos uma das operações industriais mais eficientes da atualidade.
O nome de um alceno é derivado do nome do alcano com o mesmo número de átomos de carbono. A presença da ligação dupla é significada pela substituição do sufixo -ane pelo sufixo -ene. A localização da ligação dupla é identificada nomeando o menor dos números de átomos de carbono que participam da ligação dupla:
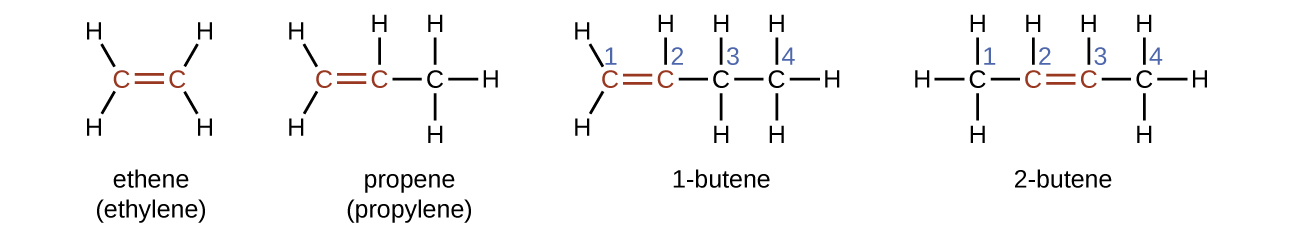
Isômeros de Alcenes
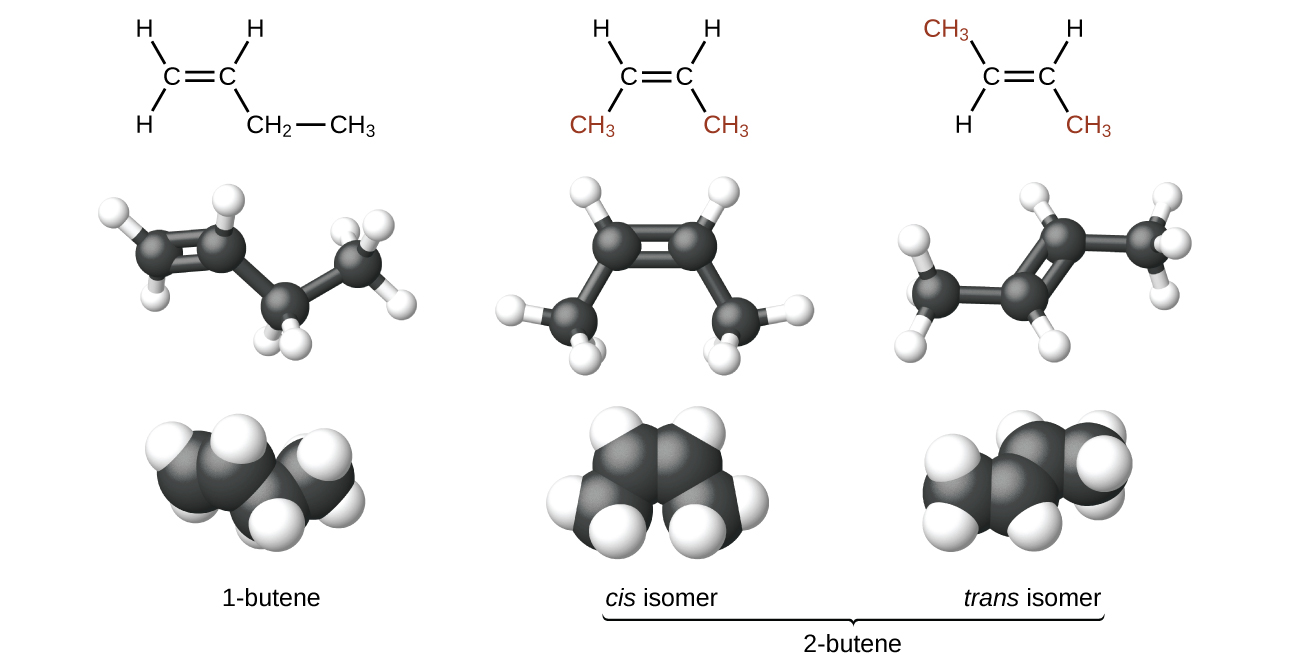
Moléculas de 1-buteno e 2-buteno são isômeros estruturais; a disposição dos átomos nessas duas moléculas é diferente. Como exemplo de diferenças de arranjo, o primeiro átomo de carbono em 1-buteno está ligado a dois átomos de hidrogênio; o primeiro átomo de carbono em 2-buteno está ligado a três átomos de hidrogênio.
O composto 2-buteno e alguns outros alcenos também formam um segundo tipo de isômero chamado isômero geométrico. Em um conjunto de isômeros geométricos, os mesmos tipos de átomos estão ligados uns aos outros na mesma ordem, mas as geometrias das duas moléculas são diferentes. Os isômeros geométricos dos alcenos diferem na orientação dos grupos em ambos os lados de uma\(\mathrm{C=C}\) ligação.
Os átomos de carbono são livres para girar em torno de uma única ligação, mas não em torno de uma ligação dupla; uma ligação dupla é rígida. Isso torna possível ter dois isômeros de 2-buteno, um com os dois grupos metil no mesmo lado da ligação dupla e outro com os grupos metil em lados opostos. Quando estruturas de buteno são desenhadas com ângulos de ligação de 120° em torno dos átomos de carbono hibridizado sp 2 que participam da ligação dupla, os isômeros são aparentes. O isômero 2-buteno no qual os dois grupos metil estão do mesmo lado é chamado de isômero cis; aquele em que os dois grupos metil estão em lados opostos é chamado de isômero trans (Figura\(\PageIndex{9}\)). As diferentes geometrias produzem propriedades físicas diferentes, como ponto de ebulição, que podem possibilitar a separação dos isômeros:
Os alcenos são muito mais reativos do que os alcanos porque a\(\mathrm{C=C}\) fração é um grupo funcional reativo. Uma ligação π, sendo uma ligação mais fraca, é interrompida com muito mais facilidade do que uma ligação σ. Assim, os alcenos sofrem uma reação característica na qual a ligação π é quebrada e substituída por duas ligações σ. Essa reação é chamada de reação de adição. A hibridização dos átomos de carbono na ligação dupla em um alceno muda de sp 2 para sp 3 durante uma reação de adição. Por exemplo, os halogênios se somam à ligação dupla em um alceno em vez de substituir o hidrogênio, como ocorre em um alcano:
Forneça os nomes da IUPAC para o reagente e o produto da reação de halogenação mostrados aqui:
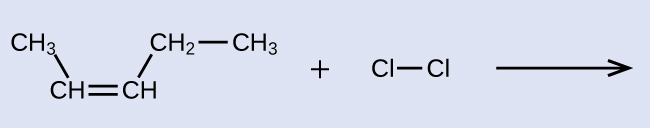
Solução
O reagente é uma cadeia de cinco carbonos que contém uma ligação dupla carbono-carbono, então o nome base será penteno. Começamos a contar na extremidade da cadeia mais próxima da ligação dupla - neste caso, da esquerda - a ligação dupla abrange os carbonos 2 e 3, então o nome se torna 2-penteno. Como existem dois grupos contendo carbono ligados aos dois átomos de carbono na ligação dupla - e eles estão do mesmo lado da ligação dupla - essa molécula é o isômero cis, fazendo o nome do alceno inicial cis -2-penteno. O produto da reação de halogenação terá dois átomos de cloro ligados aos átomos de carbono que faziam parte da ligação dupla carbono-carbono:
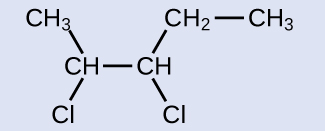
Essa molécula agora é um alcano substituído e será denominada como tal. A base do nome será pentano. Contaremos a partir do final que numera os átomos de carbono aos quais os átomos de cloro estão ligados como 2 e 3, fazendo com que o nome do produto seja 2,3-dicloropentano.
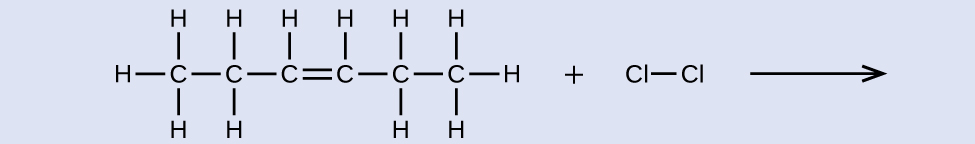
Forneça nomes para o reagente e o produto da reação mostrada:
- Resposta
-
reagente: cis-3-hexeno, produto: 3,4-diclorohexano
Alcinos
As moléculas de hidrocarbonetos com uma ou mais ligações triplas são chamadas de alcinos; elas formam outra série de hidrocarbonetos insaturados. Dois átomos de carbono unidos por uma ligação tripla são unidos por uma ligação σ e duas ligações π. Os carbonos hibridizados sp envolvidos na ligação tripla têm ângulos de ligação de 180°, dando a esses tipos de ligações uma forma linear semelhante a uma haste.
O membro mais simples da série alcina é o etino, C 2 H 2, comumente chamado de acetileno. A estrutura de Lewis para o etino, uma molécula linear, é:
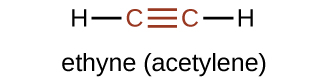
A nomenclatura IUPAC para alcinos é semelhante à dos alcenos, exceto que o sufixo -yne é usado para indicar uma ligação tripla na cadeia. Por exemplo,\(\mathrm{CH_3CH_2C≡CH}\) é chamado de 1-butino.
Descreva a geometria e a hibridização dos átomos de carbono na seguinte molécula:
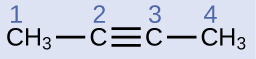
Solução
Os átomos de carbono 1 e 4 têm quatro ligações simples e, portanto, são tetraédricos com hibridização sp 3. Os átomos de carbono 2 e 3 estão envolvidos na ligação tripla, então eles têm geometrias lineares e seriam classificados como híbridos sp.
Identifique os ângulos de hibridação e ligação nos átomos de carbono na molécula mostrada:
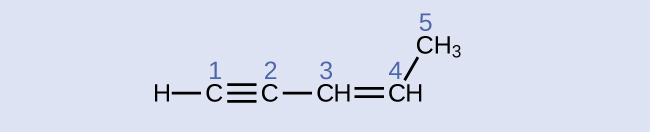
- Resposta
-
carbono 1: sp, 180°; carbono 2: sp, 180°; carbono 3: sp 2, 120°; carbono 4: sp 2, 120°; carbono 5: sp 3, 109,5°
Quimicamente, os alcinos são semelhantes aos alcenos. Como o grupo\(\mathrm{C≡C}\) funcional tem duas ligações π, os alcinos normalmente reagem ainda mais rapidamente e reagem com o dobro de reagente, além de reações adicionais. A reação do acetileno com o bromo é um exemplo típico:
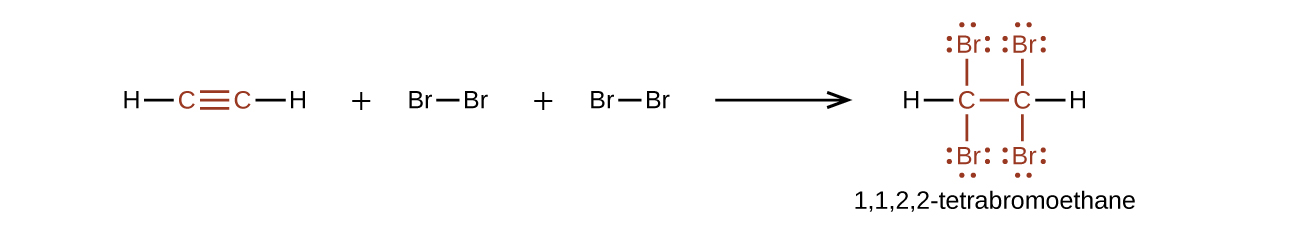
O acetileno e os outros alcinos também queimam rapidamente. Uma tocha de acetileno aproveita o alto calor de combustão do acetileno.
Hidrocarbonetos aromáticos
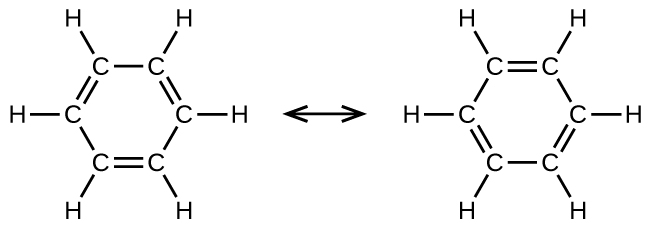
O benzeno, C 6 H 6, é o membro mais simples de uma grande família de hidrocarbonetos, chamados hidrocarbonetos aromáticos. Esses compostos contêm estruturas em anel e exibem ligações que devem ser descritas usando o conceito híbrido de ressonância da teoria da ligação de valência ou o conceito de deslocalização da teoria orbital molecular. (Para revisar esses conceitos, consulte os capítulos anteriores sobre ligação química). As estruturas de ressonância do benzeno, C 6 H 6, são:

Existem muitos derivados do benzeno. Os átomos de hidrogênio podem ser substituídos por muitos substituintes diferentes. Compostos aromáticos sofrem mais facilmente reações de substituição do que reações de adição; a substituição de um dos átomos de hidrogênio por outro substituinte deixará intactas as ligações duplas deslocalizadas. A seguir estão exemplos típicos de derivados de benzeno substituídos:
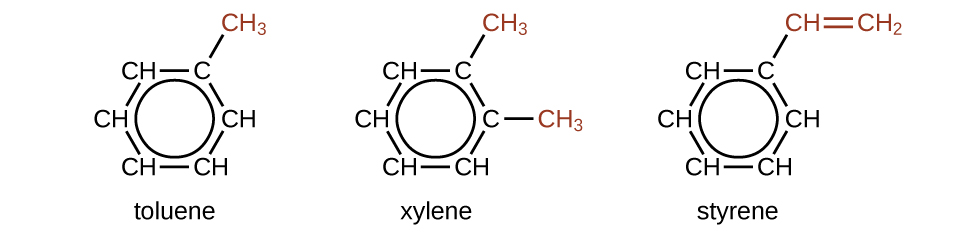
O tolueno e o xileno são solventes e matérias-primas importantes na indústria química. O estireno é usado para produzir o poliestireno polimérico.
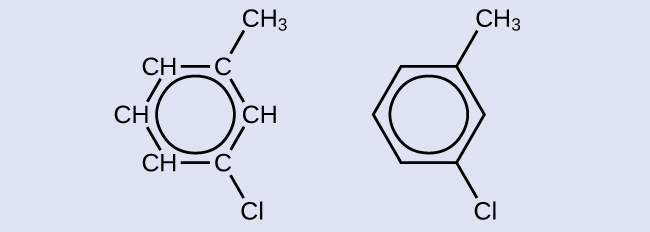
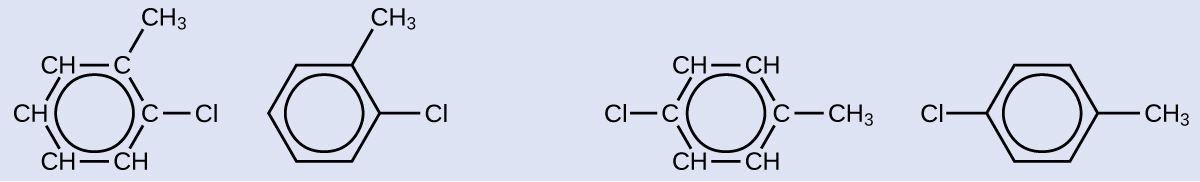
Um possível isômero criado por uma reação de substituição que substitui um átomo de hidrogênio ligado ao anel aromático de tolueno por um átomo de cloro é mostrado aqui. Desenhe dois outros isômeros possíveis nos quais o átomo de cloro substitui um átomo de hidrogênio diferente ligado ao anel aromático:
Solução
Como o anel de seis carbonos com ligações duplas alternadas é necessário para que a molécula seja classificada como aromática, isômeros apropriados só podem ser produzidos alterando as posições do cloro-substituinte em relação ao substituinte metil:
Desenhe três isômeros de um composto de anel aromático de seis membros substituído por dois bromos.
- Resposta
-
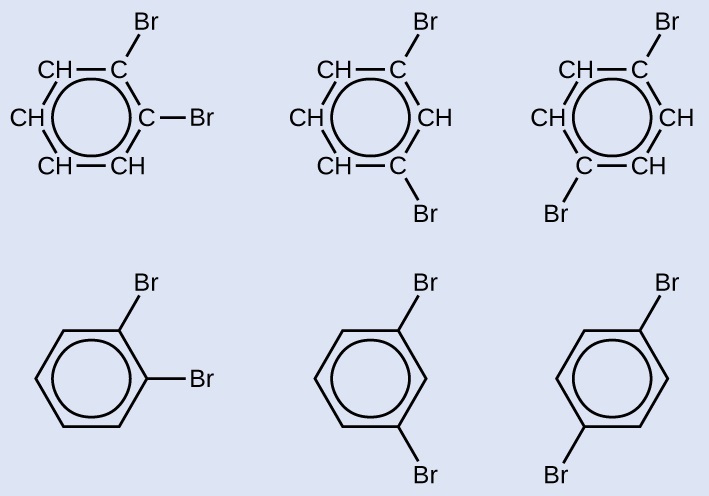
Três pares de fórmulas estruturais são mostrados. O primeiro tem um anel de seis hidrocarbonetos de carbono no qual quatro dos átomos de C estão cada um ligado a apenas um átomo de H. No canto superior direito e direito do anel, os dois átomos de C que não têm átomos H ligados têm um átomo B r ligado cada um. Um círculo está no centro do anel. Abaixo dessa estrutura, é mostrada uma estrutura semelhante que tem um hexágono com um círculo interno. Dos vértices do hexágono no canto superior direito e direito, átomos B r simples são conectados. O segundo tem um anel de seis hidrocarbonetos de carbono no qual quatro dos átomos de C estão cada um ligado a apenas um átomo de H. No canto superior direito e inferior direito do anel, os dois átomos de C que não têm átomos H ligados têm um único átomo B r ligado cada um. Um círculo está no centro do anel. Abaixo dessa estrutura, é mostrada uma estrutura semelhante que tem um hexágono com um círculo interno. Dos vértices do hexágono no canto superior direito e inferior direito, átomos B r simples são conectados. O terceiro tem um anel de seis hidrocarbonetos de carbono no qual quatro dos átomos de C estão cada um ligado a apenas um átomo de H. No canto superior direito e inferior esquerdo do anel, os dois átomos de C que não têm átomos de H ligados têm átomos B r ligados. Um círculo está no centro do anel. Abaixo dessa estrutura, é mostrada uma estrutura semelhante que tem um hexágono com um círculo interno. Dos vértices do hexágono no canto superior direito e inferior esquerdo, átomos B r únicos são conectados.
Resumo
Ligações fortes e estáveis entre átomos de carbono produzem moléculas complexas contendo cadeias, galhos e anéis. A química desses compostos é chamada de química orgânica. Os hidrocarbonetos são compostos orgânicos compostos apenas de carbono e hidrogênio. Os alcanos são hidrocarbonetos saturados, ou seja, hidrocarbonetos que contêm apenas ligações simples. Os alcenos contêm uma ou mais ligações duplas carbono-carbono. Os alcinos contêm uma ou mais ligações triplas carbono-carbono. Os hidrocarbonetos aromáticos contêm estruturas em anel com sistemas de elétrons π deslocalizados.
Notas de pé
- Esse é o banco de dados Beilstein, agora disponível no site da Reaxys (www.elsevier.com/online-tools/reaxys).
- Caramba, Mark. “Síntese orgânica: o robô-químico”, Nature 512 (2014): 20—2.
- As propriedades físicas de C 4 H 10 e moléculas mais pesadas são as do isômero normal, n -butano, n -pentano, etc.
- STP indica uma temperatura de 0 °C e uma pressão de 1 atm.
Glossário
- reação de adição
- reação na qual uma ligação dupla carbono-carbono forma uma única ligação carbono-carbono pela adição de um reagente. Reação típica de um alceno.
- alcano
- molécula que consiste apenas em átomos de carbono e hidrogênio conectados por ligações simples (σ)
- alceno
- molécula constituída por carbono e hidrogênio contendo pelo menos uma ligação dupla carbono-carbono
- grupo alquil
- substituinte, consistindo de um alcano sem um átomo de hidrogênio, ligado a uma estrutura maior
- alcino
- molécula constituída por carbono e hidrogênio contendo pelo menos uma ligação tripla carbono-carbono
- hidrocarboneto aromático
- molécula cíclica que consiste em carbono e hidrogênio com ligações simples e duplas alternadas deslocalizadas de carbono e carbono, resultando em maior estabilidade
- grupo funcional
- parte de uma molécula orgânica que transmite uma reatividade química específica à molécula
- composto orgânico
- composto natural ou sintético que contém carbono
- hidrocarboneto saturado
- molécula contendo carbono e hidrogênio que tem apenas ligações simples entre átomos de carbono
- estrutura esquelética
- método abreviado de desenhar moléculas orgânicas nas quais os átomos de carbono são representados pelas extremidades das linhas e curvas entre as linhas, e os átomos de hidrogênio ligados aos átomos de carbono não são mostrados (mas são entendidos como presentes pelo contexto da estrutura)
- substituinte
- ramo ou grupo funcional que substitui átomos de hidrogênio em uma cadeia maior de hidrocarbonetos
- reação de substituição
- reação na qual um átomo substitui outro em uma molécula


