19.3: Propriedades ópticas e magnéticas de compostos de coordenação
- Page ID
- 185227
- Descreva a premissa básica da teoria do campo cristalino (CFT)
- Identifique geometrias moleculares associadas a vários padrões de divisão do orbital d
- Preveja configurações eletrônicas de orbitais d divididos para átomos ou íons de metais de transição selecionados
- Explicar as propriedades espectrais e magnéticas em termos de conceitos de CFT
O comportamento dos compostos de coordenação não pode ser explicado adequadamente pelas mesmas teorias usadas para a química dos elementos do grupo principal. As geometrias observadas dos complexos de coordenação não são consistentes com orbitais hibridizados no metal central sobrepostos aos orbitais do ligante, como seria previsto pela teoria da ligação de valência. As cores observadas indicam que os orbitais d geralmente ocorrem em diferentes níveis de energia, em vez de todos serem degenerados, ou seja, de igual energia, assim como os três orbitais p. Para explicar as estabilidades, estruturas, cores e propriedades magnéticas dos complexos de metais de transição, um modelo de ligação diferente foi desenvolvido. Assim como a teoria da ligação de valência explica muitos aspectos da ligação na química do grupo principal, a teoria do campo cristalino é útil para entender e prever o comportamento dos complexos de metais de transição.
Teoria do campo de crist
Para explicar o comportamento observado dos complexos de metais de transição (como a forma como as cores surgem), um modelo envolvendo interações eletrostáticas entre os elétrons dos ligantes e os elétrons nos orbitais d não hibridizados do átomo central de metal foi desenvolvido. Este modelo eletrostático é a teoria do campo cristalino (CFT). Isso nos permite entender, interpretar e prever as cores, o comportamento magnético e algumas estruturas de compostos de coordenação dos metais de transição.
O CFT se concentra nos elétrons não ligados ao íon metálico central em complexos de coordenação, não nas ligações metal-ligante. Como a teoria do vínculo de valência, o CFT conta apenas parte da história do comportamento dos complexos. No entanto, diz a parte que a teoria do vínculo de valência não. Em sua forma pura, o CFT ignora qualquer ligação covalente entre ligantes e íons metálicos. Tanto o ligante quanto o metal são tratados como cargas pontuais infinitesimalmente pequenas.
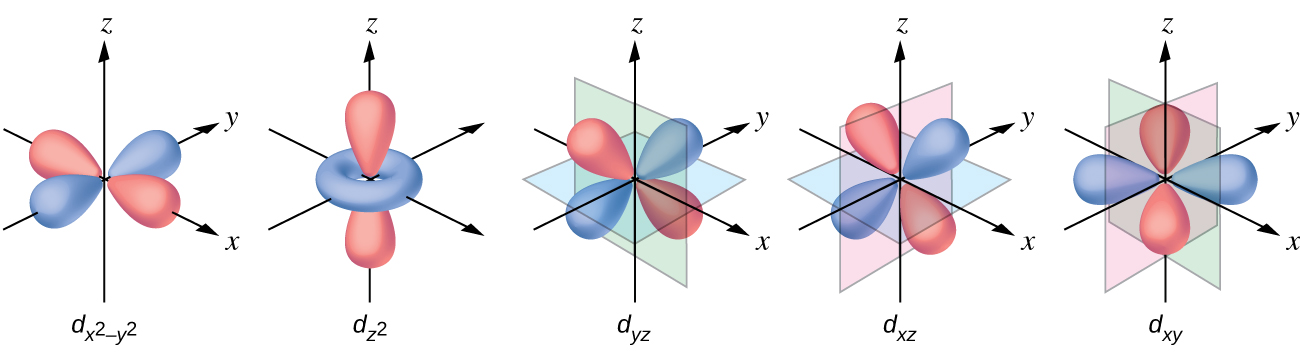
Todos os elétrons são negativos, então os elétrons doados pelos ligantes repelirão os elétrons do metal central. Vamos considerar o comportamento dos elétrons nos orbitais d não hibridizados em um complexo octaédrico. Os cinco orbitais d consistem em regiões em forma de lóbulo e estão dispostos no espaço, conforme mostrado na Figura\(\PageIndex{1}\). Em um complexo octaédrico, os seis ligantes se coordenam ao longo dos eixos.
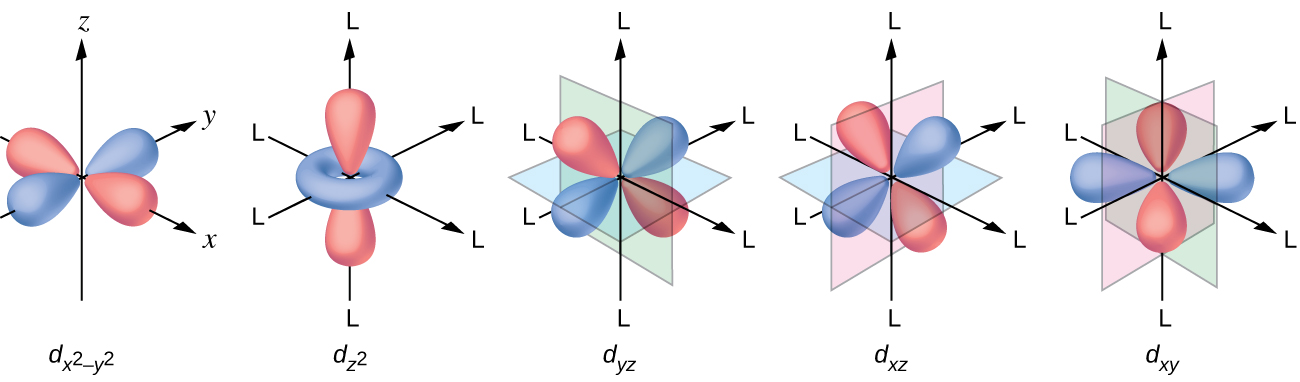
Em um íon metálico não complexado na fase gasosa, os elétrons são distribuídos entre os cinco orbitais d de acordo com a regra de Hund porque todos os orbitais têm a mesma energia. No entanto, quando os ligantes se coordenam com um íon metálico, as energias dos orbitais d não são mais as mesmas.
Em complexos octaédricos, os lóbulos em dois dos cinco orbitais d, os\(d_{x^2−y^2}\) orbitais\(d_{z^2}\) e, apontam para os ligantes (Figura\(\PageIndex{1}\)). Esses dois orbitais são chamados de orbitais e g (o símbolo na verdade se refere à simetria dos orbitais, mas vamos usá-lo como um nome conveniente para esses dois orbitais em um complexo octaédrico). Os outros três orbitais, os orbitais d xy, d xz e d yz, têm lóbulos que apontam entre os ligantes e são chamados de orbitais t 2 g (novamente, o símbolo realmente se refere à simetria dos orbitais). Quando seis ligantes se aproximam do íon metálico ao longo dos eixos do octaedro, suas cargas pontuais repelem os elétrons nos orbitais d do íon metálico. No entanto, as repulsões entre os elétrons nos orbitais\(d_{z^2}\) e g (os\(d_{x^2−y^2}\) orbitais e) e os ligantes são maiores do que as repulsões entre os elétrons nos orbitais t 2 g (o d zy, orbitais d, xz e d yz) e os ligantes. Isso ocorre porque os lóbulos dos orbitais e g apontam diretamente para os ligantes, enquanto os lóbulos dos orbitais t 2 g apontam entre eles. Assim, os elétrons nos orbitais e g do íon metálico em um complexo octaédrico têm energias potenciais mais altas do que as dos elétrons nos orbitais t 2 g. A diferença de energia pode ser representada conforme mostrado na Figura\(\PageIndex{2}\).
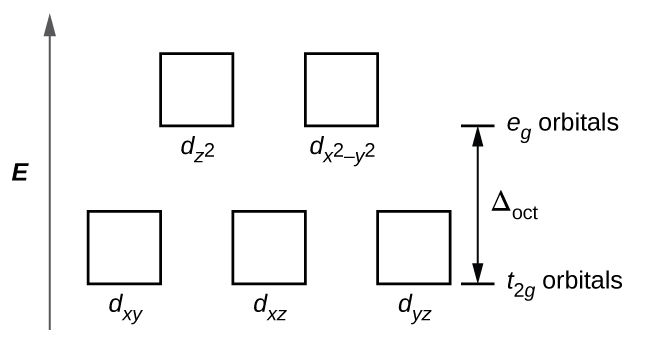
A diferença de energia entre os orbitais e g e t 2 g é chamada de divisão do campo cristalino e é simbolizada por Δoct, onde oct significa octaédrico.
A magnitude de Δoct depende de muitos fatores, incluindo a natureza dos seis ligantes localizados ao redor do íon metálico central, a carga no metal e se o metal está usando orbitais de 3 d, 4 d ou 5 d. Ligantes diferentes produzem diferentes divisões do campo cristalino. A crescente divisão do campo cristalino produzida pelos ligantes é expressa na série espectroquímica, cuja versão curta é dada aqui:
\[\large \underset{\textrm{a few ligands of the spectrochemical series, in order of increasing field strength of the ligand}}{\xrightarrow{\ce{I- <Br- <Cl- <F- <H2O<C2O4^2- <NH3<\mathit{en}<NO2- <CN-}}} \nonumber \]
Nesta série, os ligantes à esquerda causam pequenas divisões no campo cristalino e são ligantes de campo fraco, enquanto os da direita causam divisões maiores e são ligantes de campo forte. Assim, o valor de Δoct para um complexo octaédrico com ligantes de iodeto (I −) é muito menor do que o valor de Δoct para o mesmo metal com ligantes de cianeto (CN −).
Os elétrons nos orbitais d seguem o princípio de aufbau (“preenchimento”), que diz que os orbitais serão preenchidos para fornecer a menor energia total, assim como na química do grupo principal. Quando dois elétrons ocupam o mesmo orbital, cargas similares se repelem. A energia necessária para emparelhar dois elétrons em um único orbital é chamada de energia de emparelhamento (P). Os elétrons sempre ocuparão individualmente cada orbital em um conjunto degenerado antes do emparelhamento. P é semelhante em magnitude a Δoct. Quando os elétrons preenchem os orbitais d, as magnitudes relativas de Δoct e P determinam quais orbitais serão ocupados.
Em [Fe (CN) 6] 4−, o forte campo de seis ligantes de cianeto produz um grande Δoct. Sob essas condições, os elétrons precisam de menos energia para emparelhar do que precisam para serem excitados com os orbitais e g (Δoct > P). Os seis elétrons 3 d do par de íons Fe 2 + nos três orbitais t 2 g (Figura\(\PageIndex{3}\)). Os complexos nos quais os elétrons estão emparelhados devido à grande divisão do campo cristalino são chamados de complexos de baixa rotação porque o número de elétrons não pareados (spins) é minimizado.
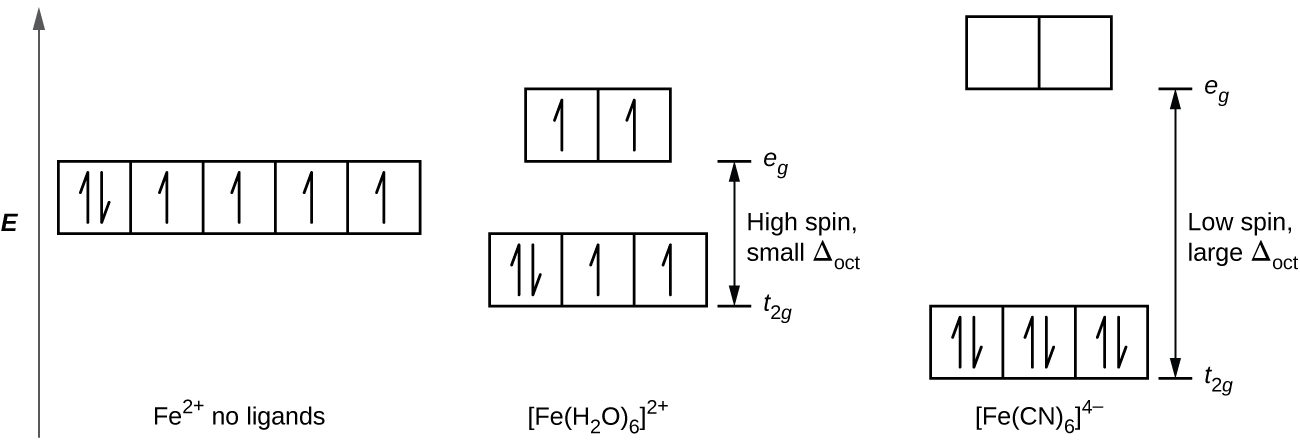
Em [Fe (H 2 O) 6] 2+, por outro lado, o campo fraco das moléculas de água produz apenas uma pequena divisão do campo cristalino (Δoct < P). Como requer menos energia para que os elétrons ocupem os orbitais e g do que para se emparelharem, haverá um elétron em cada um dos cinco orbitais de 3 d antes que o emparelhamento ocorra. Para os seis elétrons d no centro de ferro (II) em [Fe (H 2 O) 6] 2+, haverá um par de elétrons e quatro elétrons desemparelhados (Figura\(\PageIndex{3}\)). Complexos como o íon [Fe (H 2 O) 6] 2+, no qual os elétrons não estão emparelhados porque a divisão do campo cristalino não é grande o suficiente para fazê-los emparelhar, são chamados de complexos de alto spin porque o número de elétrons não pareados (spins) é maximizado.
Uma linha de raciocínio semelhante mostra por que o íon [Fe (CN) 6] 3− é um complexo de baixo spin com apenas um elétron não pareado, enquanto os íons [Fe (H 2 O) 6] 3+ e [FeF 6] 3− são complexos de alto spin com cinco elétrons desemparelhados.
Preveja o número de elétrons desemparelhados.
- K 3 [CRi 6]
- [Cu (en) 2 (H 2 O) 2] Cl 2
- Na 3 [Co (NO 26)]
Solução
Os complexos são octaédricos.
- O Cr 3 + tem uma configuração d 3. Esses elétrons serão todos desemparelhados.
- Cu 2 + é d 9, então haverá um elétron não pareado.
- Co 3 + tem d 6 elétrons de valência, então a divisão do campo cristalino determinará quantos estão emparelhados. O nitrito é um ligante de campo forte, então o complexo terá baixa rotação. Seis elétrons entrarão nos orbitais t 2 g, deixando 0 sem par.
O tamanho da divisão do campo cristalino só influencia a disposição dos elétrons quando há uma escolha entre emparelhar elétrons e preencher os orbitais de maior energia. Para quais configurações de elétrons d haverá uma diferença entre configurações de alta e baixa rotação em complexos octaédricos?
- Resposta
-
d 4, d 5, d 6 e d 7
O CFT é aplicável a moléculas em geometrias diferentes da octaédrica. Em complexos octaédricos, lembre-se de que os lóbulos do conjunto e g apontam diretamente para os ligantes. Para complexos tetraédricos, os orbitais d permanecem no lugar, mas agora temos apenas quatro ligantes localizados entre os eixos (Figura\(\PageIndex{4}\)). Nenhum dos orbitais aponta diretamente para os ligantes tetraédricos. No entanto, o conjunto e g (ao longo dos eixos cartesianos) se sobrepõe aos ligantes menores do que o conjunto t 2 g. Por analogia com o caso octaédrico, preveja o diagrama de energia para os orbitais d em um campo cristalino tetraédrico. Para evitar confusão, o conjunto octaédrico e g se torna um conjunto tetraédrico e, e o conjunto octaédrico t 2 g se torna um conjunto t 2.
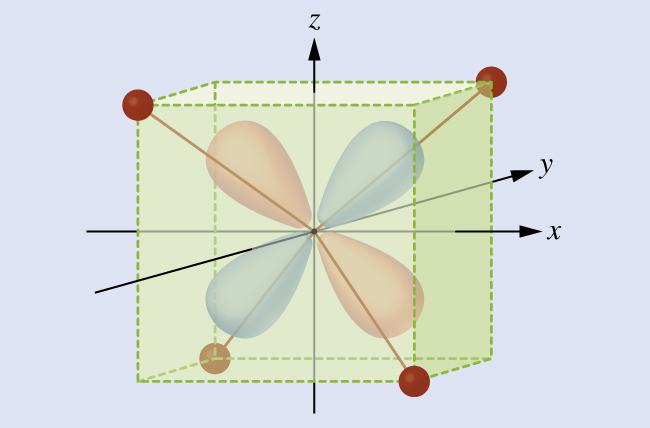
Solução
Como o CFT é baseado na repulsão eletrostática, os orbitais mais próximos dos ligantes serão desestabilizados e aumentados em energia em relação ao outro conjunto de orbitais. A divisão é menor do que para complexos octaédricos porque a sobreposição é menor, então Δtet geralmente é pequeno\(\left(Δ_\ce{tet}=\dfrac{4}{9}Δ_\ce{oct}\right)\):
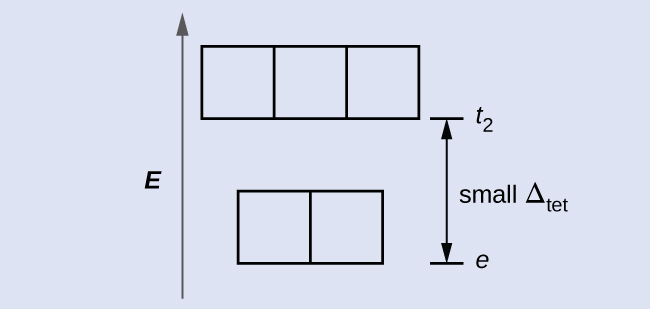
Explique quantos elétrons não pareados um íon d 4 tetraédrico terá.
- Resposta
-
4; como o texto δ é pequeno, todos os complexos tetraédricos são de alta rotação e os elétrons entram nos orbitais t 2 antes do emparelhamento
A outra geometria comum é quadrada plana. É possível considerar uma geometria plana quadrada como uma estrutura octaédrica com um par de ligantes trans removidos. Supõe-se que os ligantes removidos estejam no eixo z. Isso muda a distribuição dos orbitais d, à medida que os orbitais no eixo z ou perto dele se tornam mais estáveis, e aqueles nos eixos x ou y ou próximos se tornam menos estáveis. Isso resulta na divisão octaédrica de t 2 g e dos conjuntos e g e fornece um padrão mais complicado sem uma simples oct Δ. O padrão básico é:
Momentos magnéticos de moléculas e íons
Evidências experimentais de medições magnéticas apóiam a teoria de complexos de alta e baixa rotação. Lembre-se de que moléculas como O 2 que contêm elétrons não pareados são paramagnéticas. Substâncias paramagnéticas são atraídas por campos magnéticos. Muitos complexos de metais de transição têm elétrons desemparelhados e, portanto, são paramagnéticos. Moléculas como N 2 e íons como Na + e [Fe (CN) 6] 4− que não contêm elétrons desemparelhados são diamagnéticas. As substâncias diamagnéticas têm uma leve tendência a serem repelidas por campos magnéticos.
Quando um elétron em um átomo ou íon não está emparelhado, o momento magnético devido ao seu giro torna todo o átomo ou íon paramagnético. O tamanho do momento magnético de um sistema contendo elétrons não pareados está diretamente relacionado ao número desses elétrons: quanto maior o número de elétrons desemparelhados, maior o momento magnético. Portanto, o momento magnético observado é usado para determinar o número de elétrons não pareados presentes. O momento magnético medido de baixa rotação d 6 [Fe (CN) 6] 4− confirma que o ferro é diamagnético, enquanto o giro alto d 6 [Fe (H 2 O) 6] 2+ tem quatro elétrons desemparelhados com um momento magnético que confirma esse arranjo.
Cores dos complexos de metais de transição
Quando átomos ou moléculas absorvem luz na frequência adequada, seus elétrons são excitados para orbitais de maior energia. Para muitos átomos e moléculas do grupo principal, os fótons absorvidos estão na faixa ultravioleta do espectro eletromagnético, que não pode ser detectado pelo olho humano. Para compostos de coordenação, a diferença de energia entre os orbitais d geralmente permite que fótons na faixa visível sejam absorvidos.
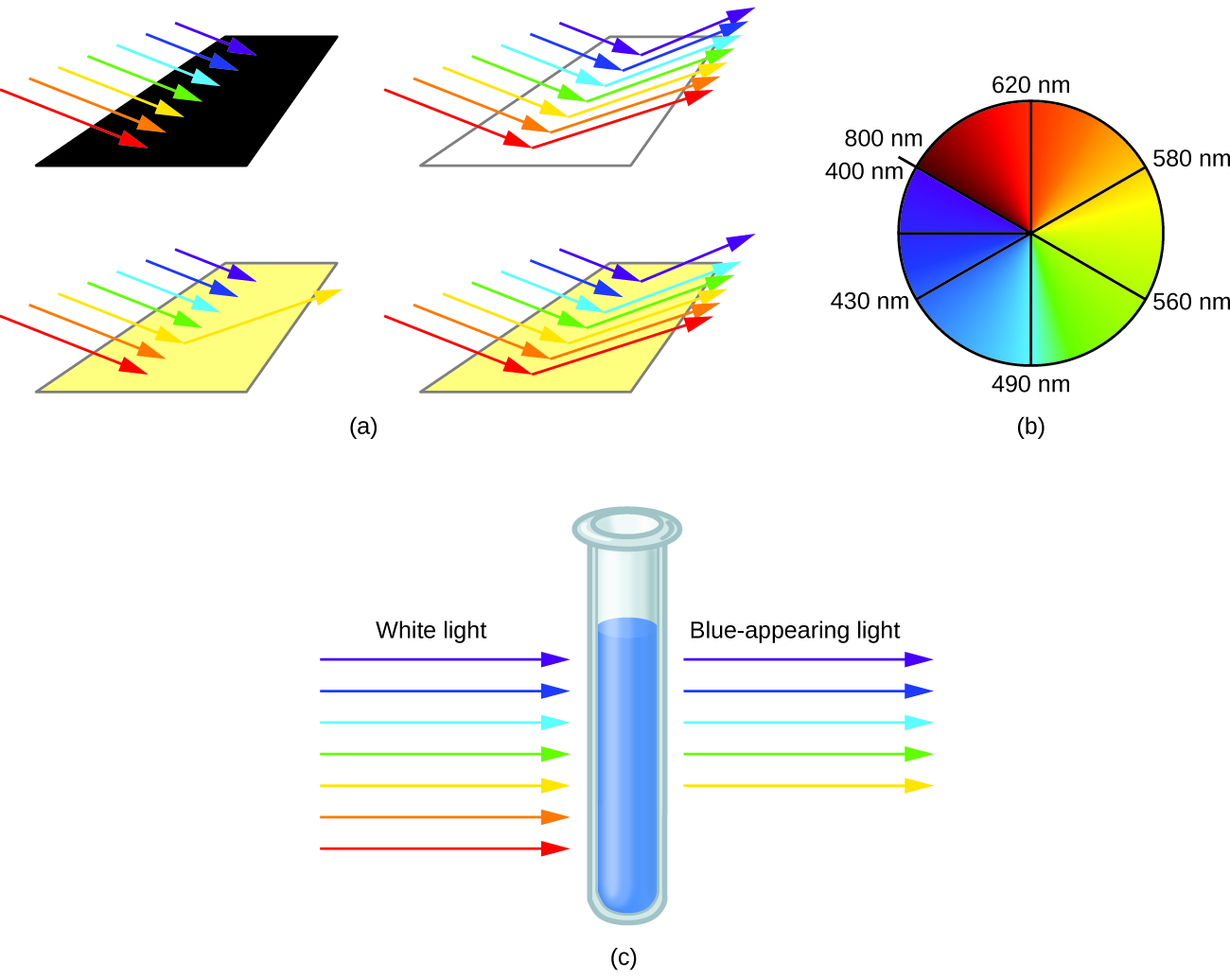
O olho humano percebe uma mistura de todas as cores, nas proporções presentes na luz solar, como luz branca. Cores complementares, aquelas localizadas uma em frente à outra em uma roda de cores, também são usadas na visão de cores. O olho percebe uma mistura de duas cores complementares, nas proporções adequadas, como luz branca. Da mesma forma, quando falta uma cor na luz branca, o olho vê seu complemento. Por exemplo, quando os fótons vermelhos são absorvidos pela luz branca, os olhos veem a cor verde. Quando os fótons violetas são removidos da luz branca, os olhos veem amarelo-limão. A cor azul do íon [Cu (NH 3) 4] 2+ resulta porque esse íon absorve a luz laranja e vermelha, deixando as cores complementares de azul e verde (Figura\(\PageIndex{5}\)).
O complexo octaédrico [Ti (H 2 O) 6] 3+ tem um único elétron d. Para excitar esse elétron do orbital t 2 g do estado fundamental para o orbital e g, esse complexo absorve luz de 450 a 600 nm. A absorbância máxima corresponde a Δoct e ocorre a 499 nm. Calcule o valor de Δoct em Joules e preveja em qual cor a solução aparecerá.
Solução
Usando a equação de Planck (consulte a seção sobre energia eletromagnética), calculamos:
\[v=\dfrac{c}{λ}\mathrm{\:so\:\dfrac{3.00×10^8\: m/s}{\dfrac{499\: nm×1\: m}{10^9\:nm}}=6.01×10^{14}\:Hz} \nonumber \]
\[E=hnu\mathrm{\:so\:6.63×10^{−34}\:\textrm{J⋅s}×6.01×10^{14}\:Hz=3.99×10^{−19}\:Joules/ion} \nonumber \]
Como o complexo absorve 600 nm (laranja) a 450 (azul), os comprimentos de onda índigo, violeta e vermelho serão transmitidos e o complexo aparecerá roxo.
Um complexo que parece verde, absorve fótons de quais comprimentos de onda?
- Resposta
-
vermelho, 620—800 nm
Pequenas mudanças nas energias relativas dos orbitais entre os quais os elétrons estão em transição podem levar a mudanças drásticas na cor da luz absorvida. Portanto, as cores dos compostos de coordenação dependem de muitos fatores. Conforme mostrado na Figura\(\PageIndex{6}\), diferentes íons metálicos aquosos podem ter cores diferentes. Além disso, diferentes estados de oxidação de um metal podem produzir cores diferentes, conforme mostrado para os complexos de vanádio no link abaixo.

Os ligantes específicos coordenados ao centro do metal também influenciam a cor dos complexos de coordenação. Por exemplo, o complexo de ferro (II) [Fe (H 2 O) 6] SO 4 aparece azul-esverdeado porque o complexo de alta rotação absorve fótons nos comprimentos de onda vermelhos (Figura\(\PageIndex{7}\)). Em contraste, o complexo de ferro (II) de baixa rotação K 4 [Fe (CN) 6] parece amarelo pálido porque absorve fótons violetas de maior energia.

Em geral, ligantes de campo forte causam uma grande divisão nas energias dos orbitais d do átomo de metal central (grande Δoct). Os compostos de coordenação de metais de transição com esses ligantes são amarelos, laranja ou vermelhos porque absorvem luz violeta ou azul de maior energia. Por outro lado, os compostos de coordenação de metais de transição com ligantes de campo fraco são geralmente azul-esverdeados, azuis ou índigo porque absorvem luz amarela, laranja ou vermelha de baixa energia.
Um composto de coordenação do íon Cu+ tem uma configuração d 10 e todos os orbitais e g estão preenchidos. Para excitar um elétron a um nível mais alto, como o orbital 4p, fótons de energia muito alta são necessários. Essa energia corresponde a comprimentos de onda muito curtos na região ultravioleta do espectro. Nenhuma luz visível é absorvida, então o olho não vê nenhuma mudança e o composto parece branco ou incolor. Uma solução contendo [Cu (CN) 2] −, por exemplo, é incolor. Por outro lado, os complexos octaédricos de Cu 2 + têm uma vaga nos orbitais e g, e os elétrons podem ser excitados até esse nível. O comprimento de onda (energia) da luz absorvida corresponde à parte visível do espectro, e os complexos de Cu 2+ são quase sempre coloridos - azul, azul esverdeado violeta ou amarelo (Figura\(\PageIndex{8}\)). Embora o CFT descreva com sucesso muitas propriedades dos complexos de coordenação, explicações orbitais moleculares (além do escopo introdutório fornecido aqui) são necessárias para entender completamente o comportamento dos complexos de coordenação.

Resumo
A teoria do campo cristalino trata as interações entre os elétrons no metal e os ligantes como um simples efeito eletrostático. A presença dos ligantes próximos ao íon metálico altera as energias dos orbitais do metal d em relação às suas energias no íon livre. Tanto a cor quanto as propriedades magnéticas de um complexo podem ser atribuídas a essa divisão do campo cristalino. A magnitude da divisão (Δoct) depende da natureza dos ligantes ligados ao metal. Ligantes de campo forte produzem grandes divisões e favorecem complexos de baixa rotação, nos quais os orbitais t 2 g são completamente preenchidos antes que qualquer elétron ocupe os orbitais e g. Ligantes de campo fraco favorecem a formação de complexos de alto spin. Os orbitais t 2 g e e g são ocupados individualmente antes que qualquer um seja ocupado duplamente.
Glossário
- divisão do campo cristalino (Δoct)
- diferença de energia entre os conjuntos t 2 g e e g ou conjuntos t e e de orbitais
- teoria do campo cristalino
- modelo que explica as energias dos orbitais em metais de transição em termos de interações eletrostáticas com os ligantes, mas não inclui a ligação de ligantes metálicos
- por exemplo, orbitais
- conjunto de dois orbitais d que são orientados nos eixos cartesianos para complexos de coordenação; em complexos octaédricos, eles têm maior energia do que os orbitais t 2 g
- isômeros geométricos
- isômeros que diferem na forma como os átomos são orientados no espaço em relação uns aos outros, levando a diferentes propriedades físicas e químicas
- complexo de alta rotação
- complexo no qual os elétrons maximizam o giro total do elétron preenchendo individualmente todos os orbitais antes de emparelhar dois elétrons nos orbitais de baixa energia
- complexo de baixa rotação
- complexo no qual os elétrons minimizam o giro total de elétrons emparelhando-se nos orbitais de baixa energia antes de preencher os orbitais de maior energia
- energia de emparelhamento (P)
- energia necessária para colocar dois elétrons com giros opostos em um único orbital
- série espectroquímica
- classificação dos ligantes de acordo com a magnitude da divisão do campo cristalino que eles induzem
- ligante de campo forte
- ligante que causa maiores divisões no campo cristalino
- orbitais de 1 a 2 kg
- conjunto de três orbitais d alinhados entre os eixos cartesianos para complexos de coordenação; em complexos octaédricos, eles são reduzidos em energia em comparação com os orbitais e g de acordo com o CFT
- ligante de campo fraco
- ligando que causa pequenas divisões no campo cristalino


