18.5: Ocorrência, preparação e compostos de hidrogênio
- Page ID
- 184965
- Descreva as propriedades, a preparação e os compostos do hidrogênio
O hidrogênio é o elemento mais abundante no universo. O sol e outras estrelas são compostos em grande parte de hidrogênio. Os astrônomos estimam que 90% dos átomos do universo são átomos de hidrogênio. O hidrogênio é um componente de mais compostos do que qualquer outro elemento. A água é o composto de hidrogênio mais abundante encontrado na Terra. O hidrogênio é uma parte importante do petróleo, muitos minerais, celulose e amido, açúcar, gorduras, óleos, álcoois, ácidos e milhares de outras substâncias.
Em temperaturas normais, o hidrogênio é um gás incolor, inodoro, insípido e não venenoso que consiste na molécula diatômica H 2. O hidrogênio é composto por três isótopos e, ao contrário de outros elementos, esses isótopos têm nomes e símbolos químicos diferentes: prótio, 1 H, deutério, 2 H (ou “D”) e trítio 3 H (ou “T”). Em uma amostra natural de hidrogênio, há um átomo de deutério para cada 7000 átomos de H e um átomo de trítio radioativo para cada 10 átomos de 18 H. As propriedades químicas dos diferentes isótopos são muito semelhantes porque eles têm estruturas eletrônicas idênticas, mas diferem em algumas propriedades físicas por causa de suas diferentes massas atômicas. O deutério elementar e o trítio têm menor pressão de vapor do que o hidrogênio comum. Consequentemente, quando o hidrogênio líquido evapora, os isótopos mais pesados se concentram nas últimas porções a evaporar. A eletrólise da água pesada, D 2 O, produz deutério. A maior parte do trítio se origina de reações nucleares.
Preparação do hidrogênio
O hidrogênio elementar deve ser preparado a partir de compostos quebrando ligações químicas. Seguem os métodos mais comuns de preparação do hidrogênio.
De vapor e carbono ou hidrocarbonetos
A água é a fonte mais barata e abundante de hidrogênio. Passar vapor sobre o coque (uma forma impura de carbono elementar) a 1000 °C produz uma mistura de monóxido de carbono e hidrogênio conhecida como gás de água:
\[\ce{C}(s)+\ce{H2O}(g)\:\mathrm{\xrightarrow{1000\:°C}}\:\underset{\Large\mathrm{water\: gas}}{\ce{CO}(g)+\ce{H2}(g)} \nonumber \]
O gás aquático é como combustível industrial. É possível produzir hidrogênio adicional misturando o gás da água com o vapor na presença de um catalisador para converter o CO em CO 2. Essa reação é a reação de mudança de gás da água.
Também é possível preparar uma mistura de hidrogênio e monóxido de carbono passando hidrocarbonetos do gás natural ou petróleo e do vapor sobre um catalisador à base de níquel. O propano é um exemplo de reagente de hidrocarboneto:
\[\ce{C3H8}(g)+\ce{3H2O}(g)\:\mathrm{\underset{catalyst}{\xrightarrow{900\:°C}}}\:\ce{3CO}(g)+\ce{7H2}(g) \nonumber \]
Eletrólise
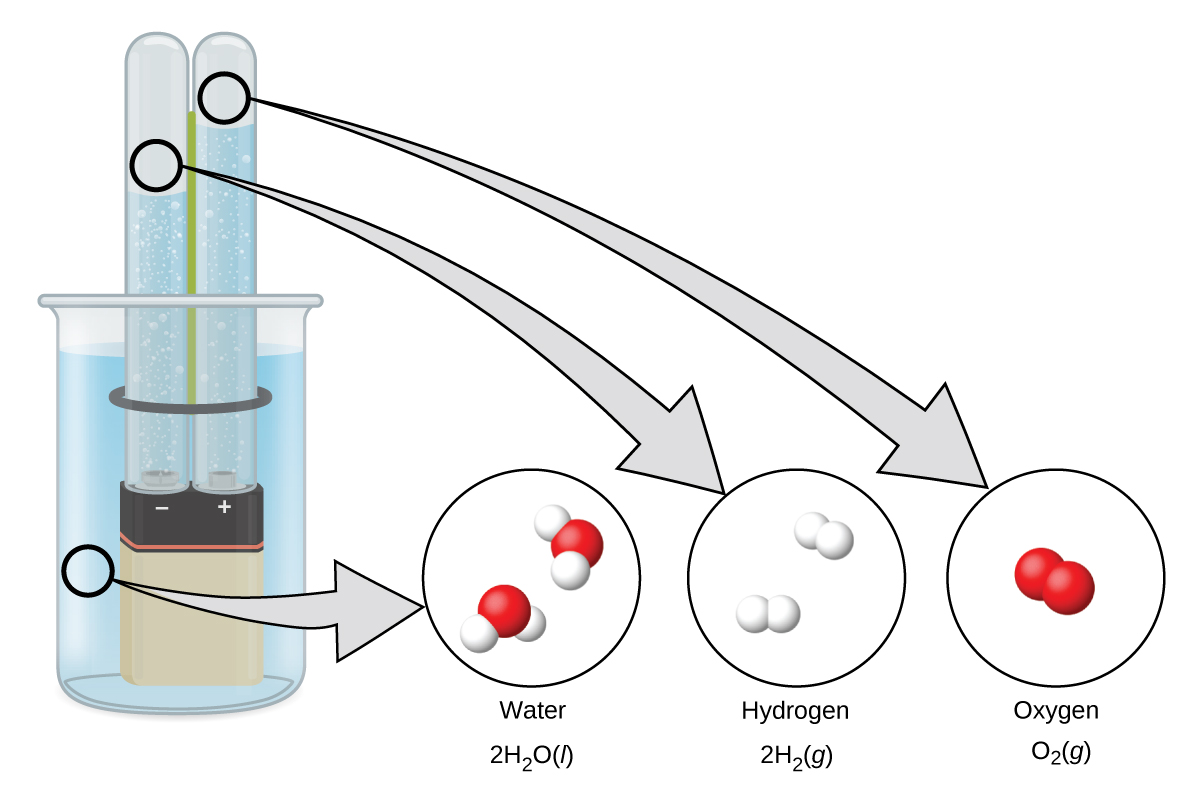
O hidrogênio se forma quando a eletricidade de corrente contínua passa pela água (eletrólise) contendo um eletrólito como H 2 SO 4, (Figura\(\PageIndex{1}\).) Bolhas de hidrogênio se formam no cátodo e o oxigênio evolui no ânodo. A próxima reação é:
\[\ce{2H2O}(l)+\ce{electrical\: energy}⟶\ce{2H2}(g)+\ce{O2}(g) \nonumber \]
Reação de metais com ácidos
Este é o método laboratorial mais conveniente para produzir hidrogênio. Metais com menor potencial de redução reduzem o íon hidrogênio em ácidos diluídos para produzir gás hidrogênio e sais metálicos. Por exemplo, conforme mostrado na Figura\(\PageIndex{2}\), o ferro no ácido clorídrico diluído produz gás hidrogênio e cloreto de ferro (II):
\[\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{2Cl-}(aq)⟶\ce{Fe^2+}(aq)+\ce{2Cl-}(aq)+\ce{H2}(g)+\ce{2H2O}(l) \nonumber \]

Reação de hidretos de metais iônicos com água
É possível produzir hidrogênio a partir da reação dos hidretos dos metais ativos, que contêm o ânion H − altamente básico, com a água:
\[\ce{CaH2}(s)+\ce{2H2O}(l)⟶\ce{Ca^2+}(aq)+\ce{2OH-}(aq)+\ce{2H2}(g) \nonumber \]
Os hidretos metálicos são fontes de hidrogênio caras, mas convenientes, especialmente onde o espaço e o peso são fatores importantes. Eles são importantes na inflação de coletes salva-vidas, botes salva-vidas e balões militares.
Reações
Em condições normais, o hidrogênio é relativamente inativo quimicamente, mas quando aquecido, ele entra em muitas reações químicas.
Dois terços da produção mundial de hidrogênio são dedicados à fabricação de amônia, que é um fertilizante e usada na fabricação de ácido nítrico. Grandes quantidades de hidrogênio também são importantes no processo de hidrogenação, discutido no capítulo sobre química orgânica.
É possível usar o hidrogênio como combustível não poluente. A reação do hidrogênio com o oxigênio é uma reação muito exotérmica, liberando 286 kJ de energia por mol de água formado. O hidrogênio queima sem explosão sob condições controladas. A tocha de oxigênio-hidrogênio, devido ao alto calor de combustão do hidrogênio, pode atingir temperaturas de até 2800° C. A chama quente dessa tocha é útil no corte de chapas grossas de muitos metais. O hidrogênio líquido também é um importante combustível de foguete (Figura\(\PageIndex{3}\)).

Um átomo de hidrogênio não combinado consiste em um núcleo e um elétron de valência no orbital de 1 s. A camada de valência n = 1 tem capacidade para dois elétrons, e o hidrogênio pode legitimamente ocupar dois locais na tabela periódica. É possível considerar o hidrogênio um elemento do grupo 1 porque o hidrogênio pode perder um elétron para formar o cátion, H +. Também é possível considerar o hidrogênio como um elemento do grupo 17 porque ele precisa de apenas um elétron para preencher seu orbital de valência para formar um íon hidreto, H −, ou pode compartilhar um elétron para formar uma única ligação covalente. Na realidade, o hidrogênio é um elemento único que quase merece sua própria localização na tabela periódica.
Reações com elementos
Quando aquecido, o hidrogênio reage com os metais do grupo 1 e com Ca, Sr e Ba (os metais mais ativos no grupo 2). Os compostos formados são hidretos iônicos cristalinos que contêm o ânion hidreto, H −, um forte agente redutor e uma base forte, que reage vigorosamente com a água e outros ácidos para formar gás hidrogênio.
As reações de hidrogênio com não metais geralmente produzem compostos ácidos de hidrogênio com hidrogênio no estado de oxidação 1+. As reações se tornam mais exotérmicas e vigorosas à medida que a eletronegatividade do não metal aumenta. O hidrogênio reage com nitrogênio e enxofre somente quando aquecido, mas reage explosivamente com o flúor (formando HF) e, em algumas condições, com o cloro (formando HCl). Uma mistura de hidrogênio e oxigênio explode se inflamada. Devido à natureza explosiva da reação, é necessário ter cuidado ao manusear hidrogênio (ou qualquer outro gás combustível) para evitar a formação de uma mistura explosiva em um espaço confinado. Embora a maioria dos hidretos dos não metais sejam ácidos, a amônia e a fosfina (PH 3) são ácidos muito, muito fracos e geralmente funcionam como bases. Há um resumo dessas reações de hidrogênio com os elementos na Tabela\(\PageIndex{1}\).
| Equação geral | Comentários |
|---|---|
| \(\ce{MH\: or\: MH2⟶MOH\: or\: M(OH)2 + H2}\) | hidretos iônicos com grupo 1 e Ca, Sr e Ba |
| \(\ce{H2 + C⟶ (no\: reaction)}\) | |
| \(\ce{3H2 + N2 ⟶ 2NH3}\) | requer alta pressão e temperatura; baixo rendimento |
| \(\ce{2H2 + O2 ⟶ 2H2O}\) | exotérmico e potencialmente explosivo |
| \(\ce{H2 + S ⟶ H2S}\) | requer aquecimento; baixo rendimento |
| \(\ce{H2 + X2 ⟶ 2HX}\) | X = F, Cl, Br e I; explosivo com F 2; baixo rendimento com I 2 |
Reação com compostos
O hidrogênio reduz os óxidos aquecidos de muitos metais, com a formação do metal e do vapor de água. Por exemplo, passar hidrogênio sobre CuO aquecido forma cobre e água. O hidrogênio também pode reduzir os íons metálicos em alguns óxidos metálicos para diminuir os estados de oxidação:
\[\ce{H2}(g)+\ce{MnO2}(s)\xrightarrow{Δ}\ce{MnO}(s)+\ce{H2O}(g) \nonumber \]
compostos de hidrogênio
Além dos gases nobres, cada um dos não metais forma compostos com hidrogênio. Para resumir, discutiremos apenas alguns compostos de hidrogênio dos não metais aqui.
Compostos de nitrogênio e
A amônia, NH 3, se forma naturalmente quando qualquer material orgânico contendo nitrogênio se decompõe na ausência de ar. A preparação laboratorial da amônia é feita pela reação de um sal de amônio com uma base forte, como o hidróxido de sódio. A reação ácido-base com o íon amônio fracamente ácido fornece amônia, ilustrada na Figura\(\PageIndex{4}\). A amônia também se forma quando os nitretos iônicos reagem com a água. O íon nitreto é uma base muito mais forte do que o íon hidróxido:
\[\ce{Mg3N2}(s)+\ce{6H2O}(l)⟶\ce{3Mg(OH)2}(s)+\ce{2NH3}(g) \nonumber \]
A produção comercial de amônia se dá pela combinação direta dos elementos do processo de Haber como:
\[\ce{N2}(g)+\ce{3H2}(g)\xrightleftharpoons{\ce{catalyst}}\ce{2NH3}(g) \hspace{20px} ΔH°=\mathrm{−92\: kJ} \nonumber \]
A amônia é um gás incolor com um odor forte e pungente. Os sais cheirosos utilizam esse odor poderoso. A amônia gasosa se liquefaz prontamente para dar um líquido incolor que ferve a −33 °C. Devido à ligação intermolecular de hidrogênio, a entalpia de vaporização da amônia líquida é maior do que a de qualquer outro líquido, exceto água, então a amônia é útil como refrigerante. A amônia é bastante solúvel em água (658 L em STP se dissolvem em 1 L H 2 O).
As propriedades químicas da amônia são as seguintes:
- A amônia atua como uma base de Brønsted, conforme discutido no capítulo sobre química ácido-base. O íon amônio é semelhante em tamanho ao íon potássio; os compostos dos dois íons apresentam muitas semelhanças em suas estruturas e solubilidades.
- A amônia pode apresentar comportamento ácido, embora seja um ácido muito mais fraco do que a água. Como outros ácidos, a amônia reage com os metais, embora seja tão fraca que altas temperaturas são necessárias. Hidrogênio e (dependendo da estequiometria) amidas (sais de\(\ce{NH2-}\)), imidas (sais de NH 2 −) ou nitretos (sais de N 3−) se formam.
- O átomo de nitrogênio na amônia tem seu menor estado de oxidação possível (3−) e, portanto, não é suscetível à redução. No entanto, ele pode ser oxidado. A amônia queima no ar, dando NO e água. A amônia quente e o íon amônio são agentes redutores ativos. De particular interesse são as oxidações do íon amônio pelo íon nitrito,\(\ce{NO2-}\), para produzir nitrogênio puro e pelo íon nitrato para produzir óxido nitroso, N 2 O.
- Existem vários compostos que podemos considerar derivados da amônia por meio da substituição de um ou mais átomos de hidrogênio por algum outro átomo ou grupo de átomos. Derivações inorgânicas incluem cloramina, NH 2 Cl e hidrazina, N 2 H 4:
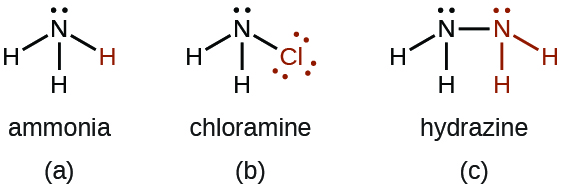
A cloramina, NH 2 Cl, resulta da reação do hipoclorito de sódio, NaOCl, com amônia em solução básica. Na presença de um grande excesso de amônia em baixa temperatura, a cloramina reage ainda mais para produzir hidrazina, N 2 H 4:
\[\ce{NH3}(aq)+\ce{OCl-}(aq)⟶\ce{NH2Cl}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2Cl}(aq)+\ce{NH3}(aq)+\ce{OH-}(aq)⟶\ce{N2H4}(aq)+\ce{Cl-}(aq)+\ce{H2O}(l) \nonumber \]
A hidrazina anidra é relativamente estável, apesar de sua energia livre positiva de formação:
\[\ce{N2}(g)+\ce{2H2}(g)⟶\ce{N2H4}(l) \hspace{20px} ΔG^\circ_\ce{f}=\mathrm{149.2\:kJ\:mol^{−1}} \nonumber \]
A hidrazina é um líquido fumegante e incolor que tem algumas propriedades físicas notavelmente semelhantes às do H 2 O (derrete a 2° C, ferve a 113,5° C e tem uma densidade a 25° C de 1,00 g/mL). Ele queima rápida e completamente no ar com evolução substancial do calor:
\[\ce{N2H4}(l)+\ce{O2}(g)⟶\ce{N2}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−621.5\:kJ\:mol^{−1}} \nonumber \]
Como a amônia, a hidrazina é tanto uma base de Brønsted quanto uma base de Lewis, embora seja mais fraca que a amônia. Ele reage com ácidos fortes e forma duas séries de sais que contêm os\(\ce{N2H6^2+}\) íons\(\ce{N2H5+}\) e, respectivamente. Alguns foguetes usam hidrazina como combustível.
Compostos de hidrogênio e fós
O hidreto de fósforo mais importante é a fosfina, PH 3, um análogo gasoso da amônia em termos de fórmula e estrutura. Ao contrário da amônia, não é possível formar fosfina pela união direta dos elementos. Existem dois métodos para a preparação da fosfina. Um método é pela ação de um ácido em um fosfeto iônico. O outro método é a desproporção de fósforo branco com base concentrada quente para produzir fosfina e o íon hidrogenofosfito:
\[\ce{AlP}(s)+\ce{3H3O+}(aq)⟶\ce{PH3}(g)+\ce{Al^3+}(aq)+\ce{3H2O}(l) \nonumber \]
\[\ce{P4}(s)+\ce{4OH-}(aq)+\ce{2H2O}(l)⟶\ce{2HPO3^2-}(aq)+\ce{2PH3}(g) \nonumber \]
A fosfina é um gás incolor e muito venenoso, que tem um odor semelhante ao de peixes em decomposição. O calor decompõe facilmente a fosfina\((\ce{4PH3}⟶\ce{P4}+\ce{6H2})\) e o composto queima no ar. Os principais usos da fosfina são como fumigante para grãos e no processamento de semicondutores. Como a amônia, a fosfina gasosa se une aos halogenetos de hidrogênio gasoso, formando compostos de fosfônio como PH 4 Cl e PH 4 I. A fosfina é uma base muito mais fraca do que a amônia; portanto, esses compostos se decompõem em água e o PH 3 insolúvel escapa da solução.
Compostos de enxofre e hidro
O sulfeto de hidrogênio, H 2 S, é um gás incolor responsável pelo odor ofensivo de ovos podres e de muitas fontes termais. O sulfeto de hidrogênio é tão tóxico quanto o cianeto de hidrogênio; portanto, é necessário ter muito cuidado ao manuseá-lo. O sulfeto de hidrogênio é particularmente enganador porque paralisa os nervos olfativos; após uma breve exposição, não se sente o cheiro.
A produção de sulfeto de hidrogênio pela reação direta dos elementos (H 2 + S) é insatisfatória porque o rendimento é baixo. Um método de preparação mais eficaz é a reação de um sulfeto de metal com um ácido diluído. Por exemplo:
\[\ce{FeS}(s)+\ce{2H3O+}(aq)⟶\ce{Fe^2+}(aq)+\ce{H2S}(g)+\ce{2H2O}(l) \nonumber \]
É fácil oxidar o enxofre em sulfetos metálicos e em sulfeto de hidrogênio, tornando os sulfetos metálicos e o H 2 S bons agentes redutores. Em soluções ácidas, o sulfeto de hidrogênio reduz Fe 3 + para Fe 2 +,\(\ce{MnO4-}\) para Mn 2 +,\(\ce{Cr2O7^2-}\) para Cr 3 + e HNO 3 para NO 2. O enxofre em H 2 S geralmente se oxida em enxofre elementar, a menos que um grande excesso do agente oxidante esteja presente. Nesse caso, o sulfeto pode oxidar para\(\ce{SO3^2-}\) ou\(\ce{SO4^2-}\) (ou para SO 2 ou SO 3 na ausência de água):
\[\ce{2H2S}(g)+\ce{O2}(g)⟶\ce{2S}(s)+\ce{2H2O}(l) \nonumber \]
Esse processo de oxidação leva à remoção do sulfeto de hidrogênio encontrado em muitas fontes de gás natural. Os depósitos de enxofre nas regiões vulcânicas podem ser o resultado da oxidação do H 2 S presente nos gases vulcânicos.
O sulfeto de hidrogênio é um ácido diprótico fraco que se dissolve na água para formar ácido hidrossulfúrico. O ácido ioniza em dois estágios, produzindo íons sulfeto de hidrogênio, HS −, no primeiro estágio e íons sulfeto, S 2−, no segundo. Como o sulfeto de hidrogênio é um ácido fraco, as soluções aquosas de sulfetos solúveis e sulfetos de hidrogênio são básicas:
\[\ce{S^2-}(aq)+\ce{H2O}(l)⇌\ce{HS-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{HS-}(aq)+\ce{H2O}(l)⇌\ce{H2S}(g)+\ce{OH-}(aq) \nonumber \]
Compostos de hidrogênio halógeno
Compostos binários contendo apenas hidrogênio e um halogênio são halogenetos de hidrogênio. À temperatura ambiente, os halogenetos de hidrogênio puros HF, HCl, HBr e HI são gases.
Em geral, é possível preparar os haletos pelas técnicas gerais usadas para preparar outros ácidos. Flúor, cloro e bromo reagem diretamente com o hidrogênio para formar o respectivo haleto de hidrogênio. Esta é uma reação comercialmente importante para preparar cloreto de hidrogênio e brometo de hidrogênio.
A reação ácido-base entre um ácido forte não volátil e um haleto metálico produzirá um haleto de hidrogênio. A fuga do haleto de hidrogênio gasoso leva a reação à conclusão. Por exemplo, o método usual de preparar o fluoreto de hidrogênio é aquecer uma mistura de fluoreto de cálcio, CaF 2 e ácido sulfúrico concentrado:
\[\ce{CaF2}(s)+\ce{H2SO4}(aq)⟶\ce{CaSO4}(s)+\ce{2HF}(g) \nonumber \]
O fluoreto de hidrogênio gasoso também é um subproduto na preparação de fertilizantes fosfatados pela reação da fluoroapatita, Ca 5 (PO 4) 3 F, com ácido sulfúrico. A reação do ácido sulfúrico concentrado com um sal de cloreto produz cloreto de hidrogênio tanto comercialmente quanto em laboratório.
Na maioria dos casos, o cloreto de sódio é o cloreto de escolha porque é o cloreto mais barato. O brometo de hidrogênio e o iodeto de hidrogênio não podem ser preparados usando ácido sulfúrico porque esse ácido é um agente oxidante capaz de oxidar tanto o brometo quanto o iodeto. No entanto, é possível preparar brometo de hidrogênio e iodeto de hidrogênio usando um ácido como o ácido fosfórico, porque é um agente oxidante mais fraco. Por exemplo:
\[\ce{H3PO4}(l)+\ce{Br-}(aq)⟶\ce{HBr}(g)+\ce{H2PO4-}(aq) \nonumber \]
Todos os halogenetos de hidrogênio são muito solúveis em água, formando ácidos hidrohálicos. Com exceção do fluoreto de hidrogênio, que tem uma forte ligação hidrogênio-fluoreto, eles são ácidos fortes. As reações dos ácidos hidrohálicos com metais, hidróxidos metálicos, óxidos ou carbonatos produzem sais dos haletos. A maioria dos sais de cloreto é solúvel em água. AgCl, PbCl 2 e Hg 2 Cl 2 são as exceções comumente encontradas.
Os íons haleto dão às substâncias as propriedades associadas a X − (aq). Os íons haletos mais pesados (Cl −, Br − e I −) podem atuar como agentes redutores, e os halogênios mais leves ou outros agentes oxidantes os oxidarão:
\ [\ ce {Cl2} (aq) +\ ce {2e-} ⟶\ ce {2Cl-} (aq)\ hspace {20px} E°=\ mathrm {1,36\ :V}\
\ ce {Br2} (aq) +\ ce {2e-} ⟶\ ce {2Br-} (aq)\ hspace {20px} E°=\ mathrm {1.09\ :V}\
\ ce {I2} (aq) +\ ce {2e-} ⟶\ ce {2I-} (aq)\ hspace {20px} E°=\ mathrm {0,54\ :V}\ nonumber\]
Por exemplo, o bromo oxida o iodo:
\[\ce{Br2}(aq)+\ce{2HI}(aq)⟶\ce{2HBr}(aq)+\ce{I2}(aq) \hspace{20px} E°=\mathrm{0.55\:V} \nonumber \]
O ácido fluorídrico é único em suas reações com areia (dióxido de silício) e com vidro, que é uma mistura de silicatos:
\[\ce{SiO2}(s)+\ce{4HF}(aq)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{CaSiO3}(s)+\ce{6HF}(aq)⟶\ce{CaF2}(s)+\ce{SiF4}(g)+\ce{3H2O}(l) \nonumber \]
O tetrafluoreto de silício volátil escapa dessas reações. Como o fluoreto de hidrogênio ataca o vidro, ele pode congelar ou gravar o vidro e é usado para gravar marcas em termômetros, buchas e outros objetos de vidro.
O maior uso do fluoreto de hidrogênio é na produção de hidroclorofluorcarbonetos para refrigerantes, plásticos e propelentes. O segundo maior uso é na fabricação de criolita, Na 3 AlF 6, que é importante na produção de alumínio. O ácido também é importante na produção de outros fluoretos inorgânicos (como o BF 3), que servem como catalisadores na síntese industrial de certos compostos orgânicos.
O ácido clorídrico é relativamente barato. É um ácido importante e versátil na indústria e é importante para a fabricação de cloretos metálicos, corantes, cola, glicose e vários outros produtos químicos. Uma quantidade considerável também é importante para a ativação de poços de petróleo e como licor de salmoura - um ácido usado para remover o revestimento de óxido de ferro ou aço que deve ser galvanizado, estanhado ou esmaltado. As quantidades de ácido bromídrico e ácido iodídrico usadas comercialmente são insignificantes em comparação.
Resumo
O hidrogênio é o elemento mais abundante no universo e sua química é verdadeiramente única. Embora tenha alguma reatividade química semelhante à dos metais alcalinos, o hidrogênio tem muitas das mesmas propriedades químicas de um não metal com uma eletronegatividade relativamente baixa. Ele forma hidretos iônicos com metais ativos, compostos covalentes nos quais tem um estado de oxidação de 1− com menos elementos eletronegativos e compostos covalentes nos quais tem um estado de oxidação de 1+ com mais não-metais eletronegativos. Ele reage de forma explosiva com oxigênio, flúor e cloro, menos facilmente com bromo e muito menos facilmente com iodo, enxofre e nitrogênio. O hidrogênio reduz os óxidos de metais com menores potenciais de redução do que o cromo para formar o metal e a água. Os halogenetos de hidrogênio são todos ácidos quando dissolvidos em água.
Glossário
- Processo Haber
- principal processo industrial usado para produzir amônia a partir de nitrogênio e hidrogênio; envolve o uso de um catalisador de ferro e temperaturas e pressões elevadas
- halogeneto de hidrogênio
- composto binário formado entre o hidrogênio e os halogênios: HF, HCl, HBr e HI
- hidrogenação
- adição de hidrogênio (H 2) para reduzir um composto


