17.6: Corrosão
- Page ID
- 184763
- Defina corrosão
- Listar alguns dos métodos usados para evitar ou retardar a corrosão
A corrosão é geralmente definida como a degradação de metais devido a um processo eletroquímico. A formação de ferrugem no ferro, manchas na prata e a pátina azul-esverdeada que se desenvolve no cobre são exemplos de corrosão. O custo total da corrosão nos Estados Unidos é significativo, com estimativas de mais de meio trilhão de dólares por ano.
A Estátua da Liberdade é um marco que todo americano reconhece. A Estátua da Liberdade é facilmente identificada por sua altura, postura e cor azul-esverdeada única. Quando esta estátua foi entregue pela primeira vez da França, sua aparência não era verde. Era marrom, da cor de sua “pele” de cobre. Então, como a Estátua da Liberdade mudou de cor? A mudança na aparência foi resultado direto da corrosão. O cobre, que é o principal componente da estátua, sofreu lentamente a oxidação do ar. As reações de oxidação-redução do metal de cobre no ambiente ocorrem em várias etapas. O cobre metálico é oxidado em óxido de cobre (I\(\ce{Cu_2O}\)) (), que é vermelho, e depois em óxido de cobre (II), que é preto.
\[\ce{2Cu(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)}} \nonumber \]
\[\ce{Cu2O(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{black}}{\ce{2CuO(s)}} \nonumber \]
O carvão, que geralmente era rico em enxofre, foi queimado extensivamente no início do século passado. Como resultado, trióxido de enxofre, dióxido de carbono e água reagiram com\(\ce{CuO}\) o.
\[\ce{2CuO(s)}+\ce{CO2(g)} + \ce{H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_2CO3(OH)2(s)}} \nonumber \]
\[\ce{3CuO(s)}+\ce{2CO2(g)}+\ce{H2O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)_2(OH)2(s)}} \nonumber \]
\[\ce{4CuO(s)}+\ce{SO3(g)}+\ce{3H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_4SO_4(OH)6(s)}} \nonumber \]
Esses três compostos são responsáveis pela pátina azul-esverdeada característica vista hoje. Felizmente, a formação da pátina criou uma camada protetora na superfície, evitando uma maior corrosão da camada de cobre. A formação da camada protetora é uma forma de passivação, que será discutida mais adiante em um capítulo posterior.
Talvez o exemplo mais familiar de corrosão seja a formação de ferrugem no ferro. O ferro enferruja quando exposto ao oxigênio e à água. As principais etapas na ferrugem do ferro parecem envolver o seguinte. Uma vez exposto à atmosfera, o ferro oxida rapidamente.
\[\textrm{anode: }\ce{Fe}_{(s)} \rightarrow \ce{Fe^{2+}}_{(aq)}+\ce{2e^-}\;\;\; E^\circ_{\ce{Fe^{2+}/Fe}}=\mathrm{−0.44\: V} \nonumber \]
Os elétrons reduzem o oxigênio no ar em soluções ácidas.
\[\textrm{cathode: }\ce{O}_{2(g)}+\ce{4H^+}_{(aq)}+\ce{4e^-} \rightarrow \ce{2H_2O}_{(l)}\;\; E^\circ_{\ce{O_2/O_2}}=\mathrm{+1.23\; V} \nonumber \]
\[\textrm{overall: }\ce{2Fe}_{(s)}+\ce{O}_{2(g)}+\ce{4H^+}_{(aq)} \rightarrow \ce{2Fe^{2+}}_{(aq)}+\ce{2H_2O}_{(l)} \;\;\;E^\circ_\ce{cell}=\mathrm{+1.67\; V} \nonumber \]
O que chamamos de ferrugem é o óxido de ferro (III) hidratado, que se forma quando os íons de ferro (II) reagem ainda mais com o oxigênio.
\[\ce{4Fe^{2+}}_{(aq)}+\ce{O}_{2(g)}+(4+2x)\ce{H_2O}_{(l)} \rightarrow \ce{2Fe_2O_3} \cdot x\ce{H_2O}_{(s)}+\ce{8H^+}_{(aq)} \nonumber \]
O número de moléculas de água é variável, então é representado por x. Ao contrário da pátina do cobre, a formação de ferrugem não cria uma camada protetora e, portanto, a corrosão do ferro continua à medida que a ferrugem se desprende e expõe o ferro fresco à atmosfera.
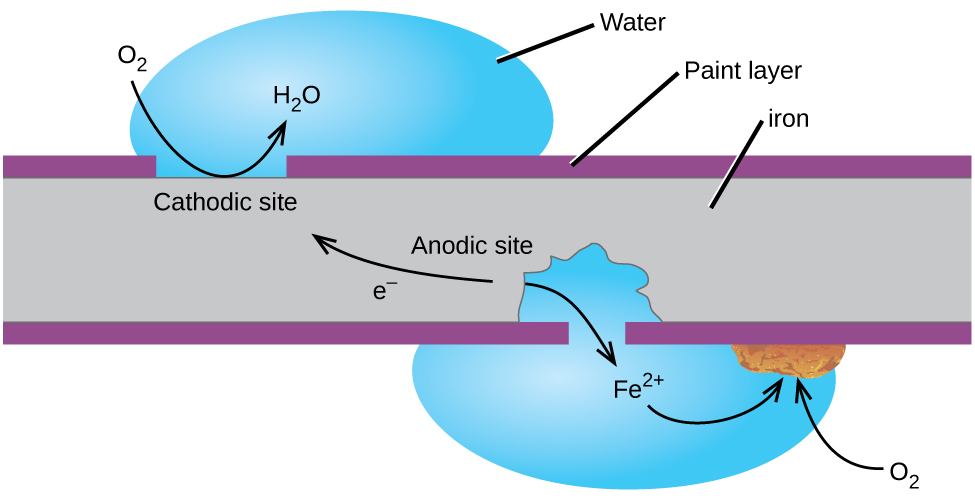
Uma maneira de evitar que o ferro corroa é mantê-lo pintado. A camada de tinta evita que a água e o oxigênio necessários para a formação de ferrugem entrem em contato com o ferro. Enquanto a tinta permanecer intacta, o ferro estará protegido da corrosão.
Outras estratégias incluem a liga do ferro com outros metais. Por exemplo, o aço inoxidável é principalmente ferro com um pouco de cromo. O cromo tende a se acumular próximo à superfície, onde forma uma camada de óxido que protege o ferro.
O ferro zincado ou galvanizado usa uma estratégia diferente. O zinco é mais facilmente oxidado do que o ferro porque o zinco tem um potencial de redução menor. Como o zinco tem um potencial de redução menor, é um metal mais ativo. Assim, mesmo que o revestimento de zinco esteja arranhado, o zinco ainda se oxidará antes do ferro. Isso sugere que essa abordagem deve funcionar com outros metais ativos.

Outra forma importante de proteger o metal é torná-lo o cátodo em uma célula galvânica. Essa é uma proteção catódica e pode ser usada para outros metais além do ferro. Por exemplo, a ferrugem de tanques e tubulações subterrâneas de armazenamento de ferro pode ser evitada ou reduzida consideravelmente conectando-os a um metal mais ativo, como zinco ou magnésio. Isso também é usado para proteger as peças de metal nos aquecedores de água. Os metais mais ativos (menor potencial de redução) são chamados de ânodos sacrificiais porque, à medida que se esgotam, corroem (oxidam) no ânodo. O metal protegido serve como cátodo e, portanto, não oxida (corrói). Quando os ânodos são monitorados adequadamente e substituídos periodicamente, a vida útil do tanque de armazenamento de ferro pode ser bastante estendida.
Resumo
A corrosão é a degradação de um metal causada por um processo eletroquímico. Grandes somas de dinheiro são gastas a cada ano reparando ou prevenindo os efeitos da corrosão. Alguns metais, como alumínio e cobre, produzem uma camada protetora quando corroem no ar. A fina camada que se forma na superfície do metal impede que o oxigênio entre em contato com mais átomos de metal e, assim, “protege” o metal restante de corrosão adicional. O ferro corrói (forma ferrugem) quando exposto à água e ao oxigênio. A ferrugem que se forma no metal de ferro se desprende, expondo o metal fresco, que também corrói. Uma forma de evitar ou retardar a corrosão é revestir o metal. O revestimento evita que a água e o oxigênio entrem em contato com o metal. A tinta ou outros revestimentos retardam a corrosão, mas não são eficazes depois de arranhados. O ferro zincado ou galvanizado explora o fato de que o zinco tem maior probabilidade de oxidar do que o ferro. Enquanto o revestimento permanecer, mesmo que seja arranhado, o zinco se oxidará antes do ferro. Outro método para proteger metais é a proteção catódica. Nesse método, um metal facilmente oxidado e barato, geralmente zinco ou magnésio (o ânodo sacrificial), é conectado eletricamente ao metal que deve ser protegido. O metal mais ativo é o ânodo sacrificial e é o ânodo em uma célula galvânica. O metal “protegido” é o cátodo e permanece não oxidado. Uma vantagem da proteção catódica é que o ânodo sacrificial pode ser monitorado e substituído, se necessário.
Glossário
- proteção catódica
- método de proteger o metal usando um ânodo sacrificial e fabricando efetivamente o metal que precisa proteger o cátodo, evitando assim sua oxidação
- corrosão
- degradação do metal por meio de um processo eletroquímico
- ferro galvanizado
- método para proteger o ferro cobrindo-o com zinco, que se oxidará antes do ferro; ferro zincado
- ânodo sacrificial
- metal mais ativo e barato usado como ânodo na proteção catódica; frequentemente feito de magnésio ou zinco


