17.3: Potenciais de redução padrão
- Page ID
- 184736
- Determine os potenciais celulares padrão para reações de redução de oxidação
- Use potenciais de redução padrão para determinar o melhor agente oxidante ou redutor dentre várias opções possíveis
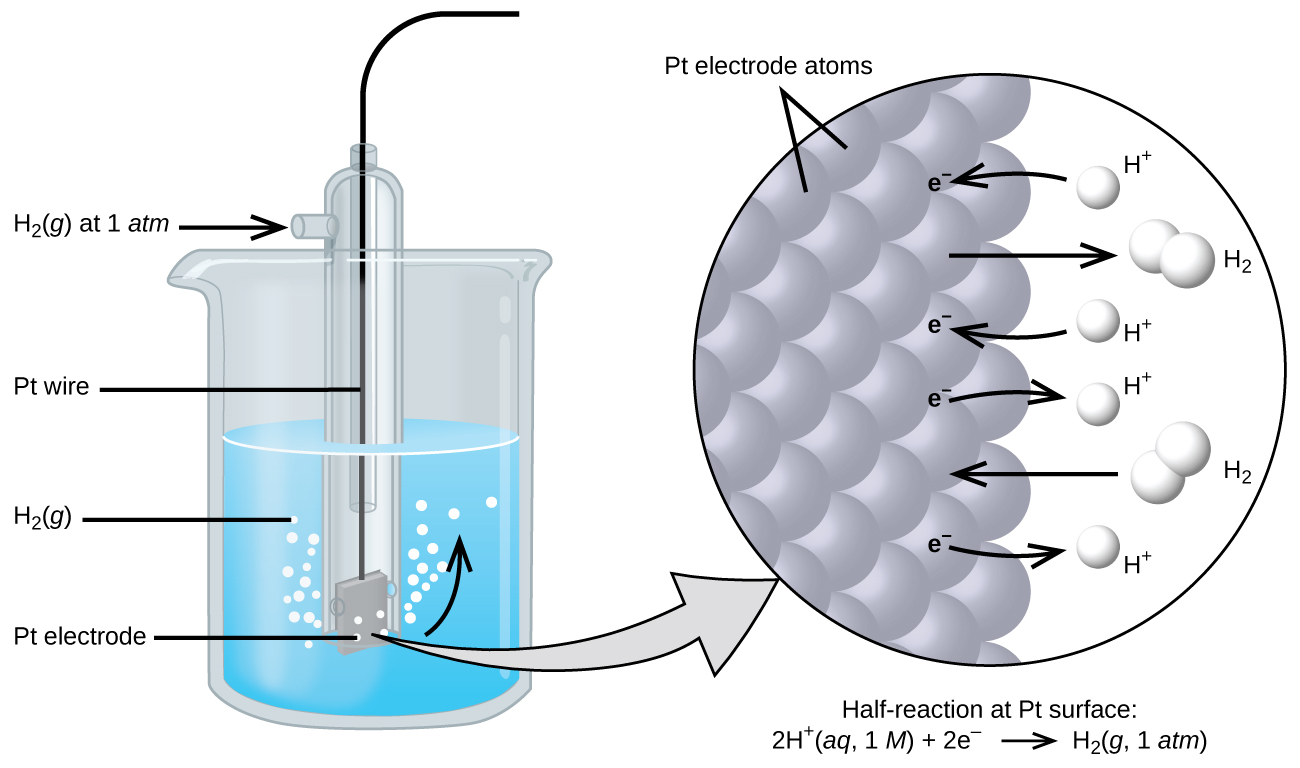
O potencial da célula resulta da diferença nos potenciais elétricos de cada eletrodo. Embora seja impossível determinar o potencial elétrico de um único eletrodo, podemos atribuir a um eletrodo o valor zero e depois usá-lo como referência. O eletrodo escolhido como zero é mostrado na Figura 17.4.1 e é chamado de eletrodo de hidrogênio padrão (SHE). O SHE consiste em 1 atm de gás hidrogênio borbulhado através de uma solução de HCl de 1 M, geralmente à temperatura ambiente. A platina, que é quimicamente inerte, é usada como eletrodo. A meia-reação de redução escolhida como referência é
\[\ce{2H+}(aq,\: 1\:M)+\ce{2e-}⇌\ce{H2}(g,\:1\: \ce{atm}) \hspace{20px} E°=\mathrm{0\: V} \nonumber \]
E° é o potencial de redução padrão. O sobrescrito “°” no E indica condições padrão (1 bar ou 1 atm para gases, 1 M para solutos). A tensão é definida como zero para todas as temperaturas.
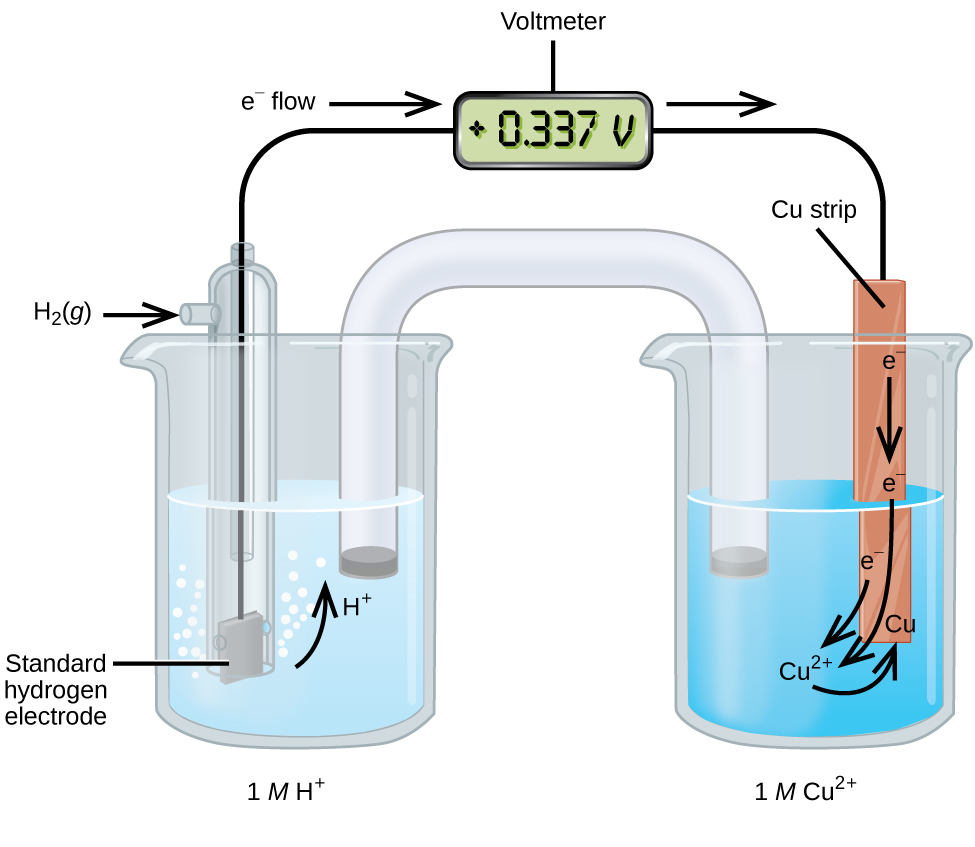
Uma célula galvânica que consiste em uma meia-célula SHE e Cu 2 + /Cu pode ser usada para determinar o potencial de redução padrão para Cu 2 + (Figura\(\PageIndex{2}\)). Na notação celular, a reação é
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\:1\:M)║\ce{Cu^2+}(aq,\:1\:M)│\ce{Cu}(s) \nonumber \]
Os elétrons fluem do ânodo para o cátodo. As reações, que são reversíveis, são
\ [\ begin {align*}
&\ textrm {Ânodo (oxidação):}\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2e-}\\
&\ textrm {Cátodo (redução):}\ ce {Cu^2+} (aq) +\ ce {2e-} ⟶\ ce {Cu} (s)\\
&\ overline {\ textrm {Geral:}\ ce {Cu^2+} (aq) +\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {Cu} (s)}
\ end {align* }\ nonumber\]
O potencial de redução padrão pode ser determinado subtraindo o potencial de redução padrão para a reação que ocorre no ânodo do potencial de redução padrão para a reação que ocorre no cátodo. O sinal negativo é necessário porque a oxidação é o inverso da redução.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.34\: V}=E^\circ_{\ce{Cu^2+/Cu}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Cu^2+/Cu}}−0=E^\circ_{\ce{Cu^2+/Cu}} \nonumber \]
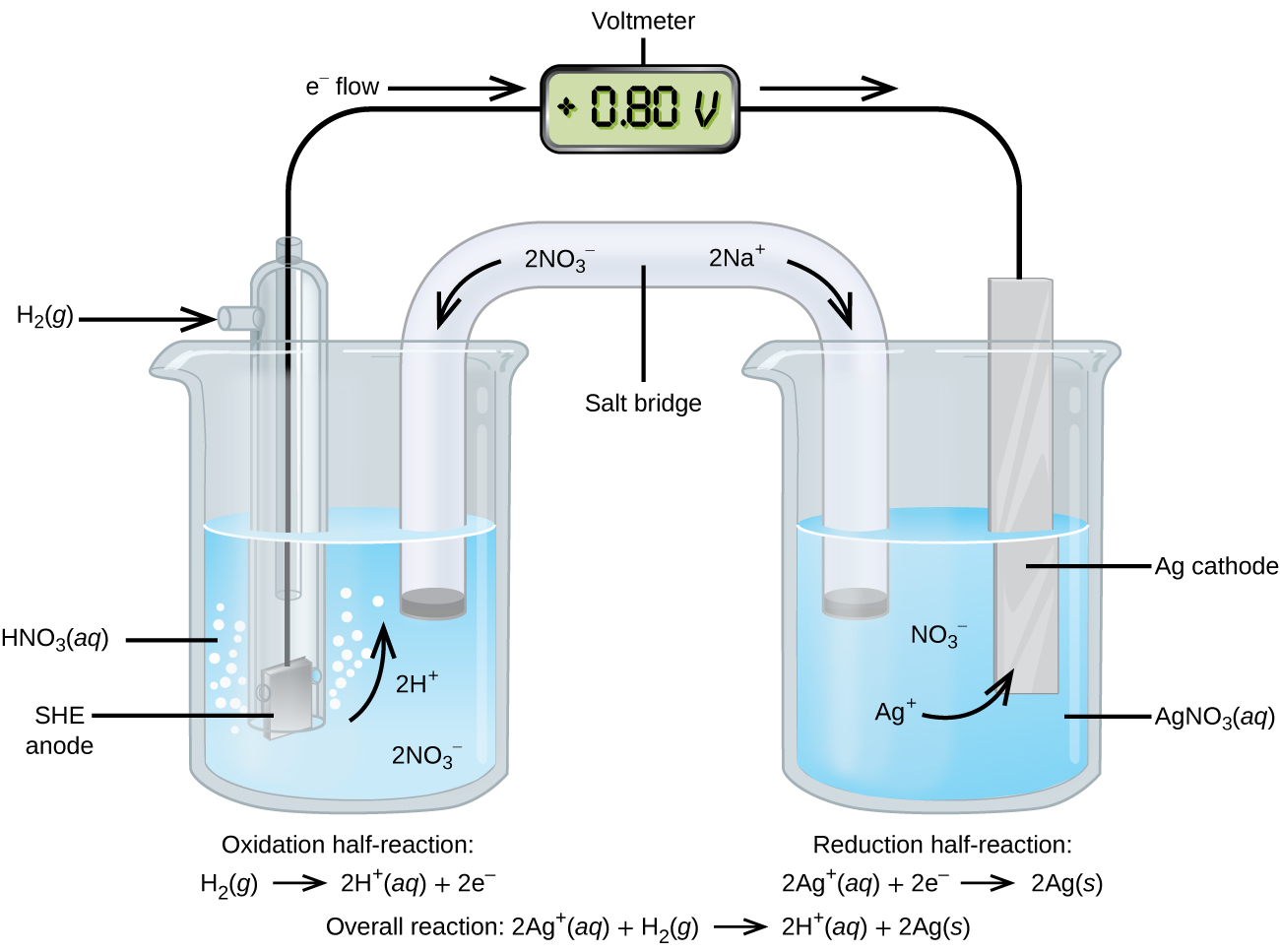
Usando o SHE como referência, outros potenciais de redução padrão podem ser determinados. Considere a célula mostrada na Figura\(\PageIndex{2}\), onde
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Os elétrons fluem da esquerda para a direita e as reações são
\ [\ begin {align*}
&\ textrm {ânodo (oxidação):}\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (redução):}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s)\\
&\ overline {\ textrm {geral:}\ ce {2Ag+} (aq) +\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2Ag} (s)}
\ end {align*} \ nonumber\]
O potencial de redução padrão pode ser determinado subtraindo o potencial de redução padrão para a reação que ocorre no ânodo do potencial de redução padrão para a reação que ocorre no cátodo. O sinal negativo é necessário porque a oxidação é o inverso da redução.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.80\: V}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Ag+/Ag}}−0=E^\circ_{\ce{Ag+/Ag}} \nonumber \]
É importante observar que o potencial não é dobrado para a reação catódica.
O SHE é bastante perigoso e raramente usado em laboratório. Seu principal significado é que ele estabeleceu o zero para potenciais de redução padrão. Uma vez determinados, os potenciais de redução padrão podem ser usados para determinar o potencial celular padrão,\(E^\circ_\ce{cell}\), para qualquer célula. Por exemplo, para a seguinte célula:
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\:1\:M)║\ce{Ag+}(aq,\:1\:M)│\ce{Ag}(s) \nonumber \]
\ [\ begin {align*}
&\ textrm {ânodo (oxidação):}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (redução):}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s))\\
&\ overline {\ textrm {geral:}\ ce {Cu} (s) +\ ce {2Ag+} (aq) ⟶\ ce {Cu^2+} (aq) +\ ce {2Ag} (s)}
\ end { alinhamento*}\ nonumber\]
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{Cu^2+/Cu}}=\mathrm{0.80\: V−0.34\: V=0.46\: V} \nonumber \]
Novamente, observe que, ao calcular\(E^\circ_\ce{cell}\), os potenciais de redução padrão sempre permanecem os mesmos, mesmo quando uma meia-reação é multiplicada por um fator. Os potenciais de redução padrão para reações de redução selecionadas são mostrados na Tabela\(\PageIndex{1}\). Uma lista mais completa é fornecida nas Tabelas P1 ou P2.
| Meia-reação | E° (V) |
|---|---|
| \(\ce{F2}(g)+\ce{2e-}⟶\ce{2F-}(aq)\) | +2.866 |
| \(\ce{PbO2}(s)+\ce{SO4^2-}(aq)+\ce{4H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)\) | +1,69 |
| \(\ce{MnO4-}(aq)+\ce{8H+}(aq)+\ce{5e-}⟶\ce{Mn^2+}(aq)+\ce{4H2O}(l)\) | +1.507 |
| \(\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s)\) | +1.498 |
| \(\ce{Cl2}(g)+\ce{2e-}⟶\ce{2Cl-}(aq)\) | +1.35827 |
| \(\ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-}⟶\ce{2H2O}(l)\) | +1.229 |
| \(\ce{Pt^2+}(aq)+\ce{2e-}⟶\ce{Pt}(s)\) | +1,20 |
| \(\ce{Br2}(aq)+\ce{2e-}⟶\ce{2Br-}(aq)\) | +1.0873 |
| \(\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)\) | +0,7996 |
| \(\ce{Hg2^2+}(aq)+\ce{2e-}⟶\ce{2Hg}(l)\) | +0.7973 |
| \(\ce{Fe^3+}(aq)+\ce{e-}⟶\ce{Fe^2+}(aq)\) | +0,771 |
| \(\ce{MnO4-}(aq)+\ce{2H2O}(l)+\ce{3e-}⟶\ce{MnO2}(s)+\ce{4OH-}(aq)\) | +0,558 |
| \(\ce{I2}(s)+\ce{2e-}⟶\ce{2I-}(aq)\) | +0,5355 |
| \(\ce{NiO2}(s)+\ce{2H2O}(l)+\ce{2e-}⟶\ce{Ni(OH)2}(s)+\ce{2OH-}(aq)\) | +0,49 |
| \(\ce{Cu^2+}(aq)+\ce{2e-}⟶\ce{Cu}(s)\) | +0,34 |
| \(\ce{Hg2Cl2}(s)+\ce{2e-}⟶\ce{2Hg}(l)+\ce{2Cl-}(aq)\) | +0,26808 |
| \(\ce{AgCl}(s)+\ce{e-}⟶\ce{Ag}(s)+\ce{Cl-}(aq)\) | +0,22233 |
| \(\ce{Sn^4+}(aq)+\ce{2e-}⟶\ce{Sn^2+}(aq)\) | +0,151 |
| \(\ce{2H+}(aq)+\ce{2e-}⟶\ce{H2}(g)\) | 0,00 |
| \(\ce{Pb^2+}(aq)+\ce{2e-}⟶\ce{Pb}(s)\) | −0,1262 |
| \(\ce{Sn^2+}(aq)+\ce{2e-}⟶\ce{Sn}(s)\) | −0,1375 |
| \(\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s)\) | −0,257 |
| \(\ce{Co^2+}(aq)+\ce{2e-}⟶\ce{Co}(s)\) | −0,28 |
| \(\ce{PbSO4}(s)+\ce{2e-}⟶\ce{Pb}(s)+\ce{SO4^2-}(aq)\) | −0,3505 |
| \(\ce{Cd^2+}(aq)+\ce{2e-}⟶\ce{Cd}(s)\) | −0,4030 |
| \(\ce{Fe^2+}(aq)+\ce{2e-}⟶\ce{Fe}(s)\) | −0,447 |
| \(\ce{Cr^3+}(aq)+\ce{3e-}⟶\ce{Cr}(s)\) | −0,744 |
| \(\ce{Mn^2+}(aq)+\ce{2e-}⟶\ce{Mn}(s)\) | −1,185 |
| \(\ce{Zn(OH)2}(s)+\ce{2e-}⟶\ce{Zn}(s)+\ce{2OH-}(aq)\) | −1,245 |
| \(\ce{Zn^2+}(aq)+\ce{2e-}⟶\ce{Zn}(s)\) | −0,7618 |
| \(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\) | −1,62 |
| \(\ce{Mg^2+}(aq)+\ce{2e-}⟶\ce{Mg}(s)\) | −2,372 |
| \(\ce{Na+}(aq)+\ce{e-}⟶\ce{Na}(s)\) | −2,71 |
| \(\ce{Ca^2+}(aq)+\ce{2e-}⟶\ce{Ca}(s)\) | −2,868 |
| \(\ce{Ba^2+}(aq)+\ce{2e-}⟶\ce{Ba}(s)\) | −2,912 |
| \(\ce{K+}(aq)+\ce{e-}⟶\ce{K}(s)\) | −2,931 |
| \(\ce{Li+}(aq)+\ce{e-}⟶\ce{Li}(s)\) | −3,04 |
Tabelas como essa permitem determinar o potencial celular padrão para muitas reações de redução de oxidação.
Qual é o potencial celular padrão para uma célula galvânica que consiste em meias-células de Au 3 + /Au e Ni 2 + /Ni? Identifique os agentes oxidantes e redutores.
Solução
Usando a Tabela\(\PageIndex{1}\), as reações envolvidas na célula galvânica, ambas escritas como reduções, são
\[\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s) \hspace{20px} E^\circ_{\ce{Au^3+/Au}}=\mathrm{+1.498\: V} \nonumber \]
\[\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s) \hspace{20px} E^\circ_{\ce{Ni^2+/Ni}}=\mathrm{−0.257\: V} \nonumber \]
As células galvânicas têm potenciais celulares positivos e todas as reações de redução são reversíveis. A reação no ânodo será a meia-reação com o potencial de redução padrão menor ou mais negativo. Reverter a reação no ânodo (para mostrar a oxidação), mas não seu potencial de redução padrão, fornece:
\ [\ begin {align*}
&\ textrm {Ânodo (oxidação):}\ ce {Ni} (s) ⟶\ ce {Ni^2+} (aq) +\ ce {2e-}\ hspace {20px} E^\ circ_\ ce {ânodo} =E^\ circ_ {\ ce {Ni^2+/Ni}} =\ mathrm {−0.257\: V}\\
&\ textrm {Cátodo (redução):}\ ce {Au^3+} (aq) +\ ce {3e-} ⟶\ ce {Au} (s)\ hspace {20px} E^\ circ_\ ce {cátodo} =E^\ circ_ {\ ce {Au ^3+/Au}} =\ mathrm {+1.498\: V}
\ end {align*}\ nonumber\]
O fator menos comum é seis, então a reação geral é
Os potenciais de redução não são escalados pelos coeficientes estequiométricos ao calcular o potencial celular, e os potenciais de redução padrão não modificados devem ser usados.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=\mathrm{1.498\: V−(−0.257\: V)=1.755\: V} \nonumber \]
A partir das meias-reações, o Ni é oxidado, então é o agente redutor, e o Au 3 + é reduzido, então é o agente oxidante.
Uma célula galvânica consiste em um eletrodo de Mg em solução de 1 M Mg (NO 3) 2 e um eletrodo de Ag em solução 1 M de AgNO 3. Calcule o potencial celular padrão a 25 °C.
- Resposta
-
\[\ce{Mg}(s)+\ce{2Ag+}(aq)⟶\ce{Mg^2+}(aq)+\ce{2Ag}(s) \hspace{20px} E^\circ_\ce{cell}=\mathrm{0.7996\: V−(−2.372\: V)=3.172\: V} \nonumber \]
Resumo
Atribuir o potencial do eletrodo de hidrogênio padrão (SHE) como zero volts permite a determinação de potenciais de redução padrão, E°, para meias-reações em células eletroquímicas. Como o nome indica, os potenciais de redução padrão usam estados padrão (1 bar ou 1 atm para gases; 1 M para solutos, geralmente a 298,15 K) e são escritos como reduções (onde os elétrons aparecem no lado esquerdo da equação). As reações de redução são reversíveis, então os potenciais celulares padrão podem ser calculados subtraindo o potencial de redução padrão da reação no ânodo da redução padrão para a reação no cátodo. Ao calcular o potencial celular padrão, os potenciais de redução padrão não são escalados pelos coeficientes estequiométricos na equação geral balanceada.
Equações chave
- \(E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}\)
Glossário
- potencial celular padrão\( (E^\circ_\ce{cell})\)
- o potencial celular quando todos os reagentes e produtos estão em seus estados padrão (1 bar ou 1 atm ou gases; 1 M para solutos), geralmente a 298,15 K; pode ser calculado subtraindo o potencial de redução padrão para a meia-reação no ânodo do potencial de redução padrão para a metade reação ocorrendo no cátodo
- eletrodo de hidrogênio padrão (SHE)
- o eletrodo consiste em gás hidrogênio borbulhando através de ácido clorídrico sobre um eletrodo de platina inerte cuja redução em condições padrão recebe um valor de 0 V; o ponto de referência para potenciais de redução padrão
- potencial de redução padrão (E°)
- o valor da redução em condições padrão (1 bar ou 1 atm para gases; 1 M para solutos) geralmente a 298,15 K; valores tabulados usados para calcular potenciais celulares padrão


