17.2: Células galvânicas
- Page ID
- 184762
- Use a notação celular para descrever células galvânicas
- Descreva os componentes básicos das células galvânicas
As células galvânicas, também conhecidas como células voltaicas, são células eletroquímicas nas quais reações espontâneas de redução de oxidação produzem energia elétrica. Ao escrever as equações, geralmente é conveniente separar as reações de redução de oxidação em meias-reações para facilitar o equilíbrio da equação geral e enfatizar as transformações químicas reais.
Considere o que acontece quando um pedaço limpo de metal de cobre é colocado em uma solução de nitrato de prata (Figura\(\PageIndex{1}\)). Assim que o metal de cobre é adicionado, o metal prateado começa a se formar e os íons de cobre passam para a solução. A cor azul da solução na extrema direita indica a presença de íons de cobre. A reação pode ser dividida em suas duas meias-reações. As meias-reações separam a oxidação da redução, então cada uma pode ser considerada individualmente.
\ [\ begin {align}
&\ textrm {oxidação:}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ underline {\ textrm {redução:} 2× (\ ce {Ag+} (aq) +\ ce {e-} ⟶\ ce {Ag} (s))\ hspace {40px}\ ce {ou}\ hspace {40px}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s)}\\
&\ textrm {geral:}\ ce {2Ag+} (aq) +\ ce {Cu} (s) ⟶\ ce {2Ag} (s) +\ ce {Cu^2+} (aq)
\ end {align}\ nonumber\]
A equação para a meia-reação de redução teve que ser dobrada para que o número de elétrons “ganhos” na meia-reação de redução fosse igual ao número de elétrons “perdidos” na meia-reação de oxidação.

As células galvânicas ou voltaicas envolvem reações eletroquímicas espontâneas nas quais as meias-reações são separadas (Figura\(\PageIndex{2}\)) para que a corrente possa fluir através de um fio externo. O copo no lado esquerdo da figura é chamado de meia célula e contém uma solução 1 M de nitrato de cobre (II) [Cu (NO 3) 2] com um pedaço de metal de cobre parcialmente submerso na solução. O metal de cobre é um eletrodo. O cobre está passando por oxidação; portanto, o eletrodo de cobre é o ânodo. O ânodo é conectado a um voltímetro com um fio e o outro terminal do voltímetro é conectado a um eletrodo de prata por um fio. A prata está passando por uma redução; portanto, o eletrodo de prata é o cátodo. A meia célula no lado direito da figura consiste no eletrodo de prata em uma solução de 1 M de nitrato de prata (AgNO 3). Nesse ponto, nenhuma corrente flui — ou seja, nenhum movimento significativo de elétrons através do fio ocorre porque o circuito está aberto. O circuito é fechado usando uma ponte de sal, que transmite a corrente com íons em movimento. A ponte de sal consiste em uma solução eletrolítica concentrada e não reativa, como a solução de nitrato de sódio (NaNO 3) usada neste exemplo. À medida que os elétrons fluem da esquerda para a direita através do eletrodo e do fio, os íons nitrato (ânions) passam pelo tampão poroso à esquerda para a solução de nitrato de cobre (II). Isso mantém o copo à esquerda eletricamente neutro, neutralizando a carga nos íons de cobre (II) que são produzidos na solução à medida que o metal de cobre é oxidado. Ao mesmo tempo, os íons nitrato estão se movendo para a esquerda, os íons de sódio (cátions) se movem para a direita, através do tampão poroso e para a solução de nitrato de prata à direita. Esses cátions adicionados “substituem” os íons de prata que são removidos da solução à medida que foram reduzidos a metal prateado, mantendo o copo à direita eletricamente neutro. Sem a ponte de sal, os compartimentos não permaneceriam eletricamente neutros e nenhuma corrente significativa fluiria. No entanto, se os dois compartimentos estiverem em contato direto, não é necessária uma ponte de sal. No instante em que o circuito é concluído, o voltímetro lê +0,46 V, isso é chamado de potencial celular. O potencial celular é criado quando os dois metais diferentes são conectados e é uma medida da energia por unidade de carga disponível na reação de redução de oxidação. O volt é a unidade SI derivada para potencial elétrico
\[\mathrm{volt=\mathit{V}=\dfrac{J}{C}} \nonumber \]
Nesta equação, A é a corrente em amperes e C a carga em coulombs. Observe que os volts devem ser multiplicados pela carga em coulombs (C) para obter a energia em joules (J).
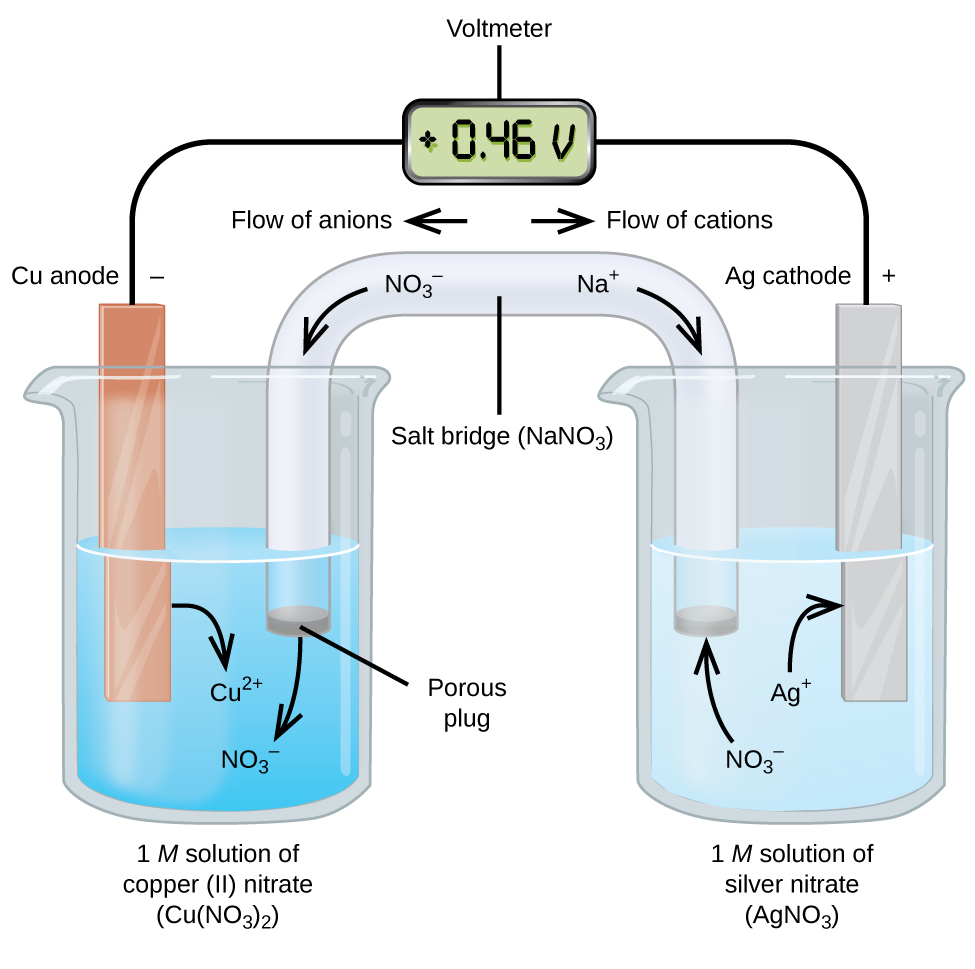
Quando a célula eletroquímica é construída dessa forma, um potencial celular positivo indica uma reação espontânea e que os elétrons estão fluindo da esquerda para a direita. Há muita coisa acontecendo na Figura\(\PageIndex{2}\), por isso é útil resumir as coisas para esse sistema:
- Os elétrons fluem do ânodo para o cátodo: da esquerda para a direita na célula galvânica padrão da figura.
- O eletrodo na meia-célula esquerda é o ânodo porque a oxidação ocorre aqui. O nome se refere ao fluxo de ânions na ponte de sal em direção a ela.
- O eletrodo na meia-célula direita é o cátodo porque a redução ocorre aqui. O nome se refere ao fluxo de cátions na ponte de sal em direção a ela.
- A oxidação ocorre no ânodo (a meia célula esquerda na figura).
- A redução ocorre no cátodo (a meia célula direita na figura).
- O potencial celular, +0,46 V, neste caso, resulta das diferenças inerentes na natureza dos materiais usados para fazer as duas meias-células.
- A ponte de sal deve estar presente para fechar (completar) o circuito e tanto uma oxidação quanto uma redução devem ocorrer para que a corrente flua.
Existem muitas células galvânicas possíveis, então uma notação abreviada geralmente é usada para descrevê-las. A notação celular (às vezes chamada de diagrama celular) fornece informações sobre as várias espécies envolvidas na reação. Essa notação também funciona para outros tipos de células. Uma linha vertical, │, denota um limite de fase e uma linha dupla, ‖, a ponte de sal. As informações sobre o ânodo são gravadas à esquerda, seguidas pela solução do ânodo, depois pela ponte de sal (quando presente), depois pela solução do cátodo e, finalmente, pelas informações sobre o cátodo à direita. A notação celular para a célula galvânica na Figura\(\PageIndex{2}\) é então
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Observe que os íons do espectador não estão incluídos e que a forma mais simples de cada meia-reação foi usada. Quando conhecidas, as concentrações iniciais dos vários íons geralmente são incluídas.
Uma das células mais simples é a célula Daniell. É possível construir essa bateria colocando um eletrodo de cobre no fundo de uma jarra e cobrindo o metal com uma solução de sulfato de cobre. Uma solução de sulfato de zinco é colocada sobre a solução de sulfato de cobre; em seguida, um eletrodo de zinco é colocado na solução de sulfato de zinco. Conectar o eletrodo de cobre ao eletrodo de zinco permite que uma corrente elétrica flua. Este é um exemplo de uma célula sem uma ponte de sal, e os íons podem fluir pela interface entre as duas soluções.
Algumas reações de redução de oxidação envolvem espécies que são maus condutores de eletricidade e, portanto, é usado um eletrodo que não participa das reações. Freqüentemente, o eletrodo é platina, ouro ou grafite, todos inertes a muitas reações químicas. Um desses sistemas é mostrado na Figura\(\PageIndex{3}\). O magnésio sofre oxidação no ânodo à esquerda na figura e os íons de hidrogênio sofrem redução no cátodo à direita. A reação pode ser resumida como
\ [\ begin {align}
&\ textrm {oxidação:}\ ce {Mg} (s) ⟶\ ce {Mg^2+} (aq) +\ ce {2e-}\\
&\ textrm {redução:}\ ce {2H+} (aq) +\ ce {2e-} ⟶\ ce {H2} (g)\\
&\ overline {textrm {geral:}\ ce {Mg} (s) +\ ce {2H+} (aq) ⟶\ ce {Mg^2+} (aq) +\ ce {H2} (g)}
\ end {align}\ nonumber\]
A célula usou um fio de platina inerte para o cátodo, então a notação celular é
\[\ce{Mg}(s)│\ce{Mg^2+}(aq)║\ce{H+}(aq)│\ce{H2}(g)│\ce{Pt}(s) \nonumber \]
O eletrodo de magnésio é um eletrodo ativo porque participa da reação de redução da oxidação. Eletrodos inertes, como o eletrodo de platina na Figura\(\PageIndex{3}\), não participam da reação de redução de oxidação e estão presentes para que a corrente possa fluir pela célula. Platina ou ouro geralmente são bons eletrodos inertes porque não são quimicamente reativos.

Considere uma célula galvânica que consiste em
\[\ce{2Cr}(s)+\ce{3Cu^2+}(aq)⟶\ce{2Cr^3+}(aq)+\ce{3Cu}(s) \nonumber \]
Escreva as meias-reações de oxidação e redução e escreva a reação usando a notação celular. Qual reação ocorre no ânodo? O cátodo?
Solução
Por inspeção, o Cr é oxidado quando três elétrons são perdidos para formar o Cr 3 +, e o Cu 2+ é reduzido à medida que ganha dois elétrons para formar o Cu. Equilibrar a carga dá
\ [\ begin {align}
&\ textrm {oxidação:}\ ce {2Cr} (s) ⟶\ ce {2Cr^3+} (aq) +\ ce {6e-}\\
&\ textrm {redução:}\ ce {3Cu^2+} (aq) +\ ce {6e-} ⟶\ ce {3Cu} (s)\\
&\ &\ overline {\ textrm {geral:}\ ce {2Cr} (s) +\ ce {3Cu^2+} (aq) ⟶\ ce {2Cr^3+} (aq) +\ ce {3Cu} (s)}
\ end {align}\ número\]
A notação celular usa a forma mais simples de cada uma das equações e começa com a reação no ânodo. Nenhuma concentração foi especificada para:
\[\ce{Cr}(s)│\ce{Cr^3+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s). \nonumber \]
A oxidação ocorre no ânodo e a redução no cátodo.
Considere uma célula galvânica que consiste em
\[\ce{5Fe^2+}(aq)+\ce{MnO4-}(aq)+\ce{8H+}(aq)⟶\ce{5Fe^3+}(aq)+\ce{Mn^2+}(aq)+\ce{4H2O}(l) \nonumber \]
Escreva as meias-reações de oxidação e redução e escreva a reação usando a notação celular. Qual reação ocorre no ânodo? O cátodo?
Solução
Por inspeção, o Fe 2+ sofre oxidação quando um elétron é perdido para formar o Fe 3 +, e o MnO 4 − é reduzido à medida que ganha cinco elétrons para formar Mn 2 +. Equilibrar a carga dá
\ [\ begin {align}
&\ textrm {oxidação:} 5 (\ ce {Fe^2+} (aq) ⟶\ ce {Fe^3+} (aq) +\ ce {e-})\\
&\ sublinhado {\ textrm {redução:}\ ce {MnO4-} (aq) +\ ce {8H+} (aq)\ + {5e-} ⟶\ ce {Mn^2+} (aq) +\ ce {4H2O} (l)}\\
&\ textrm {geral:}\ ce {5Fe^2+} (aq) +\ ce {MnO4-} (aq) +\ ce {8H+} (aq) ⟶\ ce {5Fe^3+} (aq) ) +\ ce {Mn^2+} (aq) +\ ce {4H2O} (l)
\ end {align}\ nonumber\]
A notação celular usa a forma mais simples de cada uma das equações e começa com a reação no ânodo. É necessário usar um eletrodo inerte, como a platina, porque não há metal presente para conduzir os elétrons do ânodo para o cátodo. Nenhuma concentração foi especificada para:
\[\ce{Pt}(s)│\ce{Fe^2+}(aq),\: \ce{Fe^3+}(aq)║\ce{MnO4-}(aq),\: \ce{H+}(aq),\: \ce{Mn^2+}(aq)│\ce{Pt}(s). \nonumber \]
A oxidação ocorre no ânodo e a redução no cátodo.
Use a notação celular para descrever a célula galvânica em que os íons de cobre (II) são reduzidos a cobre metálico e o zinco metálico é oxidado em íons de zinco.
- Resposta
-
A partir das informações fornecidas no problema:
\ [\ begin {align}
&\ textrm {ânodo (oxidação):}\ ce {Zn} (s) ⟶\ ce {Zn^2+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (redução):}\ ce {Cu^2+} (aq) +\ ce {2e-} ⟶\ ce {Cu} (s)\\
&\ overline {\ textrm {geral:}\ ce {Zn} (s) +\ ce {Cu^2+} (aq) ⟶\ ce {Zn^2+} (aq) +\ ce {Cu} (s)}
\ end {align}\ nonumber\]Usando a notação celular:
\[\ce{Zn}(s)│\ce{Zn^2+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s) \nonumber. \nonumber \]
Resumo
As células eletroquímicas normalmente consistem em duas meias-células. As meias-células separam a meia-reação de oxidação da meia-reação de redução e possibilitam que a corrente flua através de um fio externo. Uma meia célula, normalmente representada no lado esquerdo em uma figura, contém o ânodo. A oxidação ocorre no ânodo. O ânodo é conectado ao cátodo na outra meia célula, geralmente mostrado no lado direito em uma figura. A redução ocorre no cátodo. Adicionar uma ponte de sal completa o circuito, permitindo que a corrente flua. Os ânions na ponte de sal fluem em direção ao ânodo e os cátions na ponte de sal fluem em direção ao cátodo. O movimento desses íons completa o circuito e mantém cada meia célula eletricamente neutra. As células eletroquímicas podem ser descritas usando a notação celular. Nessa notação, as informações sobre a reação no ânodo aparecem à esquerda e as informações sobre a reação no cátodo à direita. A ponte de sal é representada por uma linha dupla, ‖. As fases sólida, líquida ou aquosa dentro de uma meia célula são separadas por uma única linha, │. A fase e a concentração das várias espécies são incluídas após o nome da espécie. Os eletrodos que participam da reação de redução da oxidação são chamados de eletrodos ativos. Eletrodos que não participam da reação de redução de oxidação, mas existem para permitir que a corrente flua, são eletrodos inertes. Os eletrodos inertes geralmente são feitos de platina ou ouro, que permanecem inalterados por muitas reações químicas.
Glossário
- eletrodo ativo
- eletrodo que participa da reação de redução de oxidação de uma célula eletroquímica; a massa de um eletrodo ativo muda durante a reação de redução de oxidação
- ânodo
- eletrodo em uma célula eletroquímica na qual ocorre a oxidação; as informações sobre o ânodo são registradas no lado esquerdo da ponte de sal na notação celular
- cátodo
- eletrodo em uma célula eletroquímica na qual ocorre a redução; as informações sobre o cátodo são registradas no lado direito da ponte de sal na notação celular
- notação celular
- forma abreviada de representar as reações em uma célula eletroquímica
- potencial celular
- diferença no potencial elétrico que surge quando metais diferentes são conectados; a força motriz para o fluxo de carga (corrente) em reações de redução de oxidação
- célula galvânica
- célula eletroquímica que envolve uma reação espontânea de redução de oxidação; células eletroquímicas com potenciais celulares positivos; também chamada de célula voltaica
- eletrodo inerte
- eletrodo que permite que a corrente flua, mas que de outra forma não participa da reação de redução de oxidação em uma célula eletroquímica; a massa de um eletrodo inerte não muda durante a reação de redução de oxidação; eletrodos inertes geralmente são feitos de platina ou ouro porque esses metais são quimicamente não reativo.
- célula voltaica
- outro nome para uma célula galvânica


