14.E: Equilíbrios ácido-base (exercícios)
- Page ID
- 185541
14.1: Ácidos e bases de Brønsted-Lowry
Q14.1.1
Escreva equações que mostrem NH 3 tanto como ácido conjugado quanto como base conjugada.
S14.1.1
Um exemplo de NH 3 como ácido conjugado:\(\ce{NH2- + H+ ⟶ NH3}\); como base conjugada:\(\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l)\)
Q14.1.2
Escreva equações que\(\ce{H2PO4-}\) mostrem atuar tanto como ácido quanto como base.
Q14.1.3
Mostre, por meio de equações iônicas de rede adequadas, que cada uma das seguintes espécies pode atuar como um ácido Brønsted-Lowry:
- \(\ce{H3O+}\)
- HCl
- NH 3
- CH 3 CO 2 H
- \(\ce{NH4+}\)
- \(\ce{HSO4-}\)
S14.1.3
- \(\ce{H3O+}(aq)⟶\ce{H+}(aq)+ \ce{H_2O}_{(l)}\);
- \(\ce{HCl}(l)⟶\ce{H+}(aq)+\ce{Cl-}(aq)\);
- \(\ce{NH3}(aq)⟶\ce{H+}(aq)+\ce{NH2-}(aq)\);
- \(\ce{CH3CO2H}(aq)⟶\ce{H+}(aq)+\ce{CH3CO2-}(aq)\);
- \(\ce{NH4+}(aq)⟶\ce{H+}(aq)+\ce{NH3}(aq)\);
- \(\ce{HSO4-}(aq)⟶\ce{H+}(aq)+\ce{SO4^2-}(aq)\)
Q14.1.4
Mostre, por meio de equações iônicas de rede adequadas, que cada uma das seguintes espécies pode atuar como um ácido Brønsted-Lowry:
- NÃO 3
- \(\ce{PH4+}\)
- H 2 S
- CH 3 CH 2 COOH
- \(\ce{H2PO4-}\)
- HS −
Q14.1.5
Mostre, por meio de equações iônicas de rede adequadas, que cada uma das seguintes espécies pode atuar como uma base de Brønsted-Lowry:
- H 2 O
- \(\ce{OH-}\)
- NH 3
- CN −
- S 2−
- \(\ce{H2PO4-}\)
S 14.1.5
- \(\ce{H_2O}_{(l)} + \ce{H^+} (aq)⟶\ce{H3O+}(aq)\)
- \(\ce{OH-} (aq) + \ce{H^+} (aq)⟶ \ce{H_2O}_{(l)}\)
- \(\ce{NH3}(aq) + \ce{H^+} (aq)⟶\ce{NH4+}(aq)\);
- \(\ce{CN-}(aq) + \ce{H^+} (aq)⟶\ce{HCN}(aq)\)
- \(\ce{S^2-}(aq) + \ce{H^+} (aq)⟶\ce{HS-}(aq)\)
- \(\ce{H2PO4-}(aq) + \ce{H^+} (aq)⟶\ce{H3PO4}(aq)\)
Q14.1.6
Mostre, por meio de equações iônicas de rede adequadas, que cada uma das seguintes espécies pode atuar como uma base de Brønsted-Lowry:
- HS −
- \(\ce{PO4^3-}\)
- \(\ce{NH2-}\)
- C 2 H 5 OH
- O 2−
- \(\ce{H2PO4-}\)
Q14.1.7
Qual é o ácido conjugado de cada um dos seguintes? Qual é a base conjugada de cada um?
- \(\ce{OH-}\)
- H 2 O
- \(\ce{HCO3-}\)
- NH 3
- \(\ce{HSO4-}\)
- H 2 OU 2
- HS −
- \(\ce{H5N2+}\)
S14.1.7
H 2 O, O 2−; H 3 O +,\(\ce{OH^-}\); H 2 CO 3,\(\ce{CO3^2-}\);\(\ce{NH4+}\),\(\ce{NH2-}\); H 2 SO 4,\(\ce{SO4^2-}\);\(\ce{H3O2+}\),\(\ce{HO2-}\); H 2 S; S 2−;\(\ce{H6N2^2+}\), H 4 N 2
Q14.1.8
Qual é o ácido conjugado de cada um dos seguintes? Qual é a base conjugada de cada um?
- H 2 S
- \(\ce{H2PO4-}\)
- PH 3
- HS −
- \(\ce{HSO3-}\)
- \(\ce{H3O2+}\)
- H 4 EM 2
- CH 3 OH
Q14.1.9
Identifique e rotule o ácido Brønsted-Lowry, sua base conjugada, a base de Brønsted-Lowry e seu ácido conjugado em cada uma das seguintes equações:
- \(\ce{HNO3 + H2O ⟶ H3O+ + NO3-}\)
- \(\ce{CN- + H2O ⟶ HCN + OH-}\)
- \(\ce{H2SO4 + Cl- ⟶ HCl + HSO4-}\)
- \(\ce{HSO4- + OH- ⟶ SO4^2- + H2O}\)
- \(\ce{O^2- + H2O ⟶ 2OH-}\)
- \(\ce{[Cu(H2O)3(OH)]+ + [Al(H2O)6]^3+ ⟶ [Cu(H2O)4]^2+ + [Al(H2O)5(OH)]^2+}\)
- \(\ce{H2S + NH2- ⟶ HS- + NH3}\)
S14.1.9
Os rótulos são ácido Brønsted-Lowry = BA; sua base conjugada = CB; base Brønsted-Lowry = BB; seu ácido conjugado = CA. HNO 3 (BA), H 2 O (BB), H 3 O + (CA),\(\ce{NO3- (CB)}\); CN − (BB), H 2 O (BA), HCN (CA),\(\ce{OH^-}\) (CB); H 2 SO 4 (BA), Cl − (BB), HCl (CA),\(\ce{HSO4- (CB)}\);\(\ce{HSO4- (BA)}\), OH - (BB)\(\ce{SO4^2- (CB)}\), H 2 O (CA); O 2− (BB), H2O (BA)\(\ce{OH^-}\) (CB e CA); [Cu (H 2 O) 3 (OH)] + (BB), [Al (H 2 O) 6] 3+ (BA), [Cu (H 2 O) 4] 2+ (CA), [Al (H 2 O) 5 ( OH)] 2+ (CB); H 2 S (BA)\(\ce{NH2- (BB)}\), HS − (CB), NH 3 (CA)
Q14.1.10
Identifique e rotule o ácido Brønsted-Lowry, sua base conjugada, a base de Brønsted-Lowry e seu ácido conjugado em cada uma das seguintes equações:
- \(\ce{NO2- + H2O ⟶ HNO2 + OH-}\)
- \(\ce{HBr + H2O ⟶ H3O+ + Br-}\)
- \(\ce{HS- + H2O ⟶ H2S + OH-}\)
- \(\ce{H2PO4- + OH- ⟶HPO4^2- + H2O}\)
- \(\ce{H2PO4- + HCl ⟶ H3PO4 + Cl-}\)
- \(\ce{[Fe(H2O)5(OH)]^2+ + [Al(H2O)6]^3+ ⟶ [Fe(H2O)6]^3+ + [Al(H2O)5(OH)]^2+}\)
- \(\ce{CH3OH + H- ⟶ CH3O- + H2}\)
Q14.1.11
O que são espécies anfipróticas? Ilustre com equações adequadas.
S14.1.11
As espécies anfipróticas podem ganhar ou perder um próton em uma reação química, agindo assim como base ou ácido. Um exemplo é H 2 O.
- Como ácido:\(\ce{H2O}(aq) + \ce{NH3}(aq) \rightleftharpoons \ce{NH4+}(aq) + \ce{OH-}(aq)\).
- Como base:\(\ce{H2O}(aq) + \ce{HCl}(aq) \rightleftharpoons \ce{H3O+}(aq) + \ce{Cl-}(aq)\)
Q14.1.12
Indique quais das seguintes espécies são anfipróticas e escreva equações químicas ilustrando o caráter anfiprótico dessas espécies:
- H 2 O
- \(\ce{H2PO4-}\)
- S 2−
- \(\ce{CO3^2-}\)
- \(\ce{HSO4-}\)
Q14.1.13
Indique quais das seguintes espécies são anfipróticas e escreva equações químicas ilustrando o caráter anfiprótico dessas espécies.
- NH 3
- \(\ce{HPO4-}\)
- Br −
- \(\ce{NH4+}\)
- \(\ce{ASO4^3-}\)
S14.113
anfiprótico:\(\ce{NH3 + H3O+ ⟶ NH4OH + H2O}\),\(\ce{NH3 + OCH3- ⟶ NH2- + CH3OH}\);\(\ce{HPO4^2- + OH- ⟶ PO4^3- + H2O}\),\(\ce{HPO4^2- + HClO4 ⟶ H2PO4- + ClO4-}\); não anfiprótico: Br −\(\ce{NH4+}\);\(\ce{AsO4^3-}\)
Q14.1.14
A autoionização da água é endotérmica ou exotérmica? A constante de ionização da água (K w) está\(2.9 \times 10^{-14}\) a 40 °C e\(9.6 \times 10^{-14}\) a 60 °C.
14.2: pH e pOH
Q14.2.1
Explique por que uma amostra de água pura a 40 °C é neutra mesmo que [H 3 O +] = 1,7 × 10 −7 M. K w é 2,9 × 10 −14 a 40 °C.
S14.2.1
Em uma solução neutra [H 3 O +] = [OH −]. A 40 °C,
[H 3 O +] = [OH −] = (2,910 −14) 1/2 = 1,7 × 10 −7.
Q14.2.2
A constante de ionização para água (K w) é 2,9 × 10 −14 a 40 °C. Calcule [H 3 O +], [OH −], pH e pOH para água pura a 40 °C.
Q14.2.3
A constante de ionização para água (K w) é 9,614 × 10 −14 a 60 °C. Calcule [H 3 O +], [OH −], pH e pOH para água pura a 60 °C.
S14.2.3
x = 3,101 × 10 −7 M = [H 3 O +] = [OH −]
pH = -log 3,101 × 10 −7 = − (−6,5085) = 6,5085
pOH = pH = 6,5085
Q14.2.4
Calcular o pH e o pOH de cada uma das seguintes soluções a 25 °C para as quais as substâncias se ionizam completamente:
- 0,200 M HCl
- 0,0143 MM NaOH
- 3,0 M HNO 3
- 0,0031 M Ca (OH) 2
Q14.2.5
Calcular o pH e o pOH de cada uma das seguintes soluções a 25 °C para as quais as substâncias se ionizam completamente:
- 0,000259 M ClO 4
- 0,21 M NaOH
- 0,000071 MB Ba (OH) 2
- 2,5 KM KOH
S 14.2.5
pH = 3,587; pOH = 10,413; pH = 0,68; pOH = 13,32; pOH = 3,85; pH = 10,15; pH = −0,40; pOH = 14,4
Q14.2.6
Quais são o pH e o pOH de uma solução de 2,0 M HCl, que ioniza completamente?
Q14.2.6
Quais são as concentrações de íons hidrônio e hidróxido em uma solução cujo pH é 6,52?
S14.2.6
[H 3 O +] = 3,0 × 10 −7 M; [OH −] = 3,3 × 10 −8 M
Q14.2.7
Calcule a concentração de íons hidrogênio e a concentração de íons hidróxido no vinho a partir de seu pH. Veja a figura abaixo para obter informações úteis.
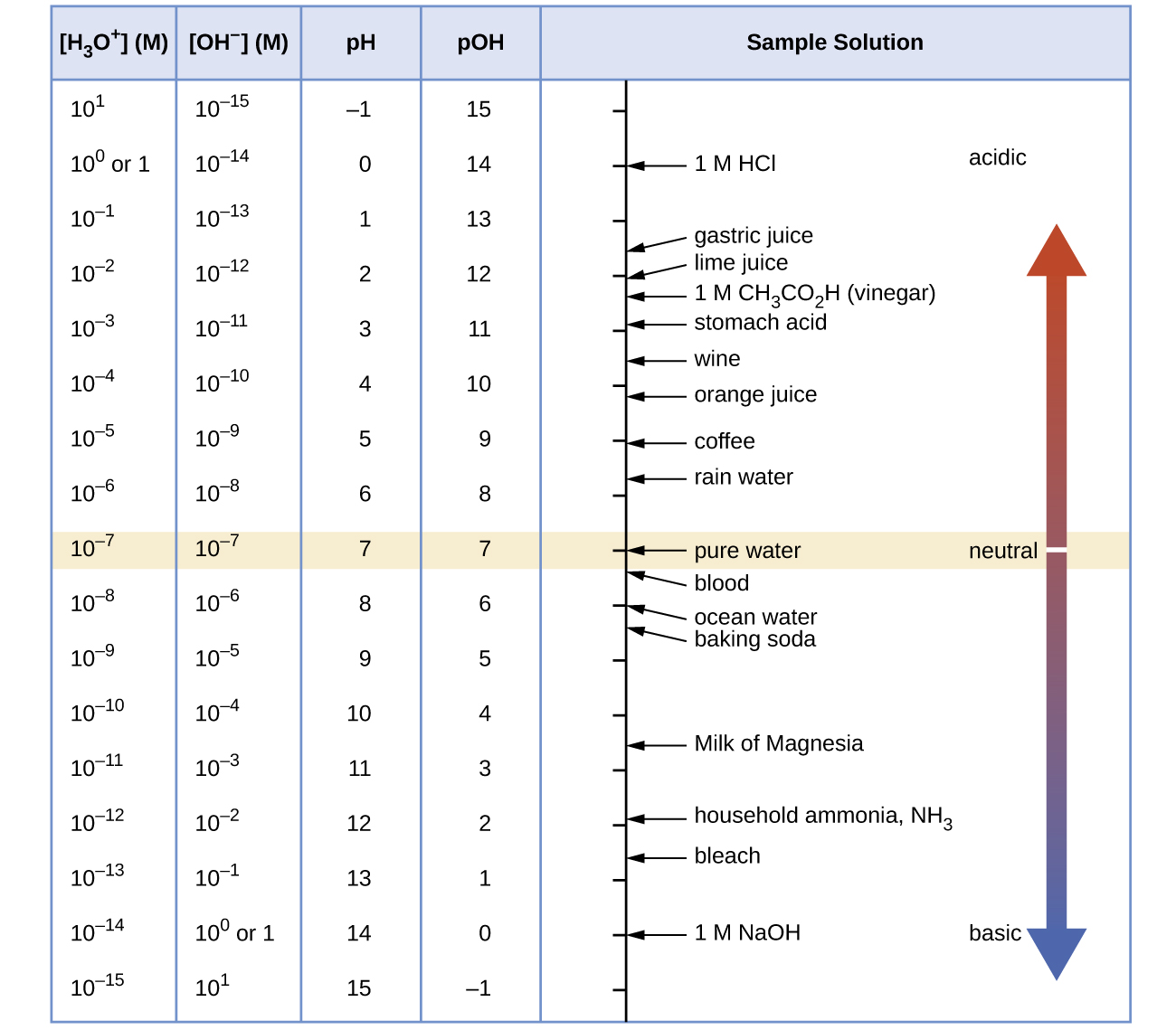
Q14.2.8
Calcule a concentração do íon hidrônio e a concentração do íon hidróxido no suco de limão a partir de seu pH. Consulte a Figura para obter informações úteis.
S 14.2.9
[H 3 O +] = 1 × 10 −2 M; [OH −] = 1 × 10 −12 M
Q14.2.9
A concentração de íons hidrônio em uma amostra de água da chuva é de 1,7 × 10 −6 M a 25 °C. Qual é a concentração de íons hidróxido na água da chuva?
Q14.2.10
A concentração de íons hidróxido na amônia doméstica é de 3,2 × 10 −3 M a 25 °C. Qual é a concentração de íons hidrônio na solução?
S14.2.10
[OH −] = 3,1 × 10 −12 M
14.3: Forças relativas de ácidos e bases
Q14.3.1
Explique por que a reação de neutralização de um ácido forte e uma base fraca fornece uma solução fracamente ácida.
Q14.3.2
Explique por que a reação de neutralização de um ácido fraco e uma base forte fornece uma solução fracamente básica.
O sal ioniza em solução, mas o ânion reage levemente com a água para formar o ácido fraco. Essa reação também forma OH −, o que faz com que a solução seja básica.
Q14.3.3
Use esta lista de compostos industriais importantes (e a Figura) para responder às seguintes perguntas sobre: CaO, Ca (OH) 2, CH 3 CO 2 H, CO 2, HCl, H 2 CO 3, HF, HNO 2, HNO 3, H 3 PO 4, H 2 SO 4, NH 3, NaOH, Na 2 CO 3.
- Identifique os ácidos Brønsted-Lowry fortes e as bases fortes de Brønsted-Lowry.
- Liste os compostos que podem se comportar como ácidos Brønsted-Lowry com pontos fortes entre os de H 3 O + e H 2 O.
- Liste os compostos que podem se comportar como bases de Brønsted-Lowry com forças situadas entre as de H 2 O e OH −.
Q14.3.4
O odor do vinagre é devido à presença de ácido acético, CH 3 CO 2 H, um ácido fraco. Liste, em ordem decrescente de concentração, todas as espécies iônicas e moleculares presentes em uma solução aquosa de 1 M desse ácido.
S14.3.4
[H 2 O] > [CH 3 CO 2 H] >\(\ce{[H3O+]}\) ≈\(\ce{[CH3CO2- ]}\) > [OH −]
Q14.3.5
A amônia doméstica é uma solução da base fraca NH 3 em água. Liste, em ordem decrescente de concentração, todas as espécies iônicas e moleculares presentes em uma solução aquosa de 1 M dessa base.
Q14.3.4
Explique por que a constante de ionização, K a, para H 2 SO 4 é maior do que a constante de ionização para H 2 SO 3.
S14.3.4
O estado de oxidação do enxofre em H 2 SO 4 é maior do que o estado de oxidação do enxofre em H 2 SO 3.
Q14.3.7
Explique por que a constante de ionização, K a, para HI é maior do que a constante de ionização para HF.
Q14.3.8
O suco gástrico, o fluido digestivo produzido no estômago, contém ácido clorídrico, HCl. O leite de magnésia, uma suspensão de Mg (OH) 2 sólido em meio aquoso, às vezes é usado para neutralizar o excesso de ácido estomacal. Escreva uma equação balanceada completa para a reação de neutralização e identifique os pares ácido-base conjugado.
S 14.3.8
\(\underset{\large\ce{BB}}{\ce{Mg(OH)2}(s)}+\underset{\large\ce{BA}}{\ce{HCl}(aq)}⟶\underset{\large\ce{CB}}{\ce{Mg^2+}(aq)}+\underset{\large\ce{CA}}{\ce{2Cl-}(aq)}+\underset{\:}{\ce{2H2O}(l)}\)
Q14.3.9
O ácido nítrico reage com o óxido de cobre (II) insolúvel para formar nitrato de cobre (II) solúvel, Cu (NO 3) 2, um composto que tem sido usado para impedir o crescimento de algas nas piscinas. Escreva a equação química balanceada para a reação de uma solução aquosa de HNO 3 com CuO.
Q14.3.10
Qual é a constante de ionização a 25 °C para o ácido fraco\(\ce{CH3NH3+}\), o ácido conjugado da base fraca CH 3 NH 2, K b = 4,4 × 10 −4.
S14.3.10
\(K_\ce{a}=2.3×10^{−11}\)
Q14.3.11
Qual é a constante de ionização a 25 °C para o ácido fraco\(\ce{(CH3)2NH2+}\), o ácido conjugado da base fraca (CH 3) 2 NH, K b = 7,4 × 10 −4?
Q14.3.12
Qual base, CH 3 NH 2 ou (CH 3) 2 NH, é a base mais forte? Qual ácido conjugado,\(\ce{(CH3)2NH2+}\) ou (CH 3) 2 NH, é o ácido mais forte?
S14.3.12
A base mais forte ou o ácido mais forte é aquele com K b ou K a maiores, respectivamente. Nesses dois exemplos, eles são (CH 3) 2 NH\(\ce{CH3NH3+}\) e.
Q14.3.3
Qual é o ácido mais forte,\(\ce{NH4+}\) ou HBro?
Q14.3.14
Qual é a base mais forte, (CH 3) 3 N ou\(\ce{H2BO3-}\)?
S14.3.14
trietilamina.
Q14.3.15
Preveja qual ácido em cada um dos pares a seguir é o mais forte e explique seu raciocínio para cada um.
- H 2 O ou HF
- B (OH) 3 ou Al (OH) 3
- \(\ce{HSO3-}\)ou\(\ce{HSO4-}\)
- NH 3 ou H 2 S
- H 2 O ou H 2 Te
Q14.3.16
Preveja qual composto em cada um dos seguintes pares de compostos é mais ácido e explique seu raciocínio para cada um.
- \(\ce{HSO4-}\)ou\(\ce{HSeO4-}\)
- NH 3 ou H 2 O
- PH 3 ou HI
- NH 3 ou PH 3
- H 2 S ou HBr
S14.3.16
- \(\ce{HSO4-}\); maior eletronegatividade do íon central. H 2 O;
- NH 3 é uma base e a água é neutra, ou decida com base nos valores de K a. OI;
- PH 3 é mais fraco que HCl; HCl é mais fraco que HI. Assim, o PH 3 é mais fraco que o HI.
- PH 3; em compostos binários de hidrogênio com não metais, a acidez aumenta para o elemento inferior em um grupo.
- HBr; em um período, a acidez aumenta da esquerda para a direita; em um grupo, aumenta de cima para baixo. Br está à esquerda e abaixo de S, então HBr é o ácido mais forte.
Q14.3.17
Classifique os compostos em cada um dos grupos a seguir em ordem crescente de acidez ou basicidade, conforme indicado, e explique a ordem atribuída.
- acidez: HCl, HBr, HI
- basicidade: H 2 O, OH −, H −, Cl −
- basicidade: Mg (OH) 2, Si (OH) 4, ClO 3 (OH) (Dica: A fórmula também pode ser escrita como HClO 4).
- acidez: HF, H 2 O, NH 3, CH 4
Q14.3.18
Classifique os compostos em cada um dos grupos a seguir em ordem crescente de acidez ou basicidade, conforme indicado, e explique a ordem atribuída.
- acidez: NaHSO 3, NaHSO 3, NaHSO 4
- basicidade:\(\ce{BrO2-}\),\(\ce{ClO2-}\),\(\ce{IO2-}\)
- acidez: HOCl, HOBr, HOI
- acidez: HOCl, HoClo, HoClo 2, HoClo 3
- basicidade:\(\ce{NH2-}\), HS −, ThE −,\(\ce{PH2-}\)
- basicidade: BrO −,\(\ce{BrO2-}\),\(\ce{BrO3-}\),\(\ce{BrO4-}\)
S14.3.18
- NaHSEO 3 < NaHSO 3 < NaHSO 4; em polioxi-ácidos, o elemento central mais eletronegativo - S, neste caso - forma o ácido mais forte. O maior número de átomos de oxigênio no átomo central (conferindo-lhe um estado de oxidação mais alto) também cria uma maior liberação de átomos de hidrogênio, resultando em um ácido mais forte. Como sal, a acidez aumenta da mesma maneira.
- \(\ce{ClO2- < BrO2- < IO2-}\); a basicidade dos ânions em uma série de ácidos será o oposto da acidez em seus oxiácidos. A acidez aumenta à medida que a eletronegatividade do átomo central aumenta. Cl é mais eletronegativo que Br e I é o menos eletronegativo dos três.
- HOI < HOBr < HOCl; em uma série da mesma forma de oxiácidos, a acidez aumenta à medida que a eletronegatividade do átomo central aumenta. Cl é mais eletronegativo que Br e I é o menos eletronegativo dos três.
- HOCl < HOClo < HOClo 2 < HOClo 3; em uma série de oxiácidos do mesmo elemento central, a acidez aumenta à medida que o número de átomos de oxigênio aumenta (ou à medida que o estado de oxidação do átomo central aumenta).
- \(\ce{HTe- < HS- << PH2- < NH2-}\);\(\ce{PH2-}\) e\(\ce{NH2-}\) são ânions de bases fracas, então eles agem como bases fortes em direção a H +. \(\ce{HTe-}\)e HS − são ânions de ácidos fracos, então eles têm menos caráter básico. Em um grupo periódico, o elemento mais eletronegativo tem o ânion mais básico.
- \(\ce{BrO4- < BrO3- < BrO2- < BrO-}\); com um número maior de átomos de oxigênio (ou seja, à medida que o estado de oxidação do íon central aumenta), o ácido correspondente se torna mais ácido e o ânion, consequentemente, menos básico.
Q14.3.19
Tanto o HF quanto o HCN ionizam na água de forma limitada. Qual das bases conjugadas, F − ou CN −, é a base mais forte? Veja a tabela.
Q14.3.20
O ingrediente ativo formado pela aspirina no organismo é o ácido salicílico, C 6 H 4 OH (CO 2 H). O grupo carboxila (−CO 2 H) atua como um ácido fraco. O grupo fenol (um grupo OH ligado a um anel aromático) também atua como um ácido, mas um ácido muito mais fraco. Liste, em ordem decrescente de concentração, todas as espécies iônicas e moleculares presentes em uma solução aquosa de 0,001- M de C 6 H 4 OH (CO 2 H).
\(\ce{[H2O] > [C6H4OH(CO2H)] > [H+]0 > [C6H4OH(CO2)- ] ≫ [C6H4O(CO2H)- ] > [OH- ]}\)
O que representamos quando escrevemos:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)?\]
Q14.3.21
Explique por que os cálculos de equilíbrio não são necessários para determinar as concentrações iônicas em soluções de certos eletrólitos fortes, como NaOH e HCl. Sob quais condições os cálculos de equilíbrio são necessários como parte da determinação das concentrações de todos os íons de alguns outros eletrólitos fortes em solução?
S14.3.21
Os eletrólitos fortes são 100% ionizados e, desde que os íons componentes não sejam ácidos fracos nem bases fracas, as espécies iônicas presentes resultam da dissociação do eletrólito forte. Os cálculos de equilíbrio são necessários quando um (ou mais) dos íons é um ácido fraco ou uma base fraca.
Q14.3.22
As concentrações de íon hidrônio e íon hidróxido em uma solução de um ácido ou base na água são diretamente proporcionais ou inversamente proporcionais? Explique sua resposta.
Q14.3.23
Quais são as duas suposições comuns que podem simplificar o cálculo das concentrações de equilíbrio em uma solução de um ácido fraco?
S14.3.23
- Suponha que a mudança na concentração inicial do ácido à medida que o equilíbrio é estabelecido possa ser negligenciada, então essa concentração pode ser considerada constante e igual ao valor inicial da concentração total de ácido.
- Suponha que possamos negligenciar a contribuição da água para a concentração de equilíbrio de H 3 O +.
Q14.3.24
Quais duas suposições comuns podem simplificar o cálculo das concentrações de equilíbrio em uma solução de uma base fraca?
Q14.3.25
Qual das opções a seguir aumentará a porcentagem de NH 3 que é convertida em íon amônio na água (Dica: use o princípio de Lechâtelier.)?
- adição de NaOH
- adição de HCl
- adição de NH 4 Cl
S 14.3.25
A adição de HCl
Q14.3.26
Qual das opções a seguir aumentará a porcentagem de HF que é convertida no íon flúor na água?
- adição de NaOH
- adição de HCl
- adição de NaF
Q14.3.27
Qual é o efeito nas concentrações de\(\ce{NO2-}\) HNO 2 e OH − quando o seguinte é adicionado a uma solução de KNO 2 em água:
- HCl
- HNO 2
- NaOH
- NaCl
- EU SEI
A equação para o equilíbrio é:
\[\ce{NO2-}(aq)+\ce{H2O}(l)⇌\ce{HNO2}(aq)+\ce{OH-}(aq)\]S 14.3.27
- A adição de HCl adicionará íons H 3 O +, que então reagirão com os íons OH −, diminuindo sua concentração. O equilíbrio mudará para a direita, aumentando a concentração de HNO 2 e diminuindo a concentração de\(\ce{NO2-}\) íons.
- Adicionar HNO 2 aumenta a concentração de HNO 2 e desloca o equilíbrio para a esquerda, aumentando a concentração de\(\ce{NO2-}\) íons e diminuindo a concentração de íons OH −.
- A adição de NaOH adiciona íons OH −, que deslocam o equilíbrio para a esquerda, aumentando a concentração de\(\ce{NO2-}\) íons e diminuindo as concentrações de HNO 2.
- A adição de NaCl não tem efeito nas concentrações dos íons.
- Adicionar KNO 2 adiciona\(\ce{NO2-}\) íons e desloca o equilíbrio para a direita, aumentando as concentrações de íons HNO 2 e OH −.
Q14.3.28
Qual é o efeito na concentração de ácido fluorídrico, íon hidrônio e íon flúor quando os seguintes são adicionados a soluções separadas de ácido fluorídrico?
- HCl
- DE
- NaCl
- KOH
- HF
A equação para o equilíbrio é:
\[\ce{HF}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{F-}(aq)\]Q14.3.29
Por que a concentração de íons hidrônio em uma solução que é 0,10 M em HCl e 0,10 M em HCOOH é determinada pela concentração de HCl?
S14.3.29
Este é um caso em que a solução contém uma mistura de ácidos de diferentes forças de ionização. Em solução, o HCO 2 H existe principalmente como moléculas de HCO 2 H porque a ionização do ácido fraco é suprimida pelo ácido forte. Portanto, o HCO 2 H contribui com uma quantidade insignificante de íons hidrônio para a solução. O ácido mais forte, HCl, é o produtor dominante de íons hidrônio porque é completamente ionizado. Em tal solução, o ácido mais forte determina a concentração de íons hidrônio, e a ionização do ácido mais fraco é fixada pelo [H 3 O +] produzido pelo ácido mais forte.
Q14.3.30
A partir das concentrações de equilíbrio dadas, calcule K a para cada um dos ácidos fracos e K b para cada uma das bases fracas.
CH 3 CO 2 H:\(\ce{[H3O+]}\) = 1,34 × 10 −3 M;
\(\ce{[CH3CO2- ]}\)= 1,34 × 10 −3 M;[CH 3 CO 2 H] = 9,866 × 10 −2 M;
ClO −: [OH −] = 4,0 × 10 −4 M;
[HClO] = 2,38 × 10 −5 M;
[ClO −] = 0,273 M;
HCO 2 H: [HCO 2 H] = 0,524 M;
\(\ce{[H3O+]}\)= 9,8 × 10 −3 M;\(\ce{[HCO2- ]}\) = 9,8 × 10 −3 M;\(\ce{C6H5NH3+ : [C6H5NH3+]}\)= 0,233 M;
[C 6 H 5 NH 2] = 2,3 × 10 −3 M;
\(\ce{[H3O+]}\)= 2,3 × 10 −3 MA partir das concentrações de equilíbrio dadas, calcule K a para cada um dos ácidos fracos e K b para cada uma das bases fracas.
NH 3: [OH −] = 3,1 × 10 −3 M;
\(\ce{[NH4+]}\)= 3,1 × 10 −3 M;[NH 3] = 0,533 M;
NO 2:\(\ce{[H3O+]}\) = 0,01 M;
\(\ce{[NO2- ]}\)= 0,0438 M;[HNO 2] = 1,07 M;
(CH 3) 3 N: [(CH 3) 3 N] = 0,25 M;
[(CH 3) 3 NH +] = 4,3 × 10 −3 M;[OH −] = 4,3 × 10 −3 M;
\(\ce{NH4+ : [NH4+]}\)= 0,100 M;
[NH 3] = 7,5 × 10 −6 M;
[H 3 O +] = 7,5 × 10 −6 M- \(K_\ce{b}=1.8×10^{−5};\)
- \(K_\ce{a}=4.5×10^{−4};\)
- \(K_\ce{b}=7.4×10^{−5};\)
- \(K_\ce{a}=5.6×10^{−10}\)
Q14.3.31
Determine K b para o íon nitrito,\(\ce{NO2-}\). Em uma solução de 0,10-M, essa base é 0,0015% ionizada.
Q14.3.32
Determine K a para o íon sulfato de hidrogênio,\(\ce{HSO4-}\). Em uma solução de 0,10-M, o ácido é 29% ionizado.
S14.3.32
\(K_\ce{a}=1.2×10^{−2}\)
Q14.3.33
Calcule a constante de ionização para cada um dos seguintes ácidos ou bases a partir da constante de ionização de sua base conjugada ou ácido conjugado:
- F −
- \(\ce{NH4+}\)
- \(\ce{AsO4^3-}\)
- \(\ce{(CH3)2NH2+}\)
- \(\ce{NO2-}\)
- \(\ce{HC2O4-}\)(como base)
Q14.3.52
Calcule a constante de ionização para cada um dos seguintes ácidos ou bases a partir da constante de ionização de sua base conjugada ou ácido conjugado:
- O − (como base)
- \(\ce{(CH3)3NH+}\)
- \(\ce{HAsO4^3-}\)(como base)
- \(\ce{HO2-}\)(como base)
- \(\ce{C6H5NH3+}\)
- \(\ce{HSO3-}\)(como base)
S 14.3.52
- \(K_\ce{b}=4.3×10^{−12};\)
- \(K_\ce{a}=1.4×10^{−10};\)
- \(K_\ce{b}=1×10^{−7};\)
- \(K_\ce{b}=4.2×10^{−3};\)
- \(K_\ce{b}=4.2×10^{−3};\)
- \(K_\ce{b}=8.3×10^{−13}\)
Q14.3.53
Para qual das seguintes soluções devemos considerar a ionização da água ao calcular o pH ou pOH?
- 3 × 10 −8 M HNO 3
- 0,10 g de HCl em 1,0 L de solução
- 0,00080 g de NaOH em 0,50 L de solução
- 1 × 10 −7 M Ca (OH) 2
- 0,0245 M KNOW 3
Q14.3.54
Embora tanto o NH 3 quanto o C 6 H 5 NH 2 sejam bases fracas, o NH 3 é um ácido muito mais forte do que o C 6 H 5 NH 2. Qual das seguintes opções está correta em equilíbrio para uma solução que é inicialmente 0,10 M em NH 3 e 0,10 M em C 6 H 5 NH 2?
- \(\ce{[OH- ]}=\ce{[NH4+]}\)
- \(\ce{[NH4+]}=\ce{[C6H5NH3+]}\)
- \(\ce{[OH- ]}=\ce{[C6H5NH3+]}\)
- [NH 3] = [C 6 H 5 NH 2]
- tanto a quanto b estão corretos
é a afirmação correta.
Q14.3.55
Calcule a concentração de equilíbrio dos ácidos não ionizados e de todos os íons em uma solução que seja 0,25 M em HCO 2 H e 0,10 M em HClO.
Q14.3.56
Calcule a concentração de equilíbrio dos ácidos não ionizados e de todos os íons em uma solução que seja 0,134 M em HNO 2 e 0,120 M em HBro.
S 14.3.56
[H 3 O +] = 7,5 × 10 −3 M
[HNO 2] = 0,126 [OH −] = 1,3 × 10 −12 M [BrO −] = 3,2 × 10 −8 M [HBro] = 0,120 MQ14.3.57
Calcule a concentração de equilíbrio das bases não ionizadas e de todos os íons em uma solução que seja 0,25 M em CH 3 NH 2 e 0,10 M em C 5 H 5 N (K b = 1,7 × 10 −9).
Q14.3.58
Calcule a concentração de equilíbrio das bases não ionizadas e de todos os íons em uma solução que seja 0,115 M em NH 3 e 0,100 M em C 6 H 5 NH 2.
S 14.3.58
[OH −] =\(\ce{[NO4+]}\) = 0,0014 M
[NH 3] = 0,144 M [H 3 O +] = 6,9 × 10 −12 M\(\ce{[C6H5NH3+]}\) = 3,9 × 10 −8 M [C 6 H 5 NH 2] = 0,100 MQ14.3.59
Usando os valores de K a no Apêndice H, coloque\(\ce{Al(H2O)6^3+}\) no local correto na Figura.
Q14.3.60
Calcule a concentração de todas as espécies de soluto em cada uma das seguintes soluções de ácidos ou bases. Suponha que a ionização da água possa ser negligenciada e mostre que a mudança nas concentrações iniciais pode ser negligenciada. As constantes de ionização podem ser encontradas no Apêndice H e no Apêndice I.
- 0,0092 M HClo, um ácido fraco
- 0,0784 M C 6 H 5 NH 2, uma base fraca
- 0,0810 M HCN, um ácido fraco
- 0,11 M (CH 3) 3 N, uma base fraca
- 0,120 M\(\ce{Fe(H2O)6^2+}\) um ácido fraco, K a = 1,6 × 10 −7
S 14.3.60
\(\ce{\dfrac{[H3O+][ClO- ]}{[HClO]}}=\dfrac{(x)(x)}{(0.0092−x)}≈\dfrac{(x)(x)}{0.0092}=3.5×10^{−8}\)
A resolução de x dá 1,79 × 10 −5 M. Esse valor é inferior a 5% de 0,0092, portanto, a suposição de que ele possa ser negligenciado é válida. Assim, as concentrações de espécies de soluto em equilíbrio são:
[H 3 O +] = [ClO] = 1,8 × 10 −5 M [HClO] = 0,00092 M [OH −] = 5,6 × 10 −10 M;
\(\ce{\dfrac{[C6H5NH3+][OH- ]}{[C6H5NH2]}}=\dfrac{(x)(x)}{(0.0784−x)}≈\dfrac{(x)(x)}{0.0784}=4.6×10^{−10}\)
A resolução de x dá 6,01 × 10 −6 M.
Esse valor é inferior a 5% de 0,0784, portanto, a suposição de que ele pode ser negligenciado é válida. Assim, as concentrações de espécies de soluto em equilíbrio são:\(\ce{[CH3CO2- ]}\) = [OH −] = 6,0 × 10 −6 M [C 6 H 5 NH 2] = 0,00784 [H 3 O +] = 1,7 × 10 −9 M;\(\ce{\dfrac{[H3O+][CN- ]}{[HCN]}}=\dfrac{(x)(x)}{(0.0810−x)}≈\dfrac{(x)(x)}{0.0810}=4×10^{−10}\) Resolvendo para x dá 5,69 × 10 −6 M. Esse valor é inferior a 5% de 0,0810, portanto, a suposição de que ele pode ser negligenciado é válida. Assim, as concentrações de espécies de soluto em equilíbrio são: [H 3 O +] = [CN −] = 5,7 × 10 −6 M [HCN] = 0,0810 M [OH −] = 1,8 × 10 −9 M;\(\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}}=\dfrac{(x)(x)}{(0.11−x)}≈\dfrac{(x)(x)}{0.11}=7.4×10^{−5}\) Resolver x dá 2,85 × 10 −3 M. Esse valor é inferior a 5% de 0,11, portanto, a suposição de que ele pode ser negligenciado é válida. Assim, as concentrações de espécies de soluto em equilíbrio são: [(CH 3) 3 NH +] = [OH −] = 2,9 × 10 −3 M [(CH 3) 3 N] = 0,11 M [H 3 O +] = 3,5 × 10 −12 M;\(\ce{\dfrac{[Fe(H2O)5(OH)+][H3O+]}{[Fe(H2O)6^2+]}}=\dfrac{(x)(x)}{(0.120−x)}≈\dfrac{(x)(x)}{0.120}=1.6×10^{−7}\) Resolver x dá 1,39 × 10 −4 M. Esse valor é inferior a 5% de 0,120, portanto, a suposição de que ele pode ser negligenciado é válida. Assim, as concentrações de espécies de soluto em equilíbrio são: [Fe (H 2 O) 5 (OH) +] = [H 3 O +] = 1,4 × 10 −4 M\(\ce{[Fe(H2O)6^2+]}\) = 0,120 M [OH −] = 7,2 × 10 −11 M
Q14.3.61
O ácido propiônico, C 2 H 5 CO 2 H (K a = 1,34 × 10 −5), é usado na fabricação de propionato de cálcio, um conservante de alimentos. Qual é a concentração de íon hidrônio em uma solução de 0,698- M de C 2 H 5 CO 2 H?
Q14.3.62
O vinagre branco é uma solução de 5,0% em massa de ácido acético em água. Se a densidade do vinagre branco for 1,007 g/cm 3, qual é o pH?
S 14.3.62
pH = 2,41
Q14.3.63
A constante de ionização do ácido lático, CH 3 CH (OH) CO 2 H, um ácido encontrado no sangue após exercícios extenuantes, é 1,36 × 10 −4. Se 20,0 g de ácido lático forem usados para fazer uma solução com um volume de 1,00 L, qual é a concentração de íon hidrônio na solução?
Q14.3.64
A nicotina, C 10 H 14 N 2, é uma base que aceita dois prótons (K 1 = 7 × 10 −7, K 2 = 1,4 × 10 −11). Qual é a concentração de cada espécie presente em uma solução de nicotina de 0,050- M?
S14.3.64
[C 10 H 14 N 2] = 0,049 M
[C 10 H 14 N 2 H +] = 1,9 × 10 −4 M\(\ce{[C10H14N2H2^2+]}\) = 1,4 × 10 −11 M [OH −] = 1,9 × 10 −4 M [H 3 O +] = 5,3 × 10 −11 MQ14.3.65
O pH de uma solução de 0,20 M de HF é 1,92. Determine K a para HF a partir desses dados.
Q14.3.66
O pH de uma solução de 0,15- M de\(\ce{HSO4-}\) é 1,43. Determine K a for\(\ce{HSO4-}\) a partir desses dados.
S14.3.66
\(K_\ce{a}=1.2×10^{−2}\)
Q14.3.67
O pH de uma solução de 0,10-M de cafeína é 11,16. Determine K b para cafeína a partir desses dados:
\(\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq)\)Q14.3.68
O pH de uma solução de amônia doméstica, uma solução de 0,950 M de NH 3, é 11,612. Determine K b para NH 3 a partir desses dados.
S 14.3.68
\(K_\ce{b}=1.77×10^{−5}\)
14.4: Hidrólise de soluções salinas
Q14.4.1
Determine se as soluções aquosas dos seguintes sais são ácidas, básicas ou neutras:
- Al (NO 33)
- RBi
- KHCO 2
- CH 3 NH 3 Br
Q14.4.2
Determine se as soluções aquosas dos seguintes sais são ácidas, básicas ou neutras:
- FeCl 3
- K 2 CO 3
- NH 4 Br
- KClO 4
S 14.4.2
ácido; básico; ácido; neutro
Q14.4.3
A novocaína, C 13 H 21 O 2 N 2 Cl, é o sal da base procaína e do ácido clorídrico. A constante de ionização da procaína é 7 × 10 −6. Uma solução de novocaína é ácida ou básica? O que são [H 3 O +], [OH −] e pH de uma solução de 2,0% em massa de novocaína, assumindo que a densidade da solução é 1,0 g/mL.
14.5: Ácidos polipróticos
Q15.5.1
Qual das seguintes concentrações seria praticamente igual em um cálculo das concentrações de equilíbrio em uma solução de 0,134- M de H 2 CO 3, um ácido diprótico:
- \(\ce{[H3O+]}\),
- \([OH^−]\)
- \([H_2CO_3]\)
- \(\ce{[HCO3- ]}\)
- \(\ce{[CO3^2- ]}\)
Não são necessários cálculos para responder a essa pergunta.
S15.5.1
[H 3 O +] e\(\ce{[HCO3- ]}\) são iguais, H 3 O + e\(\ce{HCO3-}\) são praticamente iguais
Q15.5.2
Calcule a concentração de cada espécie presente em uma solução de 0,050- M de H 2 S.
Q15.5.3
Calcule a concentração de cada espécie presente em uma solução de 0,010- M de ácido ftálico, C 6 H 4 (CO 2 H) 2.
S15.5.3
\(\ce{C6H4(CO2H)2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H4(CO2H)(CO2)-}(aq) \hspace{20px} K_\ce{a}=1.1×10^{−3}\)
\(\ce{C6H4(CO2H)(CO2)}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H4(CO2)2^2-}(aq) \hspace{20px} K_\ce{a}=3.9×10^{−6}\)
[C 6 H 4 (CO 2 H) 2] 7,2 × 10 −3 M, [C 6 H 4 (CO 2 H) (CO 2) −] = [H 3 O +] 2,8 × 10 −3 M,\(\ce{[C6H4(CO2)2^2- ]}\) 3,9 × 10 −6 M, [OH −] 3,6 × 10 −12 M
Q15.5.4
O ácido salicílico, HOC 6 H 4 CO 2 H e seus derivados têm sido usados como analgésicos há muito tempo. O ácido salicílico ocorre em pequenas quantidades nas folhas, cascas e raízes de alguma vegetação (principalmente historicamente na casca do salgueiro). Os extratos dessas plantas têm sido usados como medicamentos há séculos. O ácido foi isolado pela primeira vez no laboratório em 1838.
- Ambos os grupos funcionais do ácido salicílico ionizam na água, com K a = 1,0 × 10 −3 para o grupo —CO 2 H e 4,2 × 10 −13 para o grupo −OH. Qual é o pH de uma solução saturada do ácido (solubilidade = 1,8 g/L).
- A aspirina foi descoberta como resultado dos esforços para produzir um derivado do ácido salicílico que não fosse irritante para o revestimento do estômago. A aspirina é ácido acetilsalicílico, CH 3 CO 2 C 6 H 4 CO 2 H. O grupo funcional −CO 2 H ainda está presente, mas sua acidez é reduzida, K a = 3,0 × 10 −4. Qual é o pH de uma solução de aspirina com a mesma concentração de uma solução saturada de ácido salicílico (Veja a Parte a).
- Sob algumas condições, a aspirina reage com a água e forma uma solução de ácido salicílico e ácido acético:
\[\ce{CH3CO2C6H4CO2H}(aq)+\ce{H2O}(l)⟶\ce{HOC6H4CO2H}(aq)+\ce{CH3CO2H}(aq)\]
- Qual dos ácidos ácido salicílico ou ácido acético produz mais íons hidrônio em uma solução desse tipo?
- Quais são as concentrações de moléculas e íons em uma solução produzida pela hidrólise de 0,50 g de aspirina dissolvida em água suficiente para dar 75 mL de solução?
Q15.5.5
O íon ThE − é uma espécie anfiprótica; ele pode atuar tanto como ácido quanto como base.
- O que é K a para a reação ácida de Hte − com H 2 O?
- O que é K b para a reação na qual ThE − funciona como base na água?
- Demonstre se a segunda ionização de H 2 Te pode ou não ser negligenciada no cálculo de [Hte −] em uma solução de 0,10 M de H 2 Te.
S 15.5.5
- \(K_{\ce a2}=1×10^{−5};\)
- \(K_\ce{b}=4.3×10^{−12};\)
- \(\ce{\dfrac{[Te^2- ][H3O+]}{[HTe- ]}}=\dfrac{(x)(0.0141+x)}{(0.0141−x)}≈\dfrac{(x)(0.0141)}{0.0141}=1×10^{−5}\). A resolução de x dá 1 × 10 −5 M. Portanto, comparado com 0,014 M, esse valor é insignificante (0,071%).
14.6: Tampões
Q14.6.1
Explique por que um tampão pode ser preparado a partir de uma mistura de NH 4 Cl e NaOH, mas não de NH 3 e NaOH.
Q14.6.2
Explique por que o pH não muda significativamente quando uma pequena quantidade de ácido ou base é adicionada a uma solução que contém quantidades iguais do ácido H 3 PO 4 e um sal de sua base conjugada NaH 2 PO 4.
S14.6.2
O excesso de H 3 O + é removido principalmente pela reação:
\(\ce{H3O+}(aq)+\ce{H2PO4-}(aq)⟶\ce{H3PO4}(aq)+\ce{H2O}(l)\)O excesso de base é removido pela reação:\(\ce{OH-}(aq)+\ce{H3PO4}(aq)⟶\ce{H2PO4-}(aq)+\ce{H2O}(l)\)
Q14.6.3
Explique por que o pH não muda significativamente quando uma pequena quantidade de ácido ou base é adicionada a uma solução que contém quantidades iguais da base NH 3 e um sal de seu ácido conjugado NH 4 Cl.
Q14.6.4
O que é [H 3 O +] em uma solução de 0,25 M CH 3 CO 2 H e 0,030 M NaCH 3 CO 2?
\(\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−5}\)
S 14.6.4
[H 3 O +] = 1,5 × 10 −4 M
Q14.6.5
O que é [H 3 O +] em uma solução de 0,075 M HNO 2 e 0,030 M NaNO 2?
S 14.6.6
\(\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) \hspace{20px} K_\ce{a}=4.5×10^{−5}\)Q14.6.6
O que é [OH −] em uma solução de 0,125 M CH 3 NH 2 e 0,130 M CH 3 NH 3 Cl?
S 14.6.6
\(\ce{CH3NH2}(aq)+\ce{H2O}(l)⇌\ce{CH3NH3+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=4.4×10^{−4}\)[OH −] = 4,2 × 10 −4 M
Q14.6.7
O que é [OH −] em uma solução de 1,25 M NH 3 e 0,78 M NH 4 NO 3?
S 14.6.7
\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=1.8×10^{−5}\)Q14.6.8
Qual concentração de NH 4 NO 3 é necessária para fazer [OH −] = 1,0 × 10 −5 em uma solução de 0,200- M de NH 3?
S 14.6.8
[NH 4 NO 3] = 0,36 M
Q14.6.9A
Qual concentração de NaF é necessária para fazer [H 3 O +] = 2,3 × 10 −4 em uma solução de 0,300- M de HF?
Q14.6.9 B
Qual é o efeito na concentração de ácido acético, íon hidrônio e íon acetato quando o seguinte é adicionado a uma solução tampão ácida de concentrações iguais de ácido acético e acetato de sódio:
- HCl
- KCH 3 CO 2
- NaCl
- KOH
- CH 3 CO 2 H
S 14.6.10
- O HCl adicionado aumentará ligeiramente a concentração de H 3 O +, que reagirá\(\ce{CH3CO2-}\) e produzirá CH 3 CO 2 H no processo. Assim,\(\ce{[CH3CO2- ]}\) diminui e [CH 3 CO 2 H] aumenta.
- O KCH 3 CO 2 adicionado aumentará a concentração da\(\ce{[CH3CO2- ]}\) qual reagirá com H 3 O + e produzirá CH 3 CO 2 H no processo. Assim, [H 3 O +] diminui ligeiramente e [CH 3 CO 2 H] aumenta.
- O NaCl adicionado não terá efeito na concentração dos íons.
- O KOH adicionado produzirá íons OH −, que reagirão com o H 3 O +, reduzindo assim [H 3 O +]. Alguns CH 3 CO 2 H adicionais se dissociarão, produzindo\(\ce{[CH3CO2- ]}\) íons no processo. Assim, [CH 3 CO 2 H] diminui ligeiramente e\(\ce{[CH3CO2- ]}\) aumenta.
- O CH 3 CO 2 H adicionado aumentará sua concentração, fazendo com que mais dele se dissocie e produza mais\(\ce{[CH3CO2- ]}\) e H 3 O+ no processo. Assim, [H 3 O +] aumenta ligeiramente e\(\ce{[CH3CO2- ]}\) aumenta.
Q14.6.11
Qual é o efeito na concentração de amônia, íon hidróxido e íon amônio quando o seguinte é adicionado a uma solução tampão básica de concentrações iguais de amônia e nitrato de amônio:
- KI
- NH 3
- OI
- NaOH
- NH 4 Cl
Qual será o pH de uma solução tampão preparada a partir de 0,20 mol NH 3, 0,40 mol NH 4 NO 3 e água suficiente para fornecer 1,00 L de solução?
pH = 8,95
Calcule o pH de uma solução tampão preparada a partir de 0,155 mol de ácido fosfórico, 0,250 mol de KH 2 PO 4 e água suficiente para fazer 0,500 L de solução.
Quanto NaCH 3 CO 2 •3H 2 O sólido deve ser adicionado a 0,300 L de uma solução de ácido acético 0,50- M para obter um tampão com um pH de 5,00? (Dica: suponha uma mudança insignificante no volume à medida que o sólido é adicionado.)
37 g (0,27 mol)
Qual massa de NH 4 Cl deve ser adicionada a 0,750 L de uma solução de 0,100- M de NH 3 para obter uma solução tampão com um pH de 9,26? (Dica: suponha uma mudança insignificante no volume à medida que o sólido é adicionado.)
Q14.6.1
Uma solução tampão é preparada a partir de volumes iguais de 0,200 M de ácido acético e 0,600 M de acetato de sódio. Use 1,80 × 10 −5 como K a para o ácido acético.
- Qual é o pH da solução?
- A solução é ácida ou básica?
Q14.6.1
Qual é o pH de uma solução que resulta quando 3,00 mL de 0,034 M HCl são adicionados a 0,200 L do tampão original?
- pH = 5,222;
- A solução é ácida. (c) pH = 5,221
Q14.6.1
Uma amostra de 5,36 g de NH 4 Cl foi adicionada a 25,0 mL de 1,00 M NaOH e a solução resultante diluída para 0,100 L.
- Qual é o pH dessa solução tampão?
- A solução é ácida ou básica?
- Qual é o pH de uma solução que resulta quando 3,00 mL de 0,034 M HCl são adicionados à solução?
Qual ácido em [link] é mais apropriado para a preparação de uma solução tampão com um pH de 3,1? Explique sua escolha.
Para preparar o melhor tampão para um ácido fraco HA e seu sal, a proporção\(\dfrac{\ce{[H3O+]}}{K_\ce{a}}\) deve ser a mais próxima possível de 1 para uma ação eficaz do tampão. A concentração de [H 3 O +] em um tampão de pH 3,1 é [H 3 O +] = 10 −3,1 = 7,94 × 10 −4 M
Agora podemos resolver para K um do melhor ácido da seguinte forma:\(\dfrac{\ce{[H3O+]}}{K_\ce{a}}=1\)
\(K_\ce{a}=\dfrac{\ce{[H3O+]}}{1}=7.94×10^{−4}\)
Em [link], o ácido com o K a mais próximo de 7,94 × 10 −4 é HF, com um K a de 7,2 × 10 −4.Qual ácido em [link] é mais apropriado para a preparação de uma solução tampão com um pH de 3,7? Explique sua escolha.
Qual base em [link] é mais apropriada para a preparação de uma solução tampão com um pH de 10,65? Explique sua escolha.
Para tampões com pH > 7, você deve usar uma base fraca e seu sal. O buffer mais eficaz terá uma proporção\(\dfrac{\ce{[OH- ]}}{K_\ce{b}}\) tão próxima de 1 quanto possível. O pOH do buffer é 14,00 − 10,65 = 3,35. Portanto, [OH −] é [OH −] = 10 −pOH = 10 −3,35 = 4,467 × 10 −4 M.
Agora podemos resolver K b da melhor base da seguinte forma:\(\dfrac{\ce{[OH- ]}}{K_\ce{b}}=1\) K b = [OH −] = 4,47 × 10 −4 Em [link], a base com o K b mais próximo de 4,47 × 10 −4 é CH 3 NH 2, com K b = 4,4 × 10 −4.Qual base em [link] é mais apropriada para a preparação de uma solução tampão com um pH de 9,20? Explique sua escolha.
Q14.6.4
A sacarina, C 7 H 4 NSO 3 H, é um ácido fraco (K a = 2,1 × 10 −2). Se 0,250 L de cola dietética com um pH tamponado de 5,48 foram preparados a partir de 2,00 × 10 −3 g de sacarídeo de sódio, Na (C 7 H 4 NSO 3), quais são as concentrações finais de sacarina e sacarídeo de sódio na solução?
S 14.6.4
A massa molar do sacarídeo de sódio é 205,169 g/mol. Usando as abreviações HA para sacarina e NaA para sacarídeo de sódio, o número de moles de NaA na solução é:
9,75 × 10 −6 mol. Isso ioniza inicialmente para formar íons sacarina, A −, com: [A −] = 3,9 × 10 −5 MQ14.6.5
Qual é o pH de 1.000 L de uma solução de 100,0 g de ácido glutâmico (C 5 H 9 NO 4, um ácido diprótico; K 1 = 8,5 × 10 −5, K 2 = 3,39 × 10 −10) ao qual foram adicionados 20,0 g de NaOH durante o preparação de glutamato monossódico, o agente aromatizante? Qual é o pH quando exatamente 1 mol de NaOH por mol de ácido foi adicionado?
14.7: Titulações ácido-base
Q14.7.1
Explique como escolher o indicador ácido-base apropriado para a titulação de uma base fraca com um ácido forte.
S14.7.1
No ponto de equivalência na titulação de uma base fraca com um ácido forte, a solução resultante é levemente ácida devido à presença do ácido conjugado. Portanto, escolha um indicador que mude de cor na faixa ácida e coloque o pH entre parênteses no ponto de equivalência. A laranja metílica é um bom exemplo.
Q14.7.2
Explique por que um indicador ácido-base muda de cor em uma faixa de valores de pH, em vez de em um pH específico.
Q14.7.3
Por que podemos ignorar a contribuição da água para as concentrações de H 3 O + nas soluções dos seguintes ácidos:
- 0,0092 M HClo, um ácido fraco
- 0,0810 M HCN, um ácido fraco
- 0,120 M\(\ce{Fe(H2O)6^2+}\) um ácido fraco, K a = 1,6 × 10 −7
mas não a contribuição da água para a concentração de OH −?
S 14.7.3
Em uma solução ácida, a única fonte de íons OH − é a água. Usamos K w para calcular a concentração. Se a contribuição da água fosse negligenciada, a concentração de OH − seria zero.
Q14.7.4
Podemos ignorar a contribuição da água para a concentração de OH − em uma solução das seguintes bases:
0,0784 M C 6 H 5 NH 2, uma base fraca
0,11 M (CH 3) 3 N, uma base fraca
mas não a contribuição da água para a concentração de H 3 O +?
Q14.7.5
Desenhe uma curva para uma série de soluções de HF. Faça um gráfico do total de [H 3 O +] no eixo vertical e a concentração total de HF (a soma das concentrações das moléculas de HF ionizadas e não ionizadas) no eixo horizontal. Deixe a concentração total de HF variar de 1 × 10 −10 M a 1 × 10 −2 M.
![É mostrado um gráfico intitulado “Plot of [H subscript 3 O sobrescrito +] Against [H F]”. O eixo horizontal é rotulado como “[H F], M.” O eixo começa em 10 sobrescrito menos 10 e inclui marcações a cada 10 unidades sobrescritas, 2 unidades até 1,0. O eixo vertical é rotulado como “[H subscrito 3 O sobrescrito mais], M” e começa em 10 sobrescrito menos 10 e aumenta em 10 sobrescrito 2 até 1,0. Uma curva preta começa no lado esquerdo do gráfico em (10 sobrescrito menos 10, 10 sobrescrito menos 7). A linha se estende horizontalmente até um valor de eixo horizontal de 10 sobrescrito menos 8. Depois disso, a linha aumenta gradualmente a uma taxa constante até um valor pouco acima de 10 sobrescrito menos 3 em um valor de eixo horizontal de 10 sobrescrito menos 2.](http://cnx.org/resources/bbd3359c4d4d301b0f4471bd309310444779db56/CNX_Chem_14_07_Exercise5_img.jpg)
Q14.7.6
Desenhe uma curva semelhante à mostrada na Figura para uma série de soluções do NH 3. Faça um gráfico de [OH −] no eixo vertical e a concentração total de NH 3 (moléculas de NH 3 ionizadas e não ionizadas) no eixo horizontal. Deixe a concentração total de NH 3 variar de 1 × 10 −10 M a 1 × 10 −2 M.
Q14.7.7
Calcule o pH nos seguintes pontos em uma titulação de 40 mL (0,040 L) de ácido barbitúrico 0,100 M (K a = 9,8 × 10 −5) com 0,100 M KOH.
- nenhum KOH adicionado
- 20 mL de solução de KOH adicionada
- 39 mL de solução de KOH adicionados
- 40 mL de solução de KOH adicionada
- 41 mL de solução de KOH adicionada
S 14.7.7
- pH = 2,50;
- pH = 4,01;
- pH = 5,60;
- pH = 8,35;
- pH = 11,08
Q14.7.8
O indicador dinitrofenol é um ácido com um K a de 1,1 × 10 −4. Em uma solução de 1,0 × 10 −4 - M, é incolor em ácido e amarelo na base. Calcule a faixa de pH na qual ele vai de 10% ionizado (incolor) a 90% ionizado (amarelo).


