14.6: Tampões
- Page ID
- 185564
- Descreva a composição e a função dos tampões ácido-base
- Calcule o pH de um tampão antes e depois da adição de ácido ou base adicionado
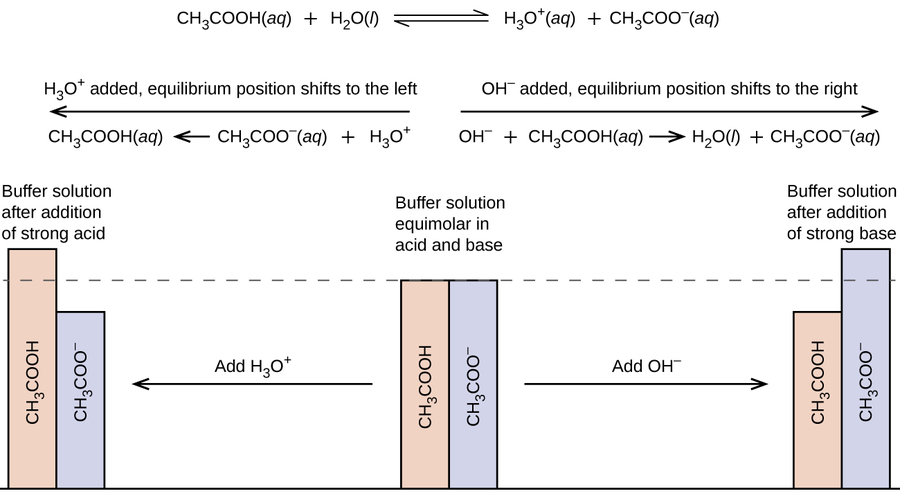
Uma mistura de um ácido fraco e sua base conjugada (ou uma mistura de uma base fraca e seu ácido conjugado) é chamada de solução tampão ou tampão. As soluções tampão resistem a uma mudança no pH quando pequenas quantidades de um ácido forte ou uma base forte são adicionadas (Figura\(\PageIndex{1}\)). Uma solução de ácido acético (\(\ce{CH3COOH}\)e acetato de sódio\(\ce{CH3COONa}\)) é um exemplo de tampão que consiste em um ácido fraco e seu sal. Um exemplo de tampão que consiste em uma base fraca e seu sal é uma solução de amônia (\(\ce{NH3(aq)}\)) e cloreto de amônio (\(\ce{NH4Cl(aq)}\)).

Como funcionam os buffers
Uma mistura de ácido acético e acetato de sódio é ácida porque o K a do ácido acético é maior que o K b de seu acetato de base conjugada. É um tampão porque contém tanto o ácido fraco quanto seu sal. Portanto, ele age para manter a concentração de íons hidrônio (e o pH) quase constante pela adição de uma pequena quantidade de um ácido forte ou de uma base forte. Se adicionarmos uma base como hidróxido de sódio, os íons hidróxido reagem com os poucos íons hidrônio presentes. Então, mais ácido acético reage com a água, restaurando a concentração do íon hidrônio quase ao seu valor original:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
O pH muda muito pouco. Se adicionarmos um ácido como o ácido clorídrico, a maioria dos íons hidrônio do ácido clorídrico se combinam com os íons acetato, formando moléculas de ácido acético:
\[\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)⟶\ce{CH3CO2H}(aq)+\ce{H2O}(l) \nonumber \]
Assim, há muito pouco aumento na concentração do íon hidrônio, e o pH permanece praticamente inalterado (Figura\(\PageIndex{2}\)).
Uma mistura de amônia e cloreto de amônio é básica porque o K b para amônia é maior do que o K a para o íon amônio. É um amortecedor porque também contém o sal da base fraca. Se adicionarmos uma base (íons hidróxido), os íons de amônio no tampão reagem com os íons hidróxido para formar amônia e água e reduzir a concentração de íons hidróxido quase ao seu valor original:
\[\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l) \nonumber \]
Se adicionarmos um ácido (íons hidrônio), as moléculas de amônia na mistura tampão reagem com os íons hidrônio para formar íons de amônio e reduzir a concentração de íons hidrônio quase ao seu valor original:
\[\ce{H3O+}(aq)+\ce{NH3}(aq)⟶\ce{NH4+}(aq)+\ce{H2O}(l) \nonumber \]
As três partes do exemplo a seguir ilustram a mudança no pH que acompanha a adição de base a uma solução tamponada de um ácido fraco e a uma solução sem tamponamento de um ácido forte.
Os tampões de acetato são usados em estudos bioquímicos de enzimas e outros componentes químicos das células para evitar alterações de pH que possam alterar a atividade bioquímica desses compostos.
- Calcule o pH de um tampão de acetato que é uma mistura com 0,10 M de ácido acético e 0,10 M de acetato de sódio.
- Calcule o pH após a adição de 1,0 mL de NaOH 0,10 M a 100 mL desse tampão, dando uma solução com um volume de 101 mL.
Solução
- Calcule o pH de um tampão de acetato que é uma mistura com 0,10 M de ácido acético e 0,10 M de acetato de sódio.
Para determinar o pH da solução tampão, usamos um cálculo de equilíbrio típico (conforme ilustrado nos exemplos anteriores):
- Determine a direção da mudança. O equilíbrio em uma mistura de H 3 O +,\(\ce{CH3CO2-}\), e CH 3 CO 2 H é:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
A constante de equilíbrio para CH 3 CO 2 H não é fornecida, então a procuramos na Tabela E1: K a = 1,8 × 10 −5. Com [CH 3 CO 2 H] =\(\ce{[CH3CO2- ]}\) = 0,10 M e [H 3 O +] = ~0 M, a reação muda para a direita para formar H 3 O +.
- Determine as concentrações de x e equilíbrio. Segue uma tabela de mudanças e concentrações:
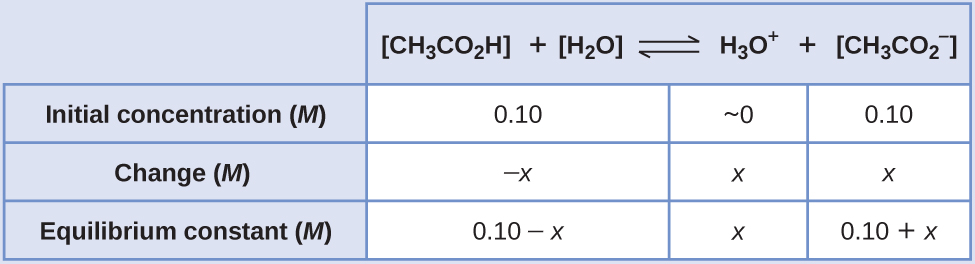
- Determine a direção da mudança. O equilíbrio em uma mistura de H 3 O +,\(\ce{CH3CO2-}\), e CH 3 CO 2 H é:
- Resolva para x e as concentrações de equilíbrio. Encontramos:
\[x=1.8×10^{−5}\:M \nonumber \]
- e
\[\ce{[H3O+]}=0+x=1.8×10^{−5}\:M \nonumber \]
Assim:\[\mathrm{pH=−log[H_3O^+]=−log(1.8×10^{−5})} \nonumber \]
\[=4.74 \nonumber \]
4. Verifique o trabalho. Se calcularmos todas as concentrações de equilíbrio calculadas, descobrimos que o valor de equilíbrio do coeficiente de reação, Q = K a.
(b) Calcule o pH após a adição de 1,0 mL de NaOH 0,10 M a 100 mL desse tampão, dando uma solução com um volume de 101 mL.
Primeiro, calculamos as concentrações de uma mistura intermediária resultante da reação completa entre o ácido no tampão e a base adicionada. Em seguida, determinamos as concentrações da mistura no novo equilíbrio:
- Determine as toupeiras de NaOH. Um mililitro (0,0010 L) de 0,10 M NaOH contém:
\[\mathrm{0.0010\cancel{L}×\left(\dfrac{0.10\:mol\: NaOH}{1\cancel{L}}\right)=1.0×10^{−4}\:mol\: NaOH} \nonumber \]
- Determine os moles de CH 2 CO 2 H. Antes da reação, 0,100 L da solução tampão contém:
\[\mathrm{0.100\cancel{L}×\left(\dfrac{0.100\:mol\:CH_3CO_2H}{1\cancel{L}}\right)=1.00×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
- Determine a quantidade de NaCH 3 CO 2 produzida. O 1,0 × 10 −4 mol de NaOH neutraliza 1,0 × 10 −4 mol de CH 3 CO 2 H, deixando:
\[\mathrm{(1.0×10^{−2})−(0.01×10^{−2})=0.99×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
e produzindo 1,0 × 10 −4 mol de NaCH 3 CO 2. Isso perfaz um total de:
[\ mathrm {(1,0×10^ {−2}) + (0,01×10^ {−2}) =1,01×10^ {−2}\ :mol\ :nACh_3CO_2}\ nonumber\]
4. Encontre a molaridade dos produtos. Após a reação, CH 3 CO 2 H e NaCH 3 CO 2 estão contidos em 101 mL da solução intermediária, então:
\[\ce{[CH3CO2H]}=\mathrm{\dfrac{9.9×10^{−3}\:mol}{0.101\:L}}=0.098\:M \nonumber \]
\[\ce{[NaCH3CO2]}=\mathrm{\dfrac{1.01×10^{−2}\:mol}{0.101\:L}}=0.100\:M \nonumber \]
Agora calculamos o pH após a solução intermediária, que é 0,098 M em CH 3 CO 2 H e 0,100 M em NaCH 3 CO 2, atingir o equilíbrio. O cálculo é muito semelhante ao da parte (a) deste exemplo:

Esta série de cálculos fornece um pH = 4,75. Assim, a adição da base mal altera o pH da solução.
(c) Para comparação, calcule o pH após 1,0 mL de 0,10 M NaOH ser adicionado a 100 mL de uma solução de uma solução sem tamponamento com um pH de 4,74 (uma solução 1,8 × 10 −5 - M de HCl). O volume da solução final é 101 mL.
Solução
Esta solução 1,8 × 10 −5 - M de HCl tem a mesma concentração de íon hidrônio que a solução 0,10- M do tampão de acetato de sódio e ácido acético descrita na parte (a) deste exemplo. A solução contém:
\(\mathrm{0.100\:L×\left(\dfrac{1.8×10^{−5}\:mol\: HCl}{1\:L}\right)=1.8×10^{−6}\:mol\: HCl} \)
Conforme mostrado na parte (b), 1 mL de 0,10 M NaOH contém 1,0 × 10 −4 mol de NaOH. Quando as soluções de NaOH e HCl são misturadas, o HCl é o reagente limitante na reação. Todo o HCl reage e a quantidade de NaOH que permanece é:
\( (1.0×10^{−4})−(1.8×10^{−6})=9.8×10^{−5}\:M \)
A concentração de NaOH é:
\(\dfrac{9.8×10^{−5}\:M\:\ce{NaOH}}{0.101\:\ce{L}}=9.7×10^{−4}\:M \)
O pOH dessa solução é:
\(\mathrm{pOH=−log[OH^- ]=−log(9.7×10^{−4})=3.01} \)O pH é:
\(\mathrm{pH=14.00−pOH=10.99} \)
O pH muda de 4,74 para 10,99 nesta solução sem tamponamento. Isso se compara à mudança de 4,74 para 4,75 que ocorreu quando a mesma quantidade de NaOH foi adicionada à solução tamponada descrita na parte (b).
Mostre que adicionar 1,0 mL de 0,10 M de HCl altera o pH de 100 mL de uma solução de HCl 1,8 × 10 −5 M de 4,74 para 3,00.
- Responda
-
pH inicial de 1,8 × 10 −5 M HCl; pH = −log [H 3 O +] = −log [1,8 × 10 −5] = 4,74
Moles de H 3 O + adicionados pela adição de 1,0 mL de HCl 0,10 M: 0,10 moles/L × 0,0010 L = 1,0 × 10 −4 moles; pH final após adição de 1,0 mL de 0,10 M HCl:
\[\mathrm{pH=−log[H_3O^+]=−log\left(\dfrac{total\: moles\:H_3O^+}{total\: volume}\right)=−log\left(\dfrac{1.0×10^{−4}\:mol+1.8×10^{−6}\:mol}{101\:mL\left(\dfrac{1\:L}{1000\:mL}\right)}\right)=3.00} \nonumber \]
Capacidade do buffer
As soluções tampão não têm uma capacidade ilimitada de manter o pH relativamente constante (Figura\(\PageIndex{3}\)). Se adicionarmos tanta base a um tampão que o ácido fraco se esgote, nenhuma outra ação de tamponamento em direção à base será possível. Por outro lado, se adicionarmos um excesso de ácido, a base fraca se esgotaria e nenhuma outra ação de tamponamento em relação a qualquer ácido adicional seria possível. Na verdade, nem precisamos esgotar todo o ácido ou a base de um tampão para sobrecarregá-lo; sua ação de tamponamento diminuirá rapidamente à medida que um determinado componente se aproxima do esgotamento.

Figura\(\PageIndex{3}\): A cor do indicador (laranja de metilo) mostra que uma pequena quantidade de ácido adicionada a uma solução tamponada de pH 8 (copo à esquerda) tem pouco efeito no sistema tamponado (copo médio). No entanto, uma grande quantidade de ácido esgota a capacidade de tamponamento da solução e o pH muda drasticamente (copo à direita). (crédito: modificação do trabalho de Mark Ott) A capacidade do tampão é a quantidade de ácido ou base que pode ser adicionada a um determinado volume de uma solução tampão antes que o pH mude significativamente, geralmente em uma unidade. A capacidade do tampão depende das quantidades de ácido fraco e de sua base conjugada que estão em uma mistura tampão. Por exemplo, 1 L de uma solução que é 1,0 M em ácido acético e 1,0 M em acetato de sódio tem uma capacidade de tampão maior do que 1 L de uma solução que é 0,10 M em ácido acético e 0,10 M em acetato de sódio, embora ambas as soluções tenham o mesmo pH. A primeira solução tem mais capacidade de tampão porque contém mais ácido acético e íon acetato.
Seleção de misturas tampão adequadas
Existem duas regras práticas úteis para selecionar misturas de tampão:
- Uma boa mistura tampão deve ter concentrações aproximadamente iguais de ambos os componentes. Uma solução de buffer geralmente perde sua utilidade quando um componente do par de buffers é menor que cerca de 10% do outro. A figura\(\PageIndex{4}\) mostra um tampão de íon acetato de ácido acético à medida que a base é adicionada. O pH inicial é 4,74. Uma mudança de 1 unidade de pH ocorre quando a concentração de ácido acético é reduzida para 11% da concentração do íon acetato.
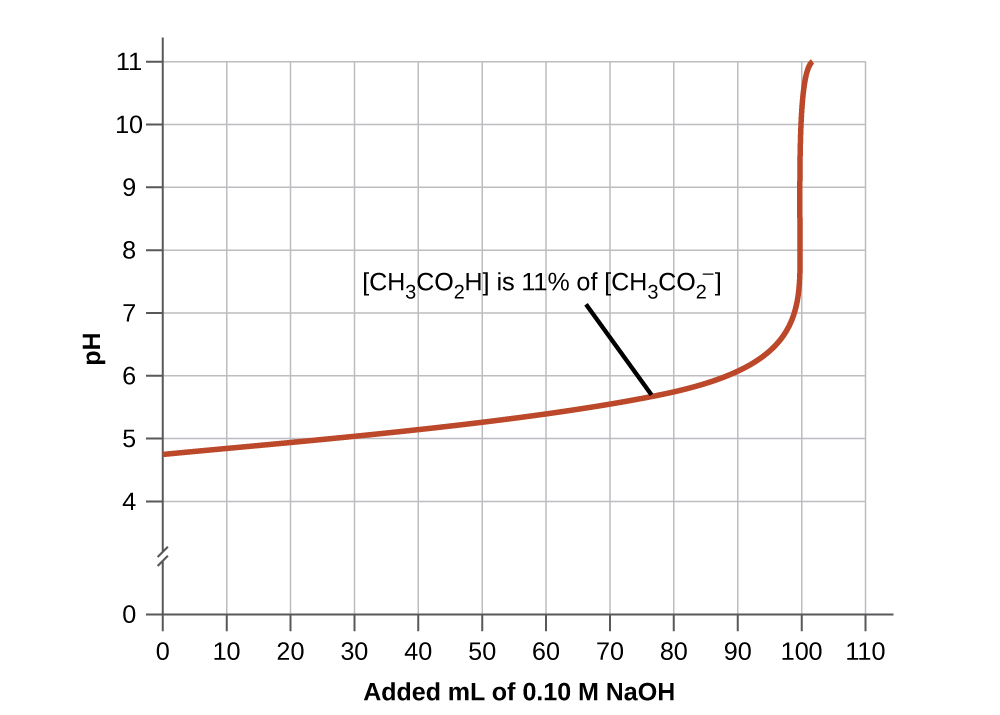
Figura\(\PageIndex{4}\): O gráfico, uma ilustração da ação de tamponamento, mostra a mudança de pH à medida que uma quantidade crescente de uma solução de NaOH 0,10 M é adicionada a 100 mL de uma solução tampão na qual, inicialmente,\([\ce{CH3CO2H}] = 0.10\: M\)\(\ce{[CH3CO2^{-}]}=0.10\:M\) e.
- Ácidos fracos e seus sais são melhores como tampões para pHs menores que 7; bases fracas e seus sais são melhores como tampões para pHs maiores que 7.
O sangue é um exemplo importante de solução tamponada, com o principal ácido e íon responsáveis pela ação tamponadora sendo o ácido carbônico, H 2 CO 3, e o íon bicarbonato,\(\ce{HCO3-}\). Quando um excesso de íon hidrogênio entra na corrente sanguínea, ele é removido principalmente pela reação:
\[\ce{H3O+}(aq)+\ce{HCO3-}(aq)⟶\ce{H2CO3}(aq)+\ce{H2O}(l) \nonumber \]
Quando um excesso do íon hidróxido está presente, ele é removido pela reação:
\[\ce{OH-}(aq)+\ce{H2CO3}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
O pH do sangue humano, portanto, permanece muito próximo de 7,35, ou seja, um pouco básico. As variações geralmente são inferiores a 0,1 de uma unidade de pH. É provável que uma mudança de 0,4 de uma unidade de pH seja fatal.
A aproximação de Henderson-Hasselbalch
A expressão constante de ionização para uma solução de um ácido fraco pode ser escrita como:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
Reorganizando para resolver [H 3 O +], obtemos:
\[\ce{[H3O+]}=K_\ce{a}×\ce{\dfrac{[HA]}{[A- ]}} \nonumber \]
Tomando o logaritmo negativo de ambos os lados dessa equação, chegamos a:
\[\mathrm{−log[H_3O^+]=−log\mathit{K}_a − log\dfrac{[HA]}{[A^- ]}} \nonumber \]
que pode ser escrito como
\[\mathrm{pH=p\mathit{K}_a+log\dfrac{[A^- ]}{[HA]}} \nonumber \]
onde p K a é o negativo do logaritmo comum da constante de ionização do ácido fraco (p K a = −log K a). Essa equação relaciona o pH, a constante de ionização de um ácido fraco e as concentrações do ácido fraco e seu sal em uma solução tamponada. Os cientistas costumam usar essa expressão, chamada de aproximação de Henderson-Hasselbalch, para calcular o pH das soluções tampão. É importante observar que a suposição “x é pequeno” deve ser válida para usar essa equação.
Lawrence Joseph Henderson (1878-1942) foi um médico, bioquímico e fisiologista americano, para citar apenas algumas de suas muitas atividades. Ele se formou em medicina em Harvard e depois passou 2 anos estudando em Estrasburgo, então parte da Alemanha, antes de retornar para assumir o cargo de professor em Harvard. Ele acabou se tornando professor em Harvard e trabalhou lá por toda a vida. Ele descobriu que o equilíbrio ácido-base no sangue humano é regulado por um sistema tampão formado pelo dióxido de carbono dissolvido no sangue. Ele escreveu uma equação em 1908 para descrever o sistema tampão de ácido carbônico e carbonato no sangue. Henderson tinha amplo conhecimento; além de sua importante pesquisa sobre a fisiologia do sangue, ele também escreveu sobre as adaptações dos organismos e sua adaptação com seus ambientes, sobre sociologia e sobre educação universitária. Ele também fundou o Laboratório de Fadiga, na Harvard Business School, que examinou a fisiologia humana com foco específico no trabalho na indústria, exercícios e nutrição.
Em 1916, Karl Albert Hasselbalch (1874-1962), médico e químico dinamarquês, compartilhou a autoria em um artigo com Christian Bohr em 1904 que descreveu o efeito Bohr, que mostrou que a capacidade da hemoglobina no sangue de se ligar ao oxigênio estava inversamente relacionada à acidez do sangue e a concentração de dióxido de carbono. A escala de pH foi introduzida em 1909 por outro dinamarquês, Sørensen, e em 1912, Hasselbalch publicou medições do pH do sangue. Em 1916, Hasselbalch expressou a equação de Henderson em termos logarítmicos, consistentes com a escala logarítmica do pH, e assim nasceu a equação de Henderson-Hasselbalch.
O pH normal do sangue humano é de cerca de 7,4. O sistema de tampão de carbonato no sangue usa a seguinte reação de equilíbrio:
\[\ce{CO2}(g)+\ce{2H2O}(l)⇌\ce{H2CO3}(aq)⇌\ce{HCO3-}(aq)+\ce{H3O+}(aq) \nonumber \]
A concentração de ácido carbônico, H 2 CO 3 é de aproximadamente 0,0012 M, e a concentração do íon hidrogenocarbonato\(\ce{HCO3-}\), é de cerca de 0,024 M. Usando a equação de Henderson-Hasselbalch e o p K a do ácido carbônico à temperatura corporal, podemos calcular o pH do sangue:
\[\mathrm{pH=p\mathit{K}_a+\log\dfrac{[base]}{[acid]}=6.1+\log\dfrac{0.024}{0.0012}=7.4} \nonumber \]
O fato de a concentração de H 2 CO 3 ser significativamente menor que a do\(\ce{HCO3-}\) íon pode parecer incomum, mas esse desequilíbrio se deve ao fato de que a maioria dos subprodutos do nosso metabolismo que entram na corrente sanguínea são ácidos. Portanto, deve haver uma proporção maior de base do que de ácido, para que a capacidade do tampão não seja excedida.
O ácido lático é produzido em nossos músculos quando nos exercitamos. Quando o ácido lático entra na corrente sanguínea, ele é neutralizado pelo\(\ce{HCO3-}\) íon, produzindo H 2 CO 3. Uma enzima então acelera a decomposição do excesso de ácido carbônico em dióxido de carbono e água, que podem ser eliminados pela respiração. De fato, além dos efeitos reguladores do sistema de tamponamento de carbonato no pH do sangue, o corpo usa a respiração para regular o pH do sangue. Se o pH do sangue diminuir muito, um aumento na respiração remove o CO 2 do sangue através dos pulmões, impulsionando a reação de equilíbrio de forma que [H 3 O +] seja reduzido. Se o sangue estiver muito alcalino, uma frequência respiratória mais baixa aumenta a concentração de CO 2 no sangue, conduzindo a reação de equilíbrio para o outro lado, aumentando [H +] e restaurando um pH apropriado.
Resumo
Uma solução contendo uma mistura de um ácido e sua base conjugada, ou de uma base e seu ácido conjugado, é chamada de solução tampão. Ao contrário do caso de uma solução ácida, base ou salina, a concentração de íons hidrônio de uma solução tampão não muda muito quando uma pequena quantidade de ácido ou base é adicionada à solução tampão. A base (ou ácido) no tampão reage com o ácido adicionado (ou base).
Equações-chave
- p K a = −log K a
- p K b = −log K b
- \(\mathrm{pH=p\mathit{K}_a+\log\dfrac{[A^- ]}{[HA]}}\)
Glossário
- capacidade do buffer
- quantidade de um ácido ou base que pode ser adicionada a um volume de uma solução tampão antes que seu pH mude significativamente (geralmente em uma unidade de pH)
- amortecedor
- mistura de um ácido fraco ou de uma base fraca e o sal de seu conjugado; o pH de um tampão resiste a mudanças quando pequenas quantidades de ácido ou base são adicionadas
- Equação de Henderson-Hasselbalch
- equação usada para calcular o pH de soluções tampão
- Determine as toupeiras de NaOH. Um mililitro (0,0010 L) de 0,10 M NaOH contém:


