12.6: Mecanismos de reação
- Page ID
- 185011
△
- Distinguir reações líquidas de reações elementares (etapas)
- Identifique a molecularidade das reações elementares
- Escreva uma equação química balanceada para um processo, dado seu mecanismo de reação
- Derive a lei de taxas consistente com um determinado mecanismo de reação
Uma equação balanceada para uma reação química indica o que está reagindo e o que é produzido, mas não revela nada sobre como a reação realmente ocorre. O mecanismo de reação (ou caminho de reação) é o processo, ou caminho, pelo qual uma reação ocorre. Uma reação química geralmente ocorre em etapas, embora nem sempre seja óbvia para um observador. A decomposição do ozônio, por exemplo, parece seguir um mecanismo com duas etapas:
\ [\ ce {O3} (g) ⟶\ ce {O2} (g) +\ ce {O}\\
\ ce {O} +\ ce {O3} (g) ⟶\ ce {2O2} (g)\ label {12.7.1}\]
Chamamos cada etapa de um mecanismo de reação de reação elementar. As reações elementares ocorrem exatamente como estão escritas e não podem ser divididas em etapas mais simples. As reações elementares se somam à reação geral, que, para a decomposição, é:
\[\ce{2O3}(g)⟶\ce{3O2}(g) \label{12.7.2} \]
Observe que o átomo de oxigênio produzido na primeira etapa desse mecanismo é consumido na segunda etapa e, portanto, não aparece como um produto na reação geral. As espécies que são produzidas em uma etapa e consumidas em uma etapa subsequente são chamadas de intermediárias.
Embora a equação geral da reação para a decomposição do ozônio indique que duas moléculas de ozônio reagem para fornecer três moléculas de oxigênio, o mecanismo da reação não envolve a colisão e reação de duas moléculas de ozônio. Pelo contrário, envolve uma molécula de ozônio se decompondo em uma molécula de oxigênio e um átomo de oxigênio intermediário; o átomo de oxigênio então reage com uma segunda molécula de ozônio para dar duas moléculas de oxigênio. Essas duas reações elementares ocorrem exatamente como são mostradas no mecanismo de reação.
Reações elementares unimoleculares
A molecularidade de uma reação elementar é o número de espécies de reagentes (átomos, moléculas ou íons). Por exemplo, uma reação unimolecular envolve o rearranjo de uma única espécie de reagente para produzir uma ou mais moléculas de produto:
\[A⟶\ce{products} \label{12.7.2b} \]
A equação da taxa para uma reação unimolecular é:
\[\ce{rate}=k[A] \label{12.7.3} \]
Uma reação unimolecular pode ser uma das várias reações elementares em um mecanismo complexo. Por exemplo, a reação:
\[\ce{O3 ⟶ O2 + O} \label{12.7.4} \]
ilustra uma reação elementar unimolecular que ocorre como parte de um mecanismo de reação de duas etapas. No entanto, algumas reações unimoleculares podem ter apenas uma única reação no mecanismo de reação. (Em outras palavras, uma reação elementar também pode ser uma reação geral em alguns casos.) Por exemplo, a decomposição em fase gasosa do ciclobutano, C 4 H 8, em etileno, C 2 H 4, ocorre por meio de um mecanismo unimolecular de etapa única:
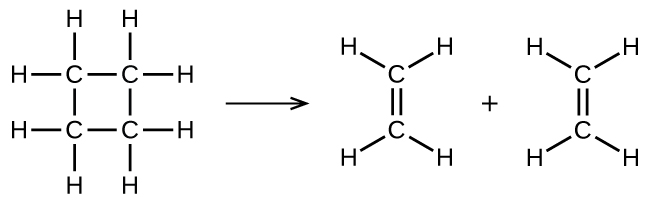
Para que essas reações unimoleculares ocorram, tudo o que é necessário é a separação de partes de moléculas de um único reagente em produtos.
As ligações químicas não se desfazem simplesmente durante as reações químicas. A energia é necessária para romper as ligações químicas. A energia de ativação para a decomposição de C 4 H 8, por exemplo, é 261 kJ por mol. Isso significa que são necessários 261 quilojoules para distorcer um mol dessas moléculas em complexos ativados que se decompõem em produtos:
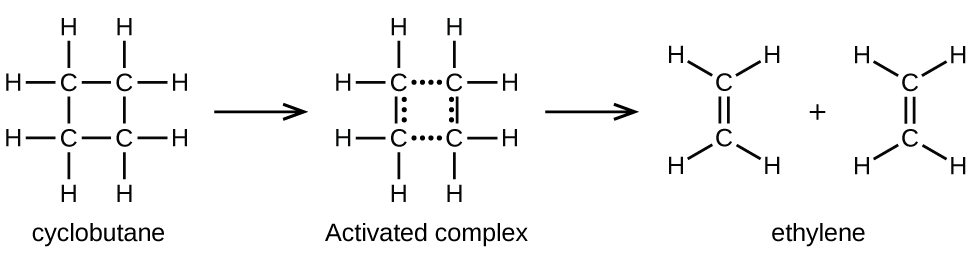
Em uma amostra de C 4 H 8, algumas das moléculas de C 4 H 8 que se movem rapidamente colidem com outras moléculas que se movem rapidamente e captam energia adicional. Quando as moléculas de C 4 H 8 ganham energia suficiente, elas podem se transformar em um complexo ativado e a formação de moléculas de etileno pode ocorrer. Com efeito, uma colisão particularmente energética coloca uma molécula C 4 H 8 na geometria do complexo ativado. No entanto, apenas uma pequena fração das moléculas de gás viaja a velocidades suficientemente altas com energias cinéticas grandes o suficiente para fazer isso. Portanto, a qualquer momento, apenas algumas moléculas captam energia suficiente das colisões para reagir.
A taxa de decomposição de C 4 H 8 é diretamente proporcional à sua concentração. Dobrar a concentração de C 4 H 8 em uma amostra dá o dobro de moléculas por litro. Embora a fração de moléculas com energia suficiente para reagir permaneça a mesma, o número total dessas moléculas é duas vezes maior. Consequentemente, há duas vezes mais C 4 H 8 por litro e a taxa de reação é duas vezes mais rápida:
\[\ce{rate}=−\dfrac{Δ[\ce{C4H8}]}{Δt}=k[\ce{C4H8}] \label{12.7.5} \]
Uma relação semelhante se aplica a qualquer reação elementar unimolecular; a taxa de reação é diretamente proporcional à concentração do reagente e a reação exibe um comportamento de primeira ordem. A constante de proporcionalidade é a constante de taxa para a reação unimolecular específica.
Reações elementares bimoleculares
A colisão e combinação de duas moléculas ou átomos para formar um complexo ativado em uma reação elementar é chamada de reação bimolecular. Existem dois tipos de reações elementares bimoleculares:
\[A+B⟶\ce{products} \label{12.7.6} \]
e
\[2A⟶\ce{products} \label{12.7.7} \]
Para o primeiro tipo, no qual as duas moléculas reagentes são diferentes, a lei da taxa é de primeira ordem em A e de primeira ordem em B:
\[\ce{rate}=k[A][B] \label{12.7.8} \]
Para o segundo tipo, no qual duas moléculas idênticas colidem e reagem, a lei da taxa é de segunda ordem em A:
\[\ce{rate}=k[A][A]=k[A]^2 \label{12.7.9} \]
Algumas reações químicas têm mecanismos que consistem em uma única reação elementar bimolecular. Um exemplo é a reação do dióxido de nitrogênio com o monóxido de carbono:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \label{12.7.10} \]
(veja a Figura\(\PageIndex{1}\))

As reações elementares bimoleculares também podem estar envolvidas como etapas em um mecanismo de reação de várias etapas. A reação do oxigênio atômico com o ozônio é um exemplo:
\[\ce{O}(g)+\ce{O3}(g)⟶\ce{2O2}(g) \label{12.7.12} \]
Reações elementares termoleculares
Uma reação termolecular elementar envolve a colisão simultânea de três átomos, moléculas ou íons. As reações elementares termoleculares são incomuns porque a probabilidade de três partículas colidirem simultaneamente é menor que um milésimo da probabilidade de duas partículas colidirem. Existem, no entanto, algumas reações elementares termoleculares estabelecidas. A reação do óxido nítrico com o oxigênio parece envolver etapas termoleculares:
\ [\ ce {2NO + O2 ⟶ 2NO2}\\
\ ce {taxa} =k [\ ce {NÃO}] ^2 [\ ce {O2}]\ label {12.7.13}\]
Da mesma forma, a reação do óxido nítrico com o cloro parece envolver etapas termoleculares:
\ [\ ce {2NO + Cl2 ⟶ 2noCl}\
\\ ce {taxa} =k [\ ce {NÃO}] ^2 [\ ce {Cl2}]\ label {12.7.14}\]
Relacionando mecanismos de reação com leis de taxas
Geralmente, uma etapa em um mecanismo de reação de várias etapas é significativamente mais lenta do que as outras. Como uma reação não pode prosseguir mais rápido do que sua etapa mais lenta, essa etapa limitará a taxa na qual a reação geral ocorre. A etapa mais lenta é, portanto, chamada de etapa limitadora de taxa (ou etapa determinante da taxa) da reação Figura\(\PageIndex{2}\).

Conforme descrito anteriormente, as leis de taxa podem ser derivadas diretamente das equações químicas para reações elementares. Esse não é o caso, no entanto, de reações químicas comuns. As equações balanceadas mais frequentemente encontradas representam a mudança geral de alguns sistemas químicos e, muitas vezes, isso é o resultado de alguns mecanismos de reação de várias etapas. Em todos os casos, devemos determinar a lei geral de taxas a partir de dados experimentais e deduzir o mecanismo da lei de taxas (e às vezes de outros dados). A reação de NO 2 e CO fornece um exemplo ilustrativo:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{CO2}(g)+\ce{NO}(g) \nonumber \]
Para temperaturas acima de 225° C, a lei da taxa foi considerada:
\[\ce{rate}=k[\ce{NO2}][\ce{CO}] \nonumber \]
A reação é de primeira ordem em relação ao NO 2 e de primeira ordem em relação ao CO. Isso é consistente com um mecanismo bimolecular de uma única etapa e é possível que esse seja o mecanismo dessa reação em altas temperaturas.
Em temperaturas abaixo de 225° C, a reação é descrita por uma lei de taxa que é de segunda ordem em relação ao NO 2:
\[\ce{rate}=k[\ce{NO2}]^2 \nonumber \]
Isso é consistente com um mecanismo que envolve as duas reações elementares a seguir, a primeira das quais é mais lenta e, portanto, a etapa de determinação da taxa:
\ [\ ce {NO2} (g) +\ ce {NO2} (g) ⟶\ ce {NO3} (g) +\ ce {NÃO} (g)\:\ ce {(lento)}\
\ ce {NO3} (g) +\ ce {CO} (g) ⟶\ ce {NO2} (g) +\ ce {CO2} (g)\:\ ce {rápido)}\ nonumber\]
A etapa de determinação da taxa fornece uma lei de taxa mostrando a dependência de segunda ordem da concentração de NO 2, e a soma das duas equações fornece a reação geral líquida.
Em geral, quando a etapa de determinação da taxa (mais lenta) é a primeira etapa em um mecanismo, a lei de taxa para a reação geral é a mesma que a lei de taxa para essa etapa. No entanto, quando a etapa de determinação da taxa é precedida por uma etapa envolvendo uma reação de equilíbrio, a lei da taxa para a reação geral pode ser mais difícil de derivar.
Uma reação elementar está em equilíbrio quando prossegue nas direções direta e reversa em taxas iguais. Considere a dimerização de NO para N 2 O 2, com k 1 usado para representar a taxa constante da reação direta e k -1 usado para representar a constante de taxa da reação reversa:
\[\ce{NO + NO ⇌ N2O2} \nonumber \]
\[\ce{rate_{forward}=rate_{reverse}} \nonumber \]
\[k_1[\ce{NO}]^2=k_{−1}[\ce{N2O2}] \nonumber \]
Se N 2 O 2 fosse um intermediário em um mecanismo, essa expressão poderia ser reorganizada para representar a concentração de N 2 O 2 na expressão geral da lei de taxas usando manipulação algébrica:
\[\mathrm{\left(\dfrac{k_1[NO]^2}{k_{−1}}\right)=[N_2O_2]} \nonumber \]
No entanto, mais uma vez, os intermediários não podem ser listados como parte da expressão geral da lei de taxas, embora possam ser incluídos em uma reação elementar individual de um mecanismo. O exemplo\(\PageIndex{1}\) ilustrará como derivar as leis gerais de taxas a partir de mecanismos que envolvem etapas de equilíbrio anteriores à etapa de determinação da taxa.
Mecanismo O cloreto de nitrilo (NO 2 Cl) se decompõe em dióxido de nitrogênio (NO 2) e gás cloro (Cl 2) de acordo com o seguinte mecanismo:
- \(\ce{2NO2Cl}(g)⇌\ce{ClO2}(g)+\ce{N2O}(g)+\ce{ClO}(g)\)(rápido, k 1 representa a taxa constante para a reação direta e k −1 a taxa constante para a reação inversa)
- \(\ce{N2O}(g)+\ce{ClO2}(g)⇌\ce{NO2}(g)+\ce{NOCl}(g)\)(rápido, k 2 para a reação direta, k −2 para a reação inversa)
- \(\ce{NOCl + ClO ⟶ NO2 + Cl2}\)(lento, k 3 a taxa constante para a reação direta)
Determine a reação geral, escreva a expressão da lei de taxas para cada reação elementar, identifique quaisquer intermediários e determine a expressão geral da lei de taxas.
Solução
Para a reação geral, basta somar as três etapas, cancelar intermediários e combinar fórmulas semelhantes:
\[\ce{2NO2Cl}(g)⟶\ce{2NO2}(g)+\ce{Cl2}(g) \nonumber \]
Em seguida, escreva a expressão da lei de taxas para cada reação elementar. Lembre-se de que, para reações elementares que fazem parte de um mecanismo, a expressão da lei de taxas pode ser derivada diretamente da estequiometria:
\ [\ begin {align*}
k_1\ ce {[No2Cl] 2} &=k_ {−1}\ ce {[ClO2] [N2O] [ClO]}\\
k_2\ ce {[N2O] [ClO2]} &=k_ {−2}\ ce {NO2] [NoCl]}\\
\ ce {Taxa} &=k_2}\\ ce 3\ ce {[NoCl] [ClO]}
\ end {align*}\ nonumber\]
A terceira etapa, que é a etapa lenta, é a etapa de determinação da taxa. Portanto, a expressão geral da lei de taxas poderia ser escrita como Taxa = k 3 [NoCl] [ClO]. No entanto, tanto o NoCl quanto o ClO são intermediários. Expressões algébricas devem ser usadas para representar [NoCl] e [ClO] de forma que nenhum intermediário permaneça na expressão geral da lei de taxas.
- Usando a reação elementar 1,\(\ce{[ClO]}=\dfrac{k_1\ce{[NO2Cl]^2}}{k_{−1}\ce{[ClO2][N2O]}}\).
- Usando a reação elementar 2,\(\ce{[NOCl]}=\dfrac{k_2\ce{[N2O][ClO2]}}{k_{−2}\ce{[NO2]}}\).
Agora substitua essas expressões algébricas pela expressão geral da lei de taxas e simplifique:
\ [\ begin {align*}
\ ce {rate} &=k_3\ left (\ dfrac {k_2\ ce {[N2O] [ClO2]}} {k_ {−2}\ ce {[NO2]}}\ direita)\ esquerda (\ dfrac {k_1\ ce {[No2Cl] ^2}} {k_ {−1}\ ce {[ClO2] [N2O]}}\ right)\
\ ce {taxa} &=\ dfrac {k_3k_2k_1\ ce {[No2Cl] ^2}} {k_ {−2} k_ {−1}\ ce {[NO2]}}
\ end {align*}\ nonumber\]
Observe que essa lei de taxas mostra uma dependência inversa da concentração de uma das espécies do produto, consistente com a presença de uma etapa de equilíbrio no mecanismo de reação.
O cloro atômico na atmosfera reage com o ozônio no seguinte par de reações elementares:
\(\ce{Cl}+\ce{O3}(g)⟶\ce{ClO}(g)+\ce{O2}(g)\hspace{20px}(\textrm{rate constant }k_1)\)
Determine a reação geral, escreva a expressão da lei de taxas para cada reação elementar, identifique quaisquer intermediários e determine a expressão geral da lei de taxas.
- Responda
-
- reação geral:\(\ce{O3}(g)+\ce{O}⟶\ce{2O2}(g)\)
- taxa 1 = k 1 [O 3] [Cl]; taxa 2 = k 2 [ClO] [O]
- intermediário: ClO (g)
- taxa geral = k 2 k 1 [O 3] [Cl] [O]
Resumo
A sequência de etapas individuais, ou reações elementares, pelas quais os reagentes são convertidos em produtos durante o curso de uma reação é chamada de mecanismo de reação. A taxa geral de uma reação é determinada pela taxa da etapa mais lenta, chamada de etapa determinante da taxa. As reações elementares unimoleculares têm leis de taxa de primeira ordem, enquanto as reações elementares bimoleculares têm leis de taxa de segunda ordem. Ao comparar as leis de taxa derivadas de um mecanismo de reação com as determinadas experimentalmente, o mecanismo pode ser considerado incorreto ou plausível.
Notas de pé
- Esta pergunta foi retirada do Exame de Colocação Avançada de Química e é usada com a permissão do Educational Testing Service.
Glossário
- reação bimolecular
- reação elementar envolvendo a colisão e combinação de duas espécies de reagentes
- reação elementar
- reação que ocorre precisamente conforme descrito em sua equação química
- mediano
- molécula ou íon produzido em uma etapa de um mecanismo de reação e consumido em outro
- molecularidade
- número de espécies reagentes (átomos, moléculas ou íons) envolvidas em uma reação elementar
- etapa de determinação da taxa
- (também, etapa limitadora de taxa) reação elementar mais lenta em um mecanismo de reação; determina a taxa da reação geral
- mecanismo de reação
- sequência gradual de reações elementares pelas quais ocorre uma mudança química
- reação termolecular
- reação elementar envolvendo a colisão simultânea e a combinação de três espécies de reagentes
- reação unimolecular
- reação elementar envolvendo o rearranjo de uma única espécie de reagente para produzir uma ou mais moléculas de produto


