11.3: Solubilidade
- Page ID
- 184853
- Descreva os efeitos da temperatura e da pressão na solubilidade
- Declare a lei de Henry e use-a em cálculos envolvendo a solubilidade de um gás em um líquido
- Explicar os graus de solubilidade possíveis para soluções líquidas e líquidas
Imagine adicionar uma pequena quantidade de sal a um copo de água, mexendo até que todo o sal se dissolva e depois adicionando um pouco mais. Você pode repetir esse processo até que a concentração de sal da solução atinja seu limite natural, um limite determinado principalmente pelas forças de atração do soluto, do solvente soluto e do solvente-solvente discutidas nos dois módulos anteriores deste capítulo. Você pode ter certeza de que atingiu esse limite porque, não importa quanto tempo você mexa a solução, o sal não dissolvido permanece. A concentração de sal na solução nesse ponto é conhecida como solubilidade.
A solubilidade de um soluto em um determinado solvente é a concentração máxima que pode ser alcançada sob determinadas condições quando o processo de dissolução está em equilíbrio. Referindo-se ao exemplo do sal na água:
\[\ce{NaCl}(s)⇌\ce{Na+}(aq)+\ce{Cl-}(aq) \label{11.4.1} \]
Quando a concentração de um soluto é igual à sua solubilidade, diz-se que a solução está saturada com esse soluto. Se a concentração do soluto for menor que sua solubilidade, diz-se que a solução é insaturada. Uma solução que contém uma concentração relativamente baixa de soluto é chamada diluída, e uma com uma concentração relativamente alta é chamada concentrada.
Se adicionarmos mais sal a uma solução saturada de sal, a vemos cair no fundo e não parece mais se dissolver. Na verdade, o sal adicionado se dissolve, conforme representado pela direção direta da equação de dissolução. Acompanhando esse processo, o sal dissolvido precipitará, conforme descrito pela direção inversa da equação. Diz-se que o sistema está em equilíbrio quando esses dois processos recíprocos estão ocorrendo em taxas iguais e, portanto, a quantidade de sal não dissolvido e dissolvido permanece constante. O suporte para a ocorrência simultânea dos processos de dissolução e precipitação é fornecido pela observação de que o número e os tamanhos dos cristais de sal não dissolvidos mudarão com o tempo, embora sua massa combinada permaneça a mesma.
Podem ser preparadas soluções nas quais uma concentração de soluto excede sua solubilidade. Diz-se que essas soluções são supersaturadas e são exemplos interessantes de estados de não equilíbrio. Por exemplo, a bebida carbonatada em um recipiente aberto que ainda não “ficou plana” é supersaturada com gás dióxido de carbono; com o tempo, a concentração de CO 2 diminuirá até atingir seu valor de equilíbrio.
Soluções de gases em líquidos
Em um módulo anterior deste capítulo, o efeito das forças de atração intermoleculares na formação da solução foi discutido. As estruturas químicas do soluto e do solvente ditam os tipos de forças possíveis e, consequentemente, são fatores importantes na determinação da solubilidade. Por exemplo, em condições semelhantes, a solubilidade em água do oxigênio é aproximadamente três vezes maior que a do hélio, mas 100 vezes menor que a solubilidade do clorometano, CHCl 3. Considerando o papel da estrutura química do solvente, observe que a solubilidade do oxigênio no hidrocarboneto hexano líquido, C 6 H 14, é aproximadamente 20 vezes maior do que na água.
Outros fatores também afetam a solubilidade de uma determinada substância em um determinado solvente. A temperatura é um desses fatores, com a solubilidade do gás normalmente diminuindo à medida que a temperatura aumenta (Figura\(\PageIndex{1}\)). Esse é um dos principais impactos resultantes da poluição térmica dos corpos d'água naturais.
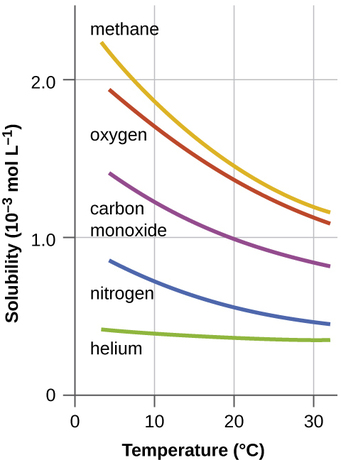
Quando a temperatura de um rio, lago ou riacho aumenta anormalmente, geralmente devido à descarga de água quente de algum processo industrial, a solubilidade do oxigênio na água diminui. A diminuição dos níveis de oxigênio dissolvido pode ter consequências graves para a saúde dos ecossistemas da água e, em casos graves, pode resultar na morte de peixes em grande escala (Figura\(\PageIndex{2}\)).

A solubilidade de um soluto gasoso também é afetada pela pressão parcial do soluto no gás ao qual a solução está exposta. A solubilidade do gás aumenta à medida que a pressão do gás aumenta. As bebidas carbonatadas fornecem uma boa ilustração dessa relação. O processo de carbonatação envolve expor a bebida a uma pressão relativamente alta de gás dióxido de carbono e, em seguida, selar o recipiente da bebida, saturando a bebida com CO 2 nessa pressão. Quando o recipiente da bebida é aberto, um chiado familiar é ouvido quando a pressão do gás dióxido de carbono é liberada, e parte do dióxido de carbono dissolvido é normalmente visto saindo da solução na forma de pequenas bolhas (Figura\(\PageIndex{3}\)). Nesse ponto, a bebida é supersaturada com dióxido de carbono e, com o tempo, a concentração de dióxido de carbono dissolvido diminuirá para seu valor de equilíbrio e a bebida ficará “plana”.

Para muitos solutos gasosos, a relação entre solubilidade\(C_g\), e pressão parcial\(P_g\),, é proporcional:
\[C_\ce{g}=kP_\ce{g} \nonumber \]
onde\(k\) é uma constante de proporcionalidade que depende das identidades do soluto gasoso e do solvente e da temperatura da solução. Esta é uma declaração matemática da lei de Henry: A quantidade de um gás ideal que se dissolve em um volume definido de líquido é diretamente proporcional à pressão do gás.
A 20 °C, a concentração de oxigênio dissolvido na água exposta ao oxigênio gasoso a uma pressão parcial de 101,3 kPa (760 torr) é 1,38 × 10 −3 mol L −1. Use a lei de Henry para determinar a solubilidade do oxigênio quando sua pressão parcial é de 20,7 kPa (155 torr), a pressão aproximada do oxigênio na atmosfera terrestre.
Solução
De acordo com a lei de Henry, para uma solução ideal, a solubilidade, C g, de um gás (1,38 × 10 −3 mol L −1, neste caso) é diretamente proporcional à pressão, P g, do gás não dissolvido acima da solução (101,3 kPa, ou 760 torr, neste caso). Como conhecemos C g e P g, podemos reorganizar essa expressão para resolver k.
\ [\ begin {align*}
C_\ ce {g} &=kp_\ ce {g}\\ [4pt]
k&=\ dfrac {C_\ ce {g}} {P_\ ce {g}}\\ [4pt]
&=\ mathrm {\ dfrac {1,38×10^ {−3}\ :mol\ :L^ {−1}} {101,3\ :kPa}}\\ [4pt]
&=\ mathrm {1,36 × 10^ {−5}\ :mol\ :L^ {−1}\ :kPa^ {−1}}\ [4 pontos]
e\ hspace {15px}\ mathrm {(1,82×10^ {−6}\ :mol\ :L^ {−1}\ :torr^ {−1})}
\ end {align*}\ nonumber\]
Agora podemos usar k para encontrar a solubilidade na pressão mais baixa.
\[C_\ce{g}=kP_\ce{g} \nonumber \]
\ [\ mathrm {1,36×10^ {−5}\ :mol\ :L^ {−1}\ :kPa^ {−1} ×20,7\ :kPa\\ [4pt]
(ou\ :1,82×10^ {−6}\ :mol\ :L^ {−1}\ :torr^ {−1} ×155\ :torr)\\ [44] pt]
=2,82 × 10^ {−4}\ :mol\ :L^ {−1}}\ nonumber\]
Observe que várias unidades podem ser usadas para expressar as quantidades envolvidas nesses tipos de cálculos. Qualquer combinação de unidades que atenda às restrições da análise dimensional é aceitável.
A exposição de uma amostra de 100,0 mL de água a 0 °C a uma atmosfera contendo um soluto gasoso a 20,26 kPa (152 torr) resultou na dissolução de 1,45 × 10 −3 g do soluto. Use a lei de Henry para determinar a solubilidade desse soluto gasoso quando sua pressão é de 101,3 kPa (760 torr).
- Resposta
-
7,25 × 10 −3 g em 100,0 mL ou 0,0725 g/L
A doença descompressiva (DCS), ou “curvas”, é um efeito do aumento da pressão do ar inalado pelos mergulhadores ao nadar debaixo d'água em profundidades consideráveis. Além da pressão exercida pela atmosfera, os mergulhadores são submetidos a pressões adicionais devido à água acima deles, experimentando um aumento de aproximadamente 1 atm para cada 10 m de profundidade. Portanto, o ar inalado por um mergulhador enquanto submerso contém gases na pressão ambiente correspondente, e as concentrações dos gases dissolvidos no sangue do mergulhador são proporcionalmente maiores de acordo com a lei de Henry.
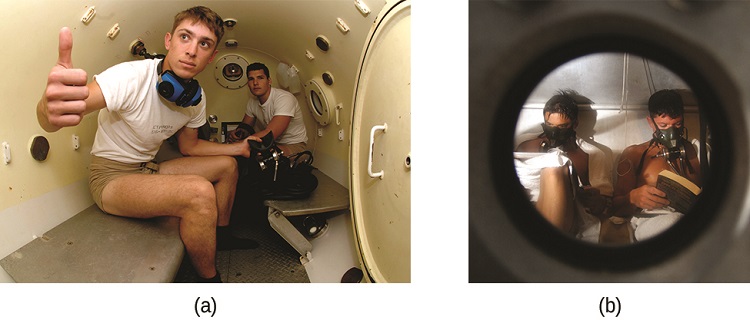
À medida que o mergulhador sobe à superfície da água, a pressão ambiente diminui e os gases dissolvidos se tornam menos solúveis. Se a subida for muito rápida, os gases que escapam do sangue do mergulhador podem formar bolhas que podem causar uma variedade de sintomas, desde erupções cutâneas e dores nas articulações até paralisia e morte. Para evitar o DCS, os mergulhadores devem subir de profundidades em velocidades relativamente lentas (10 ou 20 m/min) ou fazer várias paradas de descompressão, pausando por vários minutos em determinadas profundidades durante a subida. Quando essas medidas preventivas não são bem-sucedidas, os mergulhadores com DCS geralmente recebem oxigenoterapia hiperbárica em vasos pressurizados chamados câmaras de descompressão (ou recompressão) (Figura\(\PageIndex{4}\)).
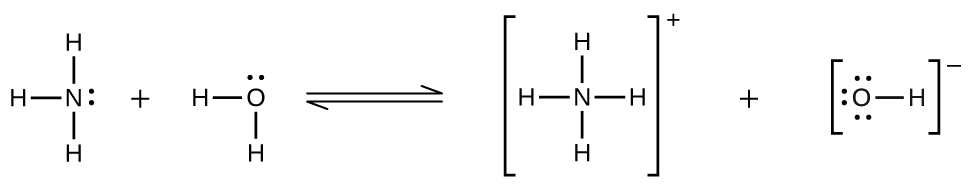
Desvios da lei de Henry são observados quando ocorre uma reação química entre o soluto gasoso e o solvente. Assim, por exemplo, a solubilidade da amônia na água não aumenta tão rapidamente com o aumento da pressão, como previsto pela lei, porque a amônia, sendo uma base, reage em certa medida com a água para formar íons de amônio e íons hidróxido.
Os gases podem formar soluções supersaturadas. Se uma solução de um gás em um líquido for preparada em baixa temperatura ou sob pressão (ou ambas), então, à medida que a solução aquece ou quando a pressão do gás é reduzida, a solução pode ficar supersaturada. Em 1986, mais de 1700 pessoas nos Camarões foram mortas quando uma nuvem de gás, quase certamente dióxido de carbono, borbulhou do Lago Nyos (Figura\(\PageIndex{5}\)), um lago profundo em uma cratera vulcânica. A água no fundo do Lago Nyos está saturada com dióxido de carbono pela atividade vulcânica abaixo do lago. Acredita-se que o lago tenha sofrido uma reviravolta devido ao aquecimento gradual vindo de baixo do lago, e a água mais quente e menos densa saturada com dióxido de carbono atingiu a superfície. Consequentemente, enormes quantidades de CO 2 dissolvido foram liberadas e o gás incolor, que é mais denso que o ar, fluiu pelo vale abaixo do lago e sufocou humanos e animais que viviam no vale.

Soluções de líquidos em líquidos
Sabemos que alguns líquidos se misturam em todas as proporções; em outras palavras, eles têm solubilidade mútua infinita e são considerados miscíveis. Etanol, ácido sulfúrico e etilenoglicol (populares para uso como anticongelante, ilustrados na Figura\(\PageIndex{6}\)) são exemplos de líquidos que são completamente miscíveis com água. O óleo de motor de dois ciclos é miscível com gasolina.

Líquidos que se misturam com água em todas as proporções geralmente são substâncias polares ou substâncias que formam ligações de hidrogênio. Para esses líquidos, as atrações dipolo-dipolo (ou ligação de hidrogênio) das moléculas de soluto com as moléculas de solvente são pelo menos tão fortes quanto aquelas entre moléculas no soluto puro ou no solvente puro. Portanto, os dois tipos de moléculas se misturam facilmente. Da mesma forma, os líquidos não polares são miscíveis entre si porque não há diferença apreciável nas forças das atrações intermoleculares soluto-soluto, solvente-solvente e solvente soluto. A solubilidade de moléculas polares em solventes polares e de moléculas não polares em solventes não polares é, novamente, uma ilustração do axioma químico “semelhante dissolve semelhante”.
Dois líquidos que não se misturam de forma apreciável são chamados de imiscíveis. As camadas são formadas quando despejamos líquidos imiscíveis no mesmo recipiente. Gasolina, óleo (Figura\(\PageIndex{7}\)), benzeno, tetracloreto de carbono, algumas tintas e muitos outros líquidos não polares são imiscíveis com a água. A atração entre as moléculas desses líquidos não polares e as moléculas de água polar é ineficazmente fraca. As únicas atrações fortes dessa mistura são entre as moléculas de água, então elas efetivamente espremem as moléculas do líquido não polar. A distinção entre imiscibilidade e miscibilidade é realmente de graus, de modo que os líquidos miscíveis são de solubilidade mútua infinita, enquanto os líquidos considerados imiscíveis são de solubilidade mútua muito baixa (embora não zero).

Diz-se que dois líquidos, como bromo e água, que são de solubilidade mútua moderada são parcialmente miscíveis. Dois líquidos parcialmente miscíveis geralmente formam duas camadas quando misturados. No caso da mistura de bromo e água, a camada superior é água, saturada com bromo, e a camada inferior é bromo saturado com água. Como o bromo é não polar e, portanto, não é muito solúvel em água, a camada de água é apenas ligeiramente descolorida pelo bromo laranja brilhante dissolvido nela. Como a solubilidade da água no bromo é muito baixa, não há efeito perceptível na cor escura da camada de bromo (Figura\(\PageIndex{8}\)).

Soluções de sólidos em líquidos
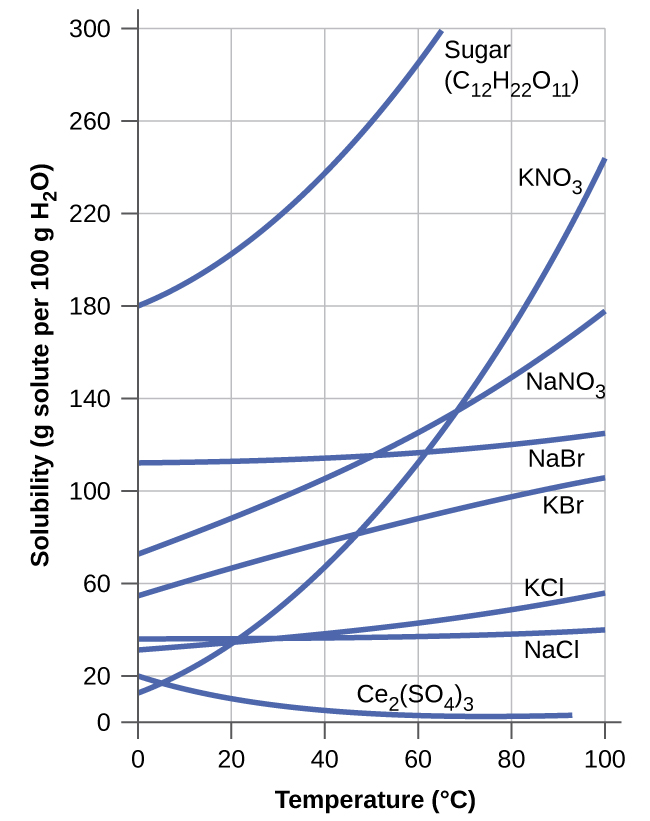
A dependência da solubilidade na temperatura para vários sólidos inorgânicos em água é mostrada pelas curvas de solubilidade na Figura\(\PageIndex{9}\). A revisão desses dados indica uma tendência geral de aumento da solubilidade com a temperatura, embora haja exceções, conforme ilustrado pelo composto iônico sulfato de cério.
A dependência da solubilidade da temperatura pode ser explorada para preparar soluções supersaturadas de certos compostos. Uma solução pode ser saturada com o composto a uma temperatura elevada (onde o soluto é mais solúvel) e posteriormente resfriada a uma temperatura mais baixa sem precipitar o soluto. A solução resultante contém soluto em uma concentração maior do que sua solubilidade de equilíbrio na temperatura mais baixa (ou seja, é supersaturada) e é relativamente estável. A precipitação do excesso de soluto pode ser iniciada adicionando um cristal de semente (veja o vídeo no Link to Learning, anteriormente neste módulo) ou agitando mecanicamente a solução. Alguns aquecedores de mãos, como o mostrado na Figura\(\PageIndex{10}\), aproveitam esse comportamento.

Vídeo\(\PageIndex{2}\): Este vídeo mostra o processo de cristalização que ocorre em um aquecedor de mãos.
Resumo
A extensão em que uma substância se dissolverá em outra é determinada por vários fatores, incluindo os tipos e as forças relativas das forças de atração intermoleculares que podem existir entre os átomos, íons ou moléculas das substâncias. Essa tendência de se dissolver é quantificada como solubilidade da substância, sua concentração máxima em uma solução em equilíbrio sob condições especificadas. Uma solução saturada contém soluto em uma concentração igual à sua solubilidade. Uma solução supersaturada é aquela em que a concentração de um soluto excede sua solubilidade — uma condição de não equilíbrio (instável) que resultará em precipitação de soluto quando a solução for perturbada adequadamente. Os líquidos miscíveis são solúveis em todas as proporções e os líquidos imiscíveis apresentam uma solubilidade mútua muito baixa. As solubilidades dos solutos gasosos diminuem com o aumento da temperatura, enquanto as da maioria, mas não de todos, os solutos sólidos aumentam com a temperatura. A concentração de um soluto gasoso em uma solução é proporcional à pressão parcial do gás ao qual a solução está exposta, uma relação conhecida como lei de Henry.
Equações-chave
- \(C_\ce{g}=kP_\ce{g}\)
Glossário
- Lei de Henry
- lei que estabelece a relação proporcional entre a concentração de gás dissolvido em uma solução e a pressão parcial do gás em contato com a solução
- imiscível
- de solubilidade mútua insignificante; normalmente se refere a substâncias líquidas
- miscível
- mutuamente solúvel em todas as proporções; normalmente refere-se a substâncias líquidas
- parcialmente miscível
- de solubilidade mútua moderada; normalmente se refere a substâncias líquidas
- saturado
- de concentração igual à solubilidade; contendo a concentração máxima de soluto possível para uma determinada temperatura e pressão
- solubilidade
- até que ponto um soluto pode ser dissolvido em água ou em qualquer solvente
- supersaturado
- de concentração que excede a solubilidade; um estado de não equilíbrio
- insaturado
- de concentração menor que a solubilidade


