11.2: Eletrólitos
- Page ID
- 184833
- Defina e dê exemplos de eletrólitos
- Faça a distinção entre as mudanças físicas e químicas que acompanham a dissolução de eletrólitos iônicos e covalentes
- Relacione a força do eletrólito às forças de atração do solvente soluto
Quando algumas substâncias são dissolvidas na água, elas sofrem uma alteração física ou química que produz íons em solução. Essas substâncias constituem uma importante classe de compostos chamados eletrólitos. Substâncias que não produzem íons quando dissolvidas são chamadas de não eletrólitos. Se o processo físico ou químico que gera os íons é essencialmente 100% eficiente (todo o composto dissolvido produz íons), então a substância é conhecida como eletrólito forte. Se apenas uma fração relativamente pequena da substância dissolvida passar pelo processo de produção de íons, ela é chamada de eletrólito fraco.
As substâncias podem ser identificadas como fortes, fracas ou não eletrólitos medindo a condutância elétrica de uma solução aquosa contendo a substância. Para conduzir eletricidade, uma substância deve conter espécies carregadas e livremente móveis. O mais familiar é a condução de eletricidade através de fios metálicos; nesse caso, as entidades móveis carregadas são elétrons. As soluções também podem conduzir eletricidade se contiverem íons dissolvidos, com a condutividade aumentando à medida que a concentração de íons aumenta. A aplicação de uma voltagem aos eletrodos imersos em uma solução permite avaliar a concentração relativa de íons dissolvidos, seja quantitativamente, medindo o fluxo de corrente elétrica, ou qualitativamente, observando o brilho de uma lâmpada incluída no circuito (Figura\(\PageIndex{1}\)).
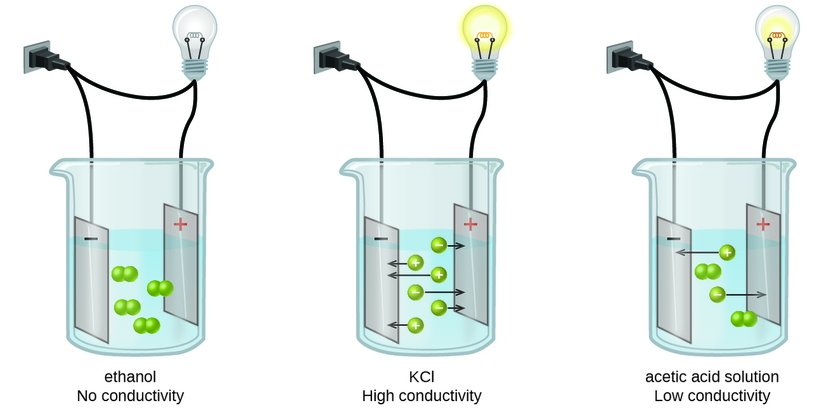
Eletrólitos iônicos
A água e outras moléculas polares são atraídas pelos íons, conforme mostrado na Figura\(\PageIndex{2}\). A atração eletrostática entre um íon e uma molécula com um dipolo é chamada de atração ion-dipolo. Essas atrações desempenham um papel importante na dissolução de compostos iônicos na água.
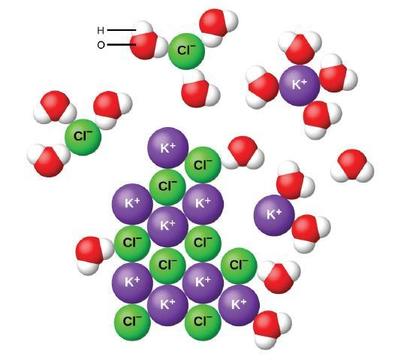
Quando os compostos iônicos se dissolvem na água, os íons no sólido se separam e se dispersam uniformemente por toda a solução porque as moléculas de água envolvem e solvatam os íons, reduzindo as fortes forças eletrostáticas entre eles. Esse processo representa uma mudança física conhecida como dissociação. Na maioria das condições, os compostos iônicos se dissociam quase completamente quando dissolvidos e, portanto, são classificados como eletrólitos fortes.
Vamos considerar o que acontece no nível microscópico quando adicionamos KCl sólido à água. As forças de dipolo de íons atraem a extremidade positiva (hidrogênio) das moléculas de água polar para os íons de cloreto negativos na superfície do sólido e atraem as extremidades negativas (oxigênio) para os íons positivos de potássio. As moléculas de água penetram entre os íons K + e Cl − individuais e os cercam, reduzindo as fortes forças interiônicas que unem os íons e permitindo que eles se movam para a solução como íons solvatados, como mostra a Figura. A redução da atração eletrostática permite o movimento independente de cada íon hidratado em uma solução diluída, resultando em um aumento na desordem do sistema à medida que os íons mudam de suas posições fixas e ordenadas no cristal para estados móveis e muito mais desordenados em solução. Esse distúrbio aumentado é responsável pela dissolução de muitos compostos iônicos, incluindo o KCl, que se dissolvem com a absorção de calor.
Em outros casos, as atrações eletrostáticas entre os íons em um cristal são tão grandes, ou as forças de atração do dipolo de íons entre os íons e as moléculas de água são tão fracas que o aumento da desordem não pode compensar a energia necessária para separar os íons, e o cristal é insolúvel. Esse é o caso de compostos como carbonato de cálcio (calcário), fosfato de cálcio (o componente inorgânico do osso) e óxido de ferro (ferrugem).
Eletrólitos covalentes
A água pura é um condutor de eletricidade extremamente pobre porque é apenas levemente ionizada — apenas cerca de duas em cada 1 bilhão de moléculas ionizam a 25 °C. A água ioniza quando uma molécula de água entrega um próton para outra molécula de água, produzindo íons hidrônio e hidróxido.
\[\ce{H_2O (l)+ H_2O (l) \rightleftharpoons H_3O^{+} (aq) + OH^{−} (aq)} \label{11.3.2} \]
Em alguns casos, descobrimos que soluções preparadas a partir de compostos covalentes conduzem eletricidade porque as moléculas do soluto reagem quimicamente com o solvente para produzir íons. Por exemplo, o cloreto de hidrogênio puro é um gás que consiste em moléculas de HCl covalentes. Esse gás não contém íons. No entanto, quando dissolvemos o cloreto de hidrogênio na água, descobrimos que a solução é um condutor muito bom. As moléculas de água desempenham um papel essencial na formação de íons: soluções de cloreto de hidrogênio em muitos outros solventes, como o benzeno, não conduzem eletricidade e não contêm íons.
O cloreto de hidrogênio é um ácido e, portanto, suas moléculas reagem com a água, transferindo íons H + para formar íons hidrônio (\(H_3O^+\)) e íons cloreto (Cl −):
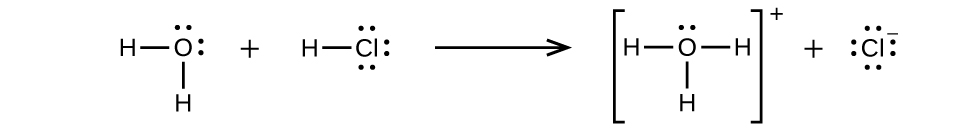
Essa reação é essencialmente 100% completa para o HCl (ou seja, é um ácido forte e, consequentemente, um eletrólito forte). Da mesma forma, ácidos e bases fracos que reagem apenas parcialmente geram concentrações relativamente baixas de íons quando dissolvidos em água e são classificados como eletrólitos fracos. O leitor pode querer revisar a discussão sobre ácidos fortes e fracos fornecida no capítulo anterior deste texto sobre classes de reação e estequiometria.
Resumo
As substâncias que se dissolvem na água para produzir íons são chamadas de eletrólitos. Os eletrólitos podem ser compostos covalentes que reagem quimicamente com a água para produzir íons (por exemplo, ácidos e bases), ou podem ser compostos iônicos que se dissociam para produzir seus cátions e ânions constituintes, quando dissolvidos. A dissolução de um composto iônico é facilitada pelas atrações de dipolo iônico entre os íons do composto e as moléculas polares de água. Substâncias iônicas solúveis e ácidos fortes ionizam completamente e são eletrólitos fortes, enquanto ácidos e bases fracos ionizam em apenas uma pequena extensão e são eletrólitos fracos. Não eletrólitos são substâncias que não produzem íons quando dissolvidas em água.
Glossário
- dissociação
- processo físico que acompanha a dissolução de um composto iônico no qual os íons constituintes do composto são solvatados e dispersos por toda a solução
- eletrólito
- substância que produz íons quando dissolvida em água
- atração de íon-dipolo
- atração eletrostática entre um íon e uma molécula polar
- não eletrólito
- substância que não produz íons quando dissolvida em água
- eletrólito forte
- substância que se dissocia ou ioniza completamente quando dissolvida em água
- eletrólito fraco
- substância que ioniza apenas parcialmente quando dissolvida em água


